2.2 课时2 氯酸盐 氯离子的检验 课件 (共19张PPT)2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 2.2 课时2 氯酸盐 氯离子的检验 课件 (共19张PPT)2024-2025学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 20.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 10:28:21 | ||
图片预览





文档简介
(共19张PPT)
氯酸盐 氯离子的检验
第二章 海水中的重要元素——钠和氯
1.理解氯气与碱溶液反应的原理及特点,能正确书写相关离子方程式
2.熟知漂白液与漂白粉的制备原理,主要成分,漂白原理及保存方法
3.通过对比实验掌握氯离子的检验方法
浓盐酸
次氯酸钠
ClO-+ H+ + Cl- Cl2 ↑
一、氯气与碱的反应
氯气与水反应生成两种酸,推测氯气与NaOH、石灰乳能否发生反应 产物是什么
Cl2 + H2O = HCl + HClO
HCl + NaOH = NaCl + H2O
HClO+ NaOH = NaClO + H2O
Cl2 + 2NaOH = NaCl + NaClO + H2O
次氯酸钠
有效成分:NaClO
写出离子方程式:
应用:实验室常用NaOH溶液吸收多余的Cl2 ,以消除污染。
1.制取漂白液
Cl2 + 2OH- = Cl- + ClO- + H2O
主要成分
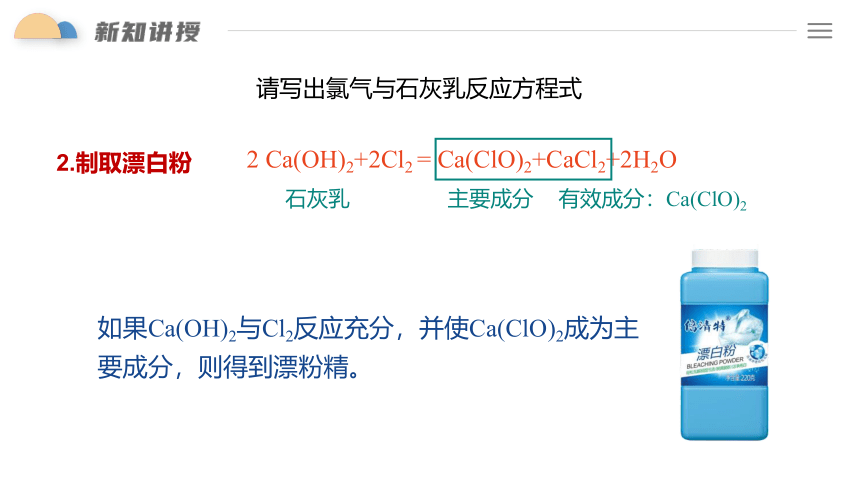
2 Ca(OH)2+2Cl2 = Ca(ClO)2+CaCl2+2H2O
请写出氯气与石灰乳反应方程式
主要成分
石灰乳
如果Ca(OH)2与Cl2反应充分,并使Ca(ClO)2成为主要成分,则得到漂粉精。
2.制取漂白粉
有效成分:Ca(ClO)2
3.漂白原理
漂白粉、漂粉精
使用原理
【思考】为什么生活、生产中用次氯酸盐代替次氯酸作漂白剂和消毒剂?
次氯酸盐比次氯酸稳定,不易分解且比氯水(次氯酸)易于贮存和运输。
资料卡片:酸性强弱比较 H2CO3>HClO
日常: Ca(ClO)2+CO2+H2O = CaCO3↓ +2HClO
工业: Ca(ClO)2+2HCl = CaCl2+2HClO
漂白粉、漂粉精长期放置于空气中会失效,为什么?
密封(隔绝水和二氧化碳)
① Ca(ClO)2+H2O+CO2= CaCO3↓+2HClO
② 2HClO = 2HCl+O2↑
光照
③ CaCO3+2HCl = CaCl2+H2O+CO2↑
应该如何保存漂白粉、漂粉精?
4.失效原因
KI
“84”淀粉溶液
I-
IO3-
I2
ClO-
ClO-
认识次氯酸盐的性质
NaClO
+1
氧化性
预测性质
设计实验
得出结论
获取证据
用途:既可做漂白棉、麻、纸张的漂白剂,又可做游泳池及环境的消毒剂
二、氯离子的检验
【实验2-9】
在三支试管中分别加入2~3mL稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
试液2~3 mL 实验现象 离子方程式
滴入几滴AgNO3溶液 加入少量稀硝酸
①稀盐酸 ______________ __________ __________________
②NaCl溶液 ______________ __________ __________________
③Na2CO3 溶液 ______________ ____________________ ________________________________________________________
有白色沉淀生成
沉淀不溶解
Cl-+Ag+= AgCl↓
有白色沉淀生成
沉淀不溶解
Cl-+Ag+= AgCl↓
有白色沉淀生成
沉淀溶解,
有气泡产生
Ag2CO3+2H+= 2Ag++CO2↑+H2O
CO32-+2Ag+= Ag2CO3↓
取少量待检液于一洁净试管中;
在待检液中滴入足量稀硝酸;
1
2
3
4
滴加AgNO3溶液;
观察现象。
排除CO32-等的干扰
则待检液中含有Cl-。
若产生白色沉淀
目的是?
稀硝酸和AgNO3溶液顺序能否颠倒?
二、氯离子的检验
(1)试剂:_______、___________。
(2)现象:产生_____________ 的___ 色沉淀。
稀硝酸
AgNO3溶液
不溶于稀硝酸
白
水质检验员在检验水质
离子检验答题模板
1、取样
2、试剂
3、现象
4、结论
氯离子的检验
稀硝酸酸化
AgNO3溶液
白色沉淀
待检液
氯气与碱的反应
2Cl2 + 2 Ca(OH)2 = Ca(ClO)2+CaCl2+2H2O
Cl2 + 2NaOH = NaCl + NaClO + H2O
1.将紫色石蕊溶液滴入NaOH溶液中,溶液变为蓝色,再通入氯气,溶液由蓝色先变成红色,最后颜色慢慢褪去,其原因是 ( )
①氯气有漂白性 ②氯气与NaOH溶液反应 ③氯气的水溶液呈酸性
④次氯酸有漂白性 ⑤氯化钠有漂白性 ⑥酸碱复分解反应比氧化还原反应快
A.①④⑥ B.②③④⑥ C.①②③ D.④⑤⑥
B
2.氯是一种富集在海水中的元素,图是几种含氯产品。
(1)储氯钢瓶上应贴的标签为_____(填字母代号)。
A.易燃品 B.有毒品 C.爆炸品
ClO- + Cl- + 2H+ = Cl2↑+ H2O
(2)写出工业制漂白粉化学方程式___________________________________。漂白粉的有效成分是_________(填化学式),漂白粉必须密封保存,是由于漂白粉中的有效成分能与空气中的二氧化碳和水蒸气发生反应而使其失效,写出该反应化学方程式_________________________________。
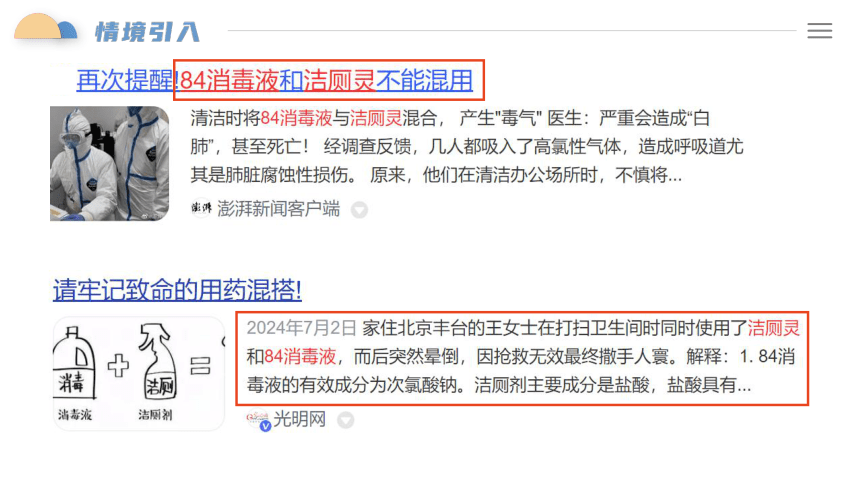
(3)84消毒液的有效成分是次氯酸钠,84消毒液与除垢剂(有效成分为盐酸)
混合使用会产生黄绿色、有刺激性气味的气体,该反应的离子方程式是____________________________________。
B
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
Ca(ClO)2
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
3.下列有关氯及其化合物的说法正确的是( )
A.干燥的氯气不能漂白鲜花
B.氯水久置后,Cl-浓度增大
C.检验HCl气体中是否混有Cl2,可将气体通入硝酸银溶液
D.实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
B
4.下列溶液里离子检验的结论正确的是( )
A.加稀盐酸产生无色无味气体,将气体通入澄清石灰水,石灰水变浑浊,原溶液可能含 CO32-
B.加 BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不溶解,原溶液一定含有 SO42-
C.加AgNO3溶液有白色沉淀产生,原溶液一定含有 Cl-
D.加Na2CO3溶液有白色沉淀产生,再加盐酸,沉淀消失,原溶液中一定含有 Ba2+
A
氯酸盐 氯离子的检验
第二章 海水中的重要元素——钠和氯
1.理解氯气与碱溶液反应的原理及特点,能正确书写相关离子方程式
2.熟知漂白液与漂白粉的制备原理,主要成分,漂白原理及保存方法
3.通过对比实验掌握氯离子的检验方法
浓盐酸
次氯酸钠
ClO-+ H+ + Cl- Cl2 ↑
一、氯气与碱的反应
氯气与水反应生成两种酸,推测氯气与NaOH、石灰乳能否发生反应 产物是什么
Cl2 + H2O = HCl + HClO
HCl + NaOH = NaCl + H2O
HClO+ NaOH = NaClO + H2O
Cl2 + 2NaOH = NaCl + NaClO + H2O
次氯酸钠
有效成分:NaClO
写出离子方程式:
应用:实验室常用NaOH溶液吸收多余的Cl2 ,以消除污染。
1.制取漂白液
Cl2 + 2OH- = Cl- + ClO- + H2O
主要成分
2 Ca(OH)2+2Cl2 = Ca(ClO)2+CaCl2+2H2O
请写出氯气与石灰乳反应方程式
主要成分
石灰乳
如果Ca(OH)2与Cl2反应充分,并使Ca(ClO)2成为主要成分,则得到漂粉精。
2.制取漂白粉
有效成分:Ca(ClO)2
3.漂白原理
漂白粉、漂粉精
使用原理
【思考】为什么生活、生产中用次氯酸盐代替次氯酸作漂白剂和消毒剂?
次氯酸盐比次氯酸稳定,不易分解且比氯水(次氯酸)易于贮存和运输。
资料卡片:酸性强弱比较 H2CO3>HClO
日常: Ca(ClO)2+CO2+H2O = CaCO3↓ +2HClO
工业: Ca(ClO)2+2HCl = CaCl2+2HClO
漂白粉、漂粉精长期放置于空气中会失效,为什么?
密封(隔绝水和二氧化碳)
① Ca(ClO)2+H2O+CO2= CaCO3↓+2HClO
② 2HClO = 2HCl+O2↑
光照
③ CaCO3+2HCl = CaCl2+H2O+CO2↑
应该如何保存漂白粉、漂粉精?
4.失效原因
KI
“84”淀粉溶液
I-
IO3-
I2
ClO-
ClO-
认识次氯酸盐的性质
NaClO
+1
氧化性
预测性质
设计实验
得出结论
获取证据
用途:既可做漂白棉、麻、纸张的漂白剂,又可做游泳池及环境的消毒剂
二、氯离子的检验
【实验2-9】
在三支试管中分别加入2~3mL稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
试液2~3 mL 实验现象 离子方程式
滴入几滴AgNO3溶液 加入少量稀硝酸
①稀盐酸 ______________ __________ __________________
②NaCl溶液 ______________ __________ __________________
③Na2CO3 溶液 ______________ ____________________ ________________________________________________________
有白色沉淀生成
沉淀不溶解
Cl-+Ag+= AgCl↓
有白色沉淀生成
沉淀不溶解
Cl-+Ag+= AgCl↓
有白色沉淀生成
沉淀溶解,
有气泡产生
Ag2CO3+2H+= 2Ag++CO2↑+H2O
CO32-+2Ag+= Ag2CO3↓
取少量待检液于一洁净试管中;
在待检液中滴入足量稀硝酸;
1
2
3
4
滴加AgNO3溶液;
观察现象。
排除CO32-等的干扰
则待检液中含有Cl-。
若产生白色沉淀
目的是?
稀硝酸和AgNO3溶液顺序能否颠倒?
二、氯离子的检验
(1)试剂:_______、___________。
(2)现象:产生_____________ 的___ 色沉淀。
稀硝酸
AgNO3溶液
不溶于稀硝酸
白
水质检验员在检验水质
离子检验答题模板
1、取样
2、试剂
3、现象
4、结论
氯离子的检验
稀硝酸酸化
AgNO3溶液
白色沉淀
待检液
氯气与碱的反应
2Cl2 + 2 Ca(OH)2 = Ca(ClO)2+CaCl2+2H2O
Cl2 + 2NaOH = NaCl + NaClO + H2O
1.将紫色石蕊溶液滴入NaOH溶液中,溶液变为蓝色,再通入氯气,溶液由蓝色先变成红色,最后颜色慢慢褪去,其原因是 ( )
①氯气有漂白性 ②氯气与NaOH溶液反应 ③氯气的水溶液呈酸性
④次氯酸有漂白性 ⑤氯化钠有漂白性 ⑥酸碱复分解反应比氧化还原反应快
A.①④⑥ B.②③④⑥ C.①②③ D.④⑤⑥
B
2.氯是一种富集在海水中的元素,图是几种含氯产品。
(1)储氯钢瓶上应贴的标签为_____(填字母代号)。
A.易燃品 B.有毒品 C.爆炸品
ClO- + Cl- + 2H+ = Cl2↑+ H2O
(2)写出工业制漂白粉化学方程式___________________________________。漂白粉的有效成分是_________(填化学式),漂白粉必须密封保存,是由于漂白粉中的有效成分能与空气中的二氧化碳和水蒸气发生反应而使其失效,写出该反应化学方程式_________________________________。
(3)84消毒液的有效成分是次氯酸钠,84消毒液与除垢剂(有效成分为盐酸)
混合使用会产生黄绿色、有刺激性气味的气体,该反应的离子方程式是____________________________________。
B
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
Ca(ClO)2
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
3.下列有关氯及其化合物的说法正确的是( )
A.干燥的氯气不能漂白鲜花
B.氯水久置后,Cl-浓度增大
C.检验HCl气体中是否混有Cl2,可将气体通入硝酸银溶液
D.实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
B
4.下列溶液里离子检验的结论正确的是( )
A.加稀盐酸产生无色无味气体,将气体通入澄清石灰水,石灰水变浑浊,原溶液可能含 CO32-
B.加 BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不溶解,原溶液一定含有 SO42-
C.加AgNO3溶液有白色沉淀产生,原溶液一定含有 Cl-
D.加Na2CO3溶液有白色沉淀产生,再加盐酸,沉淀消失,原溶液中一定含有 Ba2+
A
