2.2 课时1 氯气的性质 课件 (共24张PPT) 2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 2.2 课时1 氯气的性质 课件 (共24张PPT) 2024-2025学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 46.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 10:31:01 | ||
图片预览







文档简介
(共24张PPT)
氯气的性质
第二章 海水中的重要元素——钠和氯
1.归纳氯气的物理性质,通过氯原子结构预测氯气的主要化学性质并用实验加以验证
2.探究新制氯水的成分
3.在价类二维图上总结氯气的化学性质,形成基于物质类别、元素价态和原子结构对物质性质进行预测和检验的认知模型
从材料中体现了氯气哪些物理性质?
京沪高速公路淮安路段液氯的泄漏
2005年3月29日,京沪高速公路淮安路段一辆满载液氯的液罐车和对面来车相撞 ,大量液氯外泄。据目击者描述 : “一股黄绿色的气体 ‘唰’地射向空中,并有刺鼻的味道,眼睛也熏得睁不开 。”
事发后消防队员不断地用水枪喷射,但还是造成350人中毒进医院救治, 28人中毒死亡,附近居民采取应急措施,疏散到高坡上。
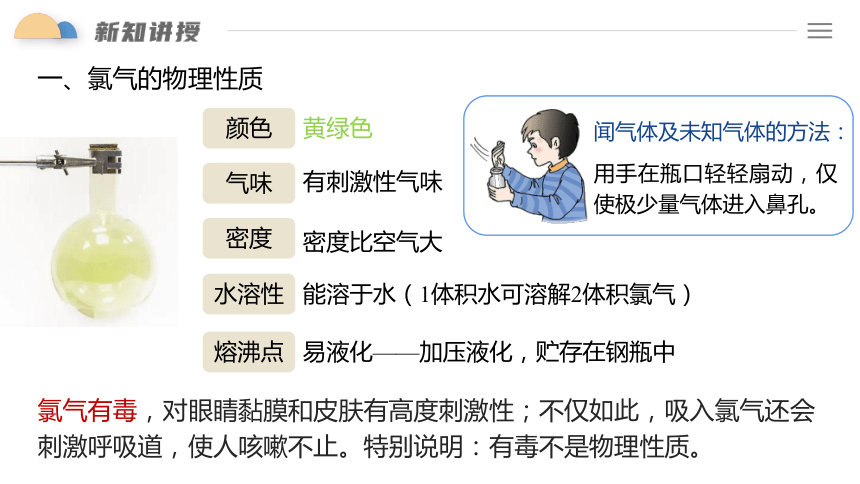
一、氯气的物理性质
颜色
气味
密度
水溶性
熔沸点
黄绿色
有刺激性气味
密度比空气大
能溶于水(1体积水可溶解2体积氯气)
易液化——加压液化,贮存在钢瓶中
闻气体及未知气体的方法:
用手在瓶口轻轻扇动,仅使极少量气体进入鼻孔。
氯气有毒,对眼睛黏膜和皮肤有高度刺激性;不仅如此,吸入氯气还会刺激呼吸道,使人咳嗽不止。特别说明:有毒不是物理性质。
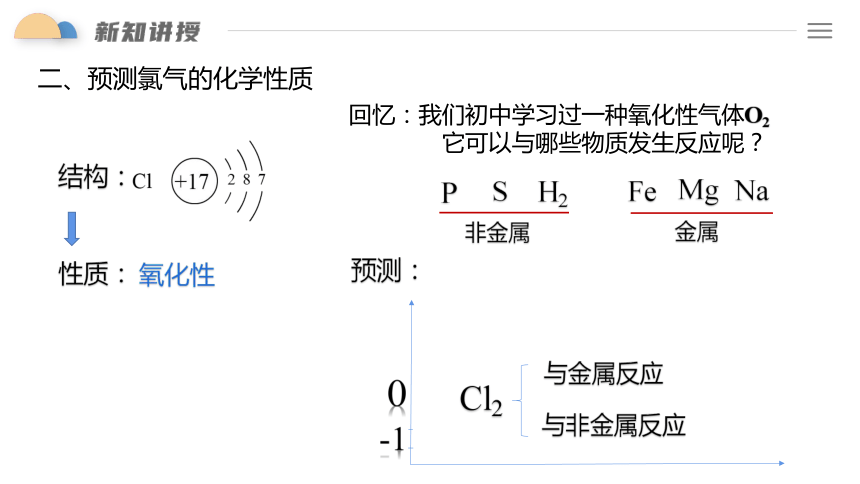
二、预测氯气的化学性质
-1
0
Cl2
与非金属反应
与金属反应
回忆:我们初中学习过一种氧化性气体O2
它可以与哪些物质发生反应呢?
Na
非金属
金属
预测:
P
S
Mg
Fe
H2
氧化性
结构:
性质:
现象:黄色火焰,产生大量白烟
2Na+Cl2 2NaCl
点燃
2Fe+3Cl2 2FeCl3
点燃
(1) 与金属反应
产生大量棕红色烟,产物的水溶液呈棕黄色
氯气与变价金属反应生成高价态吗?
产生大量棕黄色烟,水溶液呈蓝绿色
点燃
Cu + Cl2 CuCl2
Tips:
氯化亚铜CuCl是难溶于水的白色固体
反应规律:氯气和变价金属反应时生成高价金属氯化物
(2) 与非金属H2反应
H2+Cl2 2HCl
点燃
实验现象:
氢气在氯气中安静燃烧
发出苍白色火焰
瓶口有白雾出现
思考:燃烧是否一定需要氧气参加,燃烧的本质是什么?
燃烧的本质是氧化还原反应,所有发光发热的剧烈的化学反应都称为燃烧。
【思考】在海带提碘工艺中,2I-+ Cl2 ===2Cl-+I2是重要的步骤之一,在该步骤中氯气的作用是什么?
海带
碘( I2 )
富集、分离提纯、转化
氯气有强氧化性,请从氧化还原角度出发,试着总结归纳一下,氯气可以跟哪些常见的物质发生反应?
I-、Br-、Fe2+、SO2、
1. Cl2与FeCl2溶液反应:Cl2+2FeCl2=2FeCl3
2. Cl2与KI溶液反应:Cl2+2KI=2KCl+I2
3. Cl2与SO2的水溶液反应:Cl2+SO2+2H2O=2HCl+H2SO4
4. 与Na2S反应:Cl2+Na2S=2NaCl+S↓
5. 与NH3反应:8NH3+3Cl2=N2+6NH4Cl
1.生活中可以用氯气灌洞的方法来消灭田鼠,这是利用了氯气的哪些性质( )
①密度比空气大 ②易液化 ③能溶于水 ④有毒
A.①② B.③④ C.④ D.①④
D
2.制备氯化物时,常用两种方法:
①用金属与氯气直接化合制得;②用金属与盐酸反应制得。
用以上两种方法都可制得的氯化物是 ( )
A. AlCl3 B. FeCl3 C. FeCl2 D. CuCl2
A
科学史话2
法国化学家贝托莱在研究氯气时发现,氯气溶于水后形成的溶液(称为“氯水” )有漂白性,露置在日光下会失去漂白能力,同时产生盐酸和氧气,因此他推断氯气是一种含氧化合物。
贝托莱
(1748-1822)
溶液呈现黄绿色说明存在Cl2分子。如果反应,可能会生成什么产物呢?
(3) 氯气溶于水?是简单的溶解还是发生了化学反应?
预测1:Cl2、H2O根据原子守恒,可能会生成Cl-、H+
目的 预测现象 实验现象
检验Cl-
检验H+
溶液中存在H+
溶液中存在Cl-
结论:氯气溶于水发生了化学反应,生成了HCl
硝酸酸化的硝酸银产生白色沉淀
试纸变红色,之后又褪色
与预测现象一致
紫色的石蕊溶液变红色
设计实验进行验证(演示实验):
预测2: 使试纸褪色的难道是Cl2?氯气具有漂白性吗?
操作 实验现象
实验结论:1.干燥的氯气不具有漂白性,湿润的氯气具有漂白性
干燥的红色纸条放入氯气瓶中
湿润的红色纸条放入氯气瓶中
有色的鲜花放入氯气瓶中
没有现象
纸条褪色
鲜花褪色
2.氯水中一定产生了一种新的漂白性物质
-1
0
+1
+5
+3
+7
+4
单质
氧化物
酸
盐
HClO (次氯酸)
HCl
HClO2(亚氯酸)
HClO3
HClO4(高氯酸)
KClO3
Cl2
与H2O反应
查阅资料:这几种物质中
只有次氯酸具有漂白性
结论:Cl2 + H2O HCl + HClO(这个反应不完全,有氯分子)
【思考】贝托莱发现氯水露置在日光下会失去漂白能力,同时产生盐酸和氧气,解释原因?
HClO:
不稳定性,光照条件下分解产生盐酸和氧气。
2HClO 2HCl + O2
光照
HClO的性质
(1)弱酸性:__________________________________
(2)不稳定性:________________________________
(3)强氧化性:次氯酸具有强氧化性,可用于自来水的杀菌、消毒,以及漂白剂。
HClO H++ClO-
2HClO 2HCl + O2
光照
氯水需要如何保存?
现用现配,保存在棕色细口瓶中
氯水的成分和性质
(1)反应原理:Cl2 + H2O HCl + HClO、HClO H++ClO- H2O H++OH-
(2)新制氯水中所含的微粒:__________________________________________
(3)新制氯水的性质及原因
性质 理论解释 考点
显浅黄绿色 溶有Cl2
具有氧化性 Cl2 、HClO 能与Fe2+、I-、SO2、反应
具有漂白性 HClO 能使有色布条褪色
酸的通性与个性 H+ 、HClO 能使紫色石蕊先变红后褪色
Cl2、H2O、HClO、Cl-、H+、ClO-、OH-
注:不能用pH试纸测量氯水的酸碱性
新制氯水 久置氯水
成分
性质
分析新制氯水和久置氯水的成分及性质:
分子:
Cl2 HClO H2O
离子:
H+ Cl- ClO- OH-
离子:
H2O
H+ Cl- OH-
分子:
有酸性,强氧化性,漂白性
只有酸性
氯气的性质
黄绿色、刺激性气味的有毒气体,易液化,密度大于空气,易溶于水,溶解性约1:2,熔点:-101℃,沸点:-34.6℃
物理性质
与金属的反应
化学性质
与金属钠加热生成NaCl
与水的反应
Cl2 + H2O —— HCl + HClO
与金属铁加热生成FeCl3
与金属铜加热生成CuCl2
与氢气加热生成HCl
与非金属的反应
3.在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是( )
A.新制氯水使红色花瓣褪色,说明Cl2有漂白性
B.向新制氯水中滴加紫色石蕊溶液后,溶液先变红后马上褪色,说明氯水有酸性和漂白性
C.向新制氯水中加入NaOH溶液,氯水黄绿色消失,说明有HClO存在
D.光照新制氯水有气泡逸出,该气体一定是Cl2
B
4.实验表明:将氯水滴加到一片蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是( )
A.内环呈白色外环呈红色或浅红色
B.此实验表明氯水具有酸性、漂白性
C.内外环上颜色的差异表明此变化过程中,中和反应比漂白反应快
D.氯水中形成次氯酸的反应属于复分解反应
D
氯气的性质
第二章 海水中的重要元素——钠和氯
1.归纳氯气的物理性质,通过氯原子结构预测氯气的主要化学性质并用实验加以验证
2.探究新制氯水的成分
3.在价类二维图上总结氯气的化学性质,形成基于物质类别、元素价态和原子结构对物质性质进行预测和检验的认知模型
从材料中体现了氯气哪些物理性质?
京沪高速公路淮安路段液氯的泄漏
2005年3月29日,京沪高速公路淮安路段一辆满载液氯的液罐车和对面来车相撞 ,大量液氯外泄。据目击者描述 : “一股黄绿色的气体 ‘唰’地射向空中,并有刺鼻的味道,眼睛也熏得睁不开 。”
事发后消防队员不断地用水枪喷射,但还是造成350人中毒进医院救治, 28人中毒死亡,附近居民采取应急措施,疏散到高坡上。
一、氯气的物理性质
颜色
气味
密度
水溶性
熔沸点
黄绿色
有刺激性气味
密度比空气大
能溶于水(1体积水可溶解2体积氯气)
易液化——加压液化,贮存在钢瓶中
闻气体及未知气体的方法:
用手在瓶口轻轻扇动,仅使极少量气体进入鼻孔。
氯气有毒,对眼睛黏膜和皮肤有高度刺激性;不仅如此,吸入氯气还会刺激呼吸道,使人咳嗽不止。特别说明:有毒不是物理性质。
二、预测氯气的化学性质
-1
0
Cl2
与非金属反应
与金属反应
回忆:我们初中学习过一种氧化性气体O2
它可以与哪些物质发生反应呢?
Na
非金属
金属
预测:
P
S
Mg
Fe
H2
氧化性
结构:
性质:
现象:黄色火焰,产生大量白烟
2Na+Cl2 2NaCl
点燃
2Fe+3Cl2 2FeCl3
点燃
(1) 与金属反应
产生大量棕红色烟,产物的水溶液呈棕黄色
氯气与变价金属反应生成高价态吗?
产生大量棕黄色烟,水溶液呈蓝绿色
点燃
Cu + Cl2 CuCl2
Tips:
氯化亚铜CuCl是难溶于水的白色固体
反应规律:氯气和变价金属反应时生成高价金属氯化物
(2) 与非金属H2反应
H2+Cl2 2HCl
点燃
实验现象:
氢气在氯气中安静燃烧
发出苍白色火焰
瓶口有白雾出现
思考:燃烧是否一定需要氧气参加,燃烧的本质是什么?
燃烧的本质是氧化还原反应,所有发光发热的剧烈的化学反应都称为燃烧。
【思考】在海带提碘工艺中,2I-+ Cl2 ===2Cl-+I2是重要的步骤之一,在该步骤中氯气的作用是什么?
海带
碘( I2 )
富集、分离提纯、转化
氯气有强氧化性,请从氧化还原角度出发,试着总结归纳一下,氯气可以跟哪些常见的物质发生反应?
I-、Br-、Fe2+、SO2、
1. Cl2与FeCl2溶液反应:Cl2+2FeCl2=2FeCl3
2. Cl2与KI溶液反应:Cl2+2KI=2KCl+I2
3. Cl2与SO2的水溶液反应:Cl2+SO2+2H2O=2HCl+H2SO4
4. 与Na2S反应:Cl2+Na2S=2NaCl+S↓
5. 与NH3反应:8NH3+3Cl2=N2+6NH4Cl
1.生活中可以用氯气灌洞的方法来消灭田鼠,这是利用了氯气的哪些性质( )
①密度比空气大 ②易液化 ③能溶于水 ④有毒
A.①② B.③④ C.④ D.①④
D
2.制备氯化物时,常用两种方法:
①用金属与氯气直接化合制得;②用金属与盐酸反应制得。
用以上两种方法都可制得的氯化物是 ( )
A. AlCl3 B. FeCl3 C. FeCl2 D. CuCl2
A
科学史话2
法国化学家贝托莱在研究氯气时发现,氯气溶于水后形成的溶液(称为“氯水” )有漂白性,露置在日光下会失去漂白能力,同时产生盐酸和氧气,因此他推断氯气是一种含氧化合物。
贝托莱
(1748-1822)
溶液呈现黄绿色说明存在Cl2分子。如果反应,可能会生成什么产物呢?
(3) 氯气溶于水?是简单的溶解还是发生了化学反应?
预测1:Cl2、H2O根据原子守恒,可能会生成Cl-、H+
目的 预测现象 实验现象
检验Cl-
检验H+
溶液中存在H+
溶液中存在Cl-
结论:氯气溶于水发生了化学反应,生成了HCl
硝酸酸化的硝酸银产生白色沉淀
试纸变红色,之后又褪色
与预测现象一致
紫色的石蕊溶液变红色
设计实验进行验证(演示实验):
预测2: 使试纸褪色的难道是Cl2?氯气具有漂白性吗?
操作 实验现象
实验结论:1.干燥的氯气不具有漂白性,湿润的氯气具有漂白性
干燥的红色纸条放入氯气瓶中
湿润的红色纸条放入氯气瓶中
有色的鲜花放入氯气瓶中
没有现象
纸条褪色
鲜花褪色
2.氯水中一定产生了一种新的漂白性物质
-1
0
+1
+5
+3
+7
+4
单质
氧化物
酸
盐
HClO (次氯酸)
HCl
HClO2(亚氯酸)
HClO3
HClO4(高氯酸)
KClO3
Cl2
与H2O反应
查阅资料:这几种物质中
只有次氯酸具有漂白性
结论:Cl2 + H2O HCl + HClO(这个反应不完全,有氯分子)
【思考】贝托莱发现氯水露置在日光下会失去漂白能力,同时产生盐酸和氧气,解释原因?
HClO:
不稳定性,光照条件下分解产生盐酸和氧气。
2HClO 2HCl + O2
光照
HClO的性质
(1)弱酸性:__________________________________
(2)不稳定性:________________________________
(3)强氧化性:次氯酸具有强氧化性,可用于自来水的杀菌、消毒,以及漂白剂。
HClO H++ClO-
2HClO 2HCl + O2
光照
氯水需要如何保存?
现用现配,保存在棕色细口瓶中
氯水的成分和性质
(1)反应原理:Cl2 + H2O HCl + HClO、HClO H++ClO- H2O H++OH-
(2)新制氯水中所含的微粒:__________________________________________
(3)新制氯水的性质及原因
性质 理论解释 考点
显浅黄绿色 溶有Cl2
具有氧化性 Cl2 、HClO 能与Fe2+、I-、SO2、反应
具有漂白性 HClO 能使有色布条褪色
酸的通性与个性 H+ 、HClO 能使紫色石蕊先变红后褪色
Cl2、H2O、HClO、Cl-、H+、ClO-、OH-
注:不能用pH试纸测量氯水的酸碱性
新制氯水 久置氯水
成分
性质
分析新制氯水和久置氯水的成分及性质:
分子:
Cl2 HClO H2O
离子:
H+ Cl- ClO- OH-
离子:
H2O
H+ Cl- OH-
分子:
有酸性,强氧化性,漂白性
只有酸性
氯气的性质
黄绿色、刺激性气味的有毒气体,易液化,密度大于空气,易溶于水,溶解性约1:2,熔点:-101℃,沸点:-34.6℃
物理性质
与金属的反应
化学性质
与金属钠加热生成NaCl
与水的反应
Cl2 + H2O —— HCl + HClO
与金属铁加热生成FeCl3
与金属铜加热生成CuCl2
与氢气加热生成HCl
与非金属的反应
3.在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是( )
A.新制氯水使红色花瓣褪色,说明Cl2有漂白性
B.向新制氯水中滴加紫色石蕊溶液后,溶液先变红后马上褪色,说明氯水有酸性和漂白性
C.向新制氯水中加入NaOH溶液,氯水黄绿色消失,说明有HClO存在
D.光照新制氯水有气泡逸出,该气体一定是Cl2
B
4.实验表明:将氯水滴加到一片蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是( )
A.内环呈白色外环呈红色或浅红色
B.此实验表明氯水具有酸性、漂白性
C.内外环上颜色的差异表明此变化过程中,中和反应比漂白反应快
D.氯水中形成次氯酸的反应属于复分解反应
D
