2.3 课时4 物质的量浓度 课件 (共36张PPT)2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 2.3 课时4 物质的量浓度 课件 (共36张PPT)2024-2025学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 28.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 10:32:12 | ||
图片预览









文档简介
(共36张PPT)
物质的量浓度
第二章 海水中的重要元素——钠和氯
1.理解物质的量浓度的概念
2.运用物质的量、摩尔质量及物质的量浓度之间的关系进行简单计算
3.认识容量瓶,初步学会配制一定物质的量浓度溶液的方法和技能,通过对实验细节的分析,发展定量研究的意识
初中化学,哪个物理量可定量表示溶液浓度大小?
一、物质的量浓度
1、定义:
2、表达式:
3、单位:
单位体积溶液里所含溶质B的物质的量。 cB表示。
cB=nB/V
mol/L或 mol·L-1
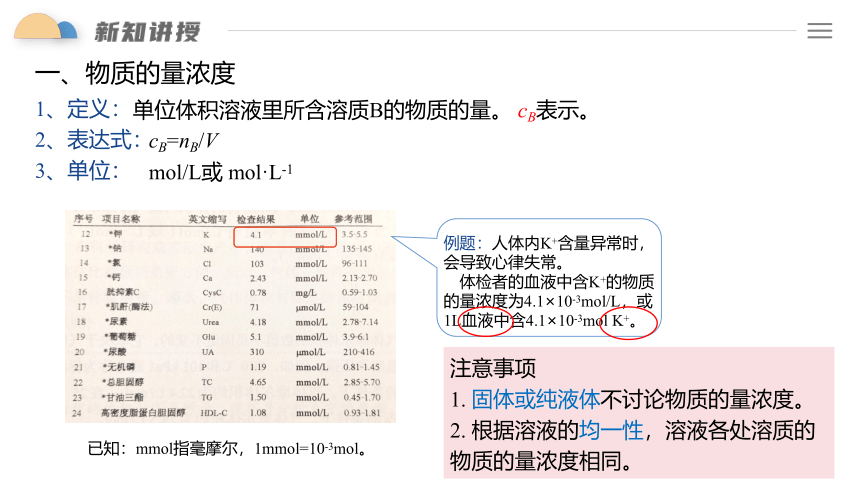
例题:人体内K+含量异常时,会导致心律失常。
体检者的血液中含K+的物质的量浓度为4.1×10-3mol/L,或1L血液中含4.1×10-3mol K+。
已知:mmol指毫摩尔,1mmol=10-3mol。
注意事项
1. 固体或纯液体不讨论物质的量浓度。
2. 根据溶液的均一性,溶液各处溶质的物质的量浓度相同。
【学以致用】
问题1:表示什么含义?
问题2:为模拟检测该血液中葡萄糖含量,需配制相同浓度葡萄糖的溶液,现将10.2mmol葡萄糖可配制多少升?
问题3:抽取5 mL该血液,含甘油三酯多少摩尔?
2L
7.5×10-6mol
1L血液中含2.43×10-3mol Ca2+
已知:mmol指毫摩尔,1mmol=10-3mol。
判断下列说法是否正确。
(1)将 1g NaCl溶于水制成1L溶液 ,则该溶液的物质的量浓度为1mol/L。
(2)将58.5 gNaCl完全溶解于1 L水中,所得溶液中NaCl的物质的量浓度为1mol/L。
(3)1L食盐水中溶有1 mol NaCl,该溶液中NaCl物质的量浓度为1mol/L。
(4)从1L 2mol/L的稀硫酸中取出0.5 L, 则这0.5L溶液中硫酸的物质的量浓度为1 mol/L 。
(5)2mol/L的BaCl2溶液中Ba2+ 的物质的量浓度为2mol/L , Cl- 的物质的量浓度为4mol/L。
例题:医用生理盐水的物质的量浓度为0.154mol/L,欲配制500mL该溶液:
n 、c、m的转换关系
解:nB =cBVB=0.154mol/L×0.5L=0.077mol
m = nBM=0.077mol×58.5g/mol=4.5045g
(2)需要称取的质量是多少?
(1)需要NaCl的物质的量是多少?
【学以致用】
电镀工业排放的废水中常含有大量的Ag+,为了检测某电镀工厂排放电镀的经过处理后的废水是否达标,现检测该废水中是否还含有大量Ag+。
解:nB = cBVB=1.00mol/L×0.1L=0.1mol
m = nBM=0.1mol×5.85g/mol=5.85g
(1)欲配制100mL1.00mol/L NaCl溶液,需称取多少克NaCl?
例题:浓硫酸的稀释
做实验需使用250mL 1.0mol/L的稀硫酸,目前实验室仅有浓度为18mol/L 的浓硫酸,需量取该浓硫酸多少升?
类比:
将质量分数为98%的浓硫酸稀释为100g 质量分数为19.6%的稀硫酸,需要浓硫酸的质量是多少克?
已学:m(浓)= m(稀)
m(浓)·ω(浓)= m(稀)·ω(稀)
新知:n(浓)= n(稀)
c(浓)·V(浓)= c(稀)·V(稀)
0.25L×1.0mol/L= 18mol/L·V
V≈ 0.0139L
【学以致用】
电镀工业排放的废水中常含有大量的Ag+,为了检测某电镀工厂排放电镀的经过处理后的废水是否达标,现检测该废水中是否还含有大量Ag+。
c(浓)·V(浓)= c(稀)·V(稀)
1.00mol/L·V = 0.5mol/L×0.1L
V=0.05L
(2)实验时要将配置好的1.00mol/LNaCl溶液稀释为100mL 0.5mol/L ,需量取多少升该浓溶液?
(1)欲配制100mL1.00mol/L NaCl溶液,需称取多少克NaCl?
5.85g
如何配制?
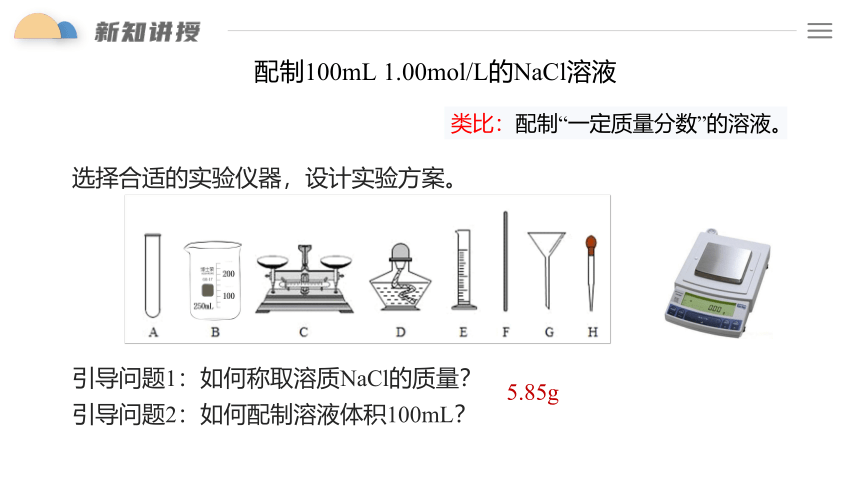
配制100mL 1.00mol/L的NaCl溶液
选择合适的实验仪器,设计实验方案。
引导问题1:如何称取溶质NaCl的质量?
引导问题2:如何配制溶液体积100mL?
类比:配制“一定质量分数”的溶液。
5.85g
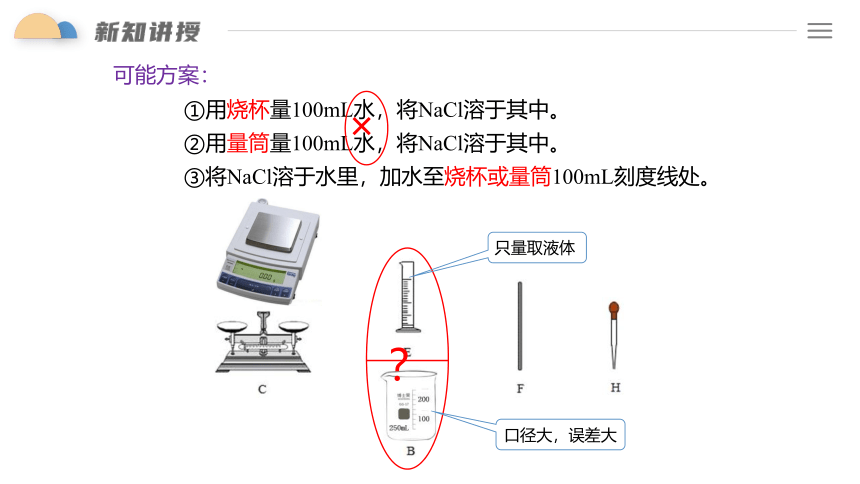
可能方案:
①用烧杯量100mL水,将NaCl溶于其中。
②用量筒量100mL水,将NaCl溶于其中。
③将NaCl溶于水里,加水至烧杯或量筒100mL刻度线处。
?
口径大,误差大
只量取液体
×
容量瓶简介:
一条刻度线
温度
容积
(1)构造:
(2)常见规格:
(3)按颜色分类:
50mL、100mL、250mL、500mL,1000mL;
无色、棕色。
1.使用前、使用完毕,应怎样操作?
2.配好的溶液保存在容量瓶里吗?
3.若配制NaOH溶液,能否直接将称取的NaOH固体放入容量瓶?
①使用前:要先检查是否漏水。
查漏的操作程序:加水→塞瓶塞→倒立→查漏→瓶塞旋转180°→倒立→查漏。
使用后:洗净、晾干。
②不能长期存放溶液或进行化学反应;
③只能用于配制溶液,溶解(或稀释)的操作不能在容量瓶中进行。
容量瓶使用的主要事项:
【活动】 观看实验,回答问题
1. 溶液配制的仪器及步骤?
2. 转移溶液时为什么要用玻璃棒?
3. 容量瓶中溶液接近瓶颈刻度时,为什么要改用胶头滴管加水?
4. 教材P56“思考与交流”:
【活动】 观看实验,回答问题
1. 溶液配制的仪器及步骤?
2. 转移溶液时为什么要用玻璃棒?
3. 容量瓶中溶液接近瓶颈刻度时,为什么要改用胶头滴管加水?
4. 教材P56“思考与交流”:
计算、称取、溶解(冷却)、转移、洗涤、定容、摇匀、装瓶 。
天平、药匙、量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管。
防止液体洒出
(1)将溶质全部转移到容量瓶;
(2)小;
(3)俯视:V减小,c变大;
仰视:V增大,c变小。
逐滴滴加,减小误差
误差分析
能引起误差的一些操作 c/
mol·L-1
托盘 天平 (1)药品、砝码左右位置颠倒(移动游码) ______
(2)称量易潮解的物质(如NaOH)时间过长 ______
量筒 (3)用量筒量取液体(溶质)时,仰视读数 ______
(4)用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中 ______
偏小
偏小
偏大
偏大
能引起误差的一些操作 c/mol·L-1
烧杯及 玻璃棒 (5)溶解前烧杯内有水 _______
(6)溶质含有其他杂质 ______
(7)搅拌时部分液体溅出 ______
(8)移液后未洗涤烧杯和玻璃棒 ______
无影响
偏小
偏小
偏小
能引起误差的一些操作 c/mol·L-1
容量瓶 (9)未冷却到室温就注入容量瓶定容 ______
(10)向容量瓶转移溶液时有少量液体流出 ______
(11)定容时,水加多了,用滴管吸出 ______
(12)定容后,经振荡、摇匀、静置,液面下降再加水 ______
(13)定容时,仰视读刻度数 ______
(14)定容时,俯视读刻度数 ______
(15)配好的溶液装入干净的试剂瓶时,不慎溅出部分溶液 ________
偏大
偏小
偏小
偏小
偏小
偏大
无影响
归纳:
2. 溶液的稀释
(1)仪器:
(2)步骤:
思考:若将配制好的1.00mol/L NaCl溶液配制成100mL 0.5mol/L的NaCl溶液。
浓硫酸
(3)浓硫酸稀释的注意事项:
计算、量取(量筒)、稀释(冷却)、转移、洗涤、定容、摇匀、装瓶。
同上。
1、酸入水;
2、冷却至室温再转移。
类比学习,自主归纳
下列各溶液中氯离子(Cl-)的物质的量浓度最大的是( )
A.200mL,0.5mol·L-1的FeCl3溶液
B.100mL,0.5mol·L-1的MgCl2溶液
C.150mL,1mol·L-1的NaCl溶液
D.50mL,0.5mol·L-1的CuCl2溶液
A
下列说法中正确的是 ( )
A. 1 mol/L的NaCl溶液是指此溶液中含有1 mol NaCl
B. 从1 L 0.5 mol/L的NaCl溶液中取出100 mL溶液,其物质的量浓度变为0.1 mol/L
C. 0 ℃时,1 mol Cl2的体积约为22.4 L
D. 1 mol/L的CaCl2溶液中Cl﹣的物质的量浓度为2 mol/L
D
将4 g NaOH固体完全溶解在水里,配成100 mL溶液,从中取出10 mL,加水稀释至50 mL,所得溶液的物质的量浓度是( )
A.0.2 mol·L-1
B.0.02 mol·L-1
C.1 mol·L-1
D.0.1 mol·L-1
A
n总
V总
混合溶液物质的量浓度的计算(忽略体积变化)
例题: 200mL 0.1mol/L的盐酸和100mL 0.4mol/L的盐酸混合后(忽略体积变化),求混合溶液中盐酸的物质的量浓度。
c (HCl) =
200mL ×0. 1mol/L + 100mL ×0. 4mol/L
200mL+ 100mL
= 0. 2mol/ L
解:
c (混) = =
c1 V1 + c2V2+ ……
V1+V2+……
c (Cl-) =
50mL ×0. 5mol/L ×2 + 100mL ×0. 5mol/L
50mL+ 100mL
= 0. 67 mol/ L
变式:50mL 0.5mol/LBaCl2溶液和100mL 0.5mol/LNaCl溶液混合后,求溶液中Cl- 的物质的量浓度 。(设溶液体积变化忽略不计)。
根据质量分数求算
V(aq)
mB
MB
=
m液×ωB
MB×V(aq)
1000ρV(aq)×ωB
MB×V(aq)
=
=
结论:c=1000ρω/M (直接使用)
ρ
(注意:密度(ρ )的单位为g/mL)
推导过程
m质
m液
ω =
×100%
例1、36.5%的盐酸,密度为1.19g/cm3,求c
c(HCl) =
1.19g/cm3×1000× 36.5%
36.5g/mol
=11.9mol/L
练习1、 98%的硫酸,密度1.84g/cm3,求c
c(H2SO4 )=
1000× 1.84g/mL× 98%
98g/mol
=18.4mol/L
c = ───────
1000×ρ× ω
M
ρ单位为g/cm3
练习2、 12mol/L,密度为1.32g/cm3的硝酸溶液的质量分数
ω=
12mol/L×63g/mol
1.32g/cm3×1000
=57.3%
物质的量浓度
物质的量浓度
概念:单位体积的溶液里所含溶质B的物质的量,也称B的物质的量浓度
符号:CB
常用单位:mol/L(或 mol·L-1)
物质的量浓度的相关计算
已知溶液的体积和物质的量浓度,求解溶质的质量
1.实验室工作人员现用Na2CO3·10H2O晶体配制0.2 mol·L-1的Na2CO3溶液480 mL。请回答下列问题:
(1)配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、天平、量筒和_______。
(2)应称取Na2CO3·10H2O晶体的质量:________。从所配溶液中取出100 mL溶液,取出溶液中的Na+的物质的量浓度为_______。
500 mL容量瓶
28.6 g
0.4 mol·L-1
(3)下列主要操作步骤的正确顺序是___________(填序号)。
①称取一定质量的Na2CO3·10H2O晶体,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
①③⑤②④
(4)根据下列操作对所配溶液的浓度产生的影响,完成下列问题:
①Na2CO3·10H2O晶体失去了部分结晶水
②用“左码右物”的称量方法称量晶体(使用游码)
③碳酸钠晶体不纯,其中混有氯化钠
④称量碳酸钠晶体时所用砝码生锈
⑤容量瓶未经干燥使用
其中引起所配溶液浓度偏高的有________(填序号,下同),无影响的有_____。
①④
⑤
2.某“84”消毒液部分标签如下图所示,回答下列问题:
(1)计算该“84”消毒液的物质的量浓度_______mol·L-1(保留小数点后一位)。
(2)某实验需用480mL 2.0mol·L-1NaClO的消毒液,现用NaClO固体配制。需要用托盘天平称量NaClO的固体质量为_______g;
(3)在配制过程中,除需要烧杯、托盘天平、玻璃棒外还必需的仪器有(写两种)_______。
净含量:500mL密度:1.19g·cm-3
主要成分:25%NaClO(NaClO的摩尔质量74.5g·mol-1)
注意事项:密封保存
胶头滴管、500mL容量瓶(或药匙)
4.0
74.5
(4)下列操作可能使配制溶液浓度偏低的是(填字母)______。
A.移液时,未洗涤烧杯内壁和玻璃棒
B.溶解后未经冷却就移液
C.移液时,有少量液体溅出
D.定容时,俯视刻度线
E.容量瓶用蒸馏水洗净后,没烘干就直接使用
(5)取出配制准确的该溶液100mL,再加入28.4克Na2SO4(Na2SO4的摩尔质量142 g·mol-1)固体,将其溶解并配成500mL溶液,此时溶液中Na+的物质的量浓度为_______mol·L-1。
1.2
AC
3.某小组用12 mol/L浓盐酸配制480 mL1 mol/L稀盐酸,下列说法正确的是( )
A.需要用量筒量取40.0 mL浓盐酸
B.稀释后的浓盐酸可直接倒入容量瓶中
C.该实验需要的仪器有托盘天平、烧杯、玻璃棒、容量瓶等
D.定容时仰视刻度线,会使所配溶液浓度偏低
D
4.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.1 mol/L CaCl2溶液中含有Cl-的数目为2NA
B.标准状况下,NA个H2O分子所占体积为22.4 L
C.1.0 L 的0.5 mol/L Na2SO4水溶液中含有的氧原子数为2NA
D.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
D
5.向100 mL 0.5 mol/L的Na2CO3溶液中加入一定体积的1 mol/L的盐酸,恰好完全反应。计算:
(1)加入盐酸的体积;
(2)反应生成气体的体积(标准状况);
(3)假设反应前后溶液体积不变,所得溶液中Na+的物质的量的浓度;
(4)将1 L 0.5 mol/L的Na2CO3溶液稀释为0.1 mol/L,所得溶液的体积。
(1) 100 mL (2) 1.12 L (3) 0.5 mol/L (4) 5 L
物质的量浓度
第二章 海水中的重要元素——钠和氯
1.理解物质的量浓度的概念
2.运用物质的量、摩尔质量及物质的量浓度之间的关系进行简单计算
3.认识容量瓶,初步学会配制一定物质的量浓度溶液的方法和技能,通过对实验细节的分析,发展定量研究的意识
初中化学,哪个物理量可定量表示溶液浓度大小?
一、物质的量浓度
1、定义:
2、表达式:
3、单位:
单位体积溶液里所含溶质B的物质的量。 cB表示。
cB=nB/V
mol/L或 mol·L-1
例题:人体内K+含量异常时,会导致心律失常。
体检者的血液中含K+的物质的量浓度为4.1×10-3mol/L,或1L血液中含4.1×10-3mol K+。
已知:mmol指毫摩尔,1mmol=10-3mol。
注意事项
1. 固体或纯液体不讨论物质的量浓度。
2. 根据溶液的均一性,溶液各处溶质的物质的量浓度相同。
【学以致用】
问题1:表示什么含义?
问题2:为模拟检测该血液中葡萄糖含量,需配制相同浓度葡萄糖的溶液,现将10.2mmol葡萄糖可配制多少升?
问题3:抽取5 mL该血液,含甘油三酯多少摩尔?
2L
7.5×10-6mol
1L血液中含2.43×10-3mol Ca2+
已知:mmol指毫摩尔,1mmol=10-3mol。
判断下列说法是否正确。
(1)将 1g NaCl溶于水制成1L溶液 ,则该溶液的物质的量浓度为1mol/L。
(2)将58.5 gNaCl完全溶解于1 L水中,所得溶液中NaCl的物质的量浓度为1mol/L。
(3)1L食盐水中溶有1 mol NaCl,该溶液中NaCl物质的量浓度为1mol/L。
(4)从1L 2mol/L的稀硫酸中取出0.5 L, 则这0.5L溶液中硫酸的物质的量浓度为1 mol/L 。
(5)2mol/L的BaCl2溶液中Ba2+ 的物质的量浓度为2mol/L , Cl- 的物质的量浓度为4mol/L。
例题:医用生理盐水的物质的量浓度为0.154mol/L,欲配制500mL该溶液:
n 、c、m的转换关系
解:nB =cBVB=0.154mol/L×0.5L=0.077mol
m = nBM=0.077mol×58.5g/mol=4.5045g
(2)需要称取的质量是多少?
(1)需要NaCl的物质的量是多少?
【学以致用】
电镀工业排放的废水中常含有大量的Ag+,为了检测某电镀工厂排放电镀的经过处理后的废水是否达标,现检测该废水中是否还含有大量Ag+。
解:nB = cBVB=1.00mol/L×0.1L=0.1mol
m = nBM=0.1mol×5.85g/mol=5.85g
(1)欲配制100mL1.00mol/L NaCl溶液,需称取多少克NaCl?
例题:浓硫酸的稀释
做实验需使用250mL 1.0mol/L的稀硫酸,目前实验室仅有浓度为18mol/L 的浓硫酸,需量取该浓硫酸多少升?
类比:
将质量分数为98%的浓硫酸稀释为100g 质量分数为19.6%的稀硫酸,需要浓硫酸的质量是多少克?
已学:m(浓)= m(稀)
m(浓)·ω(浓)= m(稀)·ω(稀)
新知:n(浓)= n(稀)
c(浓)·V(浓)= c(稀)·V(稀)
0.25L×1.0mol/L= 18mol/L·V
V≈ 0.0139L
【学以致用】
电镀工业排放的废水中常含有大量的Ag+,为了检测某电镀工厂排放电镀的经过处理后的废水是否达标,现检测该废水中是否还含有大量Ag+。
c(浓)·V(浓)= c(稀)·V(稀)
1.00mol/L·V = 0.5mol/L×0.1L
V=0.05L
(2)实验时要将配置好的1.00mol/LNaCl溶液稀释为100mL 0.5mol/L ,需量取多少升该浓溶液?
(1)欲配制100mL1.00mol/L NaCl溶液,需称取多少克NaCl?
5.85g
如何配制?
配制100mL 1.00mol/L的NaCl溶液
选择合适的实验仪器,设计实验方案。
引导问题1:如何称取溶质NaCl的质量?
引导问题2:如何配制溶液体积100mL?
类比:配制“一定质量分数”的溶液。
5.85g
可能方案:
①用烧杯量100mL水,将NaCl溶于其中。
②用量筒量100mL水,将NaCl溶于其中。
③将NaCl溶于水里,加水至烧杯或量筒100mL刻度线处。
?
口径大,误差大
只量取液体
×
容量瓶简介:
一条刻度线
温度
容积
(1)构造:
(2)常见规格:
(3)按颜色分类:
50mL、100mL、250mL、500mL,1000mL;
无色、棕色。
1.使用前、使用完毕,应怎样操作?
2.配好的溶液保存在容量瓶里吗?
3.若配制NaOH溶液,能否直接将称取的NaOH固体放入容量瓶?
①使用前:要先检查是否漏水。
查漏的操作程序:加水→塞瓶塞→倒立→查漏→瓶塞旋转180°→倒立→查漏。
使用后:洗净、晾干。
②不能长期存放溶液或进行化学反应;
③只能用于配制溶液,溶解(或稀释)的操作不能在容量瓶中进行。
容量瓶使用的主要事项:
【活动】 观看实验,回答问题
1. 溶液配制的仪器及步骤?
2. 转移溶液时为什么要用玻璃棒?
3. 容量瓶中溶液接近瓶颈刻度时,为什么要改用胶头滴管加水?
4. 教材P56“思考与交流”:
【活动】 观看实验,回答问题
1. 溶液配制的仪器及步骤?
2. 转移溶液时为什么要用玻璃棒?
3. 容量瓶中溶液接近瓶颈刻度时,为什么要改用胶头滴管加水?
4. 教材P56“思考与交流”:
计算、称取、溶解(冷却)、转移、洗涤、定容、摇匀、装瓶 。
天平、药匙、量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管。
防止液体洒出
(1)将溶质全部转移到容量瓶;
(2)小;
(3)俯视:V减小,c变大;
仰视:V增大,c变小。
逐滴滴加,减小误差
误差分析
能引起误差的一些操作 c/
mol·L-1
托盘 天平 (1)药品、砝码左右位置颠倒(移动游码) ______
(2)称量易潮解的物质(如NaOH)时间过长 ______
量筒 (3)用量筒量取液体(溶质)时,仰视读数 ______
(4)用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中 ______
偏小
偏小
偏大
偏大
能引起误差的一些操作 c/mol·L-1
烧杯及 玻璃棒 (5)溶解前烧杯内有水 _______
(6)溶质含有其他杂质 ______
(7)搅拌时部分液体溅出 ______
(8)移液后未洗涤烧杯和玻璃棒 ______
无影响
偏小
偏小
偏小
能引起误差的一些操作 c/mol·L-1
容量瓶 (9)未冷却到室温就注入容量瓶定容 ______
(10)向容量瓶转移溶液时有少量液体流出 ______
(11)定容时,水加多了,用滴管吸出 ______
(12)定容后,经振荡、摇匀、静置,液面下降再加水 ______
(13)定容时,仰视读刻度数 ______
(14)定容时,俯视读刻度数 ______
(15)配好的溶液装入干净的试剂瓶时,不慎溅出部分溶液 ________
偏大
偏小
偏小
偏小
偏小
偏大
无影响
归纳:
2. 溶液的稀释
(1)仪器:
(2)步骤:
思考:若将配制好的1.00mol/L NaCl溶液配制成100mL 0.5mol/L的NaCl溶液。
浓硫酸
(3)浓硫酸稀释的注意事项:
计算、量取(量筒)、稀释(冷却)、转移、洗涤、定容、摇匀、装瓶。
同上。
1、酸入水;
2、冷却至室温再转移。
类比学习,自主归纳
下列各溶液中氯离子(Cl-)的物质的量浓度最大的是( )
A.200mL,0.5mol·L-1的FeCl3溶液
B.100mL,0.5mol·L-1的MgCl2溶液
C.150mL,1mol·L-1的NaCl溶液
D.50mL,0.5mol·L-1的CuCl2溶液
A
下列说法中正确的是 ( )
A. 1 mol/L的NaCl溶液是指此溶液中含有1 mol NaCl
B. 从1 L 0.5 mol/L的NaCl溶液中取出100 mL溶液,其物质的量浓度变为0.1 mol/L
C. 0 ℃时,1 mol Cl2的体积约为22.4 L
D. 1 mol/L的CaCl2溶液中Cl﹣的物质的量浓度为2 mol/L
D
将4 g NaOH固体完全溶解在水里,配成100 mL溶液,从中取出10 mL,加水稀释至50 mL,所得溶液的物质的量浓度是( )
A.0.2 mol·L-1
B.0.02 mol·L-1
C.1 mol·L-1
D.0.1 mol·L-1
A
n总
V总
混合溶液物质的量浓度的计算(忽略体积变化)
例题: 200mL 0.1mol/L的盐酸和100mL 0.4mol/L的盐酸混合后(忽略体积变化),求混合溶液中盐酸的物质的量浓度。
c (HCl) =
200mL ×0. 1mol/L + 100mL ×0. 4mol/L
200mL+ 100mL
= 0. 2mol/ L
解:
c (混) = =
c1 V1 + c2V2+ ……
V1+V2+……
c (Cl-) =
50mL ×0. 5mol/L ×2 + 100mL ×0. 5mol/L
50mL+ 100mL
= 0. 67 mol/ L
变式:50mL 0.5mol/LBaCl2溶液和100mL 0.5mol/LNaCl溶液混合后,求溶液中Cl- 的物质的量浓度 。(设溶液体积变化忽略不计)。
根据质量分数求算
V(aq)
mB
MB
=
m液×ωB
MB×V(aq)
1000ρV(aq)×ωB
MB×V(aq)
=
=
结论:c=1000ρω/M (直接使用)
ρ
(注意:密度(ρ )的单位为g/mL)
推导过程
m质
m液
ω =
×100%
例1、36.5%的盐酸,密度为1.19g/cm3,求c
c(HCl) =
1.19g/cm3×1000× 36.5%
36.5g/mol
=11.9mol/L
练习1、 98%的硫酸,密度1.84g/cm3,求c
c(H2SO4 )=
1000× 1.84g/mL× 98%
98g/mol
=18.4mol/L
c = ───────
1000×ρ× ω
M
ρ单位为g/cm3
练习2、 12mol/L,密度为1.32g/cm3的硝酸溶液的质量分数
ω=
12mol/L×63g/mol
1.32g/cm3×1000
=57.3%
物质的量浓度
物质的量浓度
概念:单位体积的溶液里所含溶质B的物质的量,也称B的物质的量浓度
符号:CB
常用单位:mol/L(或 mol·L-1)
物质的量浓度的相关计算
已知溶液的体积和物质的量浓度,求解溶质的质量
1.实验室工作人员现用Na2CO3·10H2O晶体配制0.2 mol·L-1的Na2CO3溶液480 mL。请回答下列问题:
(1)配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、天平、量筒和_______。
(2)应称取Na2CO3·10H2O晶体的质量:________。从所配溶液中取出100 mL溶液,取出溶液中的Na+的物质的量浓度为_______。
500 mL容量瓶
28.6 g
0.4 mol·L-1
(3)下列主要操作步骤的正确顺序是___________(填序号)。
①称取一定质量的Na2CO3·10H2O晶体,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
①③⑤②④
(4)根据下列操作对所配溶液的浓度产生的影响,完成下列问题:
①Na2CO3·10H2O晶体失去了部分结晶水
②用“左码右物”的称量方法称量晶体(使用游码)
③碳酸钠晶体不纯,其中混有氯化钠
④称量碳酸钠晶体时所用砝码生锈
⑤容量瓶未经干燥使用
其中引起所配溶液浓度偏高的有________(填序号,下同),无影响的有_____。
①④
⑤
2.某“84”消毒液部分标签如下图所示,回答下列问题:
(1)计算该“84”消毒液的物质的量浓度_______mol·L-1(保留小数点后一位)。
(2)某实验需用480mL 2.0mol·L-1NaClO的消毒液,现用NaClO固体配制。需要用托盘天平称量NaClO的固体质量为_______g;
(3)在配制过程中,除需要烧杯、托盘天平、玻璃棒外还必需的仪器有(写两种)_______。
净含量:500mL密度:1.19g·cm-3
主要成分:25%NaClO(NaClO的摩尔质量74.5g·mol-1)
注意事项:密封保存
胶头滴管、500mL容量瓶(或药匙)
4.0
74.5
(4)下列操作可能使配制溶液浓度偏低的是(填字母)______。
A.移液时,未洗涤烧杯内壁和玻璃棒
B.溶解后未经冷却就移液
C.移液时,有少量液体溅出
D.定容时,俯视刻度线
E.容量瓶用蒸馏水洗净后,没烘干就直接使用
(5)取出配制准确的该溶液100mL,再加入28.4克Na2SO4(Na2SO4的摩尔质量142 g·mol-1)固体,将其溶解并配成500mL溶液,此时溶液中Na+的物质的量浓度为_______mol·L-1。
1.2
AC
3.某小组用12 mol/L浓盐酸配制480 mL1 mol/L稀盐酸,下列说法正确的是( )
A.需要用量筒量取40.0 mL浓盐酸
B.稀释后的浓盐酸可直接倒入容量瓶中
C.该实验需要的仪器有托盘天平、烧杯、玻璃棒、容量瓶等
D.定容时仰视刻度线,会使所配溶液浓度偏低
D
4.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.1 mol/L CaCl2溶液中含有Cl-的数目为2NA
B.标准状况下,NA个H2O分子所占体积为22.4 L
C.1.0 L 的0.5 mol/L Na2SO4水溶液中含有的氧原子数为2NA
D.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
D
5.向100 mL 0.5 mol/L的Na2CO3溶液中加入一定体积的1 mol/L的盐酸,恰好完全反应。计算:
(1)加入盐酸的体积;
(2)反应生成气体的体积(标准状况);
(3)假设反应前后溶液体积不变,所得溶液中Na+的物质的量的浓度;
(4)将1 L 0.5 mol/L的Na2CO3溶液稀释为0.1 mol/L,所得溶液的体积。
(1) 100 mL (2) 1.12 L (3) 0.5 mol/L (4) 5 L
