1.1.1 反应热及其测定 课件(共22张ppt) 2024-2025学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.1.1 反应热及其测定 课件(共22张ppt) 2024-2025学年高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 10:31:57 | ||
图片预览








文档简介
(共22张PPT)
反应热及其测定
第一章 化学反应的热效应
重点:认识体系、环境和反应热的概念。
难点:能解释中和反应反应热的测定原理;能根据实验中测定并记录的数据计算反应热。
飞机飞得高,全靠燃油烧,来回狂飞几千里,热量独领风骚。飞机的运行动力来源于航空燃油的燃烧,不同燃料燃烧放出的热量不同,我们如何定量地描述这些过程中的热量变化呢?
C919是中国自主研发的一款大型民用客机
常见放热反应
③ 酸碱
中和反应
①燃烧
④ 大部分化合反应
②金属与水
/酸反应
⑤ 铝热反应
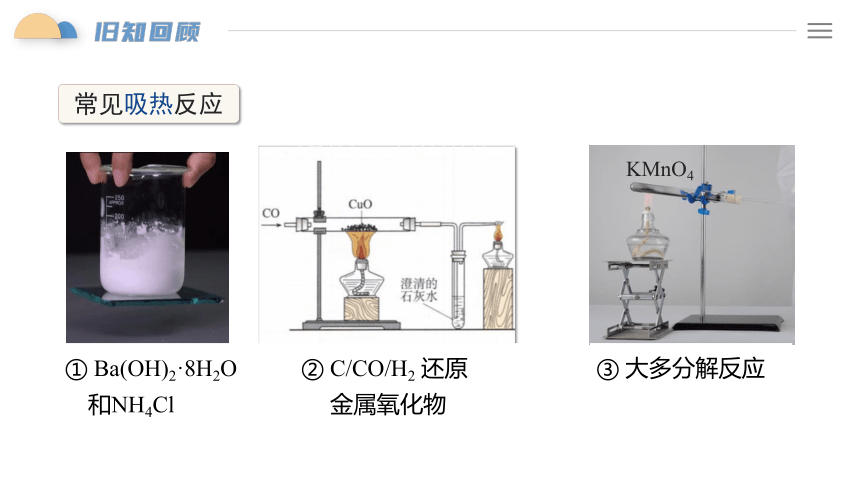
常见吸热反应
① Ba(OH)2·8H2O
和NH4Cl
② C/CO/H2 还原
金属氧化物
③ 大多分解反应
KMnO4
在化学反过程中,物质变化的同时,一定伴随着能量变化。
放热反应
吸热反应
必修二
选择性必修1
如何定量描述反应吸收或释放的能量呢?
一、反应热的概念
在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
等温:指化学反应发生后,使反应后体系的温度恢复到反应前体系的温度,即反应前后体系的温度相等。
以HCl溶液和NaOH溶液反应为例认识体系和环境
盐酸、 NaOH溶液
和发生的反应
研究对象
体系
环境
试管、空气等
与研究对象相互影响的部分
物质/热量交换
热量是指因温度不同而在体系与环境之间交换或传递的能量。
如何测定反应放出的热量?
保温杯式量热计
原理
测量仪器——量热计
二、反应热的测定
许多反应热可以通过量热计直接测定。在反应前后,如果环境的温度没有变化,则反应放出的热量就会使体系的温度升高,这时可以根据测得的体系的温度变化和有关物质的比热容等来计算反应热。
计算公式:Q = CmΔt
Q:反应放出的热量。
m:反应混合液的质量。
C:反应混合液的比热容。
Δt:反应前后溶液温度的差值。
c≈c水=4.18J/(g ℃)
m=ρV,ρ≈ρ水=1.0g/mL
单位:kJ
Δt 应多次测量取平均值
测量仪器:
保温杯式量热计
测定原理:
用温度计测量反应前后体系的温度变化,根据有关物质的比热容等来计算反应热
量热计
现代量热计
简易量热计
简易量热计
使反应物迅速混合,使反应充分进行,保持体系的温度均匀。
测量反应前后体系的温度
反应容器
减少热量散失,
降低实验误差。
减少热量散失,降低实验误差。
以盐酸与NaOH溶液的反应为例
中和反应反应热的测定
防止残留的酸与碱反应,
导致测量的数据不准。
NaOH稍过量,确保盐酸完全反应
减少热量散失
【数据处理】
某小组用50 mL 0.5 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH溶液进行实验。
取三次测量所得温度差的平均值作为计算依据。
实验 次数 反应物的温度/℃ 反应前体系的温度 反应后体系的温度 温度差
盐酸 NaOH溶液 t1/ ℃ t2/ ℃ (t2-t1)/ ℃
1 29.5 29.5 29.5 32.5 3
2 30 29 29.5 32.5 3
3 29.5 29.5 29.5 32.2 3
设溶液的密度均为1 g·cm-3,反应后溶液的比热容c=4.18 J·g-1·℃-1, 则反应放出的热量Q≈ kJ,那么生成1 mol H2O放出的热
量为= = 。
0.418(t2 - t1)
-50.16 kJ·mol-1
思考与讨论
2.实验中是否可以更换温度计?
不能,会存在仪器误差
3.能否测完酸后直接测量碱的温度?那如何操作?
不能,残留的酸与碱反应,造成酸碱消耗,热量损失。测定一种溶液后必须用水冲洗干净并用滤纸擦干再测别的溶液。
4.能否将NaOH分多次倒入热量计中?
不能,操作时动作要快,尽量减少热量的散失
5.玻璃搅拌棒能否用金属搅拌棒代替?
不能。原因是金属质搅拌器易导热,造成热量损失。
1.能否用浓硫酸代替盐酸?对结果会产生什么影响?
不能。浓硫酸溶解于水时放热,所测数值会偏大。
三、中和热
大量实验测得, 在25 ℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol H2O(l)时放出57.3kJ的热量。
H+(aq)+OH-(aq)=H2O(l)
50.16kJ
57.3kJ
VS
我们的数据
大量实验数据
为什么测量值与理论值相比较偏小?
【思考】在实验过程中为提高实验的准确度的措施有哪些?
措施 作用
实验药品用量 采用碱稍过量的方法 保证酸、碱完全中和
实验装置、 仪器选择 内筒和外筒上口对齐,内外筒中间有隔热层 可以减少热量损失
实验过程使用同一支温度计进行温度测量 减少仪器本身的误差,使测量的温度更准确
使用玻璃搅拌器 可以减少热量损失
实验操作 用温度计测量完盐酸的温度后,用水将温度计上的酸冲洗干净,擦干再测量碱溶液的温度 测量的初始温度更准确
将溶液迅速倒入内筒后,立即盖上杯盖 减少热量的损失
重复实验2~3次 测量的温度差更准确
怎么理解57.3 kJ·mol-1
(1)强酸和强碱的稀溶液反应才能保证H+(aq)+OH-(aq)=H2O(l)中和热为57.3 kJ·mol-1,而弱酸或弱碱在中和反应中由于电离吸收热量,其中和热小于57.3 kJ·mol-1;
(2)以生成1 mol液态水为基准。
(3)反应不可以生成沉淀(如Ba(OH)2+H2SO4=BaSO4↓+2H2O)。
浓H2SO4
NaOH
HNO3
Ba(OH)2
H2SO4
HNO3
NH3·H2O
Ba(OH)2
CH3COOH
NaOH
1
2
3
4
5
1. 下列有关中和反应反应热测定实验的说法正确的是( )
A.温度计能代替玻璃搅拌器,用于搅拌反应物
B.强酸与强碱反应生成1molH2O(l)释放的热量都约为57.3kJ
C.测定中和反应反应热实验中,读取混合溶液不再变化的温度为终止温度
D.某同学通过实验测得盐酸和NaOH溶液反应生成lmolH2O(1)放出的热量为52.3kJ,造成这一结果的原因不可能是所用酸、碱溶液浓度过大
D
2.某同学通过实验测出稀盐酸与稀NaOH溶液反应生成1mol水放出的热量为52.3kJ,造成这一结果的原因不可能是的是( )
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入量热计的内筒中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
B
3.某同学设计如图所示实验探究反应中的能量变化。下列判断正确的是( )
A.实验(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将玻璃搅拌器改为铁质搅拌棒对实验结果没有影响
D.实验(c)中若用NaOH固体测定,则测定数值偏高
D
4.在测定中和热的实验中,下列说法正确的是( )
A.使用环形玻璃搅拌器是为了加快反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.用 0.5mol·L-1NaOH 溶液分别与 0.5mol·L-1 的盐酸、醋酸溶液反应,如所取
的溶液体积相等,则测得的中和热数值相同
D.在测定中和热实验中需要使用的仪器有量筒、烧杯、酒精灯、温度计等
A
5.用如图所示的装置进行中和反应反应热的测定。下列说法正确的是( )
A.如图条件下实验过程中没有热量损失
B.玻璃搅拌器可用铜质材料代替
C.为了使反应均匀进行,药品可以分几次加入
D.分别测量NaOH与醋酸和硫酸中和反应的反应热,数值不同
D
反应热及其测定
第一章 化学反应的热效应
重点:认识体系、环境和反应热的概念。
难点:能解释中和反应反应热的测定原理;能根据实验中测定并记录的数据计算反应热。
飞机飞得高,全靠燃油烧,来回狂飞几千里,热量独领风骚。飞机的运行动力来源于航空燃油的燃烧,不同燃料燃烧放出的热量不同,我们如何定量地描述这些过程中的热量变化呢?
C919是中国自主研发的一款大型民用客机
常见放热反应
③ 酸碱
中和反应
①燃烧
④ 大部分化合反应
②金属与水
/酸反应
⑤ 铝热反应
常见吸热反应
① Ba(OH)2·8H2O
和NH4Cl
② C/CO/H2 还原
金属氧化物
③ 大多分解反应
KMnO4
在化学反过程中,物质变化的同时,一定伴随着能量变化。
放热反应
吸热反应
必修二
选择性必修1
如何定量描述反应吸收或释放的能量呢?
一、反应热的概念
在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
等温:指化学反应发生后,使反应后体系的温度恢复到反应前体系的温度,即反应前后体系的温度相等。
以HCl溶液和NaOH溶液反应为例认识体系和环境
盐酸、 NaOH溶液
和发生的反应
研究对象
体系
环境
试管、空气等
与研究对象相互影响的部分
物质/热量交换
热量是指因温度不同而在体系与环境之间交换或传递的能量。
如何测定反应放出的热量?
保温杯式量热计
原理
测量仪器——量热计
二、反应热的测定
许多反应热可以通过量热计直接测定。在反应前后,如果环境的温度没有变化,则反应放出的热量就会使体系的温度升高,这时可以根据测得的体系的温度变化和有关物质的比热容等来计算反应热。
计算公式:Q = CmΔt
Q:反应放出的热量。
m:反应混合液的质量。
C:反应混合液的比热容。
Δt:反应前后溶液温度的差值。
c≈c水=4.18J/(g ℃)
m=ρV,ρ≈ρ水=1.0g/mL
单位:kJ
Δt 应多次测量取平均值
测量仪器:
保温杯式量热计
测定原理:
用温度计测量反应前后体系的温度变化,根据有关物质的比热容等来计算反应热
量热计
现代量热计
简易量热计
简易量热计
使反应物迅速混合,使反应充分进行,保持体系的温度均匀。
测量反应前后体系的温度
反应容器
减少热量散失,
降低实验误差。
减少热量散失,降低实验误差。
以盐酸与NaOH溶液的反应为例
中和反应反应热的测定
防止残留的酸与碱反应,
导致测量的数据不准。
NaOH稍过量,确保盐酸完全反应
减少热量散失
【数据处理】
某小组用50 mL 0.5 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH溶液进行实验。
取三次测量所得温度差的平均值作为计算依据。
实验 次数 反应物的温度/℃ 反应前体系的温度 反应后体系的温度 温度差
盐酸 NaOH溶液 t1/ ℃ t2/ ℃ (t2-t1)/ ℃
1 29.5 29.5 29.5 32.5 3
2 30 29 29.5 32.5 3
3 29.5 29.5 29.5 32.2 3
设溶液的密度均为1 g·cm-3,反应后溶液的比热容c=4.18 J·g-1·℃-1, 则反应放出的热量Q≈ kJ,那么生成1 mol H2O放出的热
量为= = 。
0.418(t2 - t1)
-50.16 kJ·mol-1
思考与讨论
2.实验中是否可以更换温度计?
不能,会存在仪器误差
3.能否测完酸后直接测量碱的温度?那如何操作?
不能,残留的酸与碱反应,造成酸碱消耗,热量损失。测定一种溶液后必须用水冲洗干净并用滤纸擦干再测别的溶液。
4.能否将NaOH分多次倒入热量计中?
不能,操作时动作要快,尽量减少热量的散失
5.玻璃搅拌棒能否用金属搅拌棒代替?
不能。原因是金属质搅拌器易导热,造成热量损失。
1.能否用浓硫酸代替盐酸?对结果会产生什么影响?
不能。浓硫酸溶解于水时放热,所测数值会偏大。
三、中和热
大量实验测得, 在25 ℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol H2O(l)时放出57.3kJ的热量。
H+(aq)+OH-(aq)=H2O(l)
50.16kJ
57.3kJ
VS
我们的数据
大量实验数据
为什么测量值与理论值相比较偏小?
【思考】在实验过程中为提高实验的准确度的措施有哪些?
措施 作用
实验药品用量 采用碱稍过量的方法 保证酸、碱完全中和
实验装置、 仪器选择 内筒和外筒上口对齐,内外筒中间有隔热层 可以减少热量损失
实验过程使用同一支温度计进行温度测量 减少仪器本身的误差,使测量的温度更准确
使用玻璃搅拌器 可以减少热量损失
实验操作 用温度计测量完盐酸的温度后,用水将温度计上的酸冲洗干净,擦干再测量碱溶液的温度 测量的初始温度更准确
将溶液迅速倒入内筒后,立即盖上杯盖 减少热量的损失
重复实验2~3次 测量的温度差更准确
怎么理解57.3 kJ·mol-1
(1)强酸和强碱的稀溶液反应才能保证H+(aq)+OH-(aq)=H2O(l)中和热为57.3 kJ·mol-1,而弱酸或弱碱在中和反应中由于电离吸收热量,其中和热小于57.3 kJ·mol-1;
(2)以生成1 mol液态水为基准。
(3)反应不可以生成沉淀(如Ba(OH)2+H2SO4=BaSO4↓+2H2O)。
浓H2SO4
NaOH
HNO3
Ba(OH)2
H2SO4
HNO3
NH3·H2O
Ba(OH)2
CH3COOH
NaOH
1
2
3
4
5
1. 下列有关中和反应反应热测定实验的说法正确的是( )
A.温度计能代替玻璃搅拌器,用于搅拌反应物
B.强酸与强碱反应生成1molH2O(l)释放的热量都约为57.3kJ
C.测定中和反应反应热实验中,读取混合溶液不再变化的温度为终止温度
D.某同学通过实验测得盐酸和NaOH溶液反应生成lmolH2O(1)放出的热量为52.3kJ,造成这一结果的原因不可能是所用酸、碱溶液浓度过大
D
2.某同学通过实验测出稀盐酸与稀NaOH溶液反应生成1mol水放出的热量为52.3kJ,造成这一结果的原因不可能是的是( )
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入量热计的内筒中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
B
3.某同学设计如图所示实验探究反应中的能量变化。下列判断正确的是( )
A.实验(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将玻璃搅拌器改为铁质搅拌棒对实验结果没有影响
D.实验(c)中若用NaOH固体测定,则测定数值偏高
D
4.在测定中和热的实验中,下列说法正确的是( )
A.使用环形玻璃搅拌器是为了加快反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.用 0.5mol·L-1NaOH 溶液分别与 0.5mol·L-1 的盐酸、醋酸溶液反应,如所取
的溶液体积相等,则测得的中和热数值相同
D.在测定中和热实验中需要使用的仪器有量筒、烧杯、酒精灯、温度计等
A
5.用如图所示的装置进行中和反应反应热的测定。下列说法正确的是( )
A.如图条件下实验过程中没有热量损失
B.玻璃搅拌器可用铜质材料代替
C.为了使反应均匀进行,药品可以分几次加入
D.分别测量NaOH与醋酸和硫酸中和反应的反应热,数值不同
D
