2.1.2 影响化学反应速率的因素 课件(共31张ppt) 2024-2025学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.1.2 影响化学反应速率的因素 课件(共31张ppt) 2024-2025学年高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 10:29:51 | ||
图片预览









文档简介
(共31张PPT)
影响化学反应速率的因素
第二章 化学反应速率与化学平衡
1.了解化学反应速率的影响因素。
2.能用简单碰撞理论解释速率影响因素对反应速率的影响。
在必修的学习中,我们知道了钠和水、镁和水的反应速率是不一样的,这说明了什么问题?
除了物质本身的结构性质外,我们发现外界因素也会对化学反应速率造成影响。请举出有哪些相关的影响因素?
浓度、温度、压强、催化剂等
在其他条件相同时,反应物本身越活泼,化学反应越快。
2.外因:外界条件
1.内因:反应物本身的性质(决定性因素)
温度、浓度、催化剂、压强、表面积、形成原电池、其他……
影响化学反应速率因素
思考与交流
分子相互碰撞是引发反应的先决条件。
2.分子间发生化学反应的必要条件是什么?
1.化学反应的本质是什么?
反应物中旧化学键的断裂;生成物中新化学键的形成
研究发现大多数化学反应不是经过简单碰撞完成的,而是经过多个反应步骤才能实现。
通过生活经验和之前所学知识,我们知道,不同化学反应速率不同,浓度、温度、压强、催化剂也会影响化学反应速率。这些从宏观上都已得到证实,从微观上我们怎么解释这些因素对反应速率的影响呢?
活化能和简单碰撞理论
1918年,路易斯提出了化学反应速率的简单碰撞理论。该理论认为,反应物分子间的碰撞是化学反应的先决条件。反应物分子间有效碰撞的频率越高,化学反应速率越大。
第一步: 2HI → 2I + H2
第二步: 2I → I2
一、基元反应与反应历程
研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现,例如:
这其中的每一步反应都称为基元反应。
这两个先后进行的基元反应反映了2HI=H2+I2的反应历程,又称反应机理。
微粒I·存在未成对电子,它称为自由基,自由基的反应活性很强,寿命极短。
资料卡片
2.反应历程(反应机理):基元反应构成的反应序列称为反应历程。
基元反应的总和称为总反应。
2HI = H2 + I2
能够通过碰撞一步完成的反应。
1.基元反应:
一、基元反应与反应历程
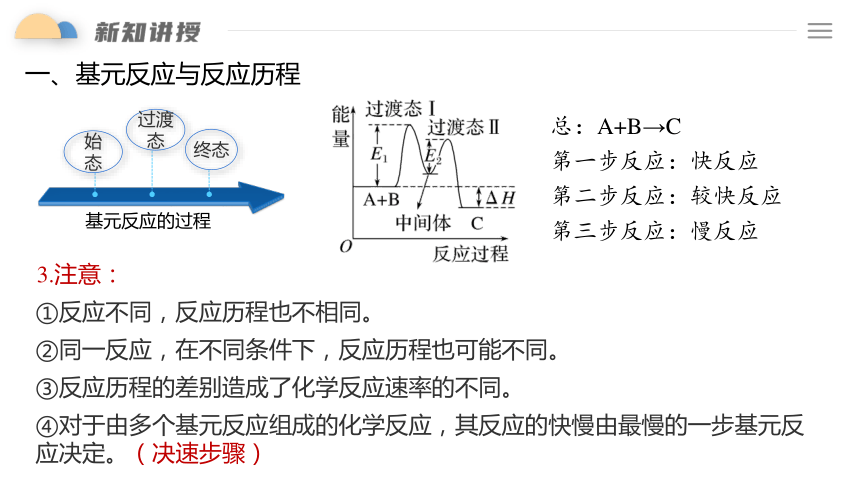
过渡态
终态
始
态
基元反应的过程
3.注意:
①反应不同,反应历程也不相同。
②同一反应,在不同条件下,反应历程也可能不同。
③反应历程的差别造成了化学反应速率的不同。
④对于由多个基元反应组成的化学反应,其反应的快慢由最慢的一步基元反应决定。(决速步骤)
总:A+B→C
第一步反应:快反应
第二步反应:较快反应
第三步反应:慢反应
一、基元反应与反应历程
力道不足
——进不去球
取向不对
——进不去球
力道、取向恰好
——进球
碰撞时的能量不足
碰撞时的取向不合适
有效碰撞,发生反应
一、基元反应与反应历程
示例:HI 分解反应中分子碰撞示意图
二、碰撞理论
分子无规则高速运动
彼此碰撞(每秒约1028次)
有效碰撞
无效碰撞
发生反应
不发生反应
1.碰撞是发生反应的先决条件
2.并不是每一次碰撞都能发生反应
3.能够发生化学反应的碰撞才是有效碰撞。
某一化学反应的速率大小与单位时间、单位体积内有效碰撞的次数有关。
简化的有效碰撞模型
二、碰撞理论
① 反应物分子必须具有一定的能量;
② 碰撞时有合适的取向。
注:单位时间内有效碰撞次数越多,反应速率就越大。
1.有效碰撞:
能够发生化学反应的碰撞。
条件:
HI
HI
能量(活化能)
普通分子
活化分子
先认识下普通分子与活化分子。
二、碰撞理论
2.活化分子:
能够发生有效碰撞的分子叫做活化分子,活化分子具有较高能量。
辨析
能发生有效碰撞的分子 活化分子。
活化分子的碰撞 有效碰撞。
反应物分子中活化分子的百分数越大、单位体积内活化分子数越多,单位时间内有效碰撞的次数越多,化学反应速率越快。
活化分子数
反应物分子总数
活化分子百分数 =
×100%
一定是
不一定是
(还需看碰撞时的取向合不合适)
二、碰撞理论
3.活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差。
也可认为逆反应的活化能
E1:反应的活化能
E2:活化分子变成生成物分子放出的能量
E1-E2:反应热(ΔH)
活化能越小,普通分子就越容易变成活化分子,反应条件越简单。
①反应物、生成物的能量与活化能的关系
活化能高,反应难;
活化能低,反应易。
②化学反应难易与活化能的关系
1、基元反应发生经历的过程
有效碰撞理论对反应速率的影响
2、有效碰撞理论对影响化学反应速率因素的解释
反应物本身的性质
活化能的大小
单位体积内活化分子的多少
单位时间内有效碰撞次数的多少
化学反应速率的快慢
决定
决定
决定
决定
下列说法错误的是( )
①具有较高能量的分子发生有适当取向的碰撞,才能发生化学反应。
②发生有效碰撞的分子都是活化分子。
③活化分子间的碰撞都是有效碰撞。
④水溶液中的化学反应的活化能都接近于0。
⑤反应热△H=正反应的活化能—逆反应的活化能。
⑥活化能指活化分子多出反应物分子平均能量的那部分能量。
⑦普通分子间的碰撞有时候也能发生化学反应。
A.①④ B.③④⑦ C.④⑤⑥ D.②⑤
B
三、有效碰撞理论对影响化学反应速率因素的解释
反应物本身的性质
活化能的大小
单位体积内活化分子的多少
单位时间内有效碰撞次数的多少
化学反应速率的快慢
决定
决定
决定
决定
内 因
外 因
结合碰撞理论,探讨外因的改变影响化学反应速率的原因
三、用碰撞理论解释外界条件对反应速率的影响—浓度
其它条件不变时
增大反应物浓度
活化分子
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数
增大浓度
增加
增加
增加
加快
不变
其他条件不变时,同一反应的活化分子百分数是一定的。
三、用碰撞理论解释外界条件对反应速率的影响—压强
容器的容积不变
压缩体积增大压强
活化分子
规律:当其他条件不变时,对于有气体参加的反应,增大压强(减少容器的容积)相当于增大反应浓度,反应速率加快;减小压强(增大容器的容积)相当于减小反应浓度,反应速率减慢。
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数
增大压强
增加
增加
增加
加快
不变
三、用碰撞理论解释外界条件对反应速率的影响—压强
容器的容积不变
压缩体积或充入气态反应物
活化分子
三、用碰撞理论解释外界条件对反应速率的影响—压强
恒温恒容通入少量惰性气体
单位体积内活化分子数不变
单位时间有效碰撞次数不变
化学反应速率不变
体积不变,浓度不变
活化分子
容器的容积不变
充入非反应气体
三、用碰撞理论解释外界条件对反应速率的影响—压强
恒温恒压通入少量惰性气体
单位体积内活化分子数减小
单位时间有效碰撞次数减小
化学反应速率减小
体积增大,浓度减小
容器内压强不变
充入非反应气体
活化分子
三、用碰撞理论解释外界条件对反应速率的影响—温度
其它条件不变时
升高温度
活化分子
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数
升高温度
不变
增加
增加
加快
增加
三、用碰撞理论解释外界条件对反应速率的影响—催化剂
SO2(g)+1/2O2(g) = SO3(g)
2VO2+1/2O2 = V2O5
SO2+V2O5 = 2VO2+SO3
A
B
催化剂能改变反应历程
SO2(g)+ 1/2O2(g)
SO3(g)
能量
SO2(g)+ 1/2O2(g)
SO3(g)
反应过程
E1
E2
E3
通过改变反应历程降低反应活化能
三、用碰撞理论解释外界条件对反应速率的影响—催化剂
注:使用催化剂能改变反应速率,但反应热不变。
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数
催化剂
不变
增加
增加
加快
增加
四、过渡态理论与飞秒化学
过渡态理论认为,当两个具有足够能量的反应物分子相互接近时,分子中的化学键要重排,能量重新分配。在反应过程中要经过一个中间的过渡态,先生成活化配合物,然后再分解为产物。
A+B [A···B] AB
[A···B]*
活化能 Ea
Ea1
Ea2
外界条件对化学反应速率的影响(总结)
影响因素 单位体积内 反应速率
分子总数 活化分子数 活化分子百分数
增大反应物浓度(增大压强)
升高温度
正催化剂
增加
增加
增加
增加
增加
增加
增加
增加
增加
不变
不变
不变
其它因素对反应速率的影响
反应物固体的颗粒大小、电磁波、超声波、形成原电池等,也会对化学反应的速率产生影响。
1.下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A、增大浓度 B、增大压强
C、升高温度 D、使用催化剂
D
2.设NO+CO2 2CO(正反应吸热)反应速率为v1;
N2+3H2 2NH3(正反应放热)反应速率为v2。对于前述反应,当温度升高时,v1和v2变化情况为( )
A、同时增大 B、 同时减小
C、v1减少,v2增大 D、v1增大,v2减小
A
3.在一氧化碳变换反应CO + H2O CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是( )
A.使用催化剂,活化分子百分数增大,有效碰撞几率增加
B.升高温度,活化分子百分数增大,有效碰撞几率增加
C.增大压强,单位体积内活化分子数增多,有效碰撞几率增加
D.增大c(CO),活化分子百分数增大,有效碰撞几率增加
D
4.已知反应:2NO(g)+Br2(g) 2NOBr(g) ΔH= a kJ mol 1(a>0),其反应机理如下:
①NO(g)+Br2(g) NOBr2(g) 快
②NO(g)+NOBr2(g) 2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A.该反应的速率主要取决于①的快慢
B.NOBr2 是该反应的催化剂
C.正反应的活化能比逆反应的活化能小 a kJ/mol
D.增大 Br2(g) 浓度能增大活化分子百分数,加快反应速率
C
影响化学反应速率的因素
第二章 化学反应速率与化学平衡
1.了解化学反应速率的影响因素。
2.能用简单碰撞理论解释速率影响因素对反应速率的影响。
在必修的学习中,我们知道了钠和水、镁和水的反应速率是不一样的,这说明了什么问题?
除了物质本身的结构性质外,我们发现外界因素也会对化学反应速率造成影响。请举出有哪些相关的影响因素?
浓度、温度、压强、催化剂等
在其他条件相同时,反应物本身越活泼,化学反应越快。
2.外因:外界条件
1.内因:反应物本身的性质(决定性因素)
温度、浓度、催化剂、压强、表面积、形成原电池、其他……
影响化学反应速率因素
思考与交流
分子相互碰撞是引发反应的先决条件。
2.分子间发生化学反应的必要条件是什么?
1.化学反应的本质是什么?
反应物中旧化学键的断裂;生成物中新化学键的形成
研究发现大多数化学反应不是经过简单碰撞完成的,而是经过多个反应步骤才能实现。
通过生活经验和之前所学知识,我们知道,不同化学反应速率不同,浓度、温度、压强、催化剂也会影响化学反应速率。这些从宏观上都已得到证实,从微观上我们怎么解释这些因素对反应速率的影响呢?
活化能和简单碰撞理论
1918年,路易斯提出了化学反应速率的简单碰撞理论。该理论认为,反应物分子间的碰撞是化学反应的先决条件。反应物分子间有效碰撞的频率越高,化学反应速率越大。
第一步: 2HI → 2I + H2
第二步: 2I → I2
一、基元反应与反应历程
研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现,例如:
这其中的每一步反应都称为基元反应。
这两个先后进行的基元反应反映了2HI=H2+I2的反应历程,又称反应机理。
微粒I·存在未成对电子,它称为自由基,自由基的反应活性很强,寿命极短。
资料卡片
2.反应历程(反应机理):基元反应构成的反应序列称为反应历程。
基元反应的总和称为总反应。
2HI = H2 + I2
能够通过碰撞一步完成的反应。
1.基元反应:
一、基元反应与反应历程
过渡态
终态
始
态
基元反应的过程
3.注意:
①反应不同,反应历程也不相同。
②同一反应,在不同条件下,反应历程也可能不同。
③反应历程的差别造成了化学反应速率的不同。
④对于由多个基元反应组成的化学反应,其反应的快慢由最慢的一步基元反应决定。(决速步骤)
总:A+B→C
第一步反应:快反应
第二步反应:较快反应
第三步反应:慢反应
一、基元反应与反应历程
力道不足
——进不去球
取向不对
——进不去球
力道、取向恰好
——进球
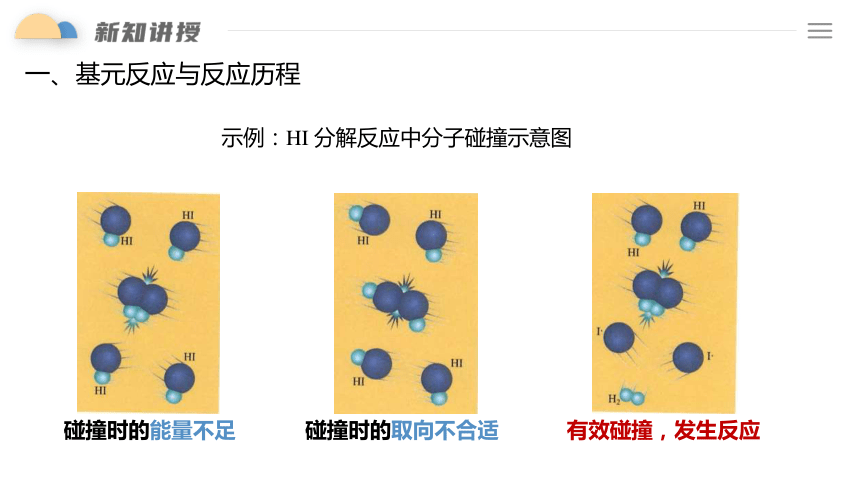
碰撞时的能量不足
碰撞时的取向不合适
有效碰撞,发生反应
一、基元反应与反应历程
示例:HI 分解反应中分子碰撞示意图
二、碰撞理论
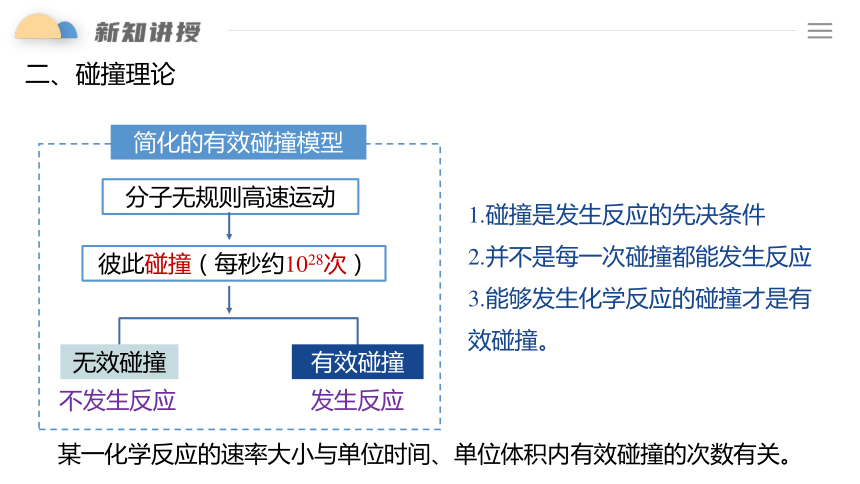
分子无规则高速运动
彼此碰撞(每秒约1028次)
有效碰撞
无效碰撞
发生反应
不发生反应
1.碰撞是发生反应的先决条件
2.并不是每一次碰撞都能发生反应
3.能够发生化学反应的碰撞才是有效碰撞。
某一化学反应的速率大小与单位时间、单位体积内有效碰撞的次数有关。
简化的有效碰撞模型
二、碰撞理论
① 反应物分子必须具有一定的能量;
② 碰撞时有合适的取向。
注:单位时间内有效碰撞次数越多,反应速率就越大。
1.有效碰撞:
能够发生化学反应的碰撞。
条件:
HI
HI
能量(活化能)
普通分子
活化分子
先认识下普通分子与活化分子。
二、碰撞理论
2.活化分子:
能够发生有效碰撞的分子叫做活化分子,活化分子具有较高能量。
辨析
能发生有效碰撞的分子 活化分子。
活化分子的碰撞 有效碰撞。
反应物分子中活化分子的百分数越大、单位体积内活化分子数越多,单位时间内有效碰撞的次数越多,化学反应速率越快。
活化分子数
反应物分子总数
活化分子百分数 =
×100%
一定是
不一定是
(还需看碰撞时的取向合不合适)
二、碰撞理论
3.活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差。
也可认为逆反应的活化能
E1:反应的活化能
E2:活化分子变成生成物分子放出的能量
E1-E2:反应热(ΔH)
活化能越小,普通分子就越容易变成活化分子,反应条件越简单。
①反应物、生成物的能量与活化能的关系
活化能高,反应难;
活化能低,反应易。
②化学反应难易与活化能的关系
1、基元反应发生经历的过程
有效碰撞理论对反应速率的影响
2、有效碰撞理论对影响化学反应速率因素的解释
反应物本身的性质
活化能的大小
单位体积内活化分子的多少
单位时间内有效碰撞次数的多少
化学反应速率的快慢
决定
决定
决定
决定
下列说法错误的是( )
①具有较高能量的分子发生有适当取向的碰撞,才能发生化学反应。
②发生有效碰撞的分子都是活化分子。
③活化分子间的碰撞都是有效碰撞。
④水溶液中的化学反应的活化能都接近于0。
⑤反应热△H=正反应的活化能—逆反应的活化能。
⑥活化能指活化分子多出反应物分子平均能量的那部分能量。
⑦普通分子间的碰撞有时候也能发生化学反应。
A.①④ B.③④⑦ C.④⑤⑥ D.②⑤
B
三、有效碰撞理论对影响化学反应速率因素的解释
反应物本身的性质
活化能的大小
单位体积内活化分子的多少
单位时间内有效碰撞次数的多少
化学反应速率的快慢
决定
决定
决定
决定
内 因
外 因
结合碰撞理论,探讨外因的改变影响化学反应速率的原因
三、用碰撞理论解释外界条件对反应速率的影响—浓度
其它条件不变时
增大反应物浓度
活化分子
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数
增大浓度
增加
增加
增加
加快
不变
其他条件不变时,同一反应的活化分子百分数是一定的。
三、用碰撞理论解释外界条件对反应速率的影响—压强
容器的容积不变
压缩体积增大压强
活化分子
规律:当其他条件不变时,对于有气体参加的反应,增大压强(减少容器的容积)相当于增大反应浓度,反应速率加快;减小压强(增大容器的容积)相当于减小反应浓度,反应速率减慢。
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数
增大压强
增加
增加
增加
加快
不变
三、用碰撞理论解释外界条件对反应速率的影响—压强
容器的容积不变
压缩体积或充入气态反应物
活化分子
三、用碰撞理论解释外界条件对反应速率的影响—压强
恒温恒容通入少量惰性气体
单位体积内活化分子数不变
单位时间有效碰撞次数不变
化学反应速率不变
体积不变,浓度不变
活化分子
容器的容积不变
充入非反应气体
三、用碰撞理论解释外界条件对反应速率的影响—压强
恒温恒压通入少量惰性气体
单位体积内活化分子数减小
单位时间有效碰撞次数减小
化学反应速率减小
体积增大,浓度减小
容器内压强不变
充入非反应气体
活化分子
三、用碰撞理论解释外界条件对反应速率的影响—温度
其它条件不变时
升高温度
活化分子
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数
升高温度
不变
增加
增加
加快
增加
三、用碰撞理论解释外界条件对反应速率的影响—催化剂
SO2(g)+1/2O2(g) = SO3(g)
2VO2+1/2O2 = V2O5
SO2+V2O5 = 2VO2+SO3
A
B
催化剂能改变反应历程
SO2(g)+ 1/2O2(g)
SO3(g)
能量
SO2(g)+ 1/2O2(g)
SO3(g)
反应过程
E1
E2
E3
通过改变反应历程降低反应活化能
三、用碰撞理论解释外界条件对反应速率的影响—催化剂
注:使用催化剂能改变反应速率,但反应热不变。
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数
催化剂
不变
增加
增加
加快
增加
四、过渡态理论与飞秒化学
过渡态理论认为,当两个具有足够能量的反应物分子相互接近时,分子中的化学键要重排,能量重新分配。在反应过程中要经过一个中间的过渡态,先生成活化配合物,然后再分解为产物。
A+B [A···B] AB
[A···B]*
活化能 Ea
Ea1
Ea2
外界条件对化学反应速率的影响(总结)
影响因素 单位体积内 反应速率
分子总数 活化分子数 活化分子百分数
增大反应物浓度(增大压强)
升高温度
正催化剂
增加
增加
增加
增加
增加
增加
增加
增加
增加
不变
不变
不变
其它因素对反应速率的影响
反应物固体的颗粒大小、电磁波、超声波、形成原电池等,也会对化学反应的速率产生影响。
1.下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A、增大浓度 B、增大压强
C、升高温度 D、使用催化剂
D
2.设NO+CO2 2CO(正反应吸热)反应速率为v1;
N2+3H2 2NH3(正反应放热)反应速率为v2。对于前述反应,当温度升高时,v1和v2变化情况为( )
A、同时增大 B、 同时减小
C、v1减少,v2增大 D、v1增大,v2减小
A
3.在一氧化碳变换反应CO + H2O CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是( )
A.使用催化剂,活化分子百分数增大,有效碰撞几率增加
B.升高温度,活化分子百分数增大,有效碰撞几率增加
C.增大压强,单位体积内活化分子数增多,有效碰撞几率增加
D.增大c(CO),活化分子百分数增大,有效碰撞几率增加
D
4.已知反应:2NO(g)+Br2(g) 2NOBr(g) ΔH= a kJ mol 1(a>0),其反应机理如下:
①NO(g)+Br2(g) NOBr2(g) 快
②NO(g)+NOBr2(g) 2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A.该反应的速率主要取决于①的快慢
B.NOBr2 是该反应的催化剂
C.正反应的活化能比逆反应的活化能小 a kJ/mol
D.增大 Br2(g) 浓度能增大活化分子百分数,加快反应速率
C
