2.2.2化学平衡 课件 (共25张ppt)高中化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2.2化学平衡 课件 (共25张ppt)高中化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 10:34:47 | ||
图片预览








文档简介
(共25张PPT)
化学平衡常数
第二章 化学反应速率与化学平衡
1.知道化学平衡常数的含义,会根据化学反应书写化学平衡常数表达式。
2.能够利用化学平衡常数进行简单的计算。
3.知道反应物的转化率计算方法。
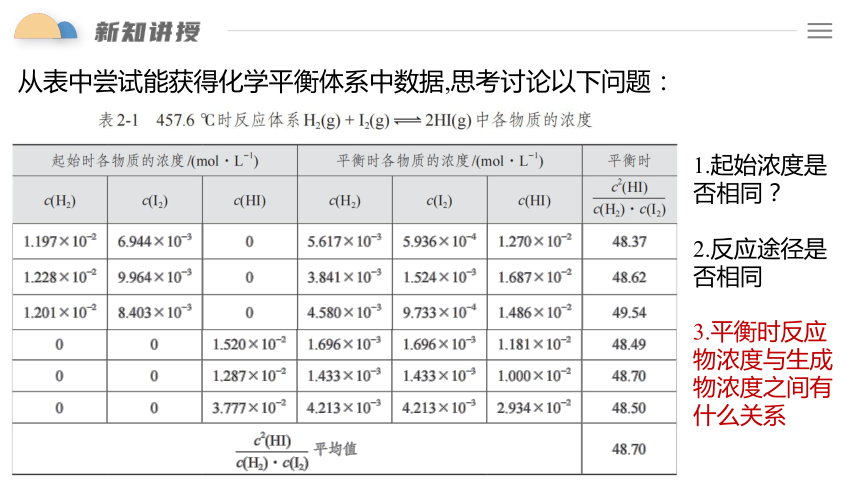
从表中尝试能获得化学平衡体系中数据,思考讨论以下问题:
2.反应途径是否相同
1.起始浓度是否相同?
3.平衡时反应物浓度与生成物浓度之间有什么关系
从表中尝试能获得化学平衡体系中反应物浓度与生成物浓度之间有什么关系?
结论:
①在 457.6℃时, 为常数
c2(HI)
c(H2) · c(I2)
③该常数与平衡建立的途径无关
②该常数与反应的起始浓度大小无关
其它平衡体系的数据进行分析,都有类似的关系
一、化学平衡常数
在一定温度下 ,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数(简称平衡常数),符号用“ K ”表示。
————
—————
—————
—————
1.定义:
注意
与反应物或生成物浓度均无关
与平衡建立的途径无关
一、化学平衡常数
2.表达式:
化学平衡常数的单位与方程式的表示形式相对应,由方程式对应系数推导出来,故化学平衡常数没有固定单位。
例 mA + nB pC + qD
K
=
生成物浓度幂之积
反应物浓度幂之积
=
cp(C)·cq(D)
cm(A)·cn(B)
其中c为各组分的
平衡时浓度;
注意规范书写:
c小写,位于左下角;
圆点要实心且显眼。
单位:
K 的单位为(mol·L-1) n
n=(p+q)-(m+n)
故化学平衡常数没有固定单位
一、化学平衡常数
3.书写平衡常数关系式的规则
(1) 纯固体、纯液体,由于其浓度可看作常数“1”,不列入平衡常数的表达式中!
例如:
K=
Fe3O4(s) + 4H2(g)
高温
3Fe(s) + 4H2O(g)
c(CO2)
c4(H2)
4(H2O)
c
K
=
K
=
)
Cr2O72-
(
c
)
CrO42-
(
c
2
)
H+
(
c
2
Cr2O72-+H2O 2CrO42-+2H+
CaCO3(s) CaO( s)+CO2(g)
注意:水溶液中的反应如有水参加,水浓度为常数,不列入。
(2)对于水的处理要分情况
①气态水H2O(g)或非水溶液中的反应,以及有机反应,此时水要代入平衡常数公式。
②在稀溶液中进行的反应,如有水参加,水的浓度视为常数“1”而不代入平衡常数公式。
(3)离子反应先写离子方程式,再写平衡常数公式。
练:写出下列反应的平衡常数K的表达式
① N2(g) + 3H2(g) 2NH3(g)
② N2(g) + H2(g) NH3(g)
③ 2NH3(g) N2(g) + 3H2(g)
注意观察三者之间的关系!
K1 = 1/K3 = K22
①对于同一可逆反应,正反应和逆反应的平衡常数互为倒数。
②若化学方程式中各物质的化学计量数都扩大或缩小至原来的n倍,则化学平衡常数变为原来的 n 次幂或 1/n 次幂。
练:下列三个反应的平衡常数K之间有什么关系
2NO(g) + O2(g) 2NO2(g) K1
2NO2(g) N2O4 (g) K2
2NO(g) +O2(g) N2O4 (g) K3
K3 = K1 K2
③若干方程式相加(减),则总反应的平衡常数等于分步平衡常数之积(商)。
下表为298K时,卤化氢生成反应的平衡常数:
化学方程式 平衡常数 K
F2+H2 = 2HF 6.5×1095
Cl2+H2 =2HCl 2.57×1033
Br2+H2 =2HBr 1.91×1019
I2+H2 2HI 8.67×102
分析表格中的数据,你有哪些发现?
K 值越大,说明平衡体系中生成物的比例越大,正反应进行的程度越大 ,即该反应进行得越完全,反应物的转化率越大。
4.意义:
a. K值越大,表示反应进行的程度越大,反应物转化率也越大;
b. 一般当K>105时,该反应进行得基本完全。
一般当K<10-5时,就认为反应很难进行。
5. 应用:
(1)衡量化学反应进行的程度
化学反应 平衡常数
①N2(g)+3H2(g) 2NH3(g) K(298 K)=5.6×105
②N2(g)+O2(g) 2NO(g) K(298 K)=1.9×10-31
两个反应中进行彻底的是__,在常温下很难进行的是____。
①
②
对于一般的可逆反应: mA(g) + nB(g) pC(g) + qD(g)
在任意状态时,生成物与反应物浓度幂之积的比值称为浓度商,用 Q表示:
Q<K ,反应向正反应方向进行
Q=K ,反应处于平衡状态
Q>K ,反应向逆反应方向进行
(2)判断平衡移动的方向
(3)判断反应的热效应
若升高温度,K值增大,则正反应为吸热反应
若升高温度,K值减小,则正反应为放热反应
高炉炼铁中发生的基本反应如下: FeO(s)+CO(g) Fe(s)+CO2(g) (条件省略)。已知1100℃,K=0.263,某时刻测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1 在这种情况下:
(1)该反应是否处于平衡状态_____(填“是”或“否”);
(2)此时反应会向______进行?(填“正向”或“逆向”);
(3)此时化学反应速率是ν正 _____ν逆(填“大于”、“小于”或“等于”)。
Q =
c(CO2)
c(CO)
=
0.025mol·L-1
0.1mol·L-1
=0. 25
否
正向
大于
Q<K ,反应向正方向进行
在一定体积密闭容器中,进行如下反应CO2(g)+H2(g) CO(g) +H2O(g),其平衡常数K和温度t的关系如下:
t/ C 700 800 830 1000 1200
k 0.6 0.9 1.0 1.7 2.6
(1)K的表达式为: ;
(2)该反应为 反应(“吸热”或“放热”);
(3)若c(CO2) ·c(H2)=c(CO) ·c(H2O),此时温度为 ;
(4)在上述温度______℃时,反应物转化率最大。
c(CO)·c(H2O)
c(CO2)·c(H2)
吸热
830℃
1200
二、转化率计算
用平衡常数来表示反应的限度有时不够直观,常用平衡转化率α来表示反应限度。
对于可逆反应: mA(g)+nB (g) pC(g)+qD(g)
反应物A的平衡转化率(该条件最大转化率)可表示:
c(CO) : c(H2O) = 1:1 时
CO + H2O CO2 + H2
起始c 1 1 0 0
转化c -x -x +x +x
平衡c 1-x 1-x x x
解得 x = 0.5 α(CO)= 50%
α(H2O)= 50%
c(CO) : c(H2O) = 1:4 时
CO + H2O CO2 + H2
起始c 1 4 0 0
转化c -x -x +x +x
平衡c 1-x 4-x x x
解得 x = 0.8 α(CO)= 80%
α(H2O)= 20%
已知CO(g) + H2O(g) CO2 (g) +H2 (g) 800℃ K = 1.0 ;求恒温恒容体系中,用c(CO):c(H2O)=1:1或1:4开始,达到平衡时CO和H2O(g)的转化率。
(1-x)(1-x )
x2
K = =1
(1-x)(4-x )
x2
K = =1
增大一种反应物的浓度,能提高另一种反应物的转化率,而本身的转化率减小
结论:
1.在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
提示:K= 该反应平衡常数与题目中反应的平衡常数互为倒数。
(1)700 ℃,CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K是多少
(2)在800 ℃时发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2 mol·L-1,c(H2)=1.5 mol·L-1,c(CO)=1 mol·L-1,c(H2O)=3 mol·L-1,则下一时刻反应向哪个方向进行
Q=
c(CO)·c(H2O)
c(CO2)·c(H2)
1 mol·L-1× 3 mol·L-1
2 mol·L-1 ×1.5 mol·L-1
=
=1>0.9
所以反应向逆反应方向进行
2. 将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容器中,加热到800 ℃ ,充分反应达到平衡后,测得CO的浓度为0.005 mol·L-1 。
(1)求该反应的平衡常数及平衡时CO的转化率。
【解】依题意可知:起始时 c(CO) = c(H2O) = 0.01 mol·L-1,平衡时 c(CO) = 0.005 mol·L-1,变化量 c(CO) = 0.005 mol·L-1
CO(g) + H2O(g) CO2(g) + H2(g)
起始浓度/(mol·L-1 ) 0.01 0.01 0 0
变化浓度/(mol·L-1 ) 0.005
平衡浓度/(mol·L-1 ) 0.005
0.005 0.005 0.005
0.005 0.005 0.005
K= = =1
c(CO2) c(H2)
c(CO) c(H2O)
0.005 × 0.005
0.005 × 0.005
CO的转化率为:
× 100%
= 50%
0.005 mol·L-1
0.01 mol·L-1
3.密闭容器中,固体NH4I在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g);
②2HI(g) H2(g)+I2(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,
则此温度下反应①的平衡常数为( )
A.9 B.16 C.20 D.25
C
注意:代入平衡常数表达式的物质的量浓度是平衡时的浓度。
拓展提升
1.分压平衡常数Kp
分压和总压
分压:一种气体单独存在于容器内时的压强
总压:混合气体总压强等于组成该混合气体各成分的分压强之和
P总=P1+P2+P3+……
PV=nRT
拓展提升
1.分压平衡常数Kp
一定温度下,气相反应: mA (g)+nB (g) eC(g)+fD(g)达平衡时,
在浓度平衡常数表达式中,用分压代替浓度,
即气态生成物分压幂之积与气态反应物分压幂之积的比值为一个常数,用符号Kp表示
pe (C) · pf (D)
pm (A) ·pn (B)
Kp =
①某气体的分压=气体总压×该气体的体积分数(物质的量分数)
②分压平衡常数的单位一般要求写出
(只受温度影响)
拓展提升
2.物质的量分数平衡常数Kx
(只受温度影响)
mA(g)+nB(g) eC(g)+fD(g)
达平衡时,令各物质的量分数分别为x(A)、x(B)、x(C)、x(D),
则有物质的量分数平衡常数Kx= 。
【2017·全国卷Ⅰ,28(3)①改编】H2S与CO2在高温下发生反应:
H2S(g)+CO2(g) COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,压强为P0 Pa,反应平衡后水的物质的量分数为0.02。
H2S的平衡转化率α1= %,
反应平衡常数Kc= 、Kp= 、Kx= 。
2.5
2.8×10-3
2.8×10-3
2.8×10-3
结论:当△n(g)=0时,Kc=Kp=Kx
拓展提升
3.标准平衡常数Kθ (相对分压平衡常数)
(只受温度影响)
一定温度下,气相反应: mA (g)+nB (g) eC(g)+fD(g)达平衡时,在浓度平衡常数表达式中,用相对分压代替浓度,
所得的平衡常数为标准平衡常数,用符号Kθ表示,
Kθ的表达式如下:
①某气体的相对分压=该气体的分压÷pθ,其中pθ=100kPa(标准压力)
②标准平衡常数的量纲为1
1.一定温度下,在1 L恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),起始总压强为P0,发生反应:2NO(g)+Cl2(g) 2NOCl(g)
达到平衡后,压强为原来的5/6。
该温度下反应的平衡常数K = 、Kp= 。
2
6/P0
2.一定温度下,在初始体积为1L的恒压密闭容器中充入2 mol NO(g)和1 mol Cl2(g),起始总压强为P0 ,发生反应:
2NO(g)+Cl2(g) 2NOCl(g)
达到平衡后,体积为原来的5/6。
该温度下反应的平衡常数K = 、Kp= 。
5/3
5/P0
化学平衡常数
表达式及书写注意事项
意义及影响因素
应用
K越大,反应进行程度越大。
只与温度有关
用浓度商Q 与K 比较:
Q<K,反应向正反应方向移动;
Q=K,反应处于平衡状态;
Q>K,反应向逆反应方向移动
三段式做有关计算题方法
化学平衡常数
第二章 化学反应速率与化学平衡
1.知道化学平衡常数的含义,会根据化学反应书写化学平衡常数表达式。
2.能够利用化学平衡常数进行简单的计算。
3.知道反应物的转化率计算方法。
从表中尝试能获得化学平衡体系中数据,思考讨论以下问题:
2.反应途径是否相同
1.起始浓度是否相同?
3.平衡时反应物浓度与生成物浓度之间有什么关系
从表中尝试能获得化学平衡体系中反应物浓度与生成物浓度之间有什么关系?
结论:
①在 457.6℃时, 为常数
c2(HI)
c(H2) · c(I2)
③该常数与平衡建立的途径无关
②该常数与反应的起始浓度大小无关
其它平衡体系的数据进行分析,都有类似的关系
一、化学平衡常数
在一定温度下 ,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数(简称平衡常数),符号用“ K ”表示。
————
—————
—————
—————
1.定义:
注意
与反应物或生成物浓度均无关
与平衡建立的途径无关
一、化学平衡常数
2.表达式:
化学平衡常数的单位与方程式的表示形式相对应,由方程式对应系数推导出来,故化学平衡常数没有固定单位。
例 mA + nB pC + qD
K
=
生成物浓度幂之积
反应物浓度幂之积
=
cp(C)·cq(D)
cm(A)·cn(B)
其中c为各组分的
平衡时浓度;
注意规范书写:
c小写,位于左下角;
圆点要实心且显眼。
单位:
K 的单位为(mol·L-1) n
n=(p+q)-(m+n)
故化学平衡常数没有固定单位
一、化学平衡常数
3.书写平衡常数关系式的规则
(1) 纯固体、纯液体,由于其浓度可看作常数“1”,不列入平衡常数的表达式中!
例如:
K=
Fe3O4(s) + 4H2(g)
高温
3Fe(s) + 4H2O(g)
c(CO2)
c4(H2)
4(H2O)
c
K
=
K
=
)
Cr2O72-
(
c
)
CrO42-
(
c
2
)
H+
(
c
2
Cr2O72-+H2O 2CrO42-+2H+
CaCO3(s) CaO( s)+CO2(g)
注意:水溶液中的反应如有水参加,水浓度为常数,不列入。
(2)对于水的处理要分情况
①气态水H2O(g)或非水溶液中的反应,以及有机反应,此时水要代入平衡常数公式。
②在稀溶液中进行的反应,如有水参加,水的浓度视为常数“1”而不代入平衡常数公式。
(3)离子反应先写离子方程式,再写平衡常数公式。
练:写出下列反应的平衡常数K的表达式
① N2(g) + 3H2(g) 2NH3(g)
② N2(g) + H2(g) NH3(g)
③ 2NH3(g) N2(g) + 3H2(g)
注意观察三者之间的关系!
K1 = 1/K3 = K22
①对于同一可逆反应,正反应和逆反应的平衡常数互为倒数。
②若化学方程式中各物质的化学计量数都扩大或缩小至原来的n倍,则化学平衡常数变为原来的 n 次幂或 1/n 次幂。
练:下列三个反应的平衡常数K之间有什么关系
2NO(g) + O2(g) 2NO2(g) K1
2NO2(g) N2O4 (g) K2
2NO(g) +O2(g) N2O4 (g) K3
K3 = K1 K2
③若干方程式相加(减),则总反应的平衡常数等于分步平衡常数之积(商)。
下表为298K时,卤化氢生成反应的平衡常数:
化学方程式 平衡常数 K
F2+H2 = 2HF 6.5×1095
Cl2+H2 =2HCl 2.57×1033
Br2+H2 =2HBr 1.91×1019
I2+H2 2HI 8.67×102
分析表格中的数据,你有哪些发现?
K 值越大,说明平衡体系中生成物的比例越大,正反应进行的程度越大 ,即该反应进行得越完全,反应物的转化率越大。
4.意义:
a. K值越大,表示反应进行的程度越大,反应物转化率也越大;
b. 一般当K>105时,该反应进行得基本完全。
一般当K<10-5时,就认为反应很难进行。
5. 应用:
(1)衡量化学反应进行的程度
化学反应 平衡常数
①N2(g)+3H2(g) 2NH3(g) K(298 K)=5.6×105
②N2(g)+O2(g) 2NO(g) K(298 K)=1.9×10-31
两个反应中进行彻底的是__,在常温下很难进行的是____。
①
②
对于一般的可逆反应: mA(g) + nB(g) pC(g) + qD(g)
在任意状态时,生成物与反应物浓度幂之积的比值称为浓度商,用 Q表示:
Q<K ,反应向正反应方向进行
Q=K ,反应处于平衡状态
Q>K ,反应向逆反应方向进行
(2)判断平衡移动的方向
(3)判断反应的热效应
若升高温度,K值增大,则正反应为吸热反应
若升高温度,K值减小,则正反应为放热反应
高炉炼铁中发生的基本反应如下: FeO(s)+CO(g) Fe(s)+CO2(g) (条件省略)。已知1100℃,K=0.263,某时刻测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1 在这种情况下:
(1)该反应是否处于平衡状态_____(填“是”或“否”);
(2)此时反应会向______进行?(填“正向”或“逆向”);
(3)此时化学反应速率是ν正 _____ν逆(填“大于”、“小于”或“等于”)。
Q =
c(CO2)
c(CO)
=
0.025mol·L-1
0.1mol·L-1
=0. 25
否
正向
大于
Q<K ,反应向正方向进行
在一定体积密闭容器中,进行如下反应CO2(g)+H2(g) CO(g) +H2O(g),其平衡常数K和温度t的关系如下:
t/ C 700 800 830 1000 1200
k 0.6 0.9 1.0 1.7 2.6
(1)K的表达式为: ;
(2)该反应为 反应(“吸热”或“放热”);
(3)若c(CO2) ·c(H2)=c(CO) ·c(H2O),此时温度为 ;
(4)在上述温度______℃时,反应物转化率最大。
c(CO)·c(H2O)
c(CO2)·c(H2)
吸热
830℃
1200
二、转化率计算
用平衡常数来表示反应的限度有时不够直观,常用平衡转化率α来表示反应限度。
对于可逆反应: mA(g)+nB (g) pC(g)+qD(g)
反应物A的平衡转化率(该条件最大转化率)可表示:
c(CO) : c(H2O) = 1:1 时
CO + H2O CO2 + H2
起始c 1 1 0 0
转化c -x -x +x +x
平衡c 1-x 1-x x x
解得 x = 0.5 α(CO)= 50%
α(H2O)= 50%
c(CO) : c(H2O) = 1:4 时
CO + H2O CO2 + H2
起始c 1 4 0 0
转化c -x -x +x +x
平衡c 1-x 4-x x x
解得 x = 0.8 α(CO)= 80%
α(H2O)= 20%
已知CO(g) + H2O(g) CO2 (g) +H2 (g) 800℃ K = 1.0 ;求恒温恒容体系中,用c(CO):c(H2O)=1:1或1:4开始,达到平衡时CO和H2O(g)的转化率。
(1-x)(1-x )
x2
K = =1
(1-x)(4-x )
x2
K = =1
增大一种反应物的浓度,能提高另一种反应物的转化率,而本身的转化率减小
结论:
1.在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
提示:K= 该反应平衡常数与题目中反应的平衡常数互为倒数。
(1)700 ℃,CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K是多少
(2)在800 ℃时发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2 mol·L-1,c(H2)=1.5 mol·L-1,c(CO)=1 mol·L-1,c(H2O)=3 mol·L-1,则下一时刻反应向哪个方向进行
Q=
c(CO)·c(H2O)
c(CO2)·c(H2)
1 mol·L-1× 3 mol·L-1
2 mol·L-1 ×1.5 mol·L-1
=
=1>0.9
所以反应向逆反应方向进行
2. 将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容器中,加热到800 ℃ ,充分反应达到平衡后,测得CO的浓度为0.005 mol·L-1 。
(1)求该反应的平衡常数及平衡时CO的转化率。
【解】依题意可知:起始时 c(CO) = c(H2O) = 0.01 mol·L-1,平衡时 c(CO) = 0.005 mol·L-1,变化量 c(CO) = 0.005 mol·L-1
CO(g) + H2O(g) CO2(g) + H2(g)
起始浓度/(mol·L-1 ) 0.01 0.01 0 0
变化浓度/(mol·L-1 ) 0.005
平衡浓度/(mol·L-1 ) 0.005
0.005 0.005 0.005
0.005 0.005 0.005
K= = =1
c(CO2) c(H2)
c(CO) c(H2O)
0.005 × 0.005
0.005 × 0.005
CO的转化率为:
× 100%
= 50%
0.005 mol·L-1
0.01 mol·L-1
3.密闭容器中,固体NH4I在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g);
②2HI(g) H2(g)+I2(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,
则此温度下反应①的平衡常数为( )
A.9 B.16 C.20 D.25
C
注意:代入平衡常数表达式的物质的量浓度是平衡时的浓度。
拓展提升
1.分压平衡常数Kp
分压和总压
分压:一种气体单独存在于容器内时的压强
总压:混合气体总压强等于组成该混合气体各成分的分压强之和
P总=P1+P2+P3+……
PV=nRT
拓展提升
1.分压平衡常数Kp
一定温度下,气相反应: mA (g)+nB (g) eC(g)+fD(g)达平衡时,
在浓度平衡常数表达式中,用分压代替浓度,
即气态生成物分压幂之积与气态反应物分压幂之积的比值为一个常数,用符号Kp表示
pe (C) · pf (D)
pm (A) ·pn (B)
Kp =
①某气体的分压=气体总压×该气体的体积分数(物质的量分数)
②分压平衡常数的单位一般要求写出
(只受温度影响)
拓展提升
2.物质的量分数平衡常数Kx
(只受温度影响)
mA(g)+nB(g) eC(g)+fD(g)
达平衡时,令各物质的量分数分别为x(A)、x(B)、x(C)、x(D),
则有物质的量分数平衡常数Kx= 。
【2017·全国卷Ⅰ,28(3)①改编】H2S与CO2在高温下发生反应:
H2S(g)+CO2(g) COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,压强为P0 Pa,反应平衡后水的物质的量分数为0.02。
H2S的平衡转化率α1= %,
反应平衡常数Kc= 、Kp= 、Kx= 。
2.5
2.8×10-3
2.8×10-3
2.8×10-3
结论:当△n(g)=0时,Kc=Kp=Kx
拓展提升
3.标准平衡常数Kθ (相对分压平衡常数)
(只受温度影响)
一定温度下,气相反应: mA (g)+nB (g) eC(g)+fD(g)达平衡时,在浓度平衡常数表达式中,用相对分压代替浓度,
所得的平衡常数为标准平衡常数,用符号Kθ表示,
Kθ的表达式如下:
①某气体的相对分压=该气体的分压÷pθ,其中pθ=100kPa(标准压力)
②标准平衡常数的量纲为1
1.一定温度下,在1 L恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),起始总压强为P0,发生反应:2NO(g)+Cl2(g) 2NOCl(g)
达到平衡后,压强为原来的5/6。
该温度下反应的平衡常数K = 、Kp= 。
2
6/P0
2.一定温度下,在初始体积为1L的恒压密闭容器中充入2 mol NO(g)和1 mol Cl2(g),起始总压强为P0 ,发生反应:
2NO(g)+Cl2(g) 2NOCl(g)
达到平衡后,体积为原来的5/6。
该温度下反应的平衡常数K = 、Kp= 。
5/3
5/P0
化学平衡常数
表达式及书写注意事项
意义及影响因素
应用
K越大,反应进行程度越大。
只与温度有关
用浓度商Q 与K 比较:
Q<K,反应向正反应方向移动;
Q=K,反应处于平衡状态;
Q>K,反应向逆反应方向移动
三段式做有关计算题方法
