2.2.6 等效平衡 课件 (共22张ppt) 2024-2025学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2.6 等效平衡 课件 (共22张ppt) 2024-2025学年高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 10:28:09 | ||
图片预览






文档简介
(共22张PPT)
等效平衡
第二章 化学反应速率与化学平衡
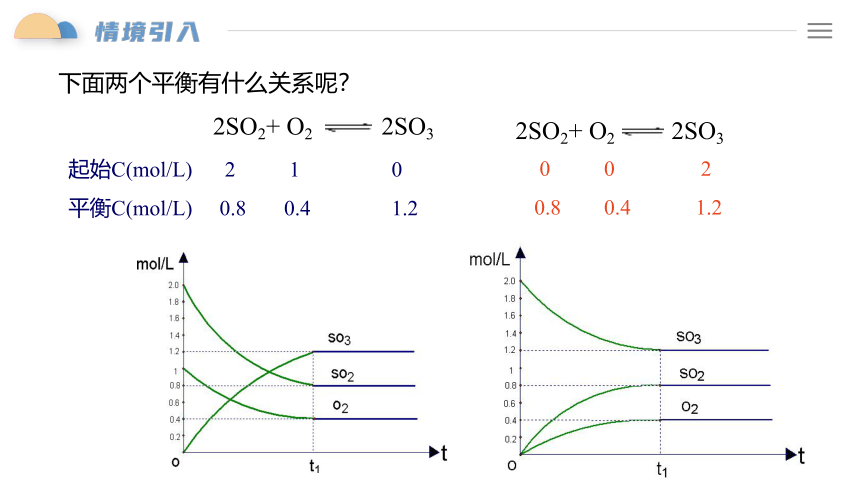
2SO2+ O2 2SO3
起始C(mol/L) 2 1 0
平衡C(mol/L) 0.8 0.4 1.2
2SO2+ O2 2SO3
0 0 2
0.8 0.4 1.2
下面两个平衡有什么关系呢?
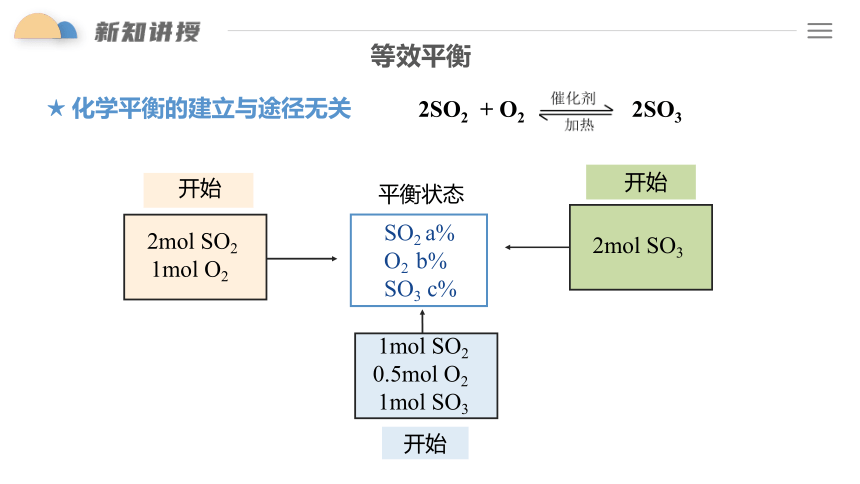
等效平衡
2SO2 + O2
2SO3
★ 化学平衡的建立与途径无关
SO2 a%
O2 b%
SO3 c%
平衡状态
2mol SO2
1mol O2
开始
2mol SO3
开始
1mol SO2
0.5mol O2
1mol SO3
开始
等效平衡
在一定条件下,同一可逆反应体系,不管是从正反应开始,还是从逆反应开始,还是正逆反应同时投料,可逆反应只要起始浓度相当,达到化学平衡状态时,任何相同组分的百分含量(物质的量分数、体积分数、质量分数)均相同,这样的化学平衡互称等效平衡。
恒温、恒容/
恒温、恒压
转化成同一边的物质,相等或成比例
但各组分的物质的量、浓度、反应速率等可能不同
等效平衡
等效平衡的建立与条件(温度、压强)有关,与途径无关,
等效平衡建立途径:
①正向建立 ③从中间某状态建立
②逆向建立 ④分批加入反应物等
等效平衡的判断方法---极值转换法(“一边倒”)
等效平衡的类型
恒温恒容
m+n=p+q
恒温恒压
m+n=p+q
m+n≠p+q
m+n≠p+q
对于:m A(g)+n B(g) p C(g)+q D(g)
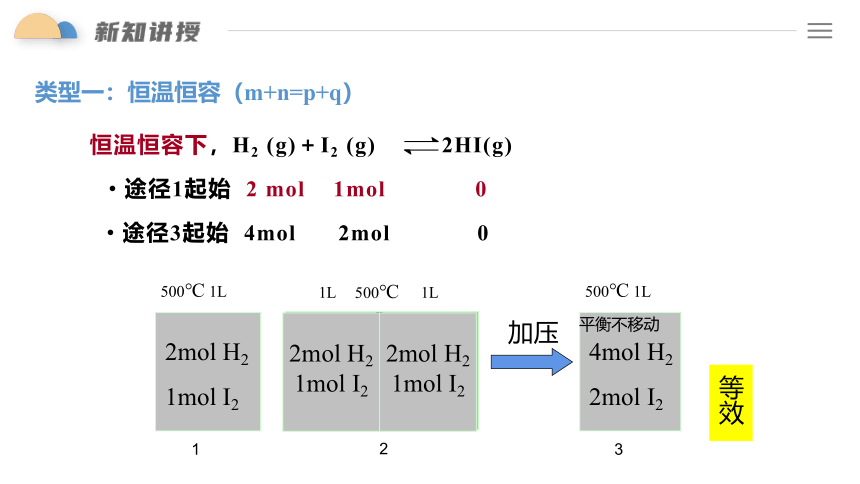
类型一:恒温恒容(m+n=p+q)
1.判断方法:极值法,一边倒,比相同
2. 达到平衡时的结果:
⑴各物质百分含量相同,
⑵ 各物质物质的量成倍数关系,
⑶各物质浓度成倍数关系。
等比平衡
对于:m A(g)+n B(g) p C(g)+q D(g)
类型一:恒温恒容(m+n=p+q)
2molH2 1molI2
500℃
2molH2 1molI2
1L
1L
恒温恒容下,H2 (g)+I2 (g) 2HI(g)
途径1起始 2 mol 1mol 0
途径3起始 4mol 2mol 0
2mol H2
1mol I2
1
500℃ 1L
2mol H2 1mol I2
2mol H2 1mol I2
4mol H2
2mol I2
3
500℃ 1L
2
平衡不移动
加压
等效
例:在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
2A(g)+B(g) 3C(g)+D(s) 达到平衡时,C的浓度为1.2mol/L 。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍为1.2mol/L的是( )
A、0.3mol C + 0.1mol D
B、1.6mol A + 0.8mol B + 0.6mol C + 0.2mol D
C、3mol C + 1mol D + 1mol B
D、4mol A + 2mol B
对于气态物质反应前后分子总数不变的可逆反应,只要起始组分的物质的量比相等(相当)。则为等效平衡。
B
类型二:恒温恒容(m+n≠p+q)
对于:m A(g)+n B(g) p C(g)+q D(g)
1.判断方法:极值法,一边倒,量相同
2. 达到平衡时的结果:
⑴各物质百分含量相同,
⑵ 各物质物质的量相同,
⑶各物质浓度相同。
等同平衡
例:以下事例为恒T、恒V条件下的等效平衡
2SO2(g) + O2(g) 2SO3(g)
起① 2 mol 1 mol 0
起② 0 0 2 mol
起③ 0.5 mol 0.25 mol 1.5 mol
起④ 0.4 mol 0.2 mol x
起⑤ a mol b mol c mol
a、b、c取值必须满足的一般条件是:_________、_________ (请用两个方程式表示,其中一个只含a和c,另一个只含b和c)。
a + c = 2
2b + c = 2
x =_____
1.6
△n ≠ 0
恒温、恒容对于气态物质反应前后分子总数变化的可逆反应,只要起始组分的物质的量相等,则为等效平衡,否则非等效 。
例:在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
2A(g)+B(g) 3C(g)+D(g)达到平衡时, C的体积分数为a% 。维持容器的体积和温度不变,按下列配比作为起始物质,达平衡后,C的体积分数仍为a%是
A、3mol C + 1mol D
B、1mol A + 0.5mol B + 1.5mol C + 0.5mol D
C、1mol A + 0.5mol B + 1.5mol C
D、4mol A + 2mol B
A、B
类型三:恒温恒压(无论气体系数是否相等)
对于:m A(g)+n B(g) p C(g)+q D(g)
2. 达到平衡时的结果:
⑴各物质百分含量相同,
⑵ 各物质物质的量成倍数关系,
⑶各物质浓度相同。
1.判断方法:极值法,一边倒,比相同
等比平衡
在一定温度下,一个压强恒定的密闭容器中发生反应2A(g)+B(g) 3C(g)+D(g),根据下表有关数据分析恒温、恒压达平衡时D的体积分数(分别选填a% 或b% a≠b )。
A
B
C
D
平衡时D的体积分数
起始
充入
2mol
1mol
0
0
1mol
0.5mol
1.5mol
0.5mol
4mol
2mol
0
0
2mol
2mol
0
0
a%
a%
a%
b% (a≠b)
归纳总结
条件 等效条件 结果
恒 温 恒 容 (△n(g)≠0)
(△n(g)=0)
恒温恒压
一边倒、量相同
一边倒、比相同
一边倒、比相同
两平衡相比,同一个组分百分含量、n、c均相同 (全等平衡)
两平衡相比,同一组分百分含量相同,n、c同比例变化 (等比平衡)
两次平衡相比,同一组分百分含量、和c相同,n同比例变化( 等比平衡)
1.思维模式:虚拟“中间态”法构建等效平衡
(1)构建恒温恒容平衡思维模式:新平衡状态可认为是两个原平衡状态简单的叠加并压缩而成,相当于增大压强。
(2)构建恒温恒压平衡思维模式(以气体物质的量增加的反应为例):新平衡状态可认为是两个原平衡状态简单叠加,压强不变,平衡不移动。
等效平衡
等效平衡
2.具体应用:利用等效平衡的方法解决不等效平衡的问题
例:把晶体N2O4放入一固定容积的密闭容器中气化并建立
N2O4(g) 2NO2(g)平衡后,保持温度不变,再通入与起始时等量的N2O4气体,反应再次达平衡,则新平衡时c(NO2)/c(N2O4)与原平衡比,其比值( )
A.变大 B.变小 C.不变 D.无法确定
B
1、在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g) 3C(g),已知加入1molA和3molB且达到平衡后,生成了amolC。
(1)达到平衡时,C在反应混合气中的体积分数是____________(用含字母a的代数式表示)。
(2)若继续向原混合物的容器中通入少量氦气后(设氦气和A.B.C都不反应),化学平衡(填字母)_______
A.向正反应方向移动 B.向逆反应方向移动 C.平衡不移动
25a%
C
2、在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g) 3C(g),
已知加入1molA和3molB且达到平衡后,生成了amolC。
(3)在相同实验条件下,若在同一容器中改为加入2molA和6molB,达到平衡后,C的物质的量为______mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比________(选填“增大”“减小”或“不变” )。
(4)在相同实验条件下,若在同一容器中改为加入2mol A和8mol B,若要求平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入C____mol。
6
不变
2a
3、将3 mol A和1 mol B混合于一容积可变的密闭容器P中,以此时的温度、压强和容积作为起始条件,发生了如下反应:3A(g)+B(g) C(g)+D(g),达到平衡时C的浓度为ω mol·L-1。试回答下列问题:
(1)保持温度和压强不变,按下列四种配比充入容器P中,平衡后C的浓度仍为ω mol·L-1的是( )
A.6 mol A和2 mol B
B.3 mol A+1 mol B+2 mol C
C.2 mol C+1 mol B+1 mol D
D.1 mol C+2 mol D
A
等比等效
4、将3 mol A和1 mol B混合于一容积可变的密闭容器P中,以此时的温度、压强和容积作为起始条件,发生了如下反应:3A(g)+B(g) 2C(g)+D(g),达到平衡时C的浓度为ω mol·L-1。试回答下列问题:
(2)保持原起始温度和容积不变,要使平衡后C的浓度仍为ω mol·L-1,应按下列哪种配比向另一容器Q中充入有关物质( )
A.3 mol A+1 mol B
B.4 mol C+2 mol D
C.1.5 mol A+0.5 mol B+1 mol C+0.5 mol D
D.无法判断
D
等值等效
5、在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下 N2(g)+3H2(g) 2NH3(g)
△H=-92.4kJ/mol下列说法不正确的是( )
A.2cl<c3 B.a+b=92.4 C.α1+α3<1 D.2p1=2p2<p3
D
等值等效
P↑V↓
等效平衡
第二章 化学反应速率与化学平衡
2SO2+ O2 2SO3
起始C(mol/L) 2 1 0
平衡C(mol/L) 0.8 0.4 1.2
2SO2+ O2 2SO3
0 0 2
0.8 0.4 1.2
下面两个平衡有什么关系呢?
等效平衡
2SO2 + O2
2SO3
★ 化学平衡的建立与途径无关
SO2 a%
O2 b%
SO3 c%
平衡状态
2mol SO2
1mol O2
开始
2mol SO3
开始
1mol SO2
0.5mol O2
1mol SO3
开始
等效平衡
在一定条件下,同一可逆反应体系,不管是从正反应开始,还是从逆反应开始,还是正逆反应同时投料,可逆反应只要起始浓度相当,达到化学平衡状态时,任何相同组分的百分含量(物质的量分数、体积分数、质量分数)均相同,这样的化学平衡互称等效平衡。
恒温、恒容/
恒温、恒压
转化成同一边的物质,相等或成比例
但各组分的物质的量、浓度、反应速率等可能不同
等效平衡
等效平衡的建立与条件(温度、压强)有关,与途径无关,
等效平衡建立途径:
①正向建立 ③从中间某状态建立
②逆向建立 ④分批加入反应物等
等效平衡的判断方法---极值转换法(“一边倒”)
等效平衡的类型
恒温恒容
m+n=p+q
恒温恒压
m+n=p+q
m+n≠p+q
m+n≠p+q
对于:m A(g)+n B(g) p C(g)+q D(g)
类型一:恒温恒容(m+n=p+q)
1.判断方法:极值法,一边倒,比相同
2. 达到平衡时的结果:
⑴各物质百分含量相同,
⑵ 各物质物质的量成倍数关系,
⑶各物质浓度成倍数关系。
等比平衡
对于:m A(g)+n B(g) p C(g)+q D(g)
类型一:恒温恒容(m+n=p+q)
2molH2 1molI2
500℃
2molH2 1molI2
1L
1L
恒温恒容下,H2 (g)+I2 (g) 2HI(g)
途径1起始 2 mol 1mol 0
途径3起始 4mol 2mol 0
2mol H2
1mol I2
1
500℃ 1L
2mol H2 1mol I2
2mol H2 1mol I2
4mol H2
2mol I2
3
500℃ 1L
2
平衡不移动
加压
等效
例:在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
2A(g)+B(g) 3C(g)+D(s) 达到平衡时,C的浓度为1.2mol/L 。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍为1.2mol/L的是( )
A、0.3mol C + 0.1mol D
B、1.6mol A + 0.8mol B + 0.6mol C + 0.2mol D
C、3mol C + 1mol D + 1mol B
D、4mol A + 2mol B
对于气态物质反应前后分子总数不变的可逆反应,只要起始组分的物质的量比相等(相当)。则为等效平衡。
B
类型二:恒温恒容(m+n≠p+q)
对于:m A(g)+n B(g) p C(g)+q D(g)
1.判断方法:极值法,一边倒,量相同
2. 达到平衡时的结果:
⑴各物质百分含量相同,
⑵ 各物质物质的量相同,
⑶各物质浓度相同。
等同平衡
例:以下事例为恒T、恒V条件下的等效平衡
2SO2(g) + O2(g) 2SO3(g)
起① 2 mol 1 mol 0
起② 0 0 2 mol
起③ 0.5 mol 0.25 mol 1.5 mol
起④ 0.4 mol 0.2 mol x
起⑤ a mol b mol c mol
a、b、c取值必须满足的一般条件是:_________、_________ (请用两个方程式表示,其中一个只含a和c,另一个只含b和c)。
a + c = 2
2b + c = 2
x =_____
1.6
△n ≠ 0
恒温、恒容对于气态物质反应前后分子总数变化的可逆反应,只要起始组分的物质的量相等,则为等效平衡,否则非等效 。
例:在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
2A(g)+B(g) 3C(g)+D(g)达到平衡时, C的体积分数为a% 。维持容器的体积和温度不变,按下列配比作为起始物质,达平衡后,C的体积分数仍为a%是
A、3mol C + 1mol D
B、1mol A + 0.5mol B + 1.5mol C + 0.5mol D
C、1mol A + 0.5mol B + 1.5mol C
D、4mol A + 2mol B
A、B
类型三:恒温恒压(无论气体系数是否相等)
对于:m A(g)+n B(g) p C(g)+q D(g)
2. 达到平衡时的结果:
⑴各物质百分含量相同,
⑵ 各物质物质的量成倍数关系,
⑶各物质浓度相同。
1.判断方法:极值法,一边倒,比相同
等比平衡
在一定温度下,一个压强恒定的密闭容器中发生反应2A(g)+B(g) 3C(g)+D(g),根据下表有关数据分析恒温、恒压达平衡时D的体积分数(分别选填a% 或b% a≠b )。
A
B
C
D
平衡时D的体积分数
起始
充入
2mol
1mol
0
0
1mol
0.5mol
1.5mol
0.5mol
4mol
2mol
0
0
2mol
2mol
0
0
a%
a%
a%
b% (a≠b)
归纳总结
条件 等效条件 结果
恒 温 恒 容 (△n(g)≠0)
(△n(g)=0)
恒温恒压
一边倒、量相同
一边倒、比相同
一边倒、比相同
两平衡相比,同一个组分百分含量、n、c均相同 (全等平衡)
两平衡相比,同一组分百分含量相同,n、c同比例变化 (等比平衡)
两次平衡相比,同一组分百分含量、和c相同,n同比例变化( 等比平衡)
1.思维模式:虚拟“中间态”法构建等效平衡
(1)构建恒温恒容平衡思维模式:新平衡状态可认为是两个原平衡状态简单的叠加并压缩而成,相当于增大压强。
(2)构建恒温恒压平衡思维模式(以气体物质的量增加的反应为例):新平衡状态可认为是两个原平衡状态简单叠加,压强不变,平衡不移动。
等效平衡
等效平衡
2.具体应用:利用等效平衡的方法解决不等效平衡的问题
例:把晶体N2O4放入一固定容积的密闭容器中气化并建立
N2O4(g) 2NO2(g)平衡后,保持温度不变,再通入与起始时等量的N2O4气体,反应再次达平衡,则新平衡时c(NO2)/c(N2O4)与原平衡比,其比值( )
A.变大 B.变小 C.不变 D.无法确定
B
1、在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g) 3C(g),已知加入1molA和3molB且达到平衡后,生成了amolC。
(1)达到平衡时,C在反应混合气中的体积分数是____________(用含字母a的代数式表示)。
(2)若继续向原混合物的容器中通入少量氦气后(设氦气和A.B.C都不反应),化学平衡(填字母)_______
A.向正反应方向移动 B.向逆反应方向移动 C.平衡不移动
25a%
C
2、在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g) 3C(g),
已知加入1molA和3molB且达到平衡后,生成了amolC。
(3)在相同实验条件下,若在同一容器中改为加入2molA和6molB,达到平衡后,C的物质的量为______mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比________(选填“增大”“减小”或“不变” )。
(4)在相同实验条件下,若在同一容器中改为加入2mol A和8mol B,若要求平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入C____mol。
6
不变
2a
3、将3 mol A和1 mol B混合于一容积可变的密闭容器P中,以此时的温度、压强和容积作为起始条件,发生了如下反应:3A(g)+B(g) C(g)+D(g),达到平衡时C的浓度为ω mol·L-1。试回答下列问题:
(1)保持温度和压强不变,按下列四种配比充入容器P中,平衡后C的浓度仍为ω mol·L-1的是( )
A.6 mol A和2 mol B
B.3 mol A+1 mol B+2 mol C
C.2 mol C+1 mol B+1 mol D
D.1 mol C+2 mol D
A
等比等效
4、将3 mol A和1 mol B混合于一容积可变的密闭容器P中,以此时的温度、压强和容积作为起始条件,发生了如下反应:3A(g)+B(g) 2C(g)+D(g),达到平衡时C的浓度为ω mol·L-1。试回答下列问题:
(2)保持原起始温度和容积不变,要使平衡后C的浓度仍为ω mol·L-1,应按下列哪种配比向另一容器Q中充入有关物质( )
A.3 mol A+1 mol B
B.4 mol C+2 mol D
C.1.5 mol A+0.5 mol B+1 mol C+0.5 mol D
D.无法判断
D
等值等效
5、在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下 N2(g)+3H2(g) 2NH3(g)
△H=-92.4kJ/mol下列说法不正确的是( )
A.2cl<c3 B.a+b=92.4 C.α1+α3<1 D.2p1=2p2<p3
D
等值等效
P↑V↓
