1.2.2 反应热的计算 课件 (共19张ppt) 2024-2025学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.2.2 反应热的计算 课件 (共19张ppt) 2024-2025学年高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 10:27:45 | ||
图片预览






文档简介
(共19张PPT)
反应热的计算
第一章 化学反应的热效应
重点:熟练掌握反应热的计算
计算反应热的三种方法:
H=
H=
E(反应物分子化学键断裂时所吸收的总能量)-
E(生成物分子化学键形成时所释放的总能量)
H=
E(反应物的总键能)- E(生成物的总键能)
H(生成物的总能量)- H(反应物的总能量)
例1 蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体燃烧的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1,则320 g“可燃冰”(分子式为CH4·8H2O)释放的甲烷气体完全燃烧生成二氧化碳气体和液态水时放出的热量为__________。
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
2 mol
成正比
1 780.6 kJ
1 mol (放出的热量) 890.3 kJ
2 mol kJ
能量
1.根据热化学方程式计算
2.根据实验数据计算
例2 家用液化气的主要成分之一是丁烷(C4H10)。常温常压下,丁烷的燃烧热
ΔH=-2 900 kJ·mol-1,则1 g丁烷完全燃烧生成CO2气体和液态水时放出的
热量为______。
1 mol C4H10 —— 58 g——放热2 900 kJ
50 kJ
如,中和热的测定
如,燃烧热的计算
3.根据反应物、生成物的键能计算
ΔH=E(反应物的键能总和)-E(生成物的键能总和)。
物质 CO2(C=O) CH4(C-H) P4(P-P) SiO2(Si-O) 石墨 金刚石 S8(S-S) Si
键数 2 4 6 4 1.5 2 8 2
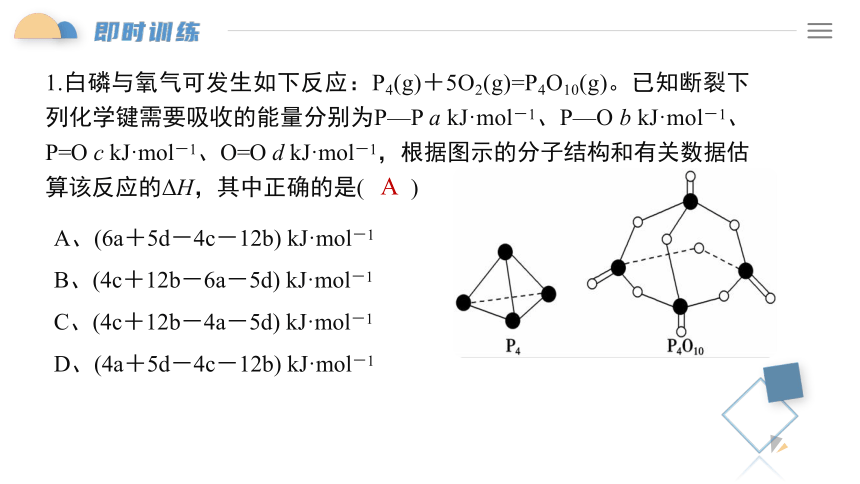
1.白磷与氧气可发生如下反应:P4(g)+5O2(g)=P4O10(g)。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A、(6a+5d-4c-12b) kJ·mol-1
B、(4c+12b-6a-5d) kJ·mol-1
C、(4c+12b-4a-5d) kJ·mol-1
D、(4a+5d-4c-12b) kJ·mol-1
A
2.乙苯催化脱氢制苯乙烯反应:
已知:
化学键 C-H C-C C=C H-H
键能/kJ·mol-1 412 348 612 436
计算上述反应的△H=________ kJ·mol-1。
+124
不变的地方不要管
4.根据图像计算
放热反应
吸热反应
3.碳燃烧的过程如图所示:
则下列说法正确的是( )
A.1 mol C(s)与0.5 mol O2(g)的总能量小于1 mol CO(g)的能量
B.CO2(g)===C(g)+O2(g) ΔH=﹢393.5 kJ·mol-1
C.2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1
D.等量的碳燃烧C(s)―→CO2(g)过程比C(s)―→CO(g)―→CO2(g)过程释放的能量多
放热反应
总能量反应物大于生成物的
C
根据盖斯定律可知,反应的反应热只与始态和终态有关,与过程无关
4.探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
回答下列问题:
ΔH3=________ kJ·mol-1。
由盖斯定律,反应Ⅲ=反应Ⅰ-反应Ⅱ,
即ΔH3=ΔH1-ΔH2
=-49.5 kJ·mol-1-(-90.4 kJ·mol-1)
+40.9
=
=
=
5.根据盖斯定律计算
ΔH的大小比较
1、与“符号”相关的反应热比较:
对于放热反应来说,ΔH=-Q kJ·mol-1,虽然“—”仅表示放热的意思,但在比较大小时要将其看成真正意义上的“负号”,即:放热越多,ΔH反而越小。
ΔH的大小比较
2、与“化学计量数”相关的反应热比较
则a b,ΔH1 ΔH2。
<
>
ΔH的大小比较
3、与“物质聚集状态”相关的反应热比较
S(s)+O2(g)=SO2(g) ΔH7
S(g)+O2(g)=SO2(g) ΔH8
ΔH7 > ΔH8
ΔH9< ΔH10
对于同种物质,气态时焓最高,液态次之,固态最低。
H2(g)+1/2O2(g)=H2O(l) ΔH9
H2(g)+1/2O2(g)=H2O(g) ΔH10
4、注意可逆反应的ΔH
将2 mol SO2、1 mol O2充入一密闭容器中充分反应后,放热98.3 kJ;
2SO2(g)+O2(g) 2SO3(g) ΔH=-Q kJ·mol-1,则Q 98.3。
大于
ΔH的大小比较
1.已知1 mol白磷(s)转化成1 mol红磷(s),放出18.39 kJ热量,又知:
4P(白,s)+5O2(g)=2P2O5(s) ΔH1
4P(红,s)+5O2(g)=2P2O5(s) ΔH2
则ΔH1和ΔH2的关系正确的是( )
A.ΔH1=ΔH2 B.ΔH1>ΔH2
C.ΔH1<ΔH2 D.无法确定
C
2.根据下列热化学方程式可判断ΔH1、ΔH2、ΔH3三者的大小关系是 ( )
2H2(g)+O2(g) = 2H2O(l) ΔH1
2H2(g)+O2(g) = 2H2O(g) ΔH2
H2(g)+ O2(g) = H2O(g) ΔH3
A.ΔH3>ΔH2>ΔH1 B.ΔH1>ΔH2>ΔH3
C.ΔH1=ΔH2>ΔH3 D.ΔH2<ΔH1<ΔH3
A
3.已知化学反应A2(g)+B2(g)==2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
A.每生成2分子AB吸收b kJ热量
B.该反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
观察题给图像可以得到,上述反应的反应物的总能量低于生成物的总能量,为吸热反应,其中反应热ΔH=+(a-b) kJ·mol-1。化学反应过程中,化学键断裂为吸热过程,化学键形成为放热过程。
B
4.黄铁矿(主要成分为FeS2)的燃烧是工业上制硫酸时得到SO2
的途径之一,反应的化学方程式为:4FeS2+11O2===2Fe2O3+8SO2
在 25℃ 和 101kPa 时,1mol FeS2 (s)完全燃烧生成Fe2O3 (s)和SO2 (g)时放出853kJ的热量。这些热量(工业中叫做“废热”)在生产过程中得到了充分利用,大大降低了生产成本,对于节约资源、能源循环利用具有重要意义。
(1)请写出FeS2燃烧的热化学方程式。
(2)计算理论上1kg黄铁矿(FeS 的含量为90%)完全燃烧放出的热量。
高温
反应热的计算
第一章 化学反应的热效应
重点:熟练掌握反应热的计算
计算反应热的三种方法:
H=
H=
E(反应物分子化学键断裂时所吸收的总能量)-
E(生成物分子化学键形成时所释放的总能量)
H=
E(反应物的总键能)- E(生成物的总键能)
H(生成物的总能量)- H(反应物的总能量)
例1 蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体燃烧的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1,则320 g“可燃冰”(分子式为CH4·8H2O)释放的甲烷气体完全燃烧生成二氧化碳气体和液态水时放出的热量为__________。
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
2 mol
成正比
1 780.6 kJ
1 mol (放出的热量) 890.3 kJ
2 mol kJ
能量
1.根据热化学方程式计算
2.根据实验数据计算
例2 家用液化气的主要成分之一是丁烷(C4H10)。常温常压下,丁烷的燃烧热
ΔH=-2 900 kJ·mol-1,则1 g丁烷完全燃烧生成CO2气体和液态水时放出的
热量为______。
1 mol C4H10 —— 58 g——放热2 900 kJ
50 kJ
如,中和热的测定
如,燃烧热的计算
3.根据反应物、生成物的键能计算
ΔH=E(反应物的键能总和)-E(生成物的键能总和)。
物质 CO2(C=O) CH4(C-H) P4(P-P) SiO2(Si-O) 石墨 金刚石 S8(S-S) Si
键数 2 4 6 4 1.5 2 8 2
1.白磷与氧气可发生如下反应:P4(g)+5O2(g)=P4O10(g)。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A、(6a+5d-4c-12b) kJ·mol-1
B、(4c+12b-6a-5d) kJ·mol-1
C、(4c+12b-4a-5d) kJ·mol-1
D、(4a+5d-4c-12b) kJ·mol-1
A
2.乙苯催化脱氢制苯乙烯反应:
已知:
化学键 C-H C-C C=C H-H
键能/kJ·mol-1 412 348 612 436
计算上述反应的△H=________ kJ·mol-1。
+124
不变的地方不要管
4.根据图像计算
放热反应
吸热反应
3.碳燃烧的过程如图所示:
则下列说法正确的是( )
A.1 mol C(s)与0.5 mol O2(g)的总能量小于1 mol CO(g)的能量
B.CO2(g)===C(g)+O2(g) ΔH=﹢393.5 kJ·mol-1
C.2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1
D.等量的碳燃烧C(s)―→CO2(g)过程比C(s)―→CO(g)―→CO2(g)过程释放的能量多
放热反应
总能量反应物大于生成物的
C
根据盖斯定律可知,反应的反应热只与始态和终态有关,与过程无关
4.探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
回答下列问题:
ΔH3=________ kJ·mol-1。
由盖斯定律,反应Ⅲ=反应Ⅰ-反应Ⅱ,
即ΔH3=ΔH1-ΔH2
=-49.5 kJ·mol-1-(-90.4 kJ·mol-1)
+40.9
=
=
=
5.根据盖斯定律计算
ΔH的大小比较
1、与“符号”相关的反应热比较:
对于放热反应来说,ΔH=-Q kJ·mol-1,虽然“—”仅表示放热的意思,但在比较大小时要将其看成真正意义上的“负号”,即:放热越多,ΔH反而越小。
ΔH的大小比较
2、与“化学计量数”相关的反应热比较
则a b,ΔH1 ΔH2。
<
>
ΔH的大小比较
3、与“物质聚集状态”相关的反应热比较
S(s)+O2(g)=SO2(g) ΔH7
S(g)+O2(g)=SO2(g) ΔH8
ΔH7 > ΔH8
ΔH9< ΔH10
对于同种物质,气态时焓最高,液态次之,固态最低。
H2(g)+1/2O2(g)=H2O(l) ΔH9
H2(g)+1/2O2(g)=H2O(g) ΔH10
4、注意可逆反应的ΔH
将2 mol SO2、1 mol O2充入一密闭容器中充分反应后,放热98.3 kJ;
2SO2(g)+O2(g) 2SO3(g) ΔH=-Q kJ·mol-1,则Q 98.3。
大于
ΔH的大小比较
1.已知1 mol白磷(s)转化成1 mol红磷(s),放出18.39 kJ热量,又知:
4P(白,s)+5O2(g)=2P2O5(s) ΔH1
4P(红,s)+5O2(g)=2P2O5(s) ΔH2
则ΔH1和ΔH2的关系正确的是( )
A.ΔH1=ΔH2 B.ΔH1>ΔH2
C.ΔH1<ΔH2 D.无法确定
C
2.根据下列热化学方程式可判断ΔH1、ΔH2、ΔH3三者的大小关系是 ( )
2H2(g)+O2(g) = 2H2O(l) ΔH1
2H2(g)+O2(g) = 2H2O(g) ΔH2
H2(g)+ O2(g) = H2O(g) ΔH3
A.ΔH3>ΔH2>ΔH1 B.ΔH1>ΔH2>ΔH3
C.ΔH1=ΔH2>ΔH3 D.ΔH2<ΔH1<ΔH3
A
3.已知化学反应A2(g)+B2(g)==2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
A.每生成2分子AB吸收b kJ热量
B.该反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
观察题给图像可以得到,上述反应的反应物的总能量低于生成物的总能量,为吸热反应,其中反应热ΔH=+(a-b) kJ·mol-1。化学反应过程中,化学键断裂为吸热过程,化学键形成为放热过程。
B
4.黄铁矿(主要成分为FeS2)的燃烧是工业上制硫酸时得到SO2
的途径之一,反应的化学方程式为:4FeS2+11O2===2Fe2O3+8SO2
在 25℃ 和 101kPa 时,1mol FeS2 (s)完全燃烧生成Fe2O3 (s)和SO2 (g)时放出853kJ的热量。这些热量(工业中叫做“废热”)在生产过程中得到了充分利用,大大降低了生产成本,对于节约资源、能源循环利用具有重要意义。
(1)请写出FeS2燃烧的热化学方程式。
(2)计算理论上1kg黄铁矿(FeS 的含量为90%)完全燃烧放出的热量。
高温
