2.2.4 影响化学平衡的因素-温度、催化剂 勒夏特列原理 课件 (共28张ppt) 2024-2025学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2.4 影响化学平衡的因素-温度、催化剂 勒夏特列原理 课件 (共28张ppt) 2024-2025学年高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 10:27:23 | ||
图片预览




文档简介
(共28张PPT)
影响化学平衡的因素
——温度、催化剂
勒夏特列原理
第二章 化学反应速率与化学平衡
1.理解温度、催化剂对化学平衡状态的影响。
2.理解勒夏特列原理,能依据原理分析平衡移动的方向。
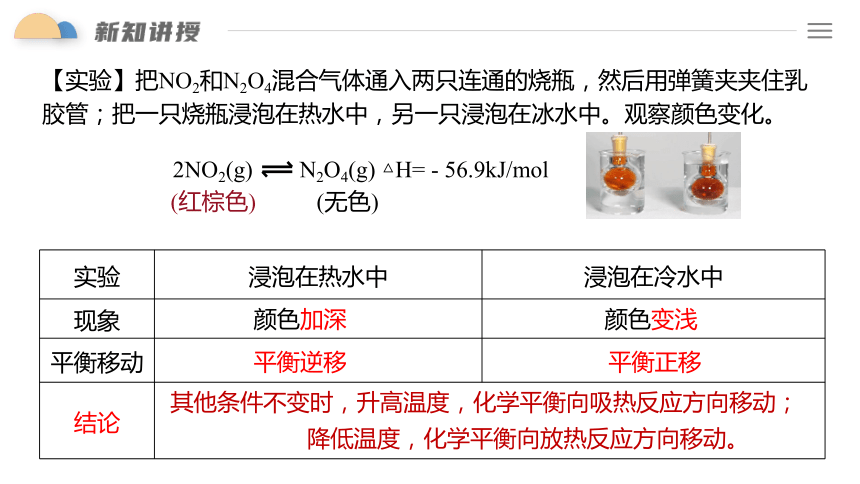
2NO2(g) N2O4(g) △H= - 56.9kJ/mol
(红棕色)
(无色)
实验 浸泡在热水中 浸泡在冷水中
现象
平衡移动
结论
颜色加深
颜色变浅
平衡逆移
平衡正移
其他条件不变时,升高温度,化学平衡向吸热反应方向移动;
降低温度,化学平衡向放热反应方向移动。
【实验】把NO2和N2O4混合气体通入两只连通的烧瓶,然后用弹簧夹夹住乳胶管;把一只烧瓶浸泡在热水中,另一只浸泡在冰水中。观察颜色变化。
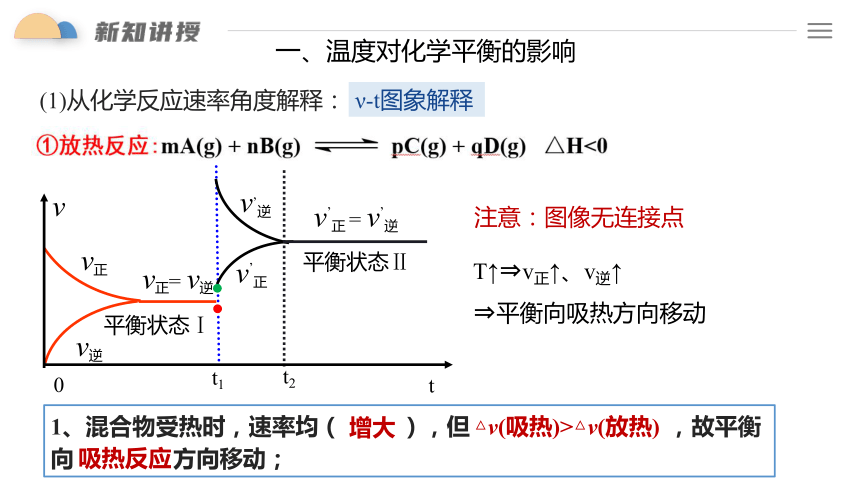
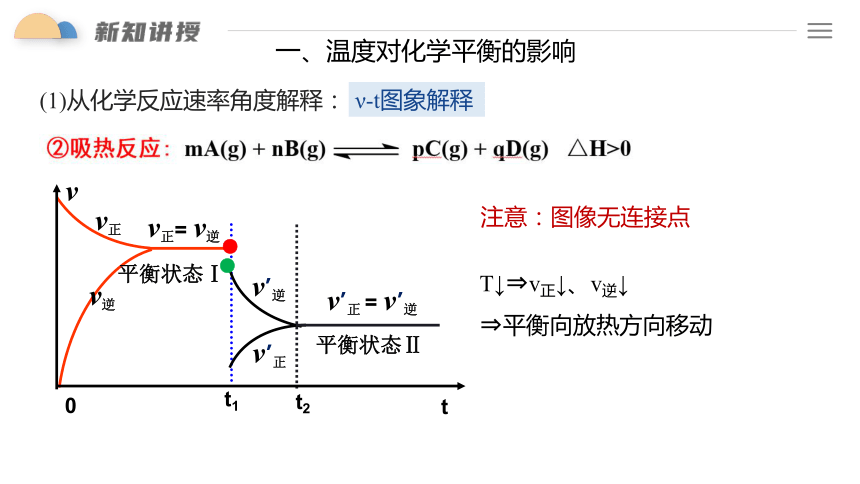
一、温度对化学平衡的影响
(1)从化学反应速率角度解释:
ν-t图象解释
t2
v’正 = v’逆
v’逆
v’正
平衡状态Ⅱ
v正= v逆
v正
v逆
t1
t
v
0
平衡状态Ⅰ
●
●
注意:图像无连接点
T↑ v正↑、v逆↑
平衡向吸热方向移动
1、混合物受热时,速率均( ),但 ,故平衡向 方向移动;
增大
△v(吸热)>△v(放热)
吸热反应
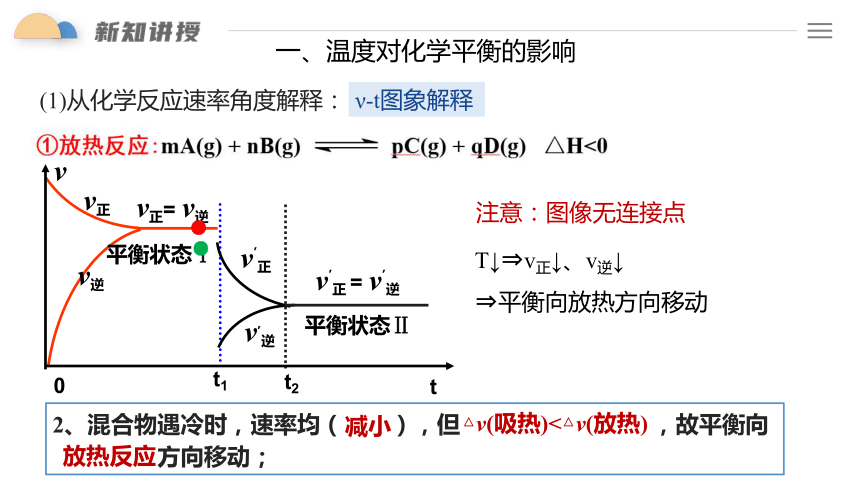
一、温度对化学平衡的影响
(1)从化学反应速率角度解释:
ν-t图象解释
t2
v’正 = v’逆
v’逆
v’正
平衡状态Ⅱ
v正= v逆
v正
v逆
t1
t
v
0
平衡状态Ⅰ
●
●
注意:图像无连接点
T↓ v正↓、v逆↓
平衡向放热方向移动
2、混合物遇冷时,速率均( ),但 ,故平衡向
方向移动;
减小
△v(吸热)<△v(放热)
放热反应
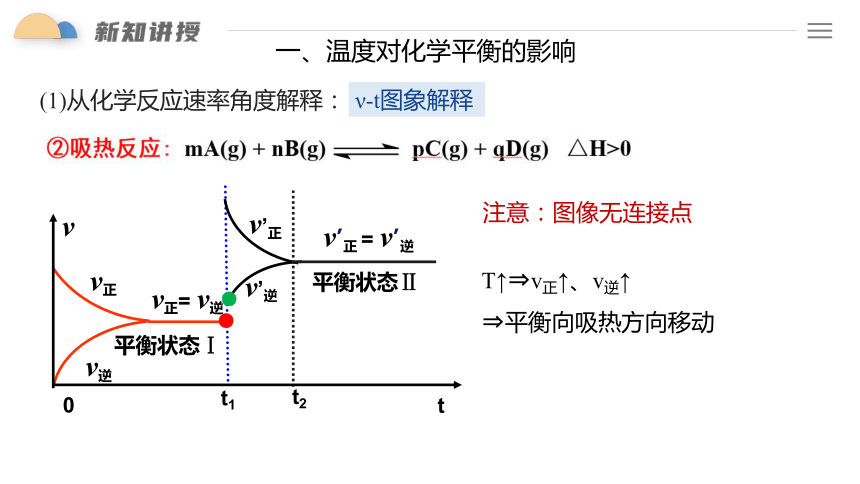
一、温度对化学平衡的影响
(1)从化学反应速率角度解释:
ν-t图象解释
t2
v’正 = v’逆
v’逆
v’正
平衡状态Ⅱ
v正= v逆
v正
v逆
t1
t
v
0
平衡状态Ⅰ
●
●
注意:图像无连接点
T↑ v正↑、v逆↑
平衡向吸热方向移动
一、温度对化学平衡的影响
(1)从化学反应速率角度解释:
ν-t图象解释
t2
v’正 = v’逆
v’逆
v’正
平衡状态Ⅱ
v正= v逆
v正
v逆
t1
t
v
0
平衡状态Ⅰ
●
●
注意:图像无连接点
T↓ v正↓、v逆↓
平衡向放热方向移动
一、温度对化学平衡的影响
(2)从化学反应平衡常数角度解释:
不同温度下H2(g) + I2(g) 2HI(g) △H<0 的平衡常数
温度 623K 698K 763K
浓度平衡常数 66 .9 54.4 45.9
正反应为放热反应:升高温度使K减小,Q>K,
正反应为吸热反应:升高温度使K增大,QQ不变
T
移动方向
K变化
△H
平衡向逆反应方向(吸热方向)移动。
平衡向正反应方向
(吸热方向)移动。
A(g)+3B(g) 2C(g) ΔH<0达到平衡后,
将反应体系的温度降低,下列叙述中正确的是( )
A、正反应速率增大,逆反应速率减小,平衡向右移动
B、正反应速率减小,逆反应速率增大,平衡向左移动
C、正反应速率和逆反应速率都减小,平衡向右移动
D、正反应速率和逆反应速率都减小,平衡向左移动
C
二、催化剂对化学平衡的影响
理论分析
催化剂降低了反应的活化能,
正反应的活化能降低,
逆反应的活化能也降低,
正逆反应的活化分子百分数增加倍数相同,
正逆反应速率增加的倍数也相等。
催化剂不能改变达到平衡状态的反应混合物的含量,
只改变到达平衡的时间。
二、催化剂对化学平衡的影响
图像分析
v'正=v'逆
含量
t
t1
t2
a
b
先拐先平
a使用催化剂
催化剂同步、等倍数改变v正和 v逆
结论:催化剂 使化学平衡发生移动;
改变反应混合物含量;但可以 达到平衡的时间。
不能
不
缩短
提醒 ①一般说的催化剂都是指的正催化剂,即可以加快反应速率。特殊情况下,也使用负催化剂,减慢反应速率。
②用速率分析化学平衡移动的一般思路
ν′正= ν′逆
影响化学平衡的因素
浓度
压强
温度
增大C反应物 或 减小C生成物
减小C反应物 或 增大C生成物
平衡正方向移动
平衡逆方向移动
催化剂
不影响平衡移动
升高温度
降低温度
平衡向吸热方向移动
平衡向放热方向移动
增大压强
减小压强
平衡向气体分子数减小方向移动
平衡向气体分子数增大方向移动
(1)温度可以影响任意可逆反应的化学平衡状态( )
(2)催化剂能加快反应速率,提高单位时间内的产量,也能提高反应物的转化率( )
(3)升高温度,反应速率加快,化学平衡正向移动( )
(4)升高温度,反应速率加快,但反应物的转化率可能降低( )
(5)对于可逆反应,改变外界条件使平衡向正反应方向移动,平衡常数一定增大( )
(6)升高温度,化学平衡常数增大( )
(7)平衡移动,平衡常数不一定改变,但平衡常数改变,平衡一定发生移动( )
√
×
×
√
×
×
√
判断正误
三、勒夏特列原理
如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向着能够减弱这种改变的方向移动。这就是勒夏特列原理,也称化学平衡移动原理。
三、勒夏特列原理
(1)适用范围
适用于任何动态平衡体系
(2)适用条件
能影响化学平衡的外界条件
平衡移动的结果:
“减弱”外界条件的影响,而不能消除外界条件改变的影响
举个例子
原平衡(100℃)
升温到200℃
减弱(降温)
吸热反应方向移动
新平衡(温度介于100-200℃之间)
减弱但不抵消
综上所述:改变浓度、压强、温度等因素可以提高反应产率或者抑制反应进行的程度。
思考并完成下列表格 2SO2(g) + O2(g) 2SO3(g)
条件的改变 平衡移动的方向 新平衡建立时
具 体 增大O2的浓度
减小SO3的浓度
增大压强
升高温度
抽象 改变一个条件
向右即O2浓度减小的方向
O2浓度较原平衡大
向右即SO3浓度增大的方向
SO3浓度较原平衡小
向右即压强减小方向
总压强比原平衡大
向左即温度降低的方向
平衡温度比旧平衡高
减弱这种改变
不能抵消这种改变
解读:勒夏特列原理
1、原理仅适用于已经达到平衡的反应体系
2、原理只适用于判断“改变一个条件”时平衡移动的方向
若同时改变多个影响平衡移动的几个条件,则不能简单的依据该原理来判断平衡移动的方向,只有在改变条件时对平衡移动的影响方向一致时,才能根据该原理进行判断。
不可逆过程或者未达到平衡的可逆过程均不能使用该原理。
此外,勒夏特列原理对所有的动态平衡(如电离平衡等)都适用。
解读:勒夏特列原理
3、原理中的“减弱”不等于“消除”,更不是“扭转”,即平衡移动不能将外界影响完全消除,而只能减弱。
例如,平衡体系的压强为P,若其他条件不变,
将体系的压强增大到2P,平衡将向气体体积减小的方向移动,
达到新平衡的体系,压强介于P—2P之间。
4、应用原理时应弄清是否真的改变了影响化学平衡的条件。
如:对于aA(g)+bB(g) cC(g)+dD(g),当a+b=c+d时,即使改变压强,化学平衡也不移动。
例如,改变平衡体系中固体或纯液体的量,对于有气体存在的化学平衡体系,在定容、定温条件下充入惰性气体等未改变影响化学平衡的条件。
还要弄清可逆反应是否存在能否减弱某项条件改变的反应方向。
化学平衡的移动
原因
改变条件使v正 ≠ v逆
方向
v正 >v逆 Qv正 K逆反应方向移动
影响化学平衡的因素
浓度
压强
温度
勒夏特列原理
c反↗,正向;c反↘,逆向
c生↗,逆向;c生↘,正向
p↗,向气体体积减小的方向移动
p↘,向气体体积增大的方向移动
升吸降放
催化剂
——只影响反应速率,不影响化学平衡
1.已知:N2(g)+3H2(g) 2NH3(g) ΔH= -92.4kJ.mol-1,反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施
t1
t2
t3
t4
增大c(N2)或c(H2)
加入催化剂
降低温度
增大压强
速率增大:升温、加压、增大浓度、加催化剂
速率减小:降温、减压、减小浓度
正逆速率相对大小:确定平衡移动方向。
2.下列事实不能用勒夏特列原理解释的是( )
A.用浓氨水和氢氧化钠固体快速制取氨气
B.将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快
C.黄绿色的氯水光照后颜色变浅
D.将CO中毒的病人迅速抬到空气新鲜的地方
B
C
3. 对于下列化学平衡在一定条件下发生移动的描述,不正确的是( )A.Cl2+H2O HCl+HClO,氯水中加入碳酸钙,漂白性增强B.ZnS+Cu2+ CuS+Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
C.2NO2 N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅D.Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
A
4. 一定温度下,反应C(s)+H2O(g) CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )①增加C的物质的量
②保持容器容积不变,充入N2使体系压强增大
③将容器的容积缩小一半
④保持压强不变,充入N2使容器容积变大A.①② B.②③ C.①④ D.③④
5.在容积一定的密闭容器中,反应:A(?)+B(g) C(g)+D(g)达到平衡后,升高温度,容器内气体的密度增大,则下列说法正确的是( )
A.正反应是放热反应
B.A不是气态物质,加入A该平衡向正反应方向移动
C.其他条件不变,降低温度该平衡向逆反应方向移动
D.改变压强对该平衡的移动无影响
C
6.有两个容积相等的密闭容器A和B如图所示,A容器有一个可上下移动的活塞,能使容器保持恒压,B容器的容积不变。起始时两容器中分别充入等量且体积比为2∶1的SO2和O2的混合气体,并使
A和B容积相等。在400 ℃条件下,发生如下反应:
2SO2(g)+O2(g) 2SO3(g)。
(1)达到平衡时所需的时间t(A)____t(B),A容器
中SO2的转化率_____B容器中SO2的转化率(填“>”、“<或“=”)。
(2)达到(1)所述平衡后,若向两容器中通入少量的等量氩气,A容器中化学平衡___移动,B容器中化学平衡_____移动(填“向左”、“向右”或“不”)。
>
<
向左
不
影响化学平衡的因素
——温度、催化剂
勒夏特列原理
第二章 化学反应速率与化学平衡
1.理解温度、催化剂对化学平衡状态的影响。
2.理解勒夏特列原理,能依据原理分析平衡移动的方向。
2NO2(g) N2O4(g) △H= - 56.9kJ/mol
(红棕色)
(无色)
实验 浸泡在热水中 浸泡在冷水中
现象
平衡移动
结论
颜色加深
颜色变浅
平衡逆移
平衡正移
其他条件不变时,升高温度,化学平衡向吸热反应方向移动;
降低温度,化学平衡向放热反应方向移动。
【实验】把NO2和N2O4混合气体通入两只连通的烧瓶,然后用弹簧夹夹住乳胶管;把一只烧瓶浸泡在热水中,另一只浸泡在冰水中。观察颜色变化。
一、温度对化学平衡的影响
(1)从化学反应速率角度解释:
ν-t图象解释
t2
v’正 = v’逆
v’逆
v’正
平衡状态Ⅱ
v正= v逆
v正
v逆
t1
t
v
0
平衡状态Ⅰ
●
●
注意:图像无连接点
T↑ v正↑、v逆↑
平衡向吸热方向移动
1、混合物受热时,速率均( ),但 ,故平衡向 方向移动;
增大
△v(吸热)>△v(放热)
吸热反应
一、温度对化学平衡的影响
(1)从化学反应速率角度解释:
ν-t图象解释
t2
v’正 = v’逆
v’逆
v’正
平衡状态Ⅱ
v正= v逆
v正
v逆
t1
t
v
0
平衡状态Ⅰ
●
●
注意:图像无连接点
T↓ v正↓、v逆↓
平衡向放热方向移动
2、混合物遇冷时,速率均( ),但 ,故平衡向
方向移动;
减小
△v(吸热)<△v(放热)
放热反应
一、温度对化学平衡的影响
(1)从化学反应速率角度解释:
ν-t图象解释
t2
v’正 = v’逆
v’逆
v’正
平衡状态Ⅱ
v正= v逆
v正
v逆
t1
t
v
0
平衡状态Ⅰ
●
●
注意:图像无连接点
T↑ v正↑、v逆↑
平衡向吸热方向移动
一、温度对化学平衡的影响
(1)从化学反应速率角度解释:
ν-t图象解释
t2
v’正 = v’逆
v’逆
v’正
平衡状态Ⅱ
v正= v逆
v正
v逆
t1
t
v
0
平衡状态Ⅰ
●
●
注意:图像无连接点
T↓ v正↓、v逆↓
平衡向放热方向移动
一、温度对化学平衡的影响
(2)从化学反应平衡常数角度解释:
不同温度下H2(g) + I2(g) 2HI(g) △H<0 的平衡常数
温度 623K 698K 763K
浓度平衡常数 66 .9 54.4 45.9
正反应为放热反应:升高温度使K减小,Q>K,
正反应为吸热反应:升高温度使K增大,Q
T
移动方向
K变化
△H
平衡向逆反应方向(吸热方向)移动。
平衡向正反应方向
(吸热方向)移动。
A(g)+3B(g) 2C(g) ΔH<0达到平衡后,
将反应体系的温度降低,下列叙述中正确的是( )
A、正反应速率增大,逆反应速率减小,平衡向右移动
B、正反应速率减小,逆反应速率增大,平衡向左移动
C、正反应速率和逆反应速率都减小,平衡向右移动
D、正反应速率和逆反应速率都减小,平衡向左移动
C
二、催化剂对化学平衡的影响
理论分析
催化剂降低了反应的活化能,
正反应的活化能降低,
逆反应的活化能也降低,
正逆反应的活化分子百分数增加倍数相同,
正逆反应速率增加的倍数也相等。
催化剂不能改变达到平衡状态的反应混合物的含量,
只改变到达平衡的时间。
二、催化剂对化学平衡的影响
图像分析
v'正=v'逆
含量
t
t1
t2
a
b
先拐先平
a使用催化剂
催化剂同步、等倍数改变v正和 v逆
结论:催化剂 使化学平衡发生移动;
改变反应混合物含量;但可以 达到平衡的时间。
不能
不
缩短
提醒 ①一般说的催化剂都是指的正催化剂,即可以加快反应速率。特殊情况下,也使用负催化剂,减慢反应速率。
②用速率分析化学平衡移动的一般思路
ν′正= ν′逆
影响化学平衡的因素
浓度
压强
温度
增大C反应物 或 减小C生成物
减小C反应物 或 增大C生成物
平衡正方向移动
平衡逆方向移动
催化剂
不影响平衡移动
升高温度
降低温度
平衡向吸热方向移动
平衡向放热方向移动
增大压强
减小压强
平衡向气体分子数减小方向移动
平衡向气体分子数增大方向移动
(1)温度可以影响任意可逆反应的化学平衡状态( )
(2)催化剂能加快反应速率,提高单位时间内的产量,也能提高反应物的转化率( )
(3)升高温度,反应速率加快,化学平衡正向移动( )
(4)升高温度,反应速率加快,但反应物的转化率可能降低( )
(5)对于可逆反应,改变外界条件使平衡向正反应方向移动,平衡常数一定增大( )
(6)升高温度,化学平衡常数增大( )
(7)平衡移动,平衡常数不一定改变,但平衡常数改变,平衡一定发生移动( )
√
×
×
√
×
×
√
判断正误
三、勒夏特列原理
如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向着能够减弱这种改变的方向移动。这就是勒夏特列原理,也称化学平衡移动原理。
三、勒夏特列原理
(1)适用范围
适用于任何动态平衡体系
(2)适用条件
能影响化学平衡的外界条件
平衡移动的结果:
“减弱”外界条件的影响,而不能消除外界条件改变的影响
举个例子
原平衡(100℃)
升温到200℃
减弱(降温)
吸热反应方向移动
新平衡(温度介于100-200℃之间)
减弱但不抵消
综上所述:改变浓度、压强、温度等因素可以提高反应产率或者抑制反应进行的程度。
思考并完成下列表格 2SO2(g) + O2(g) 2SO3(g)
条件的改变 平衡移动的方向 新平衡建立时
具 体 增大O2的浓度
减小SO3的浓度
增大压强
升高温度
抽象 改变一个条件
向右即O2浓度减小的方向
O2浓度较原平衡大
向右即SO3浓度增大的方向
SO3浓度较原平衡小
向右即压强减小方向
总压强比原平衡大
向左即温度降低的方向
平衡温度比旧平衡高
减弱这种改变
不能抵消这种改变
解读:勒夏特列原理
1、原理仅适用于已经达到平衡的反应体系
2、原理只适用于判断“改变一个条件”时平衡移动的方向
若同时改变多个影响平衡移动的几个条件,则不能简单的依据该原理来判断平衡移动的方向,只有在改变条件时对平衡移动的影响方向一致时,才能根据该原理进行判断。
不可逆过程或者未达到平衡的可逆过程均不能使用该原理。
此外,勒夏特列原理对所有的动态平衡(如电离平衡等)都适用。
解读:勒夏特列原理
3、原理中的“减弱”不等于“消除”,更不是“扭转”,即平衡移动不能将外界影响完全消除,而只能减弱。
例如,平衡体系的压强为P,若其他条件不变,
将体系的压强增大到2P,平衡将向气体体积减小的方向移动,
达到新平衡的体系,压强介于P—2P之间。
4、应用原理时应弄清是否真的改变了影响化学平衡的条件。
如:对于aA(g)+bB(g) cC(g)+dD(g),当a+b=c+d时,即使改变压强,化学平衡也不移动。
例如,改变平衡体系中固体或纯液体的量,对于有气体存在的化学平衡体系,在定容、定温条件下充入惰性气体等未改变影响化学平衡的条件。
还要弄清可逆反应是否存在能否减弱某项条件改变的反应方向。
化学平衡的移动
原因
改变条件使v正 ≠ v逆
方向
v正 >v逆 Q
影响化学平衡的因素
浓度
压强
温度
勒夏特列原理
c反↗,正向;c反↘,逆向
c生↗,逆向;c生↘,正向
p↗,向气体体积减小的方向移动
p↘,向气体体积增大的方向移动
升吸降放
催化剂
——只影响反应速率,不影响化学平衡
1.已知:N2(g)+3H2(g) 2NH3(g) ΔH= -92.4kJ.mol-1,反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施
t1
t2
t3
t4
增大c(N2)或c(H2)
加入催化剂
降低温度
增大压强
速率增大:升温、加压、增大浓度、加催化剂
速率减小:降温、减压、减小浓度
正逆速率相对大小:确定平衡移动方向。
2.下列事实不能用勒夏特列原理解释的是( )
A.用浓氨水和氢氧化钠固体快速制取氨气
B.将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快
C.黄绿色的氯水光照后颜色变浅
D.将CO中毒的病人迅速抬到空气新鲜的地方
B
C
3. 对于下列化学平衡在一定条件下发生移动的描述,不正确的是( )A.Cl2+H2O HCl+HClO,氯水中加入碳酸钙,漂白性增强B.ZnS+Cu2+ CuS+Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
C.2NO2 N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅D.Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
A
4. 一定温度下,反应C(s)+H2O(g) CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )①增加C的物质的量
②保持容器容积不变,充入N2使体系压强增大
③将容器的容积缩小一半
④保持压强不变,充入N2使容器容积变大A.①② B.②③ C.①④ D.③④
5.在容积一定的密闭容器中,反应:A(?)+B(g) C(g)+D(g)达到平衡后,升高温度,容器内气体的密度增大,则下列说法正确的是( )
A.正反应是放热反应
B.A不是气态物质,加入A该平衡向正反应方向移动
C.其他条件不变,降低温度该平衡向逆反应方向移动
D.改变压强对该平衡的移动无影响
C
6.有两个容积相等的密闭容器A和B如图所示,A容器有一个可上下移动的活塞,能使容器保持恒压,B容器的容积不变。起始时两容器中分别充入等量且体积比为2∶1的SO2和O2的混合气体,并使
A和B容积相等。在400 ℃条件下,发生如下反应:
2SO2(g)+O2(g) 2SO3(g)。
(1)达到平衡时所需的时间t(A)____t(B),A容器
中SO2的转化率_____B容器中SO2的转化率(填“>”、“<或“=”)。
(2)达到(1)所述平衡后,若向两容器中通入少量的等量氩气,A容器中化学平衡___移动,B容器中化学平衡_____移动(填“向左”、“向右”或“不”)。
>
<
向左
不
