1.3常见的酸 同步练习(含解析)
图片预览



文档简介
1.3常见的酸 同步练习
、选择题
有一瓶标签无法辨认的试剂,是稀盐酸或稀硫酸中的一种。仅用下列试剂就能进行鉴别的是( )
A.pH试纸 B.紫色石蕊试液
C.硝酸银溶液 D.硝酸钡溶液
要证明某工厂排放的污水呈酸性,用试管取样进行实验,下列方法不可行的是( )
A.滴入紫色石蕊溶液,紫色石蕊溶液变红
B.滴入无色酚酞溶液,溶液仍无色
C.加入锌片,有气泡产生
D.加入碳酸钙,有气泡产生
不用指示剂,将含有盐酸的氯化钙溶液由酸性变为中性,应选用的试剂是( )
A.澄清石灰水 B.硝酸银溶液 C.生石灰粉末 D.石灰石
小红做酸的性质实验时,不慎将盐酸溶液撒到大理石地板,立即发出“嘶嘶”响声,并冒气泡.该气泡是( )
A.CO2 B.SO2 C.H2 D.O2
胃酸中含有HCl,当胃酸过多会引起的胃病,需用抗酸剂治疗来消耗胃液中的H+。下列物质不能用抗酸剂的是( )
A.MgO B.CaCO3 C.AgNO3 D.Al(OH)3
打开浓盐酸试剂瓶,发现瓶口有“白雾”出现。已盐酸中含有水分子(H2O)、氢离子(H+)和氯离子(Cl-)。下列实验能证明“白雾”中含有氢离子的是( )
A.①③ B.②④ C.①②④ D.①③④
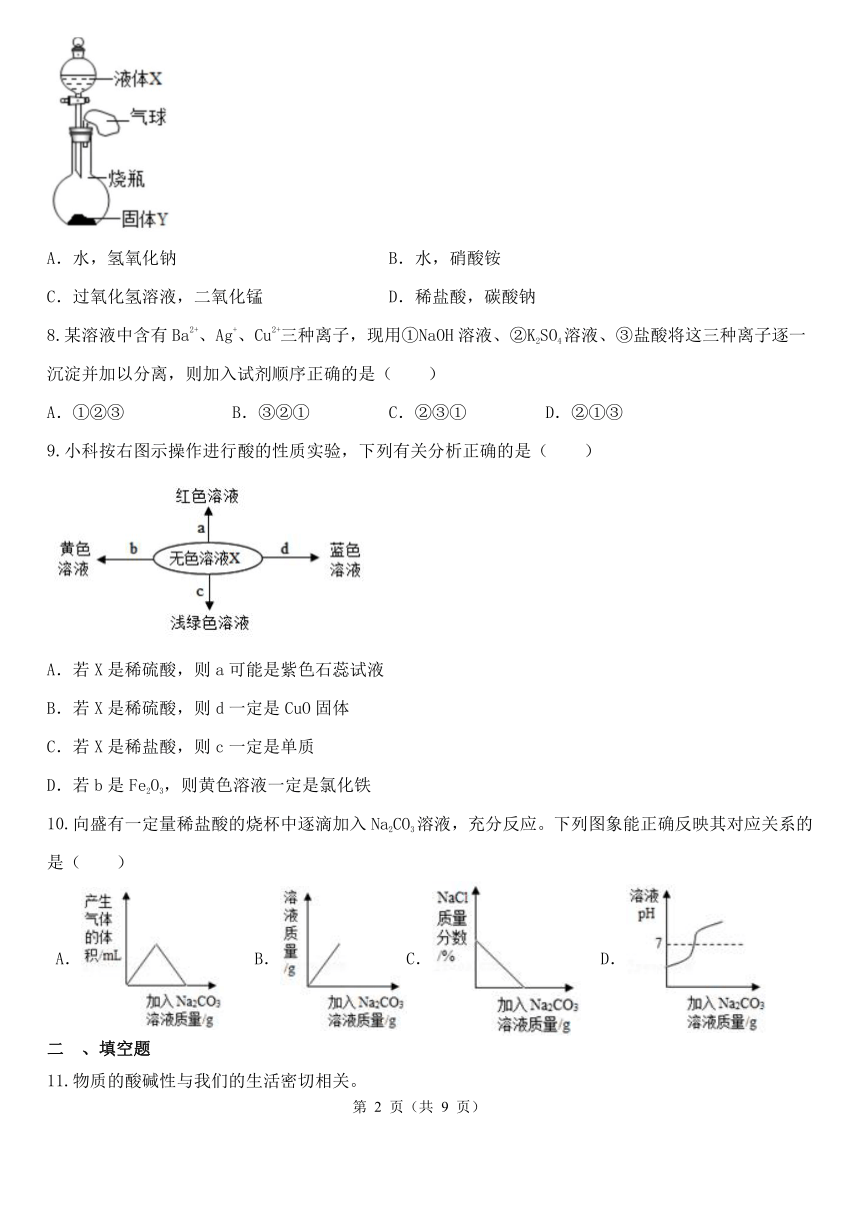
如图所示,将一定量的液体X滴入烧瓶中,若使小气球鼓起(液体X的体积忽略不计),则液体X和固体Y不可能是( )
A.水,氢氧化钠 B.水,硝酸铵
C.过氧化氢溶液,二氧化锰 D.稀盐酸,碳酸钠
某溶液中含有Ba2+、Ag+、Cu2+三种离子,现用①NaOH溶液、②K2SO4溶液、③盐酸将这三种离子逐一沉淀并加以分离,则加入试剂顺序正确的是( )
A.①②③ B.③②① C.②③① D.②①③
小科按右图示操作进行酸的性质实验,下列有关分析正确的是( )
A.若X是稀硫酸,则a可能是紫色石蕊试液
B.若X是稀硫酸,则d一定是CuO固体
C.若X是稀盐酸,则c一定是单质
D.若b是Fe2O3,则黄色溶液一定是氯化铁
向盛有一定量稀盐酸的烧杯中逐滴加入Na2CO3溶液,充分反应。下列图象能正确反映其对应关系的是( )
A. B.C. D.
、填空题
物质的酸碱性与我们的生活密切相关。
(1)酸性是因为物质能电离出 离子,可以使紫色石蕊试液变 色。
(2)酸碱性强弱可用pH表示,通常洗衣粉、香皂呈碱性,即pH 7.自然状态下头皮表面呈弱酸性,有利于头发的生长;所以用洗发水洗发后,最好再使用护发素,使头皮保持弱酸性;由此推测护发素的pH 7.(选填“>”、“<”、“=”)
对知识的及时整理与归纳是学习科学的重要方法。某同学在学习了硫酸 的化学性质后,初步归纳出稀硫酸与其他物质相互反应的关系,如图所示(“一”表示相连的两种物质能发生反应,五个圈中的物质属于不同的类别)。
(1)已知X是金属单质,则X可以是 (填一种即可)。
(2)请写出稀硫酸与Y反应的一个化学方程式: 。
小金在研究硫酸的性质时,做了以下实验:
(1)小金用玻璃棒蘸取浓硫酸和稀硫酸在白纸上写字,放置一会儿发现用浓硫酸写的字变黑,这体现了浓硫酸的 性,属于 性质(选填“物理”或“化学”)。
(2)将生锈的铁钉投入到一定量的稀硫酸中,溶液会变成黄色,请写出该反应的化学方程式: ;同时,铁钉表面产生大量的气泡,请写出相应的化学方程式: ;
、实验探究题
氢氧化钠与稀硫酸反应是否放出热量?三位同学为探究此问题按下图进行了实验:
(1)甲同学按图实验:在烧杯中先加入一定量的稀硫酸溶液,然后再加入适量的氢氧化钠固体,观察到温度计示数变大,于是得到“反应放出热量”的结论。你认为是否正确并说明理由 ;
(2)乙同学用乙图实验,可以根据 现象证明该反应放出热量.
(3)丙同学是将稀硫酸不断的滴入氢氧化钠溶液中,并用数字化仪器测量的数据。由图可知,当反应进行到20s时溶液中的溶质是 。
、解答题
为了测定实验中所用稀盐酸的溶质质量分数,某同学取10克纯碱加入100克稀盐酸,恰好完全反应后,剩余物质的总质量是107.8克.
求:
(1)生成二氧化碳的质量;
(2)稀盐酸溶液中溶质质量分数;
1.3常见的酸 同步练习答案解析
、选择题
D
【解析】物质的鉴别需要根据两种物质的不同点去鉴别酸都能使石蕊变红,酚酞不变色,pH<7。稀盐酸和稀硫酸的区别在于两者的酸根离子,氯离子和硫酸根离子。
A.盐酸和稀硫酸都显酸性,都能使pH试纸变红,不能鉴别,故A错误;
B.盐酸和稀硫酸都显酸性,都能使紫色石蕊试液变红,不能鉴别,故B错误;
C.盐酸和稀硫酸都能和硝酸银溶液反应生成白色沉淀,不能鉴别,故C错误;
D.盐酸和硝酸钡溶液不反应,稀硫酸和硝酸钡溶液反应生成白色沉淀,能鉴别,故D正确。
故选:D 。
B
【解析】根据酸的性质分析判断。
A.滴入紫色石蕊溶液,紫色石蕊溶液变红,可行,故A不合题意;
B.无色酚酞溶液遇到酸性或中性溶液都不变色,不可行,故B符合题意;
C.加入锌片,遇到酸生成氢气,可行,故C不合题意;
D.加入碳酸钙,遇到酸生成二氧化碳气体,可行,故D不合题意。
故选B。
D
【解析】根据酸的化学性质分析,根据各物质与酸反应的现象分析。
A.加澄清石灰水时,与盐酸反应没有明显现象,无法确定是否完全反应,不符合题意;
B.硝酸银溶液反应的是氯离子,而不是反应氢离子,不符合题意;
C.生石灰与盐酸反应生成氯化钙和水,但过量时会与水反应生成氢氧化钙,不符合题意;
D.石灰石为不溶性物质,只能与盐酸发生反应,所以加入过量石灰石可将氯化钙中盐酸全部除去,符合题意;
故答案为:D。
A
【解析】大理石的主要成分是碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳气体,据此分析解答。
小红做酸的性质实验时,不慎将盐酸溶液撒到大理石地板,立即发出“嘶嘶”响声,并冒气泡.该气泡是二氧化碳,即CO2,故A正确,而B、C、D错误。
故选A.
C
【解析】根据所给各物质与盐酸反应时消耗的离子种类分析。
A.氧化镁能与盐酸反应生成氯化镁和水,消耗了氢离子,可作抗酸剂,不符合题意;
B、碳酸钙可与盐酸反应,产生二氧化碳气体,消耗了氢离子,可作抗酸剂,不符合题意;
C、硝酸银能与盐酸反应生成氯化银和硝酸,没有消耗氢离子,不可作抗酸剂,符合题意;
D、 Al(OH)3与盐酸反应生成氯化铝和水,消耗了氢离子,可作抗酸剂,不符合题意;
故选C。
D
【解析】“白雾”中含有氢离子,那么它呈酸性,根据酸的通性分析判断。
①涂有紫色石蕊试液的表面皿变成红色,说明呈酸性,含有氢离子;
②涂有硝酸银的表面皿出现白色沉淀,说明有氯离子,不能说明有氢离子;
③放在浓盐酸上面的pH试纸,显示呈酸性,说明有氢离子;
④涂有氢氧化钠和酚酞的表面皿呈红色,而一会红色褪去,说明白雾呈酸性,含有氢离子。
因此能够说明“白雾”含有氢离子的是①③④。
故选D。
B
【解析】根据若使小气球鼓起 ,需使装置内压强增大,或者温度升高,或者产生气体分析。
若使小气球鼓起 ,需使装置内压强增大,或者温度升高,或者产生气体;
A.氢氧化钠溶解放热,不符合题意;
B、硝酸铵溶解于水吸热,装置内压强减小,不会使气球变大,符合题意;
C. 过氧化氢溶液在二氧化锰催化作用下会分解产生氧气 ,不符合题意;
D、稀盐酸和碳酸钠反应会产生二氧化碳气体,不符合题意;
故选B。
B
【解析】溶液含有Ba2+、Cu2+、Ag+,应先加入HCl,生成AgCl沉淀,过滤后在加入K2SO4,可得到BaSO4沉淀,最后加入NaOH,可得到Cu(OH)2沉淀,以此解答该题.
解:Ag+、Cu2+均与NaOH反应生成沉淀,Ba2+、Ag+均与K2SO4溶液反应生成沉淀,则这三种离子逐一沉淀并加以分离,应先加入HCl,生成AgCl沉淀,过滤后在加入K2SO4,可得到BaSO4沉淀,最后加入NaOH,可得到Cu(OH)2沉淀,即顺序为③②①,
故选B.
A
【解析】根据酸的性质分析判断。
A.紫色石蕊试液遇到酸性溶液变成红色,故A正确;
B.稀硫酸与氢氧化铜反应,生成蓝色的硫酸铜溶液和水,故B错误;
C.氧化亚铁与稀盐酸反应,生成浅绿色氯化亚铁溶液,故C错误;
D.黄色溶液可能是氯化铁,也可能是硫酸铁,故D错误。
故选A.
D
【解析】根据碳酸钠和稀盐酸反应的过程、现象和产物分析判断。
当碳酸钠和稀盐酸反应时,生成二氧化碳的质量不断增大;当稀盐酸完全反应后,不再有气体生成,即气体质量不变,故A错误;
当有气体生成时,溶液质量的增加量等于加入的碳酸钠的溶液质量与气体质量的差;当没有气体生成时,溶液质量的增加量等于加入的碳酸钠的溶液质量,二者增加的速度不同,故B错误;
当稀盐酸和碳酸钠反应时,氯化钠的质量不断增大;当稀盐酸完全反应后,不再有氯化钠生成,即氯化钠的质量不变,即氯化钠的质量分数先增大后不变,故C错误;
随着稀盐酸和碳酸钠的反应进行,酸的浓度不断减小,则pH逐渐增大。当二者完全反应时,pH=7;当碳酸钠过量时,溶液的pH>7,故D正确。
故选D。
、填空题
(1)氢;红
(2)>;<
【解析】(1)根据酸的特点和酸碱指示剂的用途分析解答;
(2)pH<7,溶液呈酸性;pH=7,溶液呈中性;pH>7,溶液呈碱性,据此分析解答。
(1)酸性是因为物质能电离出氢离子,可以使紫色石蕊试液变红色。
(2)酸碱性强弱可用pH表示,通常洗衣粉、香皂呈碱性,即pH>7。自然状态下头皮表面呈弱酸性,有利于头发的生长;所以用洗发水洗发后,最好再使用护发素,使头皮保持弱酸性;由此推测护发素的pH<7。
(1)铁(填活泼金属即可)
(2)与碱反应即可
【解析】(1)根据酸的通性分析解答;
(2)根据酸的通性判断Y的物质类型,然后写出符合要求的方程式。
(1)酸和活泼金属反应,生成盐和氢气。根据金属活动性顺序表可知,只要是排在氢前面的金属都可以,则X可以是铁。
(2)根据酸的通性可知,Y应该为碱,如氢氧化钠和稀硫酸反应,生成硫酸钠和水,方程式为:NaOH+H2SO4=Na2SO4+H2O。
(1)脱水;化学
(2)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;Fe+H2SO4=FeSO4+H2↑
【解析】(1)根据浓硫酸的脱水性分析;
(2)根据氧化铁和铁都能与硫酸反应分析。
(1) 用浓硫酸写的字变黑,是因为浓硫酸有脱水性,属于化学性质;
(2) 将生锈的铁钉投入到一定量的稀硫酸中,溶液会变成黄色 ,先氧化铁与硫酸反应,生成硫酸铁和水,然后铁与硫酸反应生成硫酸亚铁和氢气,反应方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;Fe+H2SO4=FeSO4+H2↑ ;
故答案为:(1)脱水;化学;(2)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;Fe+H2SO4=FeSO4+H2↑。
、实验探究题
(1)氢氧化钠固体溶于水放热
(2)导管2口有气泡
(3)NaOH 和Na2SO4
【解析】(1)温度计的示数变大,说明有热量放出,原因可能有两个:①氢氧化钠固体溶于水时放热;②氢氧化钠与稀硫酸反应放出热量;
(2)如果氢氧化钠溶液和稀硫酸反应放出热量,那么瓶内空气受热后体积膨胀,压强增大,于是右边烧杯内导气管处会有气泡冒出;
(3)根据温度变化确定20℃时反应是否完成,从而根据反应产物确定溶质种类。
(1)我认为甲同学的结论错误,理由是:氢氧化钠固体溶于水放热;
(2)乙同学用乙图实验,可以根据导管2口有气泡现象证明该反应放出热量.
(3)根据图线可知,20℃时,溶液的温度仍然在上升,那么此时反应正在进行,此时溶液中肯定有反应产物硫酸钠和剩余的氢氧化钠,即溶质为NaOH和Na2SO4。
、解答题
(1)解:生成二氧化碳质量为:10g+100g-107.8g=2.2g
答:生成了2.2g二氧化碳.
(2)解:设稀盐酸的质量分数为x,
Na2CO3+ 2HCl=2NaCl+H2O+ CO2↑
73 44
100g×x 2.2g
X=3.65%
答:稀盐酸溶液中溶质质量分数是3.65%.
【解析】(1)根据质量守恒定律可知,反应前后物质总质量的差就是生成二氧化碳的质量;
(2)写出碳酸钠和稀盐酸反应的方程式,根据二氧化碳的质量,利用质量之间的比例关系计算出参加反应的稀盐酸的溶质质量分数。
第 1 页(共 1 页)
、选择题
有一瓶标签无法辨认的试剂,是稀盐酸或稀硫酸中的一种。仅用下列试剂就能进行鉴别的是( )
A.pH试纸 B.紫色石蕊试液
C.硝酸银溶液 D.硝酸钡溶液
要证明某工厂排放的污水呈酸性,用试管取样进行实验,下列方法不可行的是( )
A.滴入紫色石蕊溶液,紫色石蕊溶液变红
B.滴入无色酚酞溶液,溶液仍无色
C.加入锌片,有气泡产生
D.加入碳酸钙,有气泡产生
不用指示剂,将含有盐酸的氯化钙溶液由酸性变为中性,应选用的试剂是( )
A.澄清石灰水 B.硝酸银溶液 C.生石灰粉末 D.石灰石
小红做酸的性质实验时,不慎将盐酸溶液撒到大理石地板,立即发出“嘶嘶”响声,并冒气泡.该气泡是( )
A.CO2 B.SO2 C.H2 D.O2
胃酸中含有HCl,当胃酸过多会引起的胃病,需用抗酸剂治疗来消耗胃液中的H+。下列物质不能用抗酸剂的是( )
A.MgO B.CaCO3 C.AgNO3 D.Al(OH)3
打开浓盐酸试剂瓶,发现瓶口有“白雾”出现。已盐酸中含有水分子(H2O)、氢离子(H+)和氯离子(Cl-)。下列实验能证明“白雾”中含有氢离子的是( )
A.①③ B.②④ C.①②④ D.①③④
如图所示,将一定量的液体X滴入烧瓶中,若使小气球鼓起(液体X的体积忽略不计),则液体X和固体Y不可能是( )
A.水,氢氧化钠 B.水,硝酸铵
C.过氧化氢溶液,二氧化锰 D.稀盐酸,碳酸钠
某溶液中含有Ba2+、Ag+、Cu2+三种离子,现用①NaOH溶液、②K2SO4溶液、③盐酸将这三种离子逐一沉淀并加以分离,则加入试剂顺序正确的是( )
A.①②③ B.③②① C.②③① D.②①③
小科按右图示操作进行酸的性质实验,下列有关分析正确的是( )
A.若X是稀硫酸,则a可能是紫色石蕊试液
B.若X是稀硫酸,则d一定是CuO固体
C.若X是稀盐酸,则c一定是单质
D.若b是Fe2O3,则黄色溶液一定是氯化铁
向盛有一定量稀盐酸的烧杯中逐滴加入Na2CO3溶液,充分反应。下列图象能正确反映其对应关系的是( )
A. B.C. D.
、填空题
物质的酸碱性与我们的生活密切相关。
(1)酸性是因为物质能电离出 离子,可以使紫色石蕊试液变 色。
(2)酸碱性强弱可用pH表示,通常洗衣粉、香皂呈碱性,即pH 7.自然状态下头皮表面呈弱酸性,有利于头发的生长;所以用洗发水洗发后,最好再使用护发素,使头皮保持弱酸性;由此推测护发素的pH 7.(选填“>”、“<”、“=”)
对知识的及时整理与归纳是学习科学的重要方法。某同学在学习了硫酸 的化学性质后,初步归纳出稀硫酸与其他物质相互反应的关系,如图所示(“一”表示相连的两种物质能发生反应,五个圈中的物质属于不同的类别)。
(1)已知X是金属单质,则X可以是 (填一种即可)。
(2)请写出稀硫酸与Y反应的一个化学方程式: 。
小金在研究硫酸的性质时,做了以下实验:
(1)小金用玻璃棒蘸取浓硫酸和稀硫酸在白纸上写字,放置一会儿发现用浓硫酸写的字变黑,这体现了浓硫酸的 性,属于 性质(选填“物理”或“化学”)。
(2)将生锈的铁钉投入到一定量的稀硫酸中,溶液会变成黄色,请写出该反应的化学方程式: ;同时,铁钉表面产生大量的气泡,请写出相应的化学方程式: ;
、实验探究题
氢氧化钠与稀硫酸反应是否放出热量?三位同学为探究此问题按下图进行了实验:
(1)甲同学按图实验:在烧杯中先加入一定量的稀硫酸溶液,然后再加入适量的氢氧化钠固体,观察到温度计示数变大,于是得到“反应放出热量”的结论。你认为是否正确并说明理由 ;
(2)乙同学用乙图实验,可以根据 现象证明该反应放出热量.
(3)丙同学是将稀硫酸不断的滴入氢氧化钠溶液中,并用数字化仪器测量的数据。由图可知,当反应进行到20s时溶液中的溶质是 。
、解答题
为了测定实验中所用稀盐酸的溶质质量分数,某同学取10克纯碱加入100克稀盐酸,恰好完全反应后,剩余物质的总质量是107.8克.
求:
(1)生成二氧化碳的质量;
(2)稀盐酸溶液中溶质质量分数;
1.3常见的酸 同步练习答案解析
、选择题
D
【解析】物质的鉴别需要根据两种物质的不同点去鉴别酸都能使石蕊变红,酚酞不变色,pH<7。稀盐酸和稀硫酸的区别在于两者的酸根离子,氯离子和硫酸根离子。
A.盐酸和稀硫酸都显酸性,都能使pH试纸变红,不能鉴别,故A错误;
B.盐酸和稀硫酸都显酸性,都能使紫色石蕊试液变红,不能鉴别,故B错误;
C.盐酸和稀硫酸都能和硝酸银溶液反应生成白色沉淀,不能鉴别,故C错误;
D.盐酸和硝酸钡溶液不反应,稀硫酸和硝酸钡溶液反应生成白色沉淀,能鉴别,故D正确。
故选:D 。
B
【解析】根据酸的性质分析判断。
A.滴入紫色石蕊溶液,紫色石蕊溶液变红,可行,故A不合题意;
B.无色酚酞溶液遇到酸性或中性溶液都不变色,不可行,故B符合题意;
C.加入锌片,遇到酸生成氢气,可行,故C不合题意;
D.加入碳酸钙,遇到酸生成二氧化碳气体,可行,故D不合题意。
故选B。
D
【解析】根据酸的化学性质分析,根据各物质与酸反应的现象分析。
A.加澄清石灰水时,与盐酸反应没有明显现象,无法确定是否完全反应,不符合题意;
B.硝酸银溶液反应的是氯离子,而不是反应氢离子,不符合题意;
C.生石灰与盐酸反应生成氯化钙和水,但过量时会与水反应生成氢氧化钙,不符合题意;
D.石灰石为不溶性物质,只能与盐酸发生反应,所以加入过量石灰石可将氯化钙中盐酸全部除去,符合题意;
故答案为:D。
A
【解析】大理石的主要成分是碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳气体,据此分析解答。
小红做酸的性质实验时,不慎将盐酸溶液撒到大理石地板,立即发出“嘶嘶”响声,并冒气泡.该气泡是二氧化碳,即CO2,故A正确,而B、C、D错误。
故选A.
C
【解析】根据所给各物质与盐酸反应时消耗的离子种类分析。
A.氧化镁能与盐酸反应生成氯化镁和水,消耗了氢离子,可作抗酸剂,不符合题意;
B、碳酸钙可与盐酸反应,产生二氧化碳气体,消耗了氢离子,可作抗酸剂,不符合题意;
C、硝酸银能与盐酸反应生成氯化银和硝酸,没有消耗氢离子,不可作抗酸剂,符合题意;
D、 Al(OH)3与盐酸反应生成氯化铝和水,消耗了氢离子,可作抗酸剂,不符合题意;
故选C。
D
【解析】“白雾”中含有氢离子,那么它呈酸性,根据酸的通性分析判断。
①涂有紫色石蕊试液的表面皿变成红色,说明呈酸性,含有氢离子;
②涂有硝酸银的表面皿出现白色沉淀,说明有氯离子,不能说明有氢离子;
③放在浓盐酸上面的pH试纸,显示呈酸性,说明有氢离子;
④涂有氢氧化钠和酚酞的表面皿呈红色,而一会红色褪去,说明白雾呈酸性,含有氢离子。
因此能够说明“白雾”含有氢离子的是①③④。
故选D。
B
【解析】根据若使小气球鼓起 ,需使装置内压强增大,或者温度升高,或者产生气体分析。
若使小气球鼓起 ,需使装置内压强增大,或者温度升高,或者产生气体;
A.氢氧化钠溶解放热,不符合题意;
B、硝酸铵溶解于水吸热,装置内压强减小,不会使气球变大,符合题意;
C. 过氧化氢溶液在二氧化锰催化作用下会分解产生氧气 ,不符合题意;
D、稀盐酸和碳酸钠反应会产生二氧化碳气体,不符合题意;
故选B。
B
【解析】溶液含有Ba2+、Cu2+、Ag+,应先加入HCl,生成AgCl沉淀,过滤后在加入K2SO4,可得到BaSO4沉淀,最后加入NaOH,可得到Cu(OH)2沉淀,以此解答该题.
解:Ag+、Cu2+均与NaOH反应生成沉淀,Ba2+、Ag+均与K2SO4溶液反应生成沉淀,则这三种离子逐一沉淀并加以分离,应先加入HCl,生成AgCl沉淀,过滤后在加入K2SO4,可得到BaSO4沉淀,最后加入NaOH,可得到Cu(OH)2沉淀,即顺序为③②①,
故选B.
A
【解析】根据酸的性质分析判断。
A.紫色石蕊试液遇到酸性溶液变成红色,故A正确;
B.稀硫酸与氢氧化铜反应,生成蓝色的硫酸铜溶液和水,故B错误;
C.氧化亚铁与稀盐酸反应,生成浅绿色氯化亚铁溶液,故C错误;
D.黄色溶液可能是氯化铁,也可能是硫酸铁,故D错误。
故选A.
D
【解析】根据碳酸钠和稀盐酸反应的过程、现象和产物分析判断。
当碳酸钠和稀盐酸反应时,生成二氧化碳的质量不断增大;当稀盐酸完全反应后,不再有气体生成,即气体质量不变,故A错误;
当有气体生成时,溶液质量的增加量等于加入的碳酸钠的溶液质量与气体质量的差;当没有气体生成时,溶液质量的增加量等于加入的碳酸钠的溶液质量,二者增加的速度不同,故B错误;
当稀盐酸和碳酸钠反应时,氯化钠的质量不断增大;当稀盐酸完全反应后,不再有氯化钠生成,即氯化钠的质量不变,即氯化钠的质量分数先增大后不变,故C错误;
随着稀盐酸和碳酸钠的反应进行,酸的浓度不断减小,则pH逐渐增大。当二者完全反应时,pH=7;当碳酸钠过量时,溶液的pH>7,故D正确。
故选D。
、填空题
(1)氢;红
(2)>;<
【解析】(1)根据酸的特点和酸碱指示剂的用途分析解答;
(2)pH<7,溶液呈酸性;pH=7,溶液呈中性;pH>7,溶液呈碱性,据此分析解答。
(1)酸性是因为物质能电离出氢离子,可以使紫色石蕊试液变红色。
(2)酸碱性强弱可用pH表示,通常洗衣粉、香皂呈碱性,即pH>7。自然状态下头皮表面呈弱酸性,有利于头发的生长;所以用洗发水洗发后,最好再使用护发素,使头皮保持弱酸性;由此推测护发素的pH<7。
(1)铁(填活泼金属即可)
(2)与碱反应即可
【解析】(1)根据酸的通性分析解答;
(2)根据酸的通性判断Y的物质类型,然后写出符合要求的方程式。
(1)酸和活泼金属反应,生成盐和氢气。根据金属活动性顺序表可知,只要是排在氢前面的金属都可以,则X可以是铁。
(2)根据酸的通性可知,Y应该为碱,如氢氧化钠和稀硫酸反应,生成硫酸钠和水,方程式为:NaOH+H2SO4=Na2SO4+H2O。
(1)脱水;化学
(2)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;Fe+H2SO4=FeSO4+H2↑
【解析】(1)根据浓硫酸的脱水性分析;
(2)根据氧化铁和铁都能与硫酸反应分析。
(1) 用浓硫酸写的字变黑,是因为浓硫酸有脱水性,属于化学性质;
(2) 将生锈的铁钉投入到一定量的稀硫酸中,溶液会变成黄色 ,先氧化铁与硫酸反应,生成硫酸铁和水,然后铁与硫酸反应生成硫酸亚铁和氢气,反应方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;Fe+H2SO4=FeSO4+H2↑ ;
故答案为:(1)脱水;化学;(2)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;Fe+H2SO4=FeSO4+H2↑。
、实验探究题
(1)氢氧化钠固体溶于水放热
(2)导管2口有气泡
(3)NaOH 和Na2SO4
【解析】(1)温度计的示数变大,说明有热量放出,原因可能有两个:①氢氧化钠固体溶于水时放热;②氢氧化钠与稀硫酸反应放出热量;
(2)如果氢氧化钠溶液和稀硫酸反应放出热量,那么瓶内空气受热后体积膨胀,压强增大,于是右边烧杯内导气管处会有气泡冒出;
(3)根据温度变化确定20℃时反应是否完成,从而根据反应产物确定溶质种类。
(1)我认为甲同学的结论错误,理由是:氢氧化钠固体溶于水放热;
(2)乙同学用乙图实验,可以根据导管2口有气泡现象证明该反应放出热量.
(3)根据图线可知,20℃时,溶液的温度仍然在上升,那么此时反应正在进行,此时溶液中肯定有反应产物硫酸钠和剩余的氢氧化钠,即溶质为NaOH和Na2SO4。
、解答题
(1)解:生成二氧化碳质量为:10g+100g-107.8g=2.2g
答:生成了2.2g二氧化碳.
(2)解:设稀盐酸的质量分数为x,
Na2CO3+ 2HCl=2NaCl+H2O+ CO2↑
73 44
100g×x 2.2g
X=3.65%
答:稀盐酸溶液中溶质质量分数是3.65%.
【解析】(1)根据质量守恒定律可知,反应前后物质总质量的差就是生成二氧化碳的质量;
(2)写出碳酸钠和稀盐酸反应的方程式,根据二氧化碳的质量,利用质量之间的比例关系计算出参加反应的稀盐酸的溶质质量分数。
第 1 页(共 1 页)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
