1.1 课时2 化学反应的内能变化与焓变 课件 (共22张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.1 课时2 化学反应的内能变化与焓变 课件 (共22张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 909.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 12:16:54 | ||
图片预览






文档简介
(共22张PPT)
化学反应的内能变化与焓变
1.知道内能、焓变的概念。
2.掌握内能、焓变与反应热的关系。
3.掌握热化学方程式的意义及书写方法。
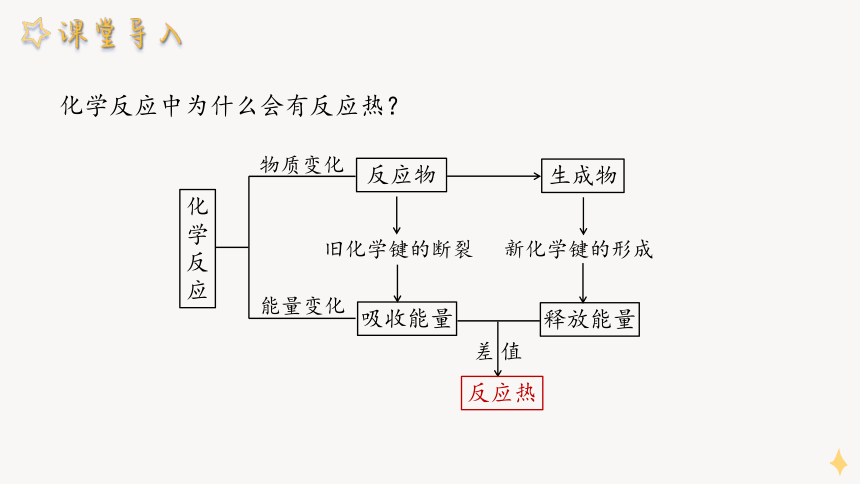
物质变化
能量变化
化学反应
反应物
生成物
旧化学键的断裂
新化学键的形成
吸收能量
释放能量
差 值
反应热
化学反应中为什么会有反应热?
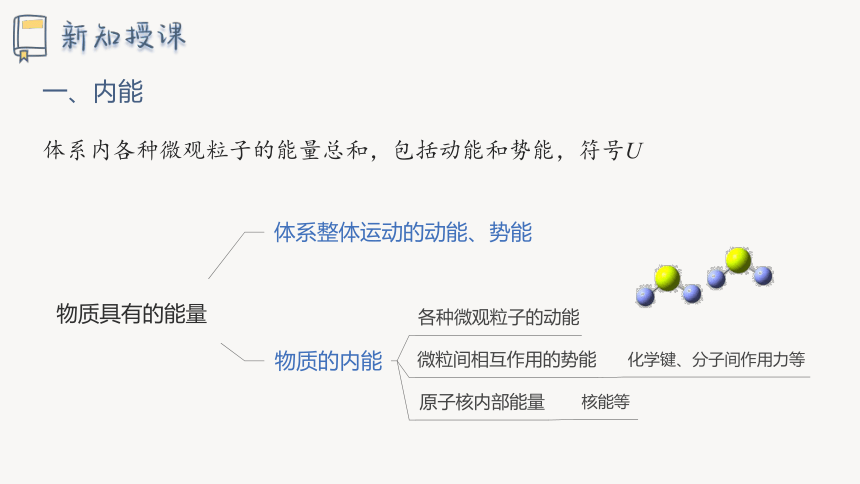
一、内能
体系内各种微观粒子的能量总和,包括动能和势能,符号U
物质具有的能量
体系整体运动的动能、势能
物质的内能
各种微观粒子的动能
微粒间相互作用的势能
原子核内部能量
核能等
化学键、分子间作用力等
物质内能与哪些因素有关?内能变化与能量变化什么关系?
影响因素:
物质的种类、数量、聚集状态、温度、压强
内能变化:
△U=U(反应产物)-U(反应物)
U(反应产物)>U(反应物) 反应吸收能量
U(反应产物)<U(反应物) 反应释放能量
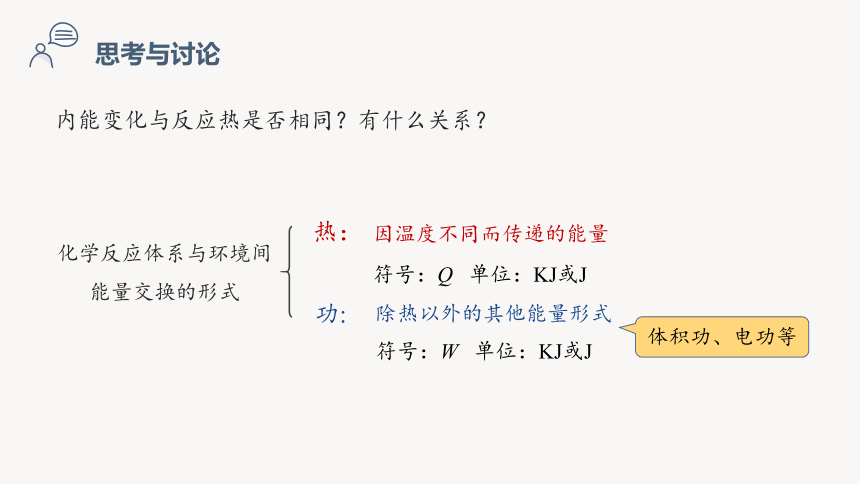
内能变化与反应热是否相同?有什么关系?
化学反应体系与环境间
能量交换的形式
热:
功:
因温度不同而传递的能量
符号:Q 单位:KJ或J
除热以外的其他能量形式
符号:W 单位:KJ或J
体积功、电功等
一、内能
根据能量守恒定律,化学反应中内能的变化等于反应热和功的加和。
△U = Q + W
若反应中体系没有做功,则ΔU=Q
[例]在恒温恒容的密闭体系中,H2(g)与I2(g)反应生成HI(g),该反应体系的内能变化如图所示(没做电功等):
(1)该反应体系的ΔU____(填“>”“<”或“=”,
下同)0。
(2)W____0。
(3)该反应体系的反应热Q=________。
<
=
-13 kJ
(4)下列关于该反应的叙述正确的是________(填序号)。
①反应物的总能量比反应产物的总能量高13 kJ
②断裂反应物中化学键所需的能量低于形成反应
产物中化学键释放的能量
③该反应不需要提供能量就能发生反应
④反应开始前体系的内能等于反应物化学键中储存的总能量
①②
在科学研究和生产实践中,化学反应通常是在等压条件下进行。
在反应前后压强不变的条件下发生的化学反应称为等压反应。
在等压反应中,可能伴随着反应体系体积的改变而有体积功存在,因此反应热不一定等于反应体系内能的变化。如何来描述等压反应的反应热?
二、焓与焓变
焓变代表等压条件下化学反应的反应热(符号为ΔH)
焓是物质所具有的能量,与内能有关的物理量(符号为H)
焓的大小也取决于物质的种类、数量及聚集状态、体系的温度、压强的影响。
H = U + pV
Q p=ΔH
单位:J或kJ
=H(反应产物) - H(反应物)
单位:J·mol-1或kJ·mol-1
反应物
焓(H)
Δ H < 0
放热反应
反应产物
反应物
焓(H)
Δ H > 0
吸热反应
反应产物
当反应产物的焓大于反应物的焓时,ΔH >0,反应为吸热反应。
当反应产物的焓小于反应物的焓时,ΔH <0,反应为放热反应。
正误判断
(1)相同质量的同种物质,在不同状态下其焓是相同的( )
(2)化学反应的反应热就是该反应的焓变( )
(3)化学反应的焓变就是反应物总焓和反应产物总焓的差值( )
(4)化学反应的焓变和反应物及反应产物的内能有关,和反应条件无关( )
(5)在一个化学反应中,当反应物总焓大于反应产物的总焓时,反应放热,ΔH为负值( )
×
×
×
√
√
化学反应N2(g)+3H2(g) 2NH3(g)的能量变化右上图所示:已知断裂1 mol N≡N键、1 mol N—H键分别需吸收946 kJ、391 kJ的能量。该反应为______反应(填“吸热”或“放热”,拆开1 mol H2中化学键所需能量为______ kJ,该反应的反应热ΔH=_____________。
放热
436
-92 kJ·mol-1
Δ H=反应物键能和-生成物键能和
ΔH = 化学键断裂吸收的能量 - 化学键形成释放的能量
如在25 ℃和101 kPa下,1 molH2与1 mol Cl2反应生成2 mol HCl时放出184.6 kJ的热量,则该反应的反应热为:
ΔH= -184.6 kJ/mol
根据上述例子,写出下述反应的焓变。
在25 ℃和101 kPa下,1 mol C(如无特别说明,C均指石墨)与1 mol H2O(g)反应,生成1 mol CO和1 mol H2,需要吸收131.5 kJ的热量,则该反应的反应热为:
ΔH= +131.5 kJ/mol
注:“+”表示“吸热”;“-”表示“放热”。
“+”或“-”不能省略,单位必须标出。
三、热化学方程式
同时把化学反应中物质的变化和反应的焓变表示出来。
H2(g)+Cl2(g)====2HCl(g) △H(298K)=-184.6 kJ/mol
点燃
101kPa
物质变化
能量变化
比较分析:与化学方程式相比,热化学方程式有哪些不同?
要标明物质的状态,方程式后注明能量变化。
在298K时,1mol H2(g)和1mol Cl2(g)反应生成了2mol HCl(g)时,放出热量184.6kJ。
热化学方程式△H的单位中mol-1的含义
反应焓变单位中的mol-1是指每摩尔反应,即反应完成时参加反应的各物质的物质的量的数值与热化学方程式中各物质化学式前的系数相同。而不是指每摩尔某物质。例如:H2(g)+1/2O2(g)====H2O(l) ΔH (298 K) =-285.8 kJ·mol-1
表示298K时,1molH2(g)与0.5molO2(g)反应生成1molH2O(l),放出285.8kJ热量。
若将化学方程式写成: 2H2(g)+O2(g)====2H2O(l) ΔH(298 K)=-571.6 kJ·mol-1
则表示298K时,2molH2(g)与1molO2(g)反应生成2molH2O(l),放出571.6kJ热量。
书写热化学方程式应注意:
对于 25℃(298K) 101kPa时进行的反
应可不注明
② 注明反应时的温度和压强,因为焓变与测定条件(温度、压强等)有关。
H2(g) + Cl2(g) == 2HCl(g) ΔH=-184.6 kJ/mol
H2(g) + I2 (g) ===== 2HI(g) ΔH=-14.9 kJ/mol
200℃
101kPa
①必须在化学方程式的右边标明反应热ΔH的符号、数值和单位
- 184.6 kJ/mol
③ 注明反应体系中反应物和生成物的聚集状态,不用写“点燃”、“加热”等条件。
H2(g)+ O2(g)==H2O(g) ΔH=-241.8kJ/mol
1
2
H2(g)+ O2(g)==H2O(l) ΔH=-285.8kJ/mol
1
2
H2O(l)==H2O(g) ΔH=+44kJ/mol
等质量水的焓:H2O(s)< H2O(l)< H2O(g)
气态(g)、固态(s)、液态(l)、溶液(aq)
由于已经注明了物质的聚集状态,所以在热化学方程式中不再用“↑”“↓”来标记气体生成物和难溶生成物
交流 · 研讨
交流 · 研讨
已知在 298K 时,由氢气和氮气反应生成 1mol NH3(g)放热 46.1kJ,请将下列化学方程式改写成热化学方程式。
3H2(g)+N2(g)===2NH3(g)
NH3(g)=== H2(g)+ N2(g)
H2(g)+ N2(g)===NH3(g)
H2(g)+ N2(g)===NH3(g)
ΔH= 46.1 kJ/mol
NH3(g)=== H2(g)+ N2(g)
ΔH= +46.1 kJ/mol
3H2(g)+N2(g)===2NH3(g)
ΔH= 92.2 kJ/mol
热化学方程式中各物质的化学计量数只表示参加反应的各物质的物质的量,因此可以写成分数或整数,其 H与系数对应成比例,系数加倍, H值也加倍。可逆反应的正反应与逆反应的ΔH数值相同,符号相反。
练一练:写出下列反应的热化学方程式:
(1)1mol气态H2与1mol气态Cl2反应生成2mol气态HCl,放出184.6KJ的热量。
(2)1molN2(g)与适量O2(g)反应生成NO (g),需吸收68kJ的热量。
H2(g)+ Cl2(g) = 2HCl(g) H = - 184.6 kJ·mol-1
N2(g)+O2(g) = 2NO (g) H = + 68 kJ·mol-1
下列热化学方程式书写正确的是(已知焓变的绝对值均正确)( )
B
判断热化学方程式的正误的思路如下:
(1)看各物质的聚集状态是否正确;
(2)看ΔH的“+”“-”符号是否正确;
(3)看反应热的单位是否为kJ·mol-1;
(4)看反应热的数值与化学计量数是否对应。
化学反应的内能变化与焓变
1.知道内能、焓变的概念。
2.掌握内能、焓变与反应热的关系。
3.掌握热化学方程式的意义及书写方法。
物质变化
能量变化
化学反应
反应物
生成物
旧化学键的断裂
新化学键的形成
吸收能量
释放能量
差 值
反应热
化学反应中为什么会有反应热?
一、内能
体系内各种微观粒子的能量总和,包括动能和势能,符号U
物质具有的能量
体系整体运动的动能、势能
物质的内能
各种微观粒子的动能
微粒间相互作用的势能
原子核内部能量
核能等
化学键、分子间作用力等
物质内能与哪些因素有关?内能变化与能量变化什么关系?
影响因素:
物质的种类、数量、聚集状态、温度、压强
内能变化:
△U=U(反应产物)-U(反应物)
U(反应产物)>U(反应物) 反应吸收能量
U(反应产物)<U(反应物) 反应释放能量
内能变化与反应热是否相同?有什么关系?
化学反应体系与环境间
能量交换的形式
热:
功:
因温度不同而传递的能量
符号:Q 单位:KJ或J
除热以外的其他能量形式
符号:W 单位:KJ或J
体积功、电功等
一、内能
根据能量守恒定律,化学反应中内能的变化等于反应热和功的加和。
△U = Q + W
若反应中体系没有做功,则ΔU=Q
[例]在恒温恒容的密闭体系中,H2(g)与I2(g)反应生成HI(g),该反应体系的内能变化如图所示(没做电功等):
(1)该反应体系的ΔU____(填“>”“<”或“=”,
下同)0。
(2)W____0。
(3)该反应体系的反应热Q=________。
<
=
-13 kJ
(4)下列关于该反应的叙述正确的是________(填序号)。
①反应物的总能量比反应产物的总能量高13 kJ
②断裂反应物中化学键所需的能量低于形成反应
产物中化学键释放的能量
③该反应不需要提供能量就能发生反应
④反应开始前体系的内能等于反应物化学键中储存的总能量
①②
在科学研究和生产实践中,化学反应通常是在等压条件下进行。
在反应前后压强不变的条件下发生的化学反应称为等压反应。
在等压反应中,可能伴随着反应体系体积的改变而有体积功存在,因此反应热不一定等于反应体系内能的变化。如何来描述等压反应的反应热?
二、焓与焓变
焓变代表等压条件下化学反应的反应热(符号为ΔH)
焓是物质所具有的能量,与内能有关的物理量(符号为H)
焓的大小也取决于物质的种类、数量及聚集状态、体系的温度、压强的影响。
H = U + pV
Q p=ΔH
单位:J或kJ
=H(反应产物) - H(反应物)
单位:J·mol-1或kJ·mol-1
反应物
焓(H)
Δ H < 0
放热反应
反应产物
反应物
焓(H)
Δ H > 0
吸热反应
反应产物
当反应产物的焓大于反应物的焓时,ΔH >0,反应为吸热反应。
当反应产物的焓小于反应物的焓时,ΔH <0,反应为放热反应。
正误判断
(1)相同质量的同种物质,在不同状态下其焓是相同的( )
(2)化学反应的反应热就是该反应的焓变( )
(3)化学反应的焓变就是反应物总焓和反应产物总焓的差值( )
(4)化学反应的焓变和反应物及反应产物的内能有关,和反应条件无关( )
(5)在一个化学反应中,当反应物总焓大于反应产物的总焓时,反应放热,ΔH为负值( )
×
×
×
√
√
化学反应N2(g)+3H2(g) 2NH3(g)的能量变化右上图所示:已知断裂1 mol N≡N键、1 mol N—H键分别需吸收946 kJ、391 kJ的能量。该反应为______反应(填“吸热”或“放热”,拆开1 mol H2中化学键所需能量为______ kJ,该反应的反应热ΔH=_____________。
放热
436
-92 kJ·mol-1
Δ H=反应物键能和-生成物键能和
ΔH = 化学键断裂吸收的能量 - 化学键形成释放的能量
如在25 ℃和101 kPa下,1 molH2与1 mol Cl2反应生成2 mol HCl时放出184.6 kJ的热量,则该反应的反应热为:
ΔH= -184.6 kJ/mol
根据上述例子,写出下述反应的焓变。
在25 ℃和101 kPa下,1 mol C(如无特别说明,C均指石墨)与1 mol H2O(g)反应,生成1 mol CO和1 mol H2,需要吸收131.5 kJ的热量,则该反应的反应热为:
ΔH= +131.5 kJ/mol
注:“+”表示“吸热”;“-”表示“放热”。
“+”或“-”不能省略,单位必须标出。
三、热化学方程式
同时把化学反应中物质的变化和反应的焓变表示出来。
H2(g)+Cl2(g)====2HCl(g) △H(298K)=-184.6 kJ/mol
点燃
101kPa
物质变化
能量变化
比较分析:与化学方程式相比,热化学方程式有哪些不同?
要标明物质的状态,方程式后注明能量变化。
在298K时,1mol H2(g)和1mol Cl2(g)反应生成了2mol HCl(g)时,放出热量184.6kJ。
热化学方程式△H的单位中mol-1的含义
反应焓变单位中的mol-1是指每摩尔反应,即反应完成时参加反应的各物质的物质的量的数值与热化学方程式中各物质化学式前的系数相同。而不是指每摩尔某物质。例如:H2(g)+1/2O2(g)====H2O(l) ΔH (298 K) =-285.8 kJ·mol-1
表示298K时,1molH2(g)与0.5molO2(g)反应生成1molH2O(l),放出285.8kJ热量。
若将化学方程式写成: 2H2(g)+O2(g)====2H2O(l) ΔH(298 K)=-571.6 kJ·mol-1
则表示298K时,2molH2(g)与1molO2(g)反应生成2molH2O(l),放出571.6kJ热量。
书写热化学方程式应注意:
对于 25℃(298K) 101kPa时进行的反
应可不注明
② 注明反应时的温度和压强,因为焓变与测定条件(温度、压强等)有关。
H2(g) + Cl2(g) == 2HCl(g) ΔH=-184.6 kJ/mol
H2(g) + I2 (g) ===== 2HI(g) ΔH=-14.9 kJ/mol
200℃
101kPa
①必须在化学方程式的右边标明反应热ΔH的符号、数值和单位
- 184.6 kJ/mol
③ 注明反应体系中反应物和生成物的聚集状态,不用写“点燃”、“加热”等条件。
H2(g)+ O2(g)==H2O(g) ΔH=-241.8kJ/mol
1
2
H2(g)+ O2(g)==H2O(l) ΔH=-285.8kJ/mol
1
2
H2O(l)==H2O(g) ΔH=+44kJ/mol
等质量水的焓:H2O(s)< H2O(l)< H2O(g)
气态(g)、固态(s)、液态(l)、溶液(aq)
由于已经注明了物质的聚集状态,所以在热化学方程式中不再用“↑”“↓”来标记气体生成物和难溶生成物
交流 · 研讨
交流 · 研讨
已知在 298K 时,由氢气和氮气反应生成 1mol NH3(g)放热 46.1kJ,请将下列化学方程式改写成热化学方程式。
3H2(g)+N2(g)===2NH3(g)
NH3(g)=== H2(g)+ N2(g)
H2(g)+ N2(g)===NH3(g)
H2(g)+ N2(g)===NH3(g)
ΔH= 46.1 kJ/mol
NH3(g)=== H2(g)+ N2(g)
ΔH= +46.1 kJ/mol
3H2(g)+N2(g)===2NH3(g)
ΔH= 92.2 kJ/mol
热化学方程式中各物质的化学计量数只表示参加反应的各物质的物质的量,因此可以写成分数或整数,其 H与系数对应成比例,系数加倍, H值也加倍。可逆反应的正反应与逆反应的ΔH数值相同,符号相反。
练一练:写出下列反应的热化学方程式:
(1)1mol气态H2与1mol气态Cl2反应生成2mol气态HCl,放出184.6KJ的热量。
(2)1molN2(g)与适量O2(g)反应生成NO (g),需吸收68kJ的热量。
H2(g)+ Cl2(g) = 2HCl(g) H = - 184.6 kJ·mol-1
N2(g)+O2(g) = 2NO (g) H = + 68 kJ·mol-1
下列热化学方程式书写正确的是(已知焓变的绝对值均正确)( )
B
判断热化学方程式的正误的思路如下:
(1)看各物质的聚集状态是否正确;
(2)看ΔH的“+”“-”符号是否正确;
(3)看反应热的单位是否为kJ·mol-1;
(4)看反应热的数值与化学计量数是否对应。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
