1.1.3 反应焓变的计算 课件(共21张ppt)2024-2025学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.1.3 反应焓变的计算 课件(共21张ppt)2024-2025学年高二化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 890.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 12:16:10 | ||
图片预览








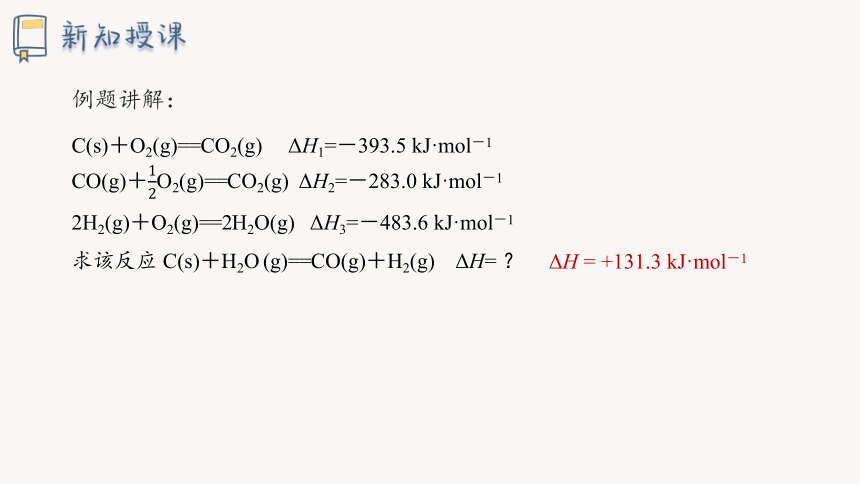
文档简介
(共21张PPT)
反应焓变的计算
1.能根据盖斯定律求算反应焓变,认识热力学状态函数的变化与变化途径无关;
2.能从综合能量变化、物质变化角度解决燃料选择、利用等实际问题;
3.了解摩尔燃烧焓的概念。
每一个化学反应在不同的温度下的 H不尽相同,如果反应焓变都要通过实验测定,工作量之大可想而知。由于反应条件的限制,有些反应焓变很难测定。
例:2C+O2=2CO(总会伴随产生CO2),那如何测得其 H呢。
一、盖斯定律
不管化学反应是一步完成或分几步完成,其反应热是相同的。
即:
化学反应的反应热只与始态和终态有关,与反应的途径无关。
即: H= H1+ H2 = H3 + H4+ H5
能量守恒角度
反应途径:A→D ΔH=ΔH1+ΔH2+ΔH3=-(ΔH4+ΔH5+ΔH6)
思考:从反应途径角度、能量守恒角度可以写出哪些等式?
能量守恒:ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0
应用盖斯定律,可以间接计算以下情况(不能直接测定)的反应热:
(1)有些反应进行得很慢/很快。
(2)有些反应不容易直接发生。
(3)有些反应往往有副反应发生。
意义
若目标方程式可由已知的几个化学方程式相加减而得到,则该化学反应的焓变(ΔH)即为已知的几个化学反应焓变(ΔH)的代数和
热化学方程式颠倒时,ΔH的符号改变,数值不变。
注意:
热化学方程式同乘以某一个数时,ΔH也必须乘上该数。
利用盖斯定律计算焓变
C(s)+O2(g)==CO2(g) ΔH1=-393.5 kJ·mol-1
CO(g)+O2(g)==CO2(g) ΔH2=-283.0 kJ·mol-1
2H2(g)+O2(g)==2H2O(g) ΔH3=-483.6 kJ·mol-1
求该反应 C(s)+H2O (g)==CO(g)+H2(g) ΔH= ?
例题讲解:
ΔH = +131.3 kJ·mol-1
找目标方程式中的且只在一个已知方程式中出现的“反应物或生成物”对原方程式进行四则运算(同侧符号不变,异侧符号相反)
利用盖斯定律书写热化学方程式的关键
1.判断正误
(1)对一个化学反应,在一定条件下,如果反应的途径不同,其焓变一定不同( )
(2)使用催化剂能够降低化学反应的反应热( )
(3)化学反应的焓变与方程式的书写方式无关( )
(4)同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同( )
(5)在 中,存在关系式:ΔH1=ΔH2+ΔH3。( )
2.按照盖斯定律,结合下述反应方程式回答问题,已知:
①NH3(g)+HCl(g)=NH4Cl(s) △H1=-176kJ/mol
②NH3(g)+H2O(l)=NH3(aq) △H2=-35.1kJ/mol
③HCl(g) +H2O(l)=HCl(aq) △H3=-72.3kJ/mol
④NH3(aq)+ HCl(aq)=NH4Cl(aq) △H4=-52.3kJ/mol
⑤NH4Cl(s)+2H2O(l)= NH4Cl(aq) △H5=?
则第⑤个方程式中的反应热△H是 。
根据盖斯定律和上述反应方程式得:⑤=④+③+②-①,
即△H5 = +16.3kJ/mol
+16.3kJ/mol
3.化学反应N2(g)+3H2(g)=2NH3(l)的能量变化如图所示,该反应的ΔH为( )
A.+2(a-b-c) kJ·mol-1 B.+2(b-a) kJ·mol-1
C.+(b+c-a) kJ·mol-1 D.+(a+b) kJ·mol-1
A
二、能源 摩尔燃烧焓
柴草
煤
液化石油气
天然气
根据什么标准来选择燃料
物质的燃烧热
燃料的储量
燃料的开采、运输
燃料储存的条件、价格
燃料对生态环境的影响
… …
1.能源
(2)种类:包括太阳能、风能、水能、生物质能、地热能、海洋能、核能、化石燃料等。
(1)概念:能为人类提供能量的物质或物质运动。
(3)能源危机解决的办法 :
开发新能源
节约现有能源,提高能源的利用率
2.摩尔燃烧焓
在一定反应温度和压强条件下,1 mol纯物质完全氧化为同温下的指定产物时的焓变。
C→CO2(g) H→H2O(l) S→SO2(g) N→N2(g)
例如:25 ℃、101 kPa时甲烷的摩尔燃烧焓为-890.3 kJ·mol-1
表示25 ℃、101 kPa时, 1 mol CH4完全燃烧生成CO2气体和液态H2O时放出890.3 kJ的热量
交流 · 研讨
交流 · 研讨
目前煤在我国依然是第一能源,煤的气化可以实现煤的综合利用,提高煤的利用价值。下表列举了几种常见物质的摩尔燃烧焓(298 K,101 kPa),且298 K,101 kPa时,1 mol H2O(l)变为H2O(g)需要吸收44.0 kJ的热量。
计算煤气化反应C(s)+H2O(g)===CO(g)+H2(g)的焓变,写出计算过程。
答案 根据摩尔燃烧焓的含义,可得热化学方程式:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1;
②CO(g)+ O2(g)===CO2(g) ΔH2=-283.0 kJ·mol-1;
③H2(g)+ O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1;
④H2O(l)===H2O(g) ΔH4=+44.0 kJ·mol-1。所以根据盖斯定律,将①-②-③-④,整理可得:C(s)+H2O(g)===CO(g)+H2(g),则ΔH=ΔH1-ΔH2-ΔH3-ΔH4=+131.3 kJ·mol-1
思考:从物质和能量的角度说明将煤炭转化为水煤气的价值:
__________________________________________________________________________________________________________________。
可以增大可燃物与氧气的接触面积提高燃烧效率;可以减少二氧化硫和一氧化碳等污染气体的排放;气化后的燃料便于运输
1、根据热化学方程式计算
2、根据反应物和生成物的焓:
3、根据反应物和生成物的键能:
4、根据盖斯定律:
5、根据物质的燃烧热数值:
6、根据比热容公式:
反应热( H)的计算
H与热化学方程式中各物质的物质的量成正比
ΔH=H生成物-H反应物
ΔH=反应物的总键能-生成物的总键能
热化学方程式叠加
Q(放)=n(可燃物)×|ΔH|
H=cm t
反应焓变的计算
盖斯定律
能源
摩尔燃烧焓
定义
意义
计算
反应焓变的计算
1.能根据盖斯定律求算反应焓变,认识热力学状态函数的变化与变化途径无关;
2.能从综合能量变化、物质变化角度解决燃料选择、利用等实际问题;
3.了解摩尔燃烧焓的概念。
每一个化学反应在不同的温度下的 H不尽相同,如果反应焓变都要通过实验测定,工作量之大可想而知。由于反应条件的限制,有些反应焓变很难测定。
例:2C+O2=2CO(总会伴随产生CO2),那如何测得其 H呢。
一、盖斯定律
不管化学反应是一步完成或分几步完成,其反应热是相同的。
即:
化学反应的反应热只与始态和终态有关,与反应的途径无关。
即: H= H1+ H2 = H3 + H4+ H5
能量守恒角度
反应途径:A→D ΔH=ΔH1+ΔH2+ΔH3=-(ΔH4+ΔH5+ΔH6)
思考:从反应途径角度、能量守恒角度可以写出哪些等式?
能量守恒:ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0
应用盖斯定律,可以间接计算以下情况(不能直接测定)的反应热:
(1)有些反应进行得很慢/很快。
(2)有些反应不容易直接发生。
(3)有些反应往往有副反应发生。
意义
若目标方程式可由已知的几个化学方程式相加减而得到,则该化学反应的焓变(ΔH)即为已知的几个化学反应焓变(ΔH)的代数和
热化学方程式颠倒时,ΔH的符号改变,数值不变。
注意:
热化学方程式同乘以某一个数时,ΔH也必须乘上该数。
利用盖斯定律计算焓变
C(s)+O2(g)==CO2(g) ΔH1=-393.5 kJ·mol-1
CO(g)+O2(g)==CO2(g) ΔH2=-283.0 kJ·mol-1
2H2(g)+O2(g)==2H2O(g) ΔH3=-483.6 kJ·mol-1
求该反应 C(s)+H2O (g)==CO(g)+H2(g) ΔH= ?
例题讲解:
ΔH = +131.3 kJ·mol-1
找目标方程式中的且只在一个已知方程式中出现的“反应物或生成物”对原方程式进行四则运算(同侧符号不变,异侧符号相反)
利用盖斯定律书写热化学方程式的关键
1.判断正误
(1)对一个化学反应,在一定条件下,如果反应的途径不同,其焓变一定不同( )
(2)使用催化剂能够降低化学反应的反应热( )
(3)化学反应的焓变与方程式的书写方式无关( )
(4)同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同( )
(5)在 中,存在关系式:ΔH1=ΔH2+ΔH3。( )
2.按照盖斯定律,结合下述反应方程式回答问题,已知:
①NH3(g)+HCl(g)=NH4Cl(s) △H1=-176kJ/mol
②NH3(g)+H2O(l)=NH3(aq) △H2=-35.1kJ/mol
③HCl(g) +H2O(l)=HCl(aq) △H3=-72.3kJ/mol
④NH3(aq)+ HCl(aq)=NH4Cl(aq) △H4=-52.3kJ/mol
⑤NH4Cl(s)+2H2O(l)= NH4Cl(aq) △H5=?
则第⑤个方程式中的反应热△H是 。
根据盖斯定律和上述反应方程式得:⑤=④+③+②-①,
即△H5 = +16.3kJ/mol
+16.3kJ/mol
3.化学反应N2(g)+3H2(g)=2NH3(l)的能量变化如图所示,该反应的ΔH为( )
A.+2(a-b-c) kJ·mol-1 B.+2(b-a) kJ·mol-1
C.+(b+c-a) kJ·mol-1 D.+(a+b) kJ·mol-1
A
二、能源 摩尔燃烧焓
柴草
煤
液化石油气
天然气
根据什么标准来选择燃料
物质的燃烧热
燃料的储量
燃料的开采、运输
燃料储存的条件、价格
燃料对生态环境的影响
… …
1.能源
(2)种类:包括太阳能、风能、水能、生物质能、地热能、海洋能、核能、化石燃料等。
(1)概念:能为人类提供能量的物质或物质运动。
(3)能源危机解决的办法 :
开发新能源
节约现有能源,提高能源的利用率
2.摩尔燃烧焓
在一定反应温度和压强条件下,1 mol纯物质完全氧化为同温下的指定产物时的焓变。
C→CO2(g) H→H2O(l) S→SO2(g) N→N2(g)
例如:25 ℃、101 kPa时甲烷的摩尔燃烧焓为-890.3 kJ·mol-1
表示25 ℃、101 kPa时, 1 mol CH4完全燃烧生成CO2气体和液态H2O时放出890.3 kJ的热量
交流 · 研讨
交流 · 研讨
目前煤在我国依然是第一能源,煤的气化可以实现煤的综合利用,提高煤的利用价值。下表列举了几种常见物质的摩尔燃烧焓(298 K,101 kPa),且298 K,101 kPa时,1 mol H2O(l)变为H2O(g)需要吸收44.0 kJ的热量。
计算煤气化反应C(s)+H2O(g)===CO(g)+H2(g)的焓变,写出计算过程。
答案 根据摩尔燃烧焓的含义,可得热化学方程式:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1;
②CO(g)+ O2(g)===CO2(g) ΔH2=-283.0 kJ·mol-1;
③H2(g)+ O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1;
④H2O(l)===H2O(g) ΔH4=+44.0 kJ·mol-1。所以根据盖斯定律,将①-②-③-④,整理可得:C(s)+H2O(g)===CO(g)+H2(g),则ΔH=ΔH1-ΔH2-ΔH3-ΔH4=+131.3 kJ·mol-1
思考:从物质和能量的角度说明将煤炭转化为水煤气的价值:
__________________________________________________________________________________________________________________。
可以增大可燃物与氧气的接触面积提高燃烧效率;可以减少二氧化硫和一氧化碳等污染气体的排放;气化后的燃料便于运输
1、根据热化学方程式计算
2、根据反应物和生成物的焓:
3、根据反应物和生成物的键能:
4、根据盖斯定律:
5、根据物质的燃烧热数值:
6、根据比热容公式:
反应热( H)的计算
H与热化学方程式中各物质的物质的量成正比
ΔH=H生成物-H反应物
ΔH=反应物的总键能-生成物的总键能
热化学方程式叠加
Q(放)=n(可燃物)×|ΔH|
H=cm t
反应焓变的计算
盖斯定律
能源
摩尔燃烧焓
定义
意义
计算
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
