1.1.2 化学反应的内能变化与焓变 课件(共24张ppt) 2024-2025学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.1.2 化学反应的内能变化与焓变 课件(共24张ppt) 2024-2025学年高二化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 15.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 12:17:38 | ||
图片预览






文档简介
(共24张PPT)
化学反应的内能变化与焓变
第1章 化学反应与能量转化
1.能从内能变化角度认识反应热、焓变。
2.理解热化学方程式的含义并能正确书写热化学方程式。
一、化学反应的内能
1.内能
概念:
微观粒子的能量包括分子的平动、转动、振动,电子运动,原子核运动等各种形式运动的动能,以及微观粒子之间相互作用的势能。
体系内物质所含各种微观粒子的能量总和
符号:
U
决定因素:
物质的种类、数量及聚集状态
体系的温度、压强
U(反应产物)>U(反应物),反应吸收能量;
U(反应产物)2.化学反应中内能的变化
ΔU=U(反应产物)-U(反应物)
化学反应体系与环境进行能量交换以热和功的形式呈现。
3.内能变化与反应热的关系
ΔU=Q+W
Q:反应热
W:功
如果反应过程中体系没有做功(如反应前后体系体积不变且没有做电功等其他功),则
ΔU=Q
U(反应产物)>U(反应物),ΔU>0,体系的内能增加,Q>0,吸热反应
化学反应前后体系内能会发生变化,是反应热产生的根源
U(反应产物)<U(反应物),ΔU<0,体系的内能减少,Q<0,放热反应
在实验室里或在生产中,化学反应大多是在压强不变的条件下进行的(等压反应),在等压反应中,可能伴随着反应体系体积的改变而有体积功存在,因此反应热不一定等于反应体系内能的变化。
与内能有关的物理量
单位:J或kJ
同样受物质的种类、数量、聚集状态以及体系的温度、压强等因素影响
意义:用它的变化描述等压反应的反应热
焓(H):
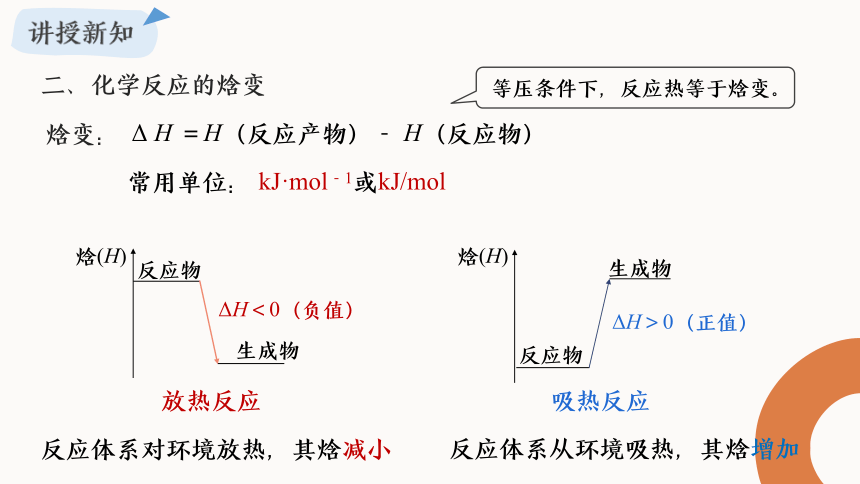
二、化学反应的焓变
等压条件下,反应热等于焓变。
Δ H =H(反应产物)- H(反应物)
常用单位: kJ·mol-1或kJ/mol
焓变:
放热反应
ΔH<0(负值)
焓(H)
反应物
生成物
吸热反应
ΔH>0(正值)
焓(H)
生成物
反应物
反应体系对环境放热,其焓减小
反应体系从环境吸热,其焓增加
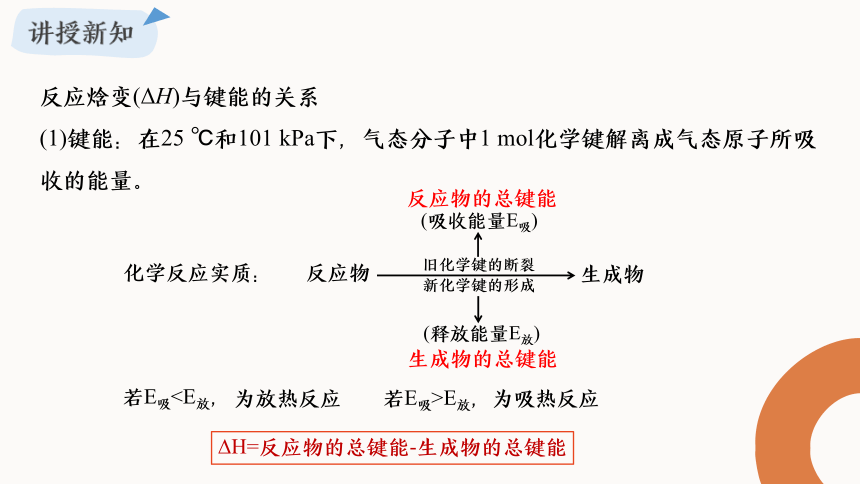
反应焓变(ΔH)与键能的关系
(1)键能:在25 ℃和101 kPa下,气态分子中1 mol化学键解离成气态原子所吸收的能量。
反应物
生成物
化学反应实质:
旧化学键的断裂
新化学键的形成
(吸收能量E吸)
(释放能量E放)
H=反应物的总键能-生成物的总键能
若E吸为放热反应
若E吸>E放,为吸热反应
反应物的总键能
生成物的总键能
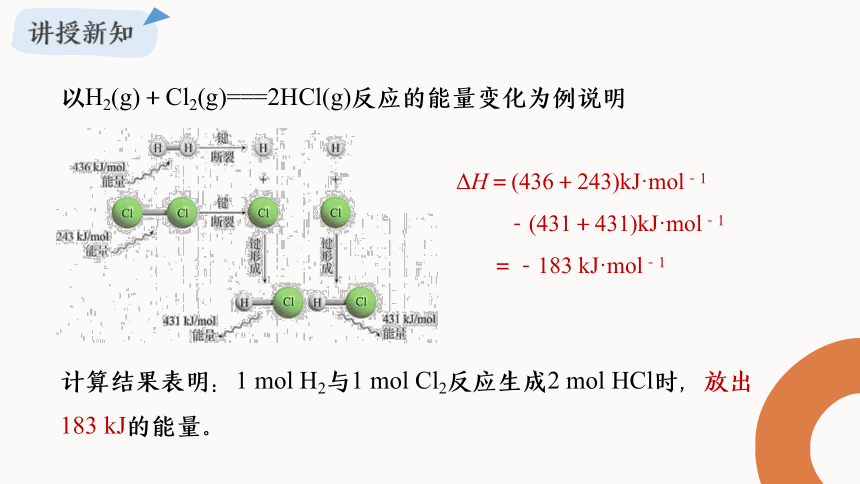
ΔH=(436+243)kJ·mol-1
-(431+431)kJ·mol-1
=-183 kJ·mol-1
以H2(g)+Cl2(g)===2HCl(g)反应的能量变化为例说明
计算结果表明:1 mol H2与1 mol Cl2反应生成2 mol HCl时,放出183 kJ的能量。
化学反应同时伴随着物质变化和能量变化,如何定量描述化学反应中的物质变化和热效应呢?
热化学方程式
三、热化学方程式
意义:1 mol液态H2和 mol液态O2反应生成 1mol气态H2O放出241.8 kJ的热量。
H2(l) + O2(l) ===H2O(g) H=﹣241.8 kJ·mol -1
热化学方程式既表示物质变化又能表示反应的焓变
思考:比较分析热化学方程式与化学方程式的区别
书写要求
1. 在反应物和反应产物的化学式后面用括号注明各物质的聚集状态
如果生成的是H2O(g) ,反应热一样吗
H2(g) + O2(g)===H2O(l) H1=﹣285.8 kJ·mol -1
H2(g) + O2(g) ===H2O(g) H2=
等质量水的焓:H2O(s)< H2O(l)< H2O(g)
﹣241.8 kJ·mol-1
1 g冰
1 g液态水
1 g水蒸气
蒸发
熔化
焓(H)增大
书写要求
1. 在反应物和反应产物的化学式后面用括号注明各物质的聚集状态
2. ΔH的单位是J·mol-1或kJ·mol-1。
ΔH的单位中“mol-1”,指的是“每摩尔反应”,对于相同物质的反应,当化学计量数不同时,其ΔH也不同。
书写要求
1. 在反应物和反应产物的化学式后面用括号注明各物质的聚集状态
2. ΔH的单位是J·mol-1或kJ·mol-1。
3. 根据焓的性质,若化学方程式中各物质化学式前的系数加倍,则ΔH数值的绝对值也加倍;若反应逆向进行,则ΔH改变符号,但数值的绝对值不变
4. 指明反应的温度和压强。若不特别说明,反应温度为298 K,压强为101 kPa。
(5)注意热化学方程式中各物质的化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数也可以是分数。
(6)热化学方程式一般不写点燃、加热、高温等反应条件。由于已经注明了物质的聚集状态,所以在热化学方程式中不再用“↑”“↓”来标记气体反应产物和难溶反应产物。
书写要求
热化学方程式与普通化学方程式的区别
普通化学方程式 热化学方程式
化学 计量数 ____________________________________________ ______________________________________________
状态 不要求注明 ___________________
ΔH正负号 及单位 无 必须注明
意义 ____________________________ ____________________________________________________________
遵循规律 __________ ____________________
原子守恒和能量守恒
是整数,既表示微粒个数又表示该物质的物质的量
可以是整数也可以是分数,只表示物质的物质的量
必须在分子式后注明
表明了化学反应中的物质变化
不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化
原子守恒
热化学方程式
二标聚集状态
三标条件(温度压强)
四判ΔH正负
五算数值
一写方程式
1.已知: ,反应过程中的能量变化如图所示,回答下列问题。
(1)a、b、c分别代表什么意义?
a:____________________;
b:____________________;
c:________。
(2)该反应是______(填“放热”或“吸热”)反应,ΔH___(填“>”或“<”)0。
旧键断裂吸收的能量
新键形成放出的能量
反应热
放热
<
2.SF6是一种优良的绝缘气体,分子结构中只存在S—F键。
已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂
1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。则反应S(s)+3F2(g)=SF6(g)的反应热为 ( )
A.-1 780 kJ·mol-1 B.-1 220 kJ·mol-1
C.-450 kJ·mol-1 D.430 kJ·mol-1
B
3.热化学方程式 C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3kJ/mol表示 ( )
A.C(s)和水反应吸收131.3 kJ能量
B.1molC(s)和1mol水反应生成1molCO和1molH2并吸收131.3 kJ热量
C.1molC(s)和1mol水蒸气反应生成1molCO气体1molH2吸收131.3 kJ热量
D.1个C(s)原子和1分子水蒸气反应吸热131.3 kJ
C
4.根据右图所示情况,判断下列说法中正确的是( )
A.其热化学方程式为
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 KJ/mol
B.该反应为吸热反应
C.该反应为放热反应
D.当H2O为液态时,其反应热大于41 KJ/mol
B
5.在常温常压下,1 g 氢气在足量氯气中完全燃烧生成
氯化氢气体,放出92.3 kJ 的热量。下列热化学方程式中正
确的是( )
A.H2(g)+Cl2(g)=2HCl(g) ΔH=-92.3 kJ/mol
B.H2(g)+Cl2(g)=2HCl(g) ΔH=+92.3 kJ/mol
C.H2(g)+Cl2(g)=2HCl(g) ΔH=+184.6 kJ/mol
D.2HCl(g)=H2(g)+Cl2(g) ΔH=+184.6 kJ/mol
D
判断热化学方程式的正误注意“五看”
一看方程式是否配平;
二看各物质的聚集状态是否正确;
三看ΔH的“+”“-”符号是否正确;
四看反应热的单位是否为“kJ·mol-1”;
五看反应热的数值与化学计量数是否对应。
H=反应物的总键能 —生成物的总键能
H=H生成物-H反应物
热化学方程式
化学反应的内能变化与焓变
第1章 化学反应与能量转化
1.能从内能变化角度认识反应热、焓变。
2.理解热化学方程式的含义并能正确书写热化学方程式。
一、化学反应的内能
1.内能
概念:
微观粒子的能量包括分子的平动、转动、振动,电子运动,原子核运动等各种形式运动的动能,以及微观粒子之间相互作用的势能。
体系内物质所含各种微观粒子的能量总和
符号:
U
决定因素:
物质的种类、数量及聚集状态
体系的温度、压强
U(反应产物)>U(反应物),反应吸收能量;
U(反应产物)
ΔU=U(反应产物)-U(反应物)
化学反应体系与环境进行能量交换以热和功的形式呈现。
3.内能变化与反应热的关系
ΔU=Q+W
Q:反应热
W:功
如果反应过程中体系没有做功(如反应前后体系体积不变且没有做电功等其他功),则
ΔU=Q
U(反应产物)>U(反应物),ΔU>0,体系的内能增加,Q>0,吸热反应
化学反应前后体系内能会发生变化,是反应热产生的根源
U(反应产物)<U(反应物),ΔU<0,体系的内能减少,Q<0,放热反应
在实验室里或在生产中,化学反应大多是在压强不变的条件下进行的(等压反应),在等压反应中,可能伴随着反应体系体积的改变而有体积功存在,因此反应热不一定等于反应体系内能的变化。
与内能有关的物理量
单位:J或kJ
同样受物质的种类、数量、聚集状态以及体系的温度、压强等因素影响
意义:用它的变化描述等压反应的反应热
焓(H):
二、化学反应的焓变
等压条件下,反应热等于焓变。
Δ H =H(反应产物)- H(反应物)
常用单位: kJ·mol-1或kJ/mol
焓变:
放热反应
ΔH<0(负值)
焓(H)
反应物
生成物
吸热反应
ΔH>0(正值)
焓(H)
生成物
反应物
反应体系对环境放热,其焓减小
反应体系从环境吸热,其焓增加
反应焓变(ΔH)与键能的关系
(1)键能:在25 ℃和101 kPa下,气态分子中1 mol化学键解离成气态原子所吸收的能量。
反应物
生成物
化学反应实质:
旧化学键的断裂
新化学键的形成
(吸收能量E吸)
(释放能量E放)
H=反应物的总键能-生成物的总键能
若E吸
若E吸>E放,为吸热反应
反应物的总键能
生成物的总键能
ΔH=(436+243)kJ·mol-1
-(431+431)kJ·mol-1
=-183 kJ·mol-1
以H2(g)+Cl2(g)===2HCl(g)反应的能量变化为例说明
计算结果表明:1 mol H2与1 mol Cl2反应生成2 mol HCl时,放出183 kJ的能量。
化学反应同时伴随着物质变化和能量变化,如何定量描述化学反应中的物质变化和热效应呢?
热化学方程式
三、热化学方程式
意义:1 mol液态H2和 mol液态O2反应生成 1mol气态H2O放出241.8 kJ的热量。
H2(l) + O2(l) ===H2O(g) H=﹣241.8 kJ·mol -1
热化学方程式既表示物质变化又能表示反应的焓变
思考:比较分析热化学方程式与化学方程式的区别
书写要求
1. 在反应物和反应产物的化学式后面用括号注明各物质的聚集状态
如果生成的是H2O(g) ,反应热一样吗
H2(g) + O2(g)===H2O(l) H1=﹣285.8 kJ·mol -1
H2(g) + O2(g) ===H2O(g) H2=
等质量水的焓:H2O(s)< H2O(l)< H2O(g)
﹣241.8 kJ·mol-1
1 g冰
1 g液态水
1 g水蒸气
蒸发
熔化
焓(H)增大
书写要求
1. 在反应物和反应产物的化学式后面用括号注明各物质的聚集状态
2. ΔH的单位是J·mol-1或kJ·mol-1。
ΔH的单位中“mol-1”,指的是“每摩尔反应”,对于相同物质的反应,当化学计量数不同时,其ΔH也不同。
书写要求
1. 在反应物和反应产物的化学式后面用括号注明各物质的聚集状态
2. ΔH的单位是J·mol-1或kJ·mol-1。
3. 根据焓的性质,若化学方程式中各物质化学式前的系数加倍,则ΔH数值的绝对值也加倍;若反应逆向进行,则ΔH改变符号,但数值的绝对值不变
4. 指明反应的温度和压强。若不特别说明,反应温度为298 K,压强为101 kPa。
(5)注意热化学方程式中各物质的化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数也可以是分数。
(6)热化学方程式一般不写点燃、加热、高温等反应条件。由于已经注明了物质的聚集状态,所以在热化学方程式中不再用“↑”“↓”来标记气体反应产物和难溶反应产物。
书写要求
热化学方程式与普通化学方程式的区别
普通化学方程式 热化学方程式
化学 计量数 ____________________________________________ ______________________________________________
状态 不要求注明 ___________________
ΔH正负号 及单位 无 必须注明
意义 ____________________________ ____________________________________________________________
遵循规律 __________ ____________________
原子守恒和能量守恒
是整数,既表示微粒个数又表示该物质的物质的量
可以是整数也可以是分数,只表示物质的物质的量
必须在分子式后注明
表明了化学反应中的物质变化
不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化
原子守恒
热化学方程式
二标聚集状态
三标条件(温度压强)
四判ΔH正负
五算数值
一写方程式
1.已知: ,反应过程中的能量变化如图所示,回答下列问题。
(1)a、b、c分别代表什么意义?
a:____________________;
b:____________________;
c:________。
(2)该反应是______(填“放热”或“吸热”)反应,ΔH___(填“>”或“<”)0。
旧键断裂吸收的能量
新键形成放出的能量
反应热
放热
<
2.SF6是一种优良的绝缘气体,分子结构中只存在S—F键。
已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂
1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。则反应S(s)+3F2(g)=SF6(g)的反应热为 ( )
A.-1 780 kJ·mol-1 B.-1 220 kJ·mol-1
C.-450 kJ·mol-1 D.430 kJ·mol-1
B
3.热化学方程式 C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3kJ/mol表示 ( )
A.C(s)和水反应吸收131.3 kJ能量
B.1molC(s)和1mol水反应生成1molCO和1molH2并吸收131.3 kJ热量
C.1molC(s)和1mol水蒸气反应生成1molCO气体1molH2吸收131.3 kJ热量
D.1个C(s)原子和1分子水蒸气反应吸热131.3 kJ
C
4.根据右图所示情况,判断下列说法中正确的是( )
A.其热化学方程式为
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 KJ/mol
B.该反应为吸热反应
C.该反应为放热反应
D.当H2O为液态时,其反应热大于41 KJ/mol
B
5.在常温常压下,1 g 氢气在足量氯气中完全燃烧生成
氯化氢气体,放出92.3 kJ 的热量。下列热化学方程式中正
确的是( )
A.H2(g)+Cl2(g)=2HCl(g) ΔH=-92.3 kJ/mol
B.H2(g)+Cl2(g)=2HCl(g) ΔH=+92.3 kJ/mol
C.H2(g)+Cl2(g)=2HCl(g) ΔH=+184.6 kJ/mol
D.2HCl(g)=H2(g)+Cl2(g) ΔH=+184.6 kJ/mol
D
判断热化学方程式的正误注意“五看”
一看方程式是否配平;
二看各物质的聚集状态是否正确;
三看ΔH的“+”“-”符号是否正确;
四看反应热的单位是否为“kJ·mol-1”;
五看反应热的数值与化学计量数是否对应。
H=反应物的总键能 —生成物的总键能
H=H生成物-H反应物
热化学方程式
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
