1.2 课时2 化学电源 课件 (共18张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.2 课时2 化学电源 课件 (共18张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 12:17:52 | ||
图片预览




文档简介
(共18张PPT)
化学电源
1.了解化学电源种类并认识化学电源在实际生活中的应用。
2.掌握一次电池、二次电池的反应原理并能书写电极反应式。
3.理解常见的氢氧燃料电池的工作原理,并能设计简易氢氧燃料电池。
4.会书写不同介质条件下,其他燃料电池的电极反应。
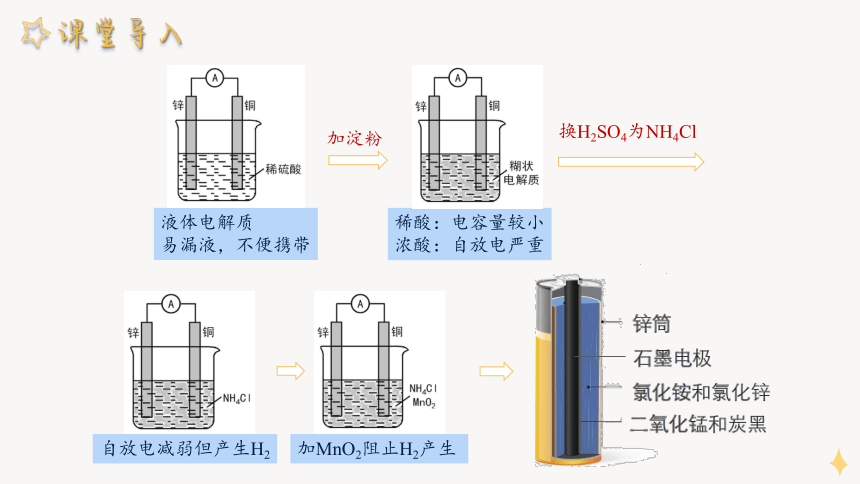
液体电解质
易漏液,不便携带
加淀粉
稀酸:电容量较小
浓酸:自放电严重
换H2SO4为NH4Cl
自放电减弱但产生H2
加MnO2阻止H2产生
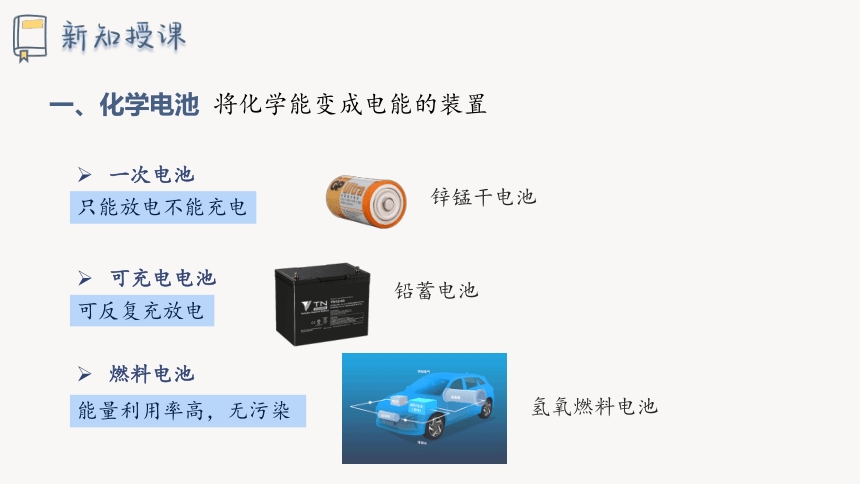
一、化学电池
将化学能变成电能的装置
能量利用率高,无污染
一次电池
可充电电池
燃料电池
只能放电不能充电
可反复充放电
氢氧燃料电池
铅蓄电池
锌锰干电池
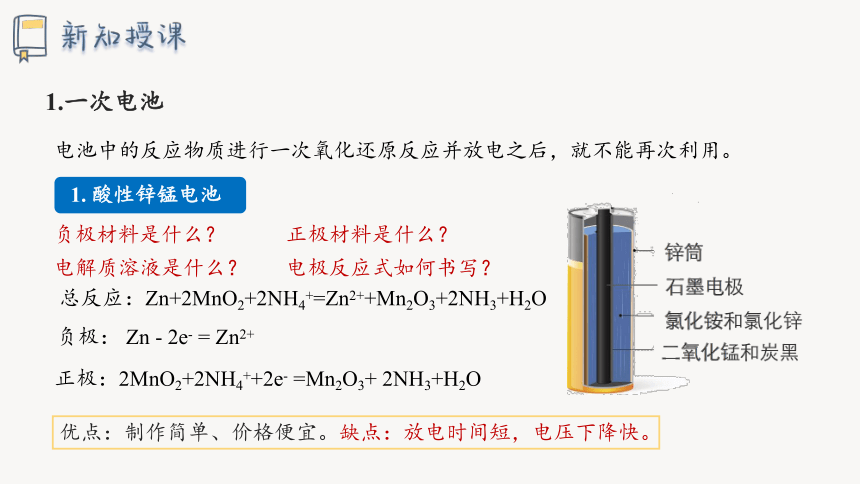
1.一次电池
电池中的反应物质进行一次氧化还原反应并放电之后,就不能再次利用。
总反应:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O
负极: Zn - 2e- = Zn2+
正极:2MnO2+2NH4++2e- =Mn2O3+ 2NH3+H2O
优点:制作简单、价格便宜。缺点:放电时间短,电压下降快。
负极材料是什么?
正极材料是什么?
电解质溶液是什么?
电极反应式如何书写?
1. 酸性锌锰电池
锌锰干电池即使不用,放置过久,也可能会漏液失效,这是为什么?在使用和保存时又应该注意哪些方面?
作为电解质的糊状NH4Cl显酸性。锌锰电池在使用和放置过程中,锌会溶解,锌筒会逐渐变薄,内部糊状电解质会泄漏出来,使电器腐蚀,长时间不用,应从电器中取出,密封储存于低温干燥处。
为了防止泄露,外壳套上防腐金属或塑料筒,制成防漏电池。
2. 碱性锌锰电池
负极:
Zn + 2OH- -2e- =ZnO+H2O
正极:
2MnO2 + 2H2O+2e-=2MnOOH+2OH-
碱式氧化锰/氢氧化氧锰
优点:比能量和储存时间有所提高,适用于大电流和连续放电(电流稳定,放电容量、时间增大几倍,不会气涨或漏液)
缺点:多数只能一次使用,不能充电;价格较贵
总反应式:
Zn+2MnO2 + H2O=ZnO+2MnOOH
2.二次电池
(1)正负极材料
正极:PbO2
负极:Pb
电解质溶液:H2SO4(aq)
化学能
电能
放电
充电
(2)工作机制
充电电池中能量的转化关系:
其电池反应可以正向和逆向进行.蓄电池放电时为自发电池,充电时为电解池。充电后电池容量得到恢复,充放电次数可达千百次。
铅蓄电池
(3)放电时电极反应式:
总反应:Pb + PbO2 + 2H2SO4=2PbSO4 + 2H2O
负极: Pb + SO42- -2e-=PbSO4
正极:PbO2 + 4H+ + SO42- + 2e-=PbSO4 + 2H2O
(4)(充放电)反应式: 充电时电极反应式与放电时电极反应式相反,所以可以
把上述反应写成一个反应式:
Pb+PbO2+2H2SO4 2PbSO4+2H2O。
3.燃料电池
燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。反应物不是储存在电池内部,而是由外设装备提供燃料和氧化剂。
1. 氢氧燃料电池
酸性电解质
溶液:H2SO4
正极:
O2
负极:
燃料H2
负极:
通氢气(燃料)
2H2 - 4e- = 4H+
O2 + 4H+ + 4e- = 2H2O
总反应:
2H2 + O2 = 2H2O
正极:
通氧气(氧化剂)
1. 氢氧燃料电池
负极:
通氢气(燃料)
2H2 + 4OH- – 4e- = 4H2O
O2 + 2H2O + 4e- = 4OH-
总反应:
2H2 + O2 = 2H2O
正极:
通氧气(氧化剂)
碱性电解质
溶液: KOH
正极:
O2
负极:
燃料H2
[注意事项]
1.电极反应是一种离子反应,遵循书写离子反应的所有规则;
2.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
3.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在);
4.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-。
负极的电极反应式 = 燃料电池总反应式 - 正极的电极反应式。
一极通入CO为燃料,一极通入空气和CO2混合气体为助燃气,以Li2CO3的熔融盐作电解质的电池。
总反应式:2CO+O2 = 2CO2
正极:O2+2CO2+4e- = 2CO32-
负极:2CO+2CO32--4e- = 4CO2
CH4-熔融碳酸盐燃料电池
总反应:CH4+2O2 = CO2+2H2O
① H2SO4溶液:
总反应式:CH4+2O2 = CO2+2H2O
正极:O2+4H++4e- = 2H2O
负极:CH4+2H2O-8e- = CO2+8H+
用导线连接的两个铂电极插入电解质溶液中,然后向两极分别通入CH4和O2,该电池的反应式:
② KOH溶液:
总反应式:CH4 + 2O2 + 2OH- = CO32-+3H2O
正极:O2+2H2O+4e- = 4OH-
负极:CH4+10OH--8e- = CO32-+7H2O
甲醇燃料电池
(电解质为H2SO4 )
电池总反应式:
正极:
负极:
CH3OH - 6e- + 8OH- = CO32- + 6H2O
O2 + 4e- + 2H2O = 4OH-
2CH3OH +3O2 + 4OH-=2CO32- +6H2O
甲醇燃料电池
(电解质为KOH)
电池总反应式:
正极:
负极:
CH3OH-6e-+H2O = CO2+6H+
O2+4e-+4H+ = 2H2O
2CH3OH+3O2 = 2CO2+4H2O
N H4-4e- +4OH- = N ↑ + 4H O
O + 4e- + 2H O = 4OH-
N H4 + O = N ↑ + 2H O
肼燃料电池
(电解质为KOH )
电池总反应式:
正极:
负极:
肼燃料电池
(电解质为H2SO4 )
电池总反应式:
正极:
负极:
N H4 + O = N ↑ + 2H O
O2 + 4H+ + 4e- = 2H2O
N H4-4e- = N ↑ + 4H+
化学电源
1.了解化学电源种类并认识化学电源在实际生活中的应用。
2.掌握一次电池、二次电池的反应原理并能书写电极反应式。
3.理解常见的氢氧燃料电池的工作原理,并能设计简易氢氧燃料电池。
4.会书写不同介质条件下,其他燃料电池的电极反应。
液体电解质
易漏液,不便携带
加淀粉
稀酸:电容量较小
浓酸:自放电严重
换H2SO4为NH4Cl
自放电减弱但产生H2
加MnO2阻止H2产生
一、化学电池
将化学能变成电能的装置
能量利用率高,无污染
一次电池
可充电电池
燃料电池
只能放电不能充电
可反复充放电
氢氧燃料电池
铅蓄电池
锌锰干电池
1.一次电池
电池中的反应物质进行一次氧化还原反应并放电之后,就不能再次利用。
总反应:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O
负极: Zn - 2e- = Zn2+
正极:2MnO2+2NH4++2e- =Mn2O3+ 2NH3+H2O
优点:制作简单、价格便宜。缺点:放电时间短,电压下降快。
负极材料是什么?
正极材料是什么?
电解质溶液是什么?
电极反应式如何书写?
1. 酸性锌锰电池
锌锰干电池即使不用,放置过久,也可能会漏液失效,这是为什么?在使用和保存时又应该注意哪些方面?
作为电解质的糊状NH4Cl显酸性。锌锰电池在使用和放置过程中,锌会溶解,锌筒会逐渐变薄,内部糊状电解质会泄漏出来,使电器腐蚀,长时间不用,应从电器中取出,密封储存于低温干燥处。
为了防止泄露,外壳套上防腐金属或塑料筒,制成防漏电池。
2. 碱性锌锰电池
负极:
Zn + 2OH- -2e- =ZnO+H2O
正极:
2MnO2 + 2H2O+2e-=2MnOOH+2OH-
碱式氧化锰/氢氧化氧锰
优点:比能量和储存时间有所提高,适用于大电流和连续放电(电流稳定,放电容量、时间增大几倍,不会气涨或漏液)
缺点:多数只能一次使用,不能充电;价格较贵
总反应式:
Zn+2MnO2 + H2O=ZnO+2MnOOH
2.二次电池
(1)正负极材料
正极:PbO2
负极:Pb
电解质溶液:H2SO4(aq)
化学能
电能
放电
充电
(2)工作机制
充电电池中能量的转化关系:
其电池反应可以正向和逆向进行.蓄电池放电时为自发电池,充电时为电解池。充电后电池容量得到恢复,充放电次数可达千百次。
铅蓄电池
(3)放电时电极反应式:
总反应:Pb + PbO2 + 2H2SO4=2PbSO4 + 2H2O
负极: Pb + SO42- -2e-=PbSO4
正极:PbO2 + 4H+ + SO42- + 2e-=PbSO4 + 2H2O
(4)(充放电)反应式: 充电时电极反应式与放电时电极反应式相反,所以可以
把上述反应写成一个反应式:
Pb+PbO2+2H2SO4 2PbSO4+2H2O。
3.燃料电池
燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。反应物不是储存在电池内部,而是由外设装备提供燃料和氧化剂。
1. 氢氧燃料电池
酸性电解质
溶液:H2SO4
正极:
O2
负极:
燃料H2
负极:
通氢气(燃料)
2H2 - 4e- = 4H+
O2 + 4H+ + 4e- = 2H2O
总反应:
2H2 + O2 = 2H2O
正极:
通氧气(氧化剂)
1. 氢氧燃料电池
负极:
通氢气(燃料)
2H2 + 4OH- – 4e- = 4H2O
O2 + 2H2O + 4e- = 4OH-
总反应:
2H2 + O2 = 2H2O
正极:
通氧气(氧化剂)
碱性电解质
溶液: KOH
正极:
O2
负极:
燃料H2
[注意事项]
1.电极反应是一种离子反应,遵循书写离子反应的所有规则;
2.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
3.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在);
4.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-。
负极的电极反应式 = 燃料电池总反应式 - 正极的电极反应式。
一极通入CO为燃料,一极通入空气和CO2混合气体为助燃气,以Li2CO3的熔融盐作电解质的电池。
总反应式:2CO+O2 = 2CO2
正极:O2+2CO2+4e- = 2CO32-
负极:2CO+2CO32--4e- = 4CO2
CH4-熔融碳酸盐燃料电池
总反应:CH4+2O2 = CO2+2H2O
① H2SO4溶液:
总反应式:CH4+2O2 = CO2+2H2O
正极:O2+4H++4e- = 2H2O
负极:CH4+2H2O-8e- = CO2+8H+
用导线连接的两个铂电极插入电解质溶液中,然后向两极分别通入CH4和O2,该电池的反应式:
② KOH溶液:
总反应式:CH4 + 2O2 + 2OH- = CO32-+3H2O
正极:O2+2H2O+4e- = 4OH-
负极:CH4+10OH--8e- = CO32-+7H2O
甲醇燃料电池
(电解质为H2SO4 )
电池总反应式:
正极:
负极:
CH3OH - 6e- + 8OH- = CO32- + 6H2O
O2 + 4e- + 2H2O = 4OH-
2CH3OH +3O2 + 4OH-=2CO32- +6H2O
甲醇燃料电池
(电解质为KOH)
电池总反应式:
正极:
负极:
CH3OH-6e-+H2O = CO2+6H+
O2+4e-+4H+ = 2H2O
2CH3OH+3O2 = 2CO2+4H2O
N H4-4e- +4OH- = N ↑ + 4H O
O + 4e- + 2H O = 4OH-
N H4 + O = N ↑ + 2H O
肼燃料电池
(电解质为KOH )
电池总反应式:
正极:
负极:
肼燃料电池
(电解质为H2SO4 )
电池总反应式:
正极:
负极:
N H4 + O = N ↑ + 2H O
O2 + 4H+ + 4e- = 2H2O
N H4-4e- = N ↑ + 4H+
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
