1.1 课时1 化学反应的热效应 课件 (共18张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.1 课时1 化学反应的热效应 课件 (共18张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 28.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 12:20:42 | ||
图片预览





文档简介
(共18张PPT)
化学反应的反应热
第1章 化学反应与能量转化
1.认识化学能可以转化为热能,并能解释化学变化、能量变化的本质。
2.通过中和反应的反应热测定实验,明确反应热测定的原理、方法和注意事项。
任何一个化学反应,都既有物质变化,又有能量变化。
思考1:化学反应中的能量变化形式有哪些?
化学能
热能(主要) 光能 电能 机械能
放热反应
吸热反应
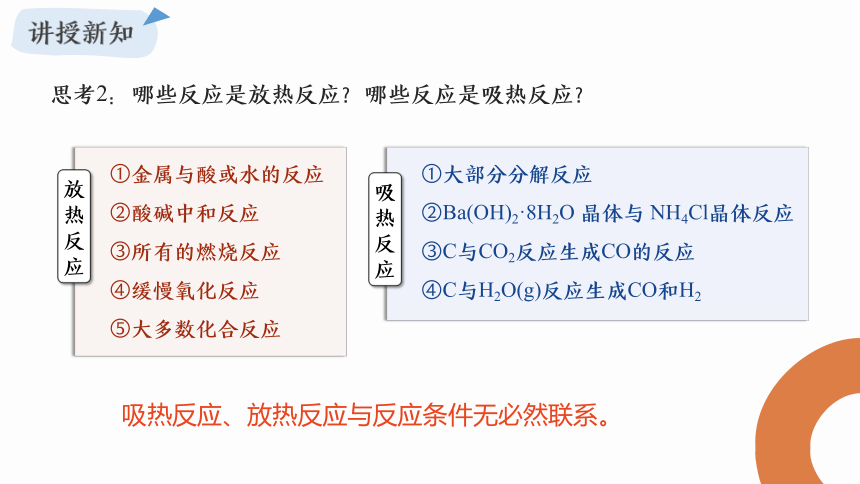
思考2:哪些反应是放热反应?哪些反应是吸热反应?
放热反应
吸热反应
①金属与酸或水的反应
②酸碱中和反应
③所有的燃烧反应
④缓慢氧化反应
⑤大多数化合反应
①大部分分解反应
②Ba(OH)2·8H2O 晶体与 NH4Cl晶体反应
③C与CO2反应生成CO的反应
④C与H2O(g)反应生成CO和H2
吸热反应、放热反应与反应条件无必然联系。
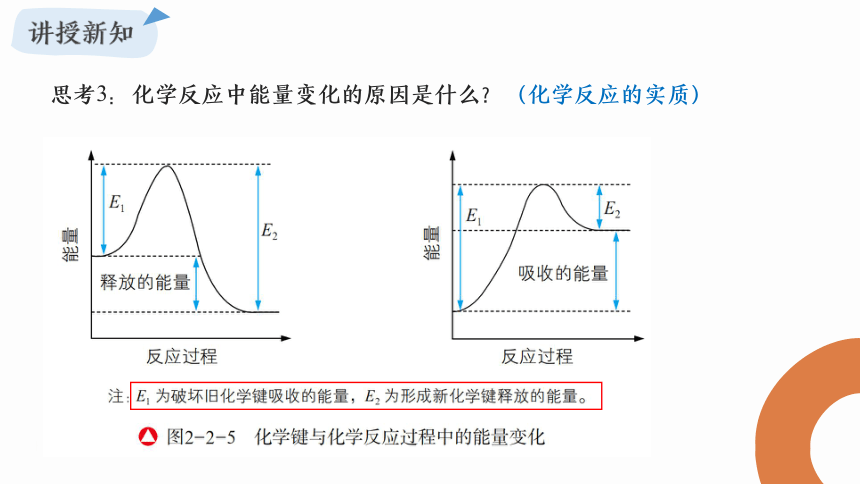
思考3:化学反应中能量变化的原因是什么?(化学反应的实质)
化学反应的实质:
旧键的断裂(吸收能量)和新键的形成(释放能量)
断裂旧化学键吸收的总能量<形成新化学键释放的总能量
断裂旧化学键吸收的总能量>形成新化学键释放的总能量
放热反应
吸热反应
(一)反应热
1、定义:
2、符号:
3、单位:
一、化学反应的反应热
当化学反应在一定的温度下进行时,反应所释放或吸收的热量为该反应在此温度下的热效应,简称反应热。
Q > 0,表示吸热;Q < 0,表示放热
J 或 kJ
反应热的数值可以通过实验测得,也可以通过理论计算求得。
反应热的理论计算
【练一练】SF6是一种优良的绝缘气体,分子结构中只存在S—F。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F需吸收的能量分别为160 kJ、330 kJ。则常温下1 mol硫单质与3 mol F2发生下列反应:
S(s)+3F2(g)===SF6(g)的反应热Q= ,该反应为 反应(填“放热”或“吸热”)
Q=280 kJ+3×160 kJ-330 kJ×6
-1220 kJ
放热
Q=Σ反应物键能-Σ反应产物键能
键能:断裂1 mol化学键吸收的能量或形成1 mol化学键释放的能量。
反应热的实验测定
测定反应热的仪器——量热计:
使反应充分进行,体系的温度均匀
测定反应前后溶液的温度
保温作用
反应容器
反应热的实验测定
想一想:
1、环形玻璃搅拌棒是怎样搅拌溶液的?
2、加入NaOH溶液时应分多次加入还是一次全部加入?
3、终止温度应记录溶液达到的最高温度还是最终温度?
1、要使用同一支温度计,这是因为不同温度计产生的系统误差不同。且测定一种溶液后必须洗净并用滤纸擦干,以便于下次测量。
2、实验动作要快,隔热和保温效果要好,以减少热量损失。
3、实验数据需重复测量2-3次,取温度差值的平均值。
注意事项:
Q =-cm ( T2-T1 )
热容与比热
在不发生化学反应和物质聚集状态不变的条件下,物质吸收热量,温度每升高 1 K 时所吸收的热量称为该物质的热容。热容用符号 C 表示,其单位为 J·K-1。
纯物质的热容与其质量成正比。单位质量的物质的热容称为该物质的比热容,简称比热c。比热的单位为kJ·K-1·kg-1。常温下,液态水的比热为 4.18 kJ·K-1·kg-1。
计算公式:
T:热力学温度 单位:K T(K)=t(℃) +273.15
起始温度t/ c 终止温度t/ c 温度差t/ c 温度差平均值t/ c
1 26.1 30.4
2 27.2 33.3
3 26.6 30.7
4 25.6 29.8
取50mL 0.5mol/L NaOH溶液和30mL 0.5mol/L H2SO4进行实验,实验数据如下:求反应放出的热量Q和中和热Q(中和热)。
4.3
6.1
4.1
4.2
4.2
误差大,舍
中和热:酸与碱的稀溶液发生中和反应,生成1mol液态水时所放出的热。
反应热的实验测定
反应热的实验测定
Q(中和热)=Q/n(H2O)
= -1.404kJ / 0.025mol = -56.2 kJ/mol
Q=-cm△T
= -4.18 kJ K-1 kg-1×4.2K×80g×10-3
= -1.404kJ
溶液的质量m=1g/mL3×(50+30)mL=80 g
近似 a、认为稀溶液的密度、比热与水相同;
处理 b、忽略量热计的热容
温度差△T=4.2 K
H++OH-===H2O
n(H+)=0.03mol 过量 n(OH-)=0.025mol
常温下,液态H2O的比热:4.18 kJ K-1 kg-1
思考:
1.按照下列量完成中和反应反应热的测定实验
①50mL 0.5mol/L NaOH溶液和50mL 0.5mol/L HCl反应
②50mL 0.5mol/L NaOH溶液和30mL 0.5mol/L HCl反应
测得的反应热数值两者是否相同?中和热数值两者是否相同?
①n(OH-)=0.025mol n(H+)=0.025mol n(H2O)=0.025mol
②n(OH-)=0.025mol n(H+)=0.015mol n(H2O)=0.015mol
同一中和反应的反应热与酸碱的用量有关。反应生成水的量不同,反应热数值两者不相同;
但中和热数值两者相同。
思考:
2.按照下列量完成中和反应反应热的测定实验
①50mL 0.5mol/L NaOH溶液和50mL 0.5mol/L HCl反应
②55mL 0.5mol/L NaOH溶液和50mL 0.5mol/L HCl反应
测得的反应热数值两者是否相同?
①n(OH-)=0.025mol n(H+)=0.025mol n(H2O)=0.025mol
②n(OH-)=0.0275mol过量 n(H+)=0.025mol n(H2O)=0.025mol
常使稀碱溶液稍过量,可使中和反应进行彻底,所测反应热数值更准确。
生成的水的量相同,故反应放热相同。
相同。
参加反应的物质都是强酸、强碱,它们在水中完全电离,中和反应的离子方程式都是H++OH-===H2O,反应都在室温下进行,且参加反应的n(H+)和n(OH-)都相同,所以反应热也相同。
思考:
3.用同体积、同浓度的KOH代替NaOH完成中和反应反应热的测定实验,用同体积、同浓度的硝酸代替盐酸完成中和反应反应热的测定实验,测得的反应热数值两者是否相同?
思考:
4.用浓硫酸代替稀硫酸完成中和反应反应热的测定实验,用同体积、同浓度的醋酸代替盐酸完成中和反应反应热的测定实验,测得的反应热数值两者是否相同?
信息:浓酸、浓碱稀释放热;弱电解质电离吸热
若用浓硫酸,由于浓硫酸和碱混合时因稀释而放热,造成反应放热偏多,测得的反应热的值偏小;
若用醋酸,由于弱酸在水溶液中不能完全电离,电离需要吸热,会导致反应放热偏小,测得的反应热的值偏大。
注意:
①强酸与强碱的中和热数值:57.3kJ/mol
(注意:弱电解质电离吸热)
②稀溶液(注意:浓硫酸稀释放热)
③生成1mol水(无其他难溶物生成)
(中和反应的实质是H+和OH—化合生成 H2O,若反应过程中有难溶物生成,这部分沉淀生成热会影响反应热的数值。)
大量实验测得,25 ℃和101 kPa下,强酸和强碱稀溶液发生中和反应生成1 mol水时,放出57.3 kJ的热量。
化学反应的反应热
第1章 化学反应与能量转化
1.认识化学能可以转化为热能,并能解释化学变化、能量变化的本质。
2.通过中和反应的反应热测定实验,明确反应热测定的原理、方法和注意事项。
任何一个化学反应,都既有物质变化,又有能量变化。
思考1:化学反应中的能量变化形式有哪些?
化学能
热能(主要) 光能 电能 机械能
放热反应
吸热反应
思考2:哪些反应是放热反应?哪些反应是吸热反应?
放热反应
吸热反应
①金属与酸或水的反应
②酸碱中和反应
③所有的燃烧反应
④缓慢氧化反应
⑤大多数化合反应
①大部分分解反应
②Ba(OH)2·8H2O 晶体与 NH4Cl晶体反应
③C与CO2反应生成CO的反应
④C与H2O(g)反应生成CO和H2
吸热反应、放热反应与反应条件无必然联系。
思考3:化学反应中能量变化的原因是什么?(化学反应的实质)
化学反应的实质:
旧键的断裂(吸收能量)和新键的形成(释放能量)
断裂旧化学键吸收的总能量<形成新化学键释放的总能量
断裂旧化学键吸收的总能量>形成新化学键释放的总能量
放热反应
吸热反应
(一)反应热
1、定义:
2、符号:
3、单位:
一、化学反应的反应热
当化学反应在一定的温度下进行时,反应所释放或吸收的热量为该反应在此温度下的热效应,简称反应热。
Q > 0,表示吸热;Q < 0,表示放热
J 或 kJ
反应热的数值可以通过实验测得,也可以通过理论计算求得。
反应热的理论计算
【练一练】SF6是一种优良的绝缘气体,分子结构中只存在S—F。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F需吸收的能量分别为160 kJ、330 kJ。则常温下1 mol硫单质与3 mol F2发生下列反应:
S(s)+3F2(g)===SF6(g)的反应热Q= ,该反应为 反应(填“放热”或“吸热”)
Q=280 kJ+3×160 kJ-330 kJ×6
-1220 kJ
放热
Q=Σ反应物键能-Σ反应产物键能
键能:断裂1 mol化学键吸收的能量或形成1 mol化学键释放的能量。
反应热的实验测定
测定反应热的仪器——量热计:
使反应充分进行,体系的温度均匀
测定反应前后溶液的温度
保温作用
反应容器
反应热的实验测定
想一想:
1、环形玻璃搅拌棒是怎样搅拌溶液的?
2、加入NaOH溶液时应分多次加入还是一次全部加入?
3、终止温度应记录溶液达到的最高温度还是最终温度?
1、要使用同一支温度计,这是因为不同温度计产生的系统误差不同。且测定一种溶液后必须洗净并用滤纸擦干,以便于下次测量。
2、实验动作要快,隔热和保温效果要好,以减少热量损失。
3、实验数据需重复测量2-3次,取温度差值的平均值。
注意事项:
Q =-cm ( T2-T1 )
热容与比热
在不发生化学反应和物质聚集状态不变的条件下,物质吸收热量,温度每升高 1 K 时所吸收的热量称为该物质的热容。热容用符号 C 表示,其单位为 J·K-1。
纯物质的热容与其质量成正比。单位质量的物质的热容称为该物质的比热容,简称比热c。比热的单位为kJ·K-1·kg-1。常温下,液态水的比热为 4.18 kJ·K-1·kg-1。
计算公式:
T:热力学温度 单位:K T(K)=t(℃) +273.15
起始温度t/ c 终止温度t/ c 温度差t/ c 温度差平均值t/ c
1 26.1 30.4
2 27.2 33.3
3 26.6 30.7
4 25.6 29.8
取50mL 0.5mol/L NaOH溶液和30mL 0.5mol/L H2SO4进行实验,实验数据如下:求反应放出的热量Q和中和热Q(中和热)。
4.3
6.1
4.1
4.2
4.2
误差大,舍
中和热:酸与碱的稀溶液发生中和反应,生成1mol液态水时所放出的热。
反应热的实验测定
反应热的实验测定
Q(中和热)=Q/n(H2O)
= -1.404kJ / 0.025mol = -56.2 kJ/mol
Q=-cm△T
= -4.18 kJ K-1 kg-1×4.2K×80g×10-3
= -1.404kJ
溶液的质量m=1g/mL3×(50+30)mL=80 g
近似 a、认为稀溶液的密度、比热与水相同;
处理 b、忽略量热计的热容
温度差△T=4.2 K
H++OH-===H2O
n(H+)=0.03mol 过量 n(OH-)=0.025mol
常温下,液态H2O的比热:4.18 kJ K-1 kg-1
思考:
1.按照下列量完成中和反应反应热的测定实验
①50mL 0.5mol/L NaOH溶液和50mL 0.5mol/L HCl反应
②50mL 0.5mol/L NaOH溶液和30mL 0.5mol/L HCl反应
测得的反应热数值两者是否相同?中和热数值两者是否相同?
①n(OH-)=0.025mol n(H+)=0.025mol n(H2O)=0.025mol
②n(OH-)=0.025mol n(H+)=0.015mol n(H2O)=0.015mol
同一中和反应的反应热与酸碱的用量有关。反应生成水的量不同,反应热数值两者不相同;
但中和热数值两者相同。
思考:
2.按照下列量完成中和反应反应热的测定实验
①50mL 0.5mol/L NaOH溶液和50mL 0.5mol/L HCl反应
②55mL 0.5mol/L NaOH溶液和50mL 0.5mol/L HCl反应
测得的反应热数值两者是否相同?
①n(OH-)=0.025mol n(H+)=0.025mol n(H2O)=0.025mol
②n(OH-)=0.0275mol过量 n(H+)=0.025mol n(H2O)=0.025mol
常使稀碱溶液稍过量,可使中和反应进行彻底,所测反应热数值更准确。
生成的水的量相同,故反应放热相同。
相同。
参加反应的物质都是强酸、强碱,它们在水中完全电离,中和反应的离子方程式都是H++OH-===H2O,反应都在室温下进行,且参加反应的n(H+)和n(OH-)都相同,所以反应热也相同。
思考:
3.用同体积、同浓度的KOH代替NaOH完成中和反应反应热的测定实验,用同体积、同浓度的硝酸代替盐酸完成中和反应反应热的测定实验,测得的反应热数值两者是否相同?
思考:
4.用浓硫酸代替稀硫酸完成中和反应反应热的测定实验,用同体积、同浓度的醋酸代替盐酸完成中和反应反应热的测定实验,测得的反应热数值两者是否相同?
信息:浓酸、浓碱稀释放热;弱电解质电离吸热
若用浓硫酸,由于浓硫酸和碱混合时因稀释而放热,造成反应放热偏多,测得的反应热的值偏小;
若用醋酸,由于弱酸在水溶液中不能完全电离,电离需要吸热,会导致反应放热偏小,测得的反应热的值偏大。
注意:
①强酸与强碱的中和热数值:57.3kJ/mol
(注意:弱电解质电离吸热)
②稀溶液(注意:浓硫酸稀释放热)
③生成1mol水(无其他难溶物生成)
(中和反应的实质是H+和OH—化合生成 H2O,若反应过程中有难溶物生成,这部分沉淀生成热会影响反应热的数值。)
大量实验测得,25 ℃和101 kPa下,强酸和强碱稀溶液发生中和反应生成1 mol水时,放出57.3 kJ的热量。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
