第三章 物质在水溶液中的行为 章末复习课件(共23张ppt) 2024-2025学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第三章 物质在水溶液中的行为 章末复习课件(共23张ppt) 2024-2025学年高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 32.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 12:23:34 | ||
图片预览








文档简介
(共23张PPT)
章末复习
第3章 物质在水溶液中的行为
一 、水的电离
H2O H+ + OH-
KW= c平(H+)·c平(OH-)
注意:①由水电离出的H+和OH- 始终相等。 c(H+)水:c(OH-)水=1:1
②相同温度时,等浓度的H+和OH-,对水的电离抑制作用相同。
强电解质:在稀的水溶液里能完全电离的电解质。
包括:强酸、强碱、大部分盐
存在形态:离子
弱电解质:在稀的水溶液里部分电离的电解质。
包括:弱酸、弱碱、水、极少数盐
存在形态:分子和离子
在写电离方程式时用“===”
在写电离方程式时用“ ”
①多元弱酸:分步电离,电离程度逐步减弱,必须分步书写。
②多元弱碱:分步进行,但一般按一步电离的形式书写。
二 、水溶液的酸碱性
方法一:比较c(H+) 和c(OH-)大小关系
适合任何温度
酸性:c平(H+)>c平(OH-) 且 c平(H+) 越大,酸性越强
中性:c平(H+)=c平(OH-)
碱性:c平(H+)<c平(OH-) 且 c平(OH-) 越大,碱性越强
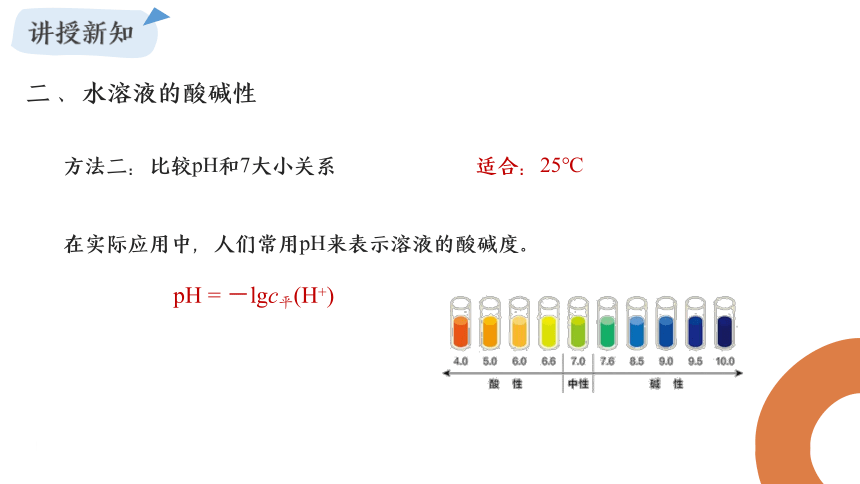
方法二:比较pH和7大小关系
适合:25℃
在实际应用中,人们常用pH来表示溶液的酸碱度。
pH = -lgc平(H+)
二 、水溶液的酸碱性
单一溶液:
(a)强酸(HmA)溶液: HmA=mH++Am-
物质的量浓度(mol/L) c mc
[H+]=mc pH=_lg[H+]=_lgmc
三 、pH值的计算
B(OH)n =Bn++nOH
物质的量浓度(mol/L) c nc
pH=_lg[H+]=_lgmc
(b)碱性B(OH)n溶液,先求[OH -],再求 [H+],最后求pH。
[OH-]=nc
[H+]=
1×10-14
[OH-]
单一溶液:
三 、pH值的计算
溶液的混合:
首先判断溶液显什么性,若为酸性溶液先求[H+ ],若为碱性溶液,先求[OH–],再求[H+ ] ,最后求pH。
三 、pH值的计算
三 、pH值的计算
(a)当加水稀释后,溶液中[H+](或[OH-]) ≥10-6mol/L时,
强酸:pH混=pH原+n
强碱:pH混=pH原–n
(b)当加水稀释倍数很大时,
酸:pH略小于7; 碱:pH略大于7
强酸、强碱加水稀释10n倍:
盐酸
醋酸
V水
3
2
pH
10倍
NaOH
氨水
V水
12
11
pH
10倍
图象分析
稀释相同倍数时
pH:盐酸>醋酸
稀释到相同pH时
稀释的倍数:醋酸>盐酸
稀释相同倍数时
pH:氨水>NaOH
稀释到相同pH时
稀释的倍数:氨水>NaOH
四 、弱电解质的电离平衡
Ka= ————————
c平(H+) c平(CH3COO-)
c平(CH3COOH)
Kb= ———————
c平(NH4+) c平(OH-)
c平(NH3·H2O)
CH3COOH H+ + CH3COO-
⑴ 一元弱酸的电离常数(Ka):
⑵ 一元弱碱的电离常数(Kb):
NH3·H2O NH4+ + OH-
多元酸的电离是分步进行的,每一步电离都有自己的电离常数,通常用 Ka1、Ka2……来表示。
五 、影响电离平衡的因素
(1)温度
(2)浓度
(3)与电离平衡有关的物质
— 加水稀释能促进弱电解质的电离
— 升高温度能促进弱电解质的电离
1. 内因
2. 外因
电解质本身的性质
六 、盐类的水解
弱酸酸根离子
弱碱阳离子
结合H+
促进水的电离
c平(H+)≠c平(OH-)
溶液呈酸性或碱性
盐电离
生成弱电解质
结合OH-
可逆
吸热
微弱
盐类水解的规律——判断盐溶液酸碱性的方法
“有弱才水解,无弱不水解”
“谁强显谁性,同强显中性”
水解方程式的书写
(1)盐类水解是可逆反应,少数水解完全的反应,书写时用“===”连接
(2)一般盐类水解程度很小,水解产物很少,通常不生成沉淀和气体,也不发生分解,产物一般不标“↑”或“↓”。
(3)多元弱酸酸根离子水解分步书写,多元弱碱阳离子水解一步写出。
盐本身的性质
(1)盐的离子对应的酸或碱越弱,则水解程度越大。
(2)正盐离子比其对应酸式盐离子的水解程度大。
1、内因:
影响盐类水解的因素
2、外界条件(外因)
(1)浓度
(2)温度
(3)外加酸、碱:
加酸抑制强酸弱碱盐的水解、促进强碱弱酸盐的水解 ;
加碱抑制强碱弱酸盐的水解、促进强酸弱碱盐的水解。
—— 浓度、温度及溶液酸碱性
越热越水解
越稀越水解
七 、沉淀溶解平衡与溶度积
Q> Ksp
Q= Ksp
Q< Ksp
溶液未达饱和,无沉淀析出
平衡向生成沉淀方向移动,生成沉淀。
难溶电解质达到沉淀溶解平衡状态,溶液是饱和溶液
沉淀溶解平衡的应用:沉淀的生成、沉淀的溶解、沉淀的转化
八 、离子反应发生的条件
1.生成沉淀
2.生成弱电解质
3.生成气体
4.发生氧化还原反应
离子方程式的书写注意要点:
(1)一易:易溶的强电解质(强酸、强碱和大多数可溶性盐)以实际参加反应的离子符号表示;其他物质(非电解质、弱电解质、难溶物、气体、单质、氧化物等)用化学式表示。
(2)两等:离子方程式两边的原子个数、电荷总数均应相等。
(3)三查:检查各项是否都有公约数,是否漏写必要的反应条件,是否漏写离子反应。
与量有关的离子方程式的书写注意问题:
(1)要注意“过量”“少量”“等物质的量”“适量”“任意量”以及滴加顺序对离子方程式的影响。
(2)以量少的为标准,一般将少量物质的物质的量,先定为“1 mol”,确定另一种物质参加反应的离子的物质的量。同时少量物质参加反应的离子系数之比要符合化学式。
九 、离子反应的应用
1.常见离子的检验
利用AgNO3(HNO3酸化)溶液检验
Cl-
Br-
I-
硝酸酸化的硝酸银溶液
白色沉淀
淡黄色沉淀
黄色沉淀
2.测定溶液中离子浓度
①沉淀法
②酸碱中和滴定法
③氧化还原反应滴定法
如溶液中SO的浓度,用Ba2+将其转化为BaSO4沉淀,再称量沉淀的质量求得。
强酸溶液中H+的浓度可以用已知准确浓度的强碱溶液滴定的方法获得。
如溶液中MnO的浓度可以用已知准确浓度的Fe2+溶液滴定获得。
实验:强酸与强碱的中和滴定及其应用
【实验目的】通过已知浓度的强碱溶液,确定待测强酸溶液的浓度。
【实验用品】盐酸样品,0.1000mol·L-1 NaOH溶液,石蕊溶液,酚酞溶液,甲基橙溶液;酸式滴定管,碱式滴定管,锥形瓶,滴定管架,胶头滴管等。
酸式、碱式滴定管的使用方法
① 查漏:活塞处是否漏水。
② 洗涤:先用蒸馏水洗,再用待盛溶液润洗2~3次。
③ 装液:注入待盛溶液,使液面位于“0”刻度线以上2~ 3 cm处,再把滴定管固定在滴定管夹上。
④排气:在滴定管下方放一个烧杯,调节活塞使滴定管的尖嘴部分充满溶液,不留气泡。
⑤调零:调节液面处在“0”或“0”以下某刻度处。
【实验原理】
c(HCl)V(HCl) = c(NaOH)V(NaOH)
向锥形瓶中滴加NaOH标准液,记录恰好中和时所用NaOH溶液的体积。
量取25.00mL盐酸
待测液于锥形瓶中
【误差分析】
章末复习
第3章 物质在水溶液中的行为
一 、水的电离
H2O H+ + OH-
KW= c平(H+)·c平(OH-)
注意:①由水电离出的H+和OH- 始终相等。 c(H+)水:c(OH-)水=1:1
②相同温度时,等浓度的H+和OH-,对水的电离抑制作用相同。
强电解质:在稀的水溶液里能完全电离的电解质。
包括:强酸、强碱、大部分盐
存在形态:离子
弱电解质:在稀的水溶液里部分电离的电解质。
包括:弱酸、弱碱、水、极少数盐
存在形态:分子和离子
在写电离方程式时用“===”
在写电离方程式时用“ ”
①多元弱酸:分步电离,电离程度逐步减弱,必须分步书写。
②多元弱碱:分步进行,但一般按一步电离的形式书写。
二 、水溶液的酸碱性
方法一:比较c(H+) 和c(OH-)大小关系
适合任何温度
酸性:c平(H+)>c平(OH-) 且 c平(H+) 越大,酸性越强
中性:c平(H+)=c平(OH-)
碱性:c平(H+)<c平(OH-) 且 c平(OH-) 越大,碱性越强
方法二:比较pH和7大小关系
适合:25℃
在实际应用中,人们常用pH来表示溶液的酸碱度。
pH = -lgc平(H+)
二 、水溶液的酸碱性
单一溶液:
(a)强酸(HmA)溶液: HmA=mH++Am-
物质的量浓度(mol/L) c mc
[H+]=mc pH=_lg[H+]=_lgmc
三 、pH值的计算
B(OH)n =Bn++nOH
物质的量浓度(mol/L) c nc
pH=_lg[H+]=_lgmc
(b)碱性B(OH)n溶液,先求[OH -],再求 [H+],最后求pH。
[OH-]=nc
[H+]=
1×10-14
[OH-]
单一溶液:
三 、pH值的计算
溶液的混合:
首先判断溶液显什么性,若为酸性溶液先求[H+ ],若为碱性溶液,先求[OH–],再求[H+ ] ,最后求pH。
三 、pH值的计算
三 、pH值的计算
(a)当加水稀释后,溶液中[H+](或[OH-]) ≥10-6mol/L时,
强酸:pH混=pH原+n
强碱:pH混=pH原–n
(b)当加水稀释倍数很大时,
酸:pH略小于7; 碱:pH略大于7
强酸、强碱加水稀释10n倍:
盐酸
醋酸
V水
3
2
pH
10倍
NaOH
氨水
V水
12
11
pH
10倍
图象分析
稀释相同倍数时
pH:盐酸>醋酸
稀释到相同pH时
稀释的倍数:醋酸>盐酸
稀释相同倍数时
pH:氨水>NaOH
稀释到相同pH时
稀释的倍数:氨水>NaOH
四 、弱电解质的电离平衡
Ka= ————————
c平(H+) c平(CH3COO-)
c平(CH3COOH)
Kb= ———————
c平(NH4+) c平(OH-)
c平(NH3·H2O)
CH3COOH H+ + CH3COO-
⑴ 一元弱酸的电离常数(Ka):
⑵ 一元弱碱的电离常数(Kb):
NH3·H2O NH4+ + OH-
多元酸的电离是分步进行的,每一步电离都有自己的电离常数,通常用 Ka1、Ka2……来表示。
五 、影响电离平衡的因素
(1)温度
(2)浓度
(3)与电离平衡有关的物质
— 加水稀释能促进弱电解质的电离
— 升高温度能促进弱电解质的电离
1. 内因
2. 外因
电解质本身的性质
六 、盐类的水解
弱酸酸根离子
弱碱阳离子
结合H+
促进水的电离
c平(H+)≠c平(OH-)
溶液呈酸性或碱性
盐电离
生成弱电解质
结合OH-
可逆
吸热
微弱
盐类水解的规律——判断盐溶液酸碱性的方法
“有弱才水解,无弱不水解”
“谁强显谁性,同强显中性”
水解方程式的书写
(1)盐类水解是可逆反应,少数水解完全的反应,书写时用“===”连接
(2)一般盐类水解程度很小,水解产物很少,通常不生成沉淀和气体,也不发生分解,产物一般不标“↑”或“↓”。
(3)多元弱酸酸根离子水解分步书写,多元弱碱阳离子水解一步写出。
盐本身的性质
(1)盐的离子对应的酸或碱越弱,则水解程度越大。
(2)正盐离子比其对应酸式盐离子的水解程度大。
1、内因:
影响盐类水解的因素
2、外界条件(外因)
(1)浓度
(2)温度
(3)外加酸、碱:
加酸抑制强酸弱碱盐的水解、促进强碱弱酸盐的水解 ;
加碱抑制强碱弱酸盐的水解、促进强酸弱碱盐的水解。
—— 浓度、温度及溶液酸碱性
越热越水解
越稀越水解
七 、沉淀溶解平衡与溶度积
Q> Ksp
Q= Ksp
Q< Ksp
溶液未达饱和,无沉淀析出
平衡向生成沉淀方向移动,生成沉淀。
难溶电解质达到沉淀溶解平衡状态,溶液是饱和溶液
沉淀溶解平衡的应用:沉淀的生成、沉淀的溶解、沉淀的转化
八 、离子反应发生的条件
1.生成沉淀
2.生成弱电解质
3.生成气体
4.发生氧化还原反应
离子方程式的书写注意要点:
(1)一易:易溶的强电解质(强酸、强碱和大多数可溶性盐)以实际参加反应的离子符号表示;其他物质(非电解质、弱电解质、难溶物、气体、单质、氧化物等)用化学式表示。
(2)两等:离子方程式两边的原子个数、电荷总数均应相等。
(3)三查:检查各项是否都有公约数,是否漏写必要的反应条件,是否漏写离子反应。
与量有关的离子方程式的书写注意问题:
(1)要注意“过量”“少量”“等物质的量”“适量”“任意量”以及滴加顺序对离子方程式的影响。
(2)以量少的为标准,一般将少量物质的物质的量,先定为“1 mol”,确定另一种物质参加反应的离子的物质的量。同时少量物质参加反应的离子系数之比要符合化学式。
九 、离子反应的应用
1.常见离子的检验
利用AgNO3(HNO3酸化)溶液检验
Cl-
Br-
I-
硝酸酸化的硝酸银溶液
白色沉淀
淡黄色沉淀
黄色沉淀
2.测定溶液中离子浓度
①沉淀法
②酸碱中和滴定法
③氧化还原反应滴定法
如溶液中SO的浓度,用Ba2+将其转化为BaSO4沉淀,再称量沉淀的质量求得。
强酸溶液中H+的浓度可以用已知准确浓度的强碱溶液滴定的方法获得。
如溶液中MnO的浓度可以用已知准确浓度的Fe2+溶液滴定获得。
实验:强酸与强碱的中和滴定及其应用
【实验目的】通过已知浓度的强碱溶液,确定待测强酸溶液的浓度。
【实验用品】盐酸样品,0.1000mol·L-1 NaOH溶液,石蕊溶液,酚酞溶液,甲基橙溶液;酸式滴定管,碱式滴定管,锥形瓶,滴定管架,胶头滴管等。
酸式、碱式滴定管的使用方法
① 查漏:活塞处是否漏水。
② 洗涤:先用蒸馏水洗,再用待盛溶液润洗2~3次。
③ 装液:注入待盛溶液,使液面位于“0”刻度线以上2~ 3 cm处,再把滴定管固定在滴定管夹上。
④排气:在滴定管下方放一个烧杯,调节活塞使滴定管的尖嘴部分充满溶液,不留气泡。
⑤调零:调节液面处在“0”或“0”以下某刻度处。
【实验原理】
c(HCl)V(HCl) = c(NaOH)V(NaOH)
向锥形瓶中滴加NaOH标准液,记录恰好中和时所用NaOH溶液的体积。
量取25.00mL盐酸
待测液于锥形瓶中
【误差分析】
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
