第一章化学反应与能量转化章末复习 课件(共38张ppt) 2024-2025学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第一章化学反应与能量转化章末复习 课件(共38张ppt) 2024-2025学年高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 33.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 12:22:45 | ||
图片预览







文档简介
(共38张PPT)
第1章 化学反应与能量转化
章末复习
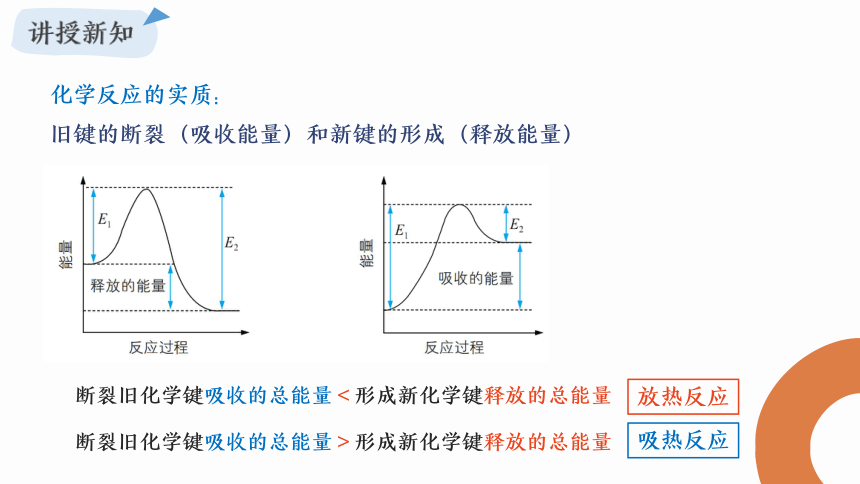
化学反应的实质:
旧键的断裂(吸收能量)和新键的形成(释放能量)
断裂旧化学键吸收的总能量<形成新化学键释放的总能量
断裂旧化学键吸收的总能量>形成新化学键释放的总能量
放热反应
吸热反应
一、化学反应的反应热
Q > 0,表示吸热;Q < 0,表示放热
Q=Σ反应物键能-Σ反应产物键能
注意:
①强酸与强碱的中和热数值:57.3kJ/mol
(注意:弱电解质电离吸热)
②稀溶液(注意:浓硫酸稀释放热)
③生成1mol水(无其他难溶物生成)
(中和反应的实质是H+和OH—化合生成 H2O,若反应过程中有难溶物生成,这部分沉淀生成热会影响反应热的数值。)
大量实验测得,25 ℃和101 kPa下,强酸和强碱稀溶液发生中和反应生成1 mol水时,放出57.3 kJ的热量。
中和热
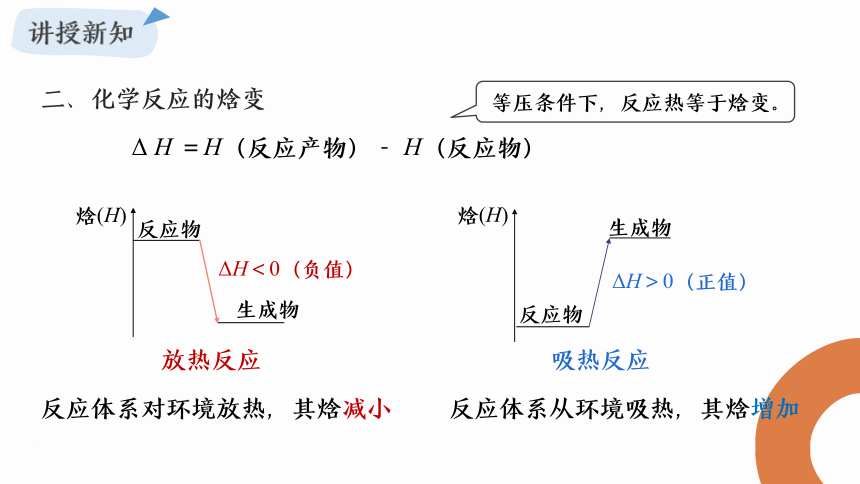
二、化学反应的焓变
等压条件下,反应热等于焓变。
Δ H =H(反应产物)- H(反应物)
放热反应
ΔH<0(负值)
焓(H)
反应物
生成物
吸热反应
ΔH>0(正值)
焓(H)
生成物
反应物
反应体系对环境放热,其焓减小
反应体系从环境吸热,其焓增加
三、热化学方程式
既表示物质变化又能表示反应的焓变
书写要求
1. 在反应物和反应产物的化学式后面用括号注明各物质的聚集状态
2. ΔH的单位是J·mol-1或kJ·mol-1。
3. 根据焓的性质,若化学方程式中各物质化学式前的系数加倍,则ΔH数值的绝对值也加倍;若反应逆向进行,则ΔH改变符号,但数值的绝对值不变
4. 指明反应的温度和压强。若不特别说明,反应温度为298 K,压强为101 kPa。
5.注意热化学方程式中各物质的化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数也可以是分数。
6.热化学方程式一般不写点燃、加热、高温等反应条件。由于已经注明了物质的聚集状态,所以在热化学方程式中不再用“↑”“↓”来标记气体反应产物和难溶反应产物。
四、盖斯定律
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
(1)定:确定待求反应的热化学方程式。
(2)找:找出待求热化学方程式中只在已知化学方程式中出现一次的物质。
(3)调:依据该物质调整已知化学方程式的方向(同侧相加,异侧相减)和化学计量数,每个已知化学方程式只能调整一次。
(4)算:ΔH与化学方程式一一对应调整和运算。
①热化学方程式中物质的化学计量数同乘以某一数时,反应热数值也必须乘以该数;
②热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减;
③将一个热化学方程式颠倒时, H的数值不变,但“+”、“-”号必须随之改变;
④若热化学方程式相减,最好能先把被减方程式进行颠倒,然后相加,更不易出错。
应用盖斯定律计算反应热应注意:
五、摩尔燃烧焓
1. 定义:在101kPa时,1mol纯物质完全燃烧生成稳定的物质时的焓变。
①N → N2(g) ② C→CO2(g)
③ S →SO2(g) ④H→H2O(l)
可燃物完全燃烧产生的热量为Q放=n(可燃物)× ΔH,
这里的ΔH是可燃物的摩尔燃烧焓
六、原电池的工作原理
阴离子移向
负极
正极
e-
电解质溶液
阳离子移向
I
1.电子流向:原电池中电子由负极流出,经导线流向正极;两极转移电子数相等。
3.离子移动方向:溶液中的阳离子向正极移动,阴离子向负极移动。
2.电流方向:电流方向与电子流向恰好相反,即由正极经导线流向负极。
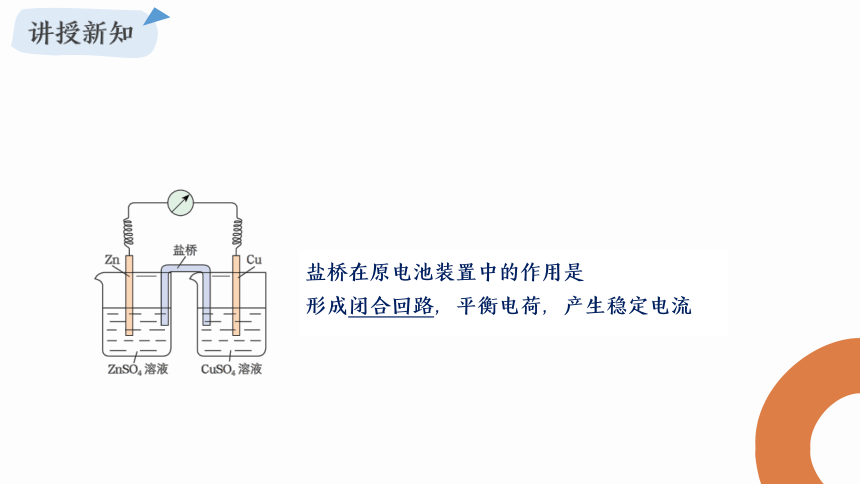
盐桥在原电池装置中的作用是
形成闭合回路,平衡电荷,产生稳定电流
原电池中正、负极的判断
判断依据 负极 正极
电子流动方向 电子流出 电子流入
离子导体中阴、阳离子定向移动的方向 阴离子移向的电极 阳离子移向的电极
电流方向 电流流入极 电流流出极
两极发生的反应 失电子,发生氧化反应 得电子,发生还原反应
电极材料 活动性较强的金属 活动性较弱的金属或能导电的非金属
七、原电池工作原理的应用
1.加快化学反应速率
2.比较金属的活动性强弱
3.设计原电池
设计原电池的一般思路
首先将氧化还原反应拆分成氧化反应和还原反应两个半反应。
其次确定正、负极选择电极材料,还原剂(一般为比较活泼的金属)为负极,比较不活泼的金属或惰性电极为正极。
最后用导线连接两个电极并插入电解质溶液形成闭合回路,如果两个半反应分别在两个容器中进行,中间应用盐桥连接。
八、化学电源
1.概念:化学电源是将化学能转化为电能的实用装置。
2.化学电源的分类
一次电池
可充电电池(二次电池)
燃料电池
化学电源
可反复充电和放电,充电时是一个电解池;放电时是一个原电池
能量利用率高,可连续使用,污染轻
只能放电,不能充电
化学电源也可按其电解质性质分为中性电池、酸性电池、碱性电池。
(1)锌锰干电池
电池反应:
负极:
正极:
Zn-2e-===Zn2+
电池反应:
负极:
正极:
Zn+2MnO2+H2O===ZnO+2MnOOH
Zn+2OH--2e-===ZnO+H2O
2MnO2+2H2O+2e-===2MnOOH+2OH-
Zn+2+2MnO2===Mn2O3+2NH3+Zn2++H2O
2MnO2+2+2e-===Mn2O3+2NH3+H2O
二氧化锰和石墨
锌粉和
氢氧化钾
(2)铅蓄电池
铅酸蓄电池是最常见的二次电池,其电极反应分为放电和充电两个过程。
①放电过程的电极反应、总反应:
负极: ;
正极: ;
总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
②充电过程的电极反应、总反应:
阴极: (还原反应);
阳极: (氧化反应);
总反应:2PbSO4+2H2O=Pb+PbO2+2H2SO4。
放电过程中,负极的质量增大,稀H2SO4的浓度减小。
充电时,阳极与直流电源正极相连,阴极与直流电源负极相连
同一电极
同一电极
外接电源正极
外接电源负极
还原反应:阴极
氧化反应:阳极
充电
可充电电池
放电
负极:氧化反应
正极:还原反应
(3)燃料电池
燃料电池负极一般通入燃料(如H2、CH4、CH3OH、CH3CH2OH等),正极一般通入氧化剂(如O2)。实现一个相当于燃烧反应的电池反应,将化学能转化为电能。
燃料电池电极反应式书写的方法
第一步:写出燃料电池的总反应式
燃料电池的总反应与燃料的燃烧反应一致,若产物能和电解质反应,则总反应为加和后的反应。
第二步:写出电池的正极反应式
正极反应物一般为氧气得电子,介质不同时其电极反应式有所不同,如:
酸性电解质溶液:O2+4H++4e-===2H2O;
碱性电解质溶液:O2+2H2O+4e-===4OH-;
固体电解质(高温下能传导O2-):O2+4e-===2O2-;
熔融碳酸盐(如熔融K2CO3):O2+2CO2+4e-=== 。
第三步:根据电池总反应式和正极反应式,写出负极反应式。电池反应的总反应式-电池正极反应式=电池负极反应式。因为O2不是负极反应物,因此两个反应式相减时要彻底消除O2。
九、电解原理
电解:让直流电通过电解质溶液或熔融电解质,在两个电极上分别发生氧化反应(阳极)和还原反应(阴极)的过程。
1、定义
2.电解池
(1)定义:将电能转化为化学能的装置。
(2)组成:
与电源相连的两个电极
电解质溶液或熔化的电解质
形成闭合回路
外加直流电源
A
(3)电极名称与电极反应:
阳极:与电源____相连,溶液中______移向此极,____电子,发生______反应。
阴极:与电源____相连,溶液中______移向此极,____电子,发生_____反应。
正极
阴离子
失去
氧化
负极
阳离子
得到
还原
(4)电子流向:
电源____极→导线→电解池的___极;电解池的___极→导线→电源的___极。
负
阴
正
阳
2.电解池
原电池 电解池
能量转换
构成条件
电极材料
电极反应
电子导体
离子导体
电极反应物、电极材料、离子导体和电子导体
无电源
有直流电源
负极→正极
电源负极→阴极;
阳极→电源正极。
阳离子向正极迁移,
阴离子向负极迁移。
阳离子向阴极迁移,
阴离子向阳极迁移。
化学能→电能
电能→化学能
发生氧化还原反应
正极
负极
阳极
阴极
[原电池和电解池的比较]
十、离子放电顺序
离子在电极表面得到或失去电子的过程也叫作“放电”。当电解质溶液中存在多种阳离子或阴离子时,离子在电极上放电的顺序是存在某种规律的。
(1)阴极放电顺序(氧化性)
Ag+>Hg2+> Fe3+> Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+ >H+(水)>Al3+>Mg2+>Na+ >Ca2+>K+
浓度大
浓度小
(2)阳极放电顺序
活性金属电极
>S2->I->Br->Cl->OH->非还原性含氧酸根>F-
(还原性)
十一、电解类型
总反应:CuCl2===Cu + Cl2↑
电解
阳极:2Cl--2e-===Cl2↑
阴极:Cu2++2e-===Cu
CuCl2
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
1.电解电解质型:
电解质电离出的阴、阳离子分别在两极放电。
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
2.电解水型:
水电离出的H+、OH-分别在两极放电。
阴极:2H2O+2e-===H2↑+2OH-
阳极:H2O-2e-=== O2↑+2H+
总反应:2H2O===2H2↑+ O2↑
电解
NaOH
NaCl
阴极:2H2O+2e-===H2↑+2OH-
阳极:2Cl--2e-===Cl2↑
总反应:2NaCl+2H2O===Cl2↑+H2↑+2NaOH
电解
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
①放氢生碱型:电解质电离的阴离子在阳极放电,水电离的阳离子在阴极放电。
2.电解电解质+水型:
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
②放氧生酸型:
电解质电离的阳离子在阴极放电,水电离的阴离子在阳极放电。
CuSO4
阳极:H2O-2e-=== O2↑+2H+
阴极:
总反应:2CuSO4 +2H2O===2Cu+2H2SO4+O2↑
电解
Cu2++2e-===Cu
十二、电解池电极反应式的书写
判断阴、阳极
分析电解质溶液或熔融电解质的组成
确定阴极、阳极上的放电物质及放电顺序
分析电极反应,判断电极产物,写出电极反应式
最后写出总反应方程式
原子守恒
电荷守恒
十三、电解原理的应用
1.电解食盐水制备烧碱、氢气和氯气
2NaCl+2H2O ==== 2NaOH+H2↑+Cl2↑
通电
2.铜的电解精炼
十三、电解原理的应用
Cu(粗铜) -2e-===Cu2+
Cu2+ +2e-=== Cu(精铜)
Ag、Pt 、Au等金属沉积在池底形成阳极泥
阴极:
阳极:
Zn-2e-===Zn2+
Fe-2e-===Fe2+
Ni-2e-===Ni2+
十三、电解原理的应用
3.电镀
电镀池
电镀液:
含有镀层金属离子的盐溶液
阳 极:
镀层金属
(与直流电源正极相连)
阴 极:
镀件
(与直流电源负极相连)
十三、电解原理的应用
4.冶炼活泼金属
2Al2O3(熔融) 4Al+3O2↑
MgCl2(熔融) Mg+Cl2↑
十四、金属的腐蚀
金属腐蚀的本质:金属原子失去电子,被氧化。
M - ne- = Mn+
化学腐蚀 电化学腐蚀
条件
现象
本质
影响 因素
联系
金属跟干燥气体或非电解质液体直接接触
不纯金属或合金跟电解质溶液接触
无电流产生
有微弱电流产生
金属被氧化
较活泼金属被氧化
与接触物质的氧化性及温度有关
与电解质溶液的酸碱性及金属活性有关
两者往往同时发生,电化学腐蚀更普遍
条件 水膜呈弱酸性、中性或碱性
负极反应
正极反应
总反应式
生成铁锈的反应
Fe - 2e- === Fe2+
O2 + 2H2O + 4e- === 4OH-
2Fe + O2 + 2H2O === 2Fe(OH)2
2 Fe(OH)3 =Fe2O3 · xH2O+(3-x)H2O
4Fe(OH)2+2H2O+O2 = 4Fe(OH)3
吸氧腐蚀
析氢腐蚀
条件 水膜呈较强酸性
负极反应
正极反应
总反应式
Fe - 2e- === Fe2+
2H+ + 2e- === H2↑
Fe + 2H+ === Fe2+ + H2↑
通常两种腐蚀同时存在,但吸氧腐蚀更普遍
1.两极材料:活泼性差别越大,活泼金属被腐蚀的速度越快。
2.电解质溶液相同时,金属腐蚀由快到慢:电解池阳极腐蚀>原电池负极腐蚀>化学腐蚀>原电池的正极>电解池的阴极
3.相同浓度的不同介质:在强电解质中>弱电解质中>非电解质中
4.金属防腐措施由好到坏:外加电流的阴极保护法>牺牲阳极的阴极保护法>有一般防腐措施保护>无防腐措施保护
5.同一种电解质溶液,浓度越大,腐蚀速率越快。
注意:在钢铁的腐蚀过程中,其电化学腐蚀更严重,在电化学腐蚀中,吸氧腐蚀更普遍。
金属腐蚀快慢的规律
十五、金属的防护
①改变金属材料的组成
②在金属表面覆盖保护层
③电化学保护法
1.牺牲阳极保护法——原电池
2.外加电流阴极保护法——电解池
第1章 化学反应与能量转化
章末复习
化学反应的实质:
旧键的断裂(吸收能量)和新键的形成(释放能量)
断裂旧化学键吸收的总能量<形成新化学键释放的总能量
断裂旧化学键吸收的总能量>形成新化学键释放的总能量
放热反应
吸热反应
一、化学反应的反应热
Q > 0,表示吸热;Q < 0,表示放热
Q=Σ反应物键能-Σ反应产物键能
注意:
①强酸与强碱的中和热数值:57.3kJ/mol
(注意:弱电解质电离吸热)
②稀溶液(注意:浓硫酸稀释放热)
③生成1mol水(无其他难溶物生成)
(中和反应的实质是H+和OH—化合生成 H2O,若反应过程中有难溶物生成,这部分沉淀生成热会影响反应热的数值。)
大量实验测得,25 ℃和101 kPa下,强酸和强碱稀溶液发生中和反应生成1 mol水时,放出57.3 kJ的热量。
中和热
二、化学反应的焓变
等压条件下,反应热等于焓变。
Δ H =H(反应产物)- H(反应物)
放热反应
ΔH<0(负值)
焓(H)
反应物
生成物
吸热反应
ΔH>0(正值)
焓(H)
生成物
反应物
反应体系对环境放热,其焓减小
反应体系从环境吸热,其焓增加
三、热化学方程式
既表示物质变化又能表示反应的焓变
书写要求
1. 在反应物和反应产物的化学式后面用括号注明各物质的聚集状态
2. ΔH的单位是J·mol-1或kJ·mol-1。
3. 根据焓的性质,若化学方程式中各物质化学式前的系数加倍,则ΔH数值的绝对值也加倍;若反应逆向进行,则ΔH改变符号,但数值的绝对值不变
4. 指明反应的温度和压强。若不特别说明,反应温度为298 K,压强为101 kPa。
5.注意热化学方程式中各物质的化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数也可以是分数。
6.热化学方程式一般不写点燃、加热、高温等反应条件。由于已经注明了物质的聚集状态,所以在热化学方程式中不再用“↑”“↓”来标记气体反应产物和难溶反应产物。
四、盖斯定律
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
(1)定:确定待求反应的热化学方程式。
(2)找:找出待求热化学方程式中只在已知化学方程式中出现一次的物质。
(3)调:依据该物质调整已知化学方程式的方向(同侧相加,异侧相减)和化学计量数,每个已知化学方程式只能调整一次。
(4)算:ΔH与化学方程式一一对应调整和运算。
①热化学方程式中物质的化学计量数同乘以某一数时,反应热数值也必须乘以该数;
②热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减;
③将一个热化学方程式颠倒时, H的数值不变,但“+”、“-”号必须随之改变;
④若热化学方程式相减,最好能先把被减方程式进行颠倒,然后相加,更不易出错。
应用盖斯定律计算反应热应注意:
五、摩尔燃烧焓
1. 定义:在101kPa时,1mol纯物质完全燃烧生成稳定的物质时的焓变。
①N → N2(g) ② C→CO2(g)
③ S →SO2(g) ④H→H2O(l)
可燃物完全燃烧产生的热量为Q放=n(可燃物)× ΔH,
这里的ΔH是可燃物的摩尔燃烧焓
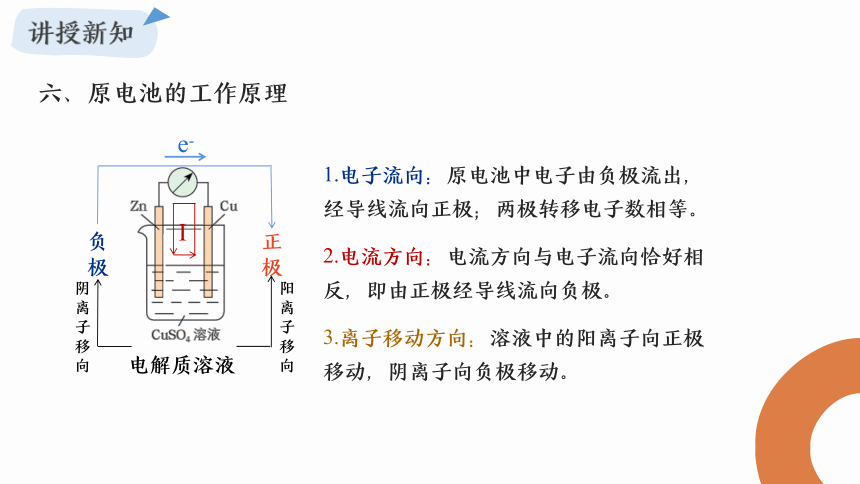
六、原电池的工作原理
阴离子移向
负极
正极
e-
电解质溶液
阳离子移向
I
1.电子流向:原电池中电子由负极流出,经导线流向正极;两极转移电子数相等。
3.离子移动方向:溶液中的阳离子向正极移动,阴离子向负极移动。
2.电流方向:电流方向与电子流向恰好相反,即由正极经导线流向负极。
盐桥在原电池装置中的作用是
形成闭合回路,平衡电荷,产生稳定电流
原电池中正、负极的判断
判断依据 负极 正极
电子流动方向 电子流出 电子流入
离子导体中阴、阳离子定向移动的方向 阴离子移向的电极 阳离子移向的电极
电流方向 电流流入极 电流流出极
两极发生的反应 失电子,发生氧化反应 得电子,发生还原反应
电极材料 活动性较强的金属 活动性较弱的金属或能导电的非金属
七、原电池工作原理的应用
1.加快化学反应速率
2.比较金属的活动性强弱
3.设计原电池
设计原电池的一般思路
首先将氧化还原反应拆分成氧化反应和还原反应两个半反应。
其次确定正、负极选择电极材料,还原剂(一般为比较活泼的金属)为负极,比较不活泼的金属或惰性电极为正极。
最后用导线连接两个电极并插入电解质溶液形成闭合回路,如果两个半反应分别在两个容器中进行,中间应用盐桥连接。
八、化学电源
1.概念:化学电源是将化学能转化为电能的实用装置。
2.化学电源的分类
一次电池
可充电电池(二次电池)
燃料电池
化学电源
可反复充电和放电,充电时是一个电解池;放电时是一个原电池
能量利用率高,可连续使用,污染轻
只能放电,不能充电
化学电源也可按其电解质性质分为中性电池、酸性电池、碱性电池。
(1)锌锰干电池
电池反应:
负极:
正极:
Zn-2e-===Zn2+
电池反应:
负极:
正极:
Zn+2MnO2+H2O===ZnO+2MnOOH
Zn+2OH--2e-===ZnO+H2O
2MnO2+2H2O+2e-===2MnOOH+2OH-
Zn+2+2MnO2===Mn2O3+2NH3+Zn2++H2O
2MnO2+2+2e-===Mn2O3+2NH3+H2O
二氧化锰和石墨
锌粉和
氢氧化钾
(2)铅蓄电池
铅酸蓄电池是最常见的二次电池,其电极反应分为放电和充电两个过程。
①放电过程的电极反应、总反应:
负极: ;
正极: ;
总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
②充电过程的电极反应、总反应:
阴极: (还原反应);
阳极: (氧化反应);
总反应:2PbSO4+2H2O=Pb+PbO2+2H2SO4。
放电过程中,负极的质量增大,稀H2SO4的浓度减小。
充电时,阳极与直流电源正极相连,阴极与直流电源负极相连
同一电极
同一电极
外接电源正极
外接电源负极
还原反应:阴极
氧化反应:阳极
充电
可充电电池
放电
负极:氧化反应
正极:还原反应
(3)燃料电池
燃料电池负极一般通入燃料(如H2、CH4、CH3OH、CH3CH2OH等),正极一般通入氧化剂(如O2)。实现一个相当于燃烧反应的电池反应,将化学能转化为电能。
燃料电池电极反应式书写的方法
第一步:写出燃料电池的总反应式
燃料电池的总反应与燃料的燃烧反应一致,若产物能和电解质反应,则总反应为加和后的反应。
第二步:写出电池的正极反应式
正极反应物一般为氧气得电子,介质不同时其电极反应式有所不同,如:
酸性电解质溶液:O2+4H++4e-===2H2O;
碱性电解质溶液:O2+2H2O+4e-===4OH-;
固体电解质(高温下能传导O2-):O2+4e-===2O2-;
熔融碳酸盐(如熔融K2CO3):O2+2CO2+4e-=== 。
第三步:根据电池总反应式和正极反应式,写出负极反应式。电池反应的总反应式-电池正极反应式=电池负极反应式。因为O2不是负极反应物,因此两个反应式相减时要彻底消除O2。
九、电解原理
电解:让直流电通过电解质溶液或熔融电解质,在两个电极上分别发生氧化反应(阳极)和还原反应(阴极)的过程。
1、定义
2.电解池
(1)定义:将电能转化为化学能的装置。
(2)组成:
与电源相连的两个电极
电解质溶液或熔化的电解质
形成闭合回路
外加直流电源
A
(3)电极名称与电极反应:
阳极:与电源____相连,溶液中______移向此极,____电子,发生______反应。
阴极:与电源____相连,溶液中______移向此极,____电子,发生_____反应。
正极
阴离子
失去
氧化
负极
阳离子
得到
还原
(4)电子流向:
电源____极→导线→电解池的___极;电解池的___极→导线→电源的___极。
负
阴
正
阳
2.电解池
原电池 电解池
能量转换
构成条件
电极材料
电极反应
电子导体
离子导体
电极反应物、电极材料、离子导体和电子导体
无电源
有直流电源
负极→正极
电源负极→阴极;
阳极→电源正极。
阳离子向正极迁移,
阴离子向负极迁移。
阳离子向阴极迁移,
阴离子向阳极迁移。
化学能→电能
电能→化学能
发生氧化还原反应
正极
负极
阳极
阴极
[原电池和电解池的比较]
十、离子放电顺序
离子在电极表面得到或失去电子的过程也叫作“放电”。当电解质溶液中存在多种阳离子或阴离子时,离子在电极上放电的顺序是存在某种规律的。
(1)阴极放电顺序(氧化性)
Ag+>Hg2+> Fe3+> Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+ >H+(水)>Al3+>Mg2+>Na+ >Ca2+>K+
浓度大
浓度小
(2)阳极放电顺序
活性金属电极
>S2->I->Br->Cl->OH->非还原性含氧酸根>F-
(还原性)
十一、电解类型
总反应:CuCl2===Cu + Cl2↑
电解
阳极:2Cl--2e-===Cl2↑
阴极:Cu2++2e-===Cu
CuCl2
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
1.电解电解质型:
电解质电离出的阴、阳离子分别在两极放电。
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
2.电解水型:
水电离出的H+、OH-分别在两极放电。
阴极:2H2O+2e-===H2↑+2OH-
阳极:H2O-2e-=== O2↑+2H+
总反应:2H2O===2H2↑+ O2↑
电解
NaOH
NaCl
阴极:2H2O+2e-===H2↑+2OH-
阳极:2Cl--2e-===Cl2↑
总反应:2NaCl+2H2O===Cl2↑+H2↑+2NaOH
电解
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
①放氢生碱型:电解质电离的阴离子在阳极放电,水电离的阳离子在阴极放电。
2.电解电解质+水型:
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
②放氧生酸型:
电解质电离的阳离子在阴极放电,水电离的阴离子在阳极放电。
CuSO4
阳极:H2O-2e-=== O2↑+2H+
阴极:
总反应:2CuSO4 +2H2O===2Cu+2H2SO4+O2↑
电解
Cu2++2e-===Cu
十二、电解池电极反应式的书写
判断阴、阳极
分析电解质溶液或熔融电解质的组成
确定阴极、阳极上的放电物质及放电顺序
分析电极反应,判断电极产物,写出电极反应式
最后写出总反应方程式
原子守恒
电荷守恒
十三、电解原理的应用
1.电解食盐水制备烧碱、氢气和氯气
2NaCl+2H2O ==== 2NaOH+H2↑+Cl2↑
通电
2.铜的电解精炼
十三、电解原理的应用
Cu(粗铜) -2e-===Cu2+
Cu2+ +2e-=== Cu(精铜)
Ag、Pt 、Au等金属沉积在池底形成阳极泥
阴极:
阳极:
Zn-2e-===Zn2+
Fe-2e-===Fe2+
Ni-2e-===Ni2+
十三、电解原理的应用
3.电镀
电镀池
电镀液:
含有镀层金属离子的盐溶液
阳 极:
镀层金属
(与直流电源正极相连)
阴 极:
镀件
(与直流电源负极相连)
十三、电解原理的应用
4.冶炼活泼金属
2Al2O3(熔融) 4Al+3O2↑
MgCl2(熔融) Mg+Cl2↑
十四、金属的腐蚀
金属腐蚀的本质:金属原子失去电子,被氧化。
M - ne- = Mn+
化学腐蚀 电化学腐蚀
条件
现象
本质
影响 因素
联系
金属跟干燥气体或非电解质液体直接接触
不纯金属或合金跟电解质溶液接触
无电流产生
有微弱电流产生
金属被氧化
较活泼金属被氧化
与接触物质的氧化性及温度有关
与电解质溶液的酸碱性及金属活性有关
两者往往同时发生,电化学腐蚀更普遍
条件 水膜呈弱酸性、中性或碱性
负极反应
正极反应
总反应式
生成铁锈的反应
Fe - 2e- === Fe2+
O2 + 2H2O + 4e- === 4OH-
2Fe + O2 + 2H2O === 2Fe(OH)2
2 Fe(OH)3 =Fe2O3 · xH2O+(3-x)H2O
4Fe(OH)2+2H2O+O2 = 4Fe(OH)3
吸氧腐蚀
析氢腐蚀
条件 水膜呈较强酸性
负极反应
正极反应
总反应式
Fe - 2e- === Fe2+
2H+ + 2e- === H2↑
Fe + 2H+ === Fe2+ + H2↑
通常两种腐蚀同时存在,但吸氧腐蚀更普遍
1.两极材料:活泼性差别越大,活泼金属被腐蚀的速度越快。
2.电解质溶液相同时,金属腐蚀由快到慢:电解池阳极腐蚀>原电池负极腐蚀>化学腐蚀>原电池的正极>电解池的阴极
3.相同浓度的不同介质:在强电解质中>弱电解质中>非电解质中
4.金属防腐措施由好到坏:外加电流的阴极保护法>牺牲阳极的阴极保护法>有一般防腐措施保护>无防腐措施保护
5.同一种电解质溶液,浓度越大,腐蚀速率越快。
注意:在钢铁的腐蚀过程中,其电化学腐蚀更严重,在电化学腐蚀中,吸氧腐蚀更普遍。
金属腐蚀快慢的规律
十五、金属的防护
①改变金属材料的组成
②在金属表面覆盖保护层
③电化学保护法
1.牺牲阳极保护法——原电池
2.外加电流阴极保护法——电解池
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
