第1章 微项目 探秘膨松剂 课件 (共22张PPT) 2024-2025学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 第1章 微项目 探秘膨松剂 课件 (共22张PPT) 2024-2025学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 53.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 12:31:59 | ||
图片预览







文档简介
(共22张PPT)
微项目 探秘膨松剂
第1章 认识化学科学
1.了解膨松剂的定义及其分类。
2.掌握碳酸氢钠的物理性质、主要化学性质。
什么是膨松剂?
(1)概念
膨松剂是在食品加工过程中加入的,能使面胚发起形成多孔组织,从而使食品具有柔软或蓬松特点的一类物质。
(2)分类
(3)化学膨松剂中基本上都含有一种化学物质 —— 碳酸氢钠 NaHCO3 。
膨松剂及其类别
膨松剂
生物膨松剂(酵头)
化学膨松剂
单一膨松剂
复合膨松剂
一、探究碳酸氢钠用作膨松剂的作用原理
推测的具体依据 推测的碳酸氢钠的作用原理
碳酸氢钠可单独作为蒸馒头膨松剂
碳酸氢钠受热分解产生CO2气体
加入食醋后蓬松效果更好
碳酸氢钠与酸反应生成CO2气体
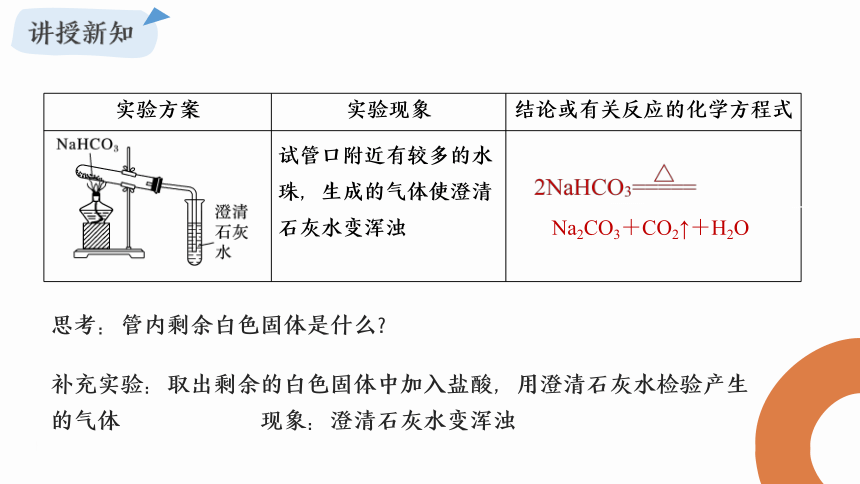
请同学们仔细阅读课本P34-35相关填写下表:
补充实验:取出剩余的白色固体中加入盐酸,用澄清石灰水检验产生的气体 现象:澄清石灰水变浑浊
实验方案 实验现象 结论或有关反应的化学方程式
试管口附近有较多的水珠,生成的气体使澄清石灰水变浑浊
思考:管内剩余白色固体是什么?
Na2CO3+CO2↑+H2O
思考:能不能在面团里直接加入纯碱做膨松剂?为什么?
但Na2CO3受热难以分解,加之碱性较强,因而不能单独用作膨松剂
二、设计并使用复合膨松剂
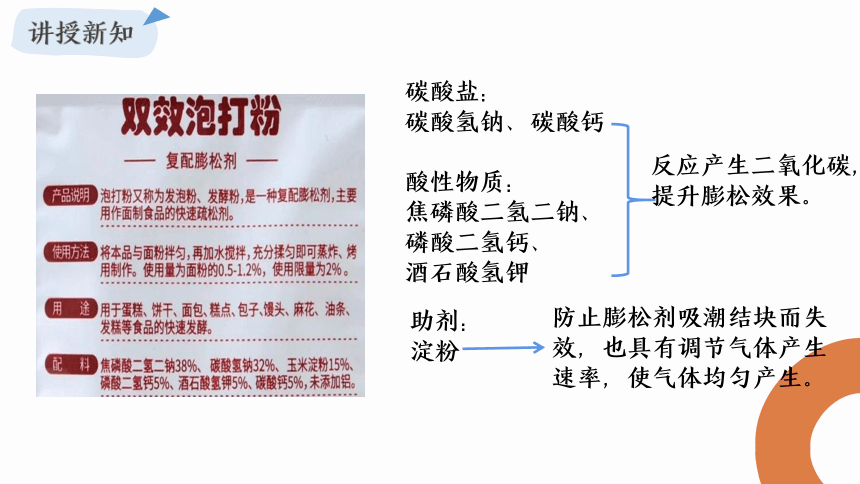
资料:厨房常用作添加到食品中的酸,比如白醋、柠檬酸。
1、白醋是烹调的酸味辅料,含3%~5%醋酸和水。其中醋酸是有机酸,分子式C2H4O2,无色液体,1mol醋酸能和1mol碳酸氢钠反应生成醋酸钠、水、二氧化碳。
2、柠檬酸常用作食品添加剂,是一种重要的有机酸,分子式为C6H8O7,无色晶体,易溶于水,1mol柠檬酸与3mol碳酸氢钠恰好反应,生成柠檬酸钠、水和二氧化碳。
碳酸盐:
碳酸氢钠、碳酸钙
酸性物质:
焦磷酸二氢二钠、
磷酸二氢钙、
酒石酸氢钾
反应产生二氧化碳,提升膨松效果。
助剂:
淀粉
防止膨松剂吸潮结块而失效,也具有调节气体产生速率,使气体均匀产生。
碳酸钠和碳酸氢钠
Na2CO3白色粉末
NaHCO3白色细小晶体
苏打、纯碱
小苏打
实验步骤 Na2CO3 NaHCO3
①观察两支试管中碳酸钠、碳酸氢钠的形态 _________ 细小的白色晶体
②加几滴水并将温度计伸入其中 加水后_____________,温度计示数_____ 加水后_____溶解,温度计示数_____
③加5 mL水 振荡一段时间后可溶解 固体量减少
④加1~2滴酚酞 溶液_____,溶液碱性较强 溶液_______,溶液碱性较弱
白色粉末
结块变成晶体
升高
部分
降低
变红
变浅红
初步结论 碳酸钠、碳酸氢钠均___溶于水,在水中的溶解度:________
>________,Na2CO3溶于水___热,NaHCO3溶于水___热,水溶液均显___性,碱性:________>________
易
Na2CO3
NaHCO3
放
吸
碱
Na2CO3
NaHCO3
鉴别碳酸钠和碳酸氢钠常用方法:加热
物质 装置图 现象或说明
Na2CO3
NaHCO3
注意:验证NaHCO3和Na2CO3热稳定性时,必须在小试管中装入
NaHCO3,大试管中装入Na2CO3。
无明显现象
生成能使澄清石灰水变浑浊的气体
鉴别碳酸钠和碳酸氢钠常用方法:与少量的稀盐酸反应
现象 化学方程式
N
NaHCO3 + HCl = NaCl + H2O + CO2↑
反应剧烈,立即有气泡产生
Na2CO3 + HCl = NaHCO3 + NaCl
Na2CO3
NaHCO3
无气泡产生
思考:有两瓶无色溶液HCl和Na2CO3,不使用任何其它的试剂,如何利用化学性质区分出二者?
盐酸逐滴加入碳酸钠溶液中
CO3 2 - + 2H+ = H2O + CO2↑
CO3 2 - + H+ = HCO3 -
HCO3 - + H+ = H2O + CO2↑
碳酸钠溶液逐滴加入盐酸中
现象:开始无明显现象,逐渐出现气泡。
现象:立刻出现气泡。
互滴法
鉴别碳酸钠和碳酸氢钠常用方法:与碱溶液反应
(1)与氢氧化钠反应:
①Na2CO3与NaOH不反应
②NaHCO3与NaOH反应
化学方程式:NaHCO3+NaOH = Na2CO3 + H2O
离子方程式:HCO3- + OH- = CO32- + H2O
(2)与氢氧化钙反应:
①Na2CO3与Ca(OH)2反应
化学方程式:Na2CO3+Ca(OH)2 = CaCO3 ↓+ 2NaOH
②NaHCO3与Ca(OH)2反应
化学方程式:2NaHCO3+Ca(OH)2(少量) = CaCO3 ↓+ Na2CO3 +2 H2O
化学方程式:NaHCO3+Ca(OH)2(过量) =CaCO3 ↓+ NaOH + H2O
Ca(OH)2溶液的量不同,反应产物不同
鉴别碳酸钠和碳酸氢钠常用方法:与可溶性钙盐溶液反应
与CaCl2(或BaCl2)反应:
①Na2CO3与CaCl2(或BaCl2)反应
化学方程式:Na2CO3+CaCl2 = CaCO3 ↓+ 2NaCl
离子方程式:CO32- + Ca2+= CaCO3 ↓
②NaHCO3与CaCl2(或BaCl2)不反应
碳酸钠和碳酸氢钠相互转化
Na2CO3 NaHCO3
①通CO2:Na2CO3 + CO2 + H2O = 2 NaHCO3↓
②加适量盐酸:Na2CO3 + HCl = NaHCO3 + NaCl
NaHCO3 Na2CO3
②加适量NaOH溶液:NaHCO3 + NaOH = Na2CO3 + H2O
①直接加热:2NaHCO3 == Na2CO3 + CO2↑ + H2O
△
制玻璃
制肥皂
造纸
纺织
发酵剂
灭火剂
Na2CO3
NaHCO3
制胃药
Na2CO3和NaHCO3的性质
外观、水溶性
1、水溶液的碱性比较
2、热稳定性比较
3、与足量或少量的稀盐酸反应
4、与碱(NaOH、Ca(OH)2溶液)反应
5、与可溶性钙盐(CaCl2溶液)反应
物理性质
化学性质
回顾碳酸钠及碳酸氢钠的性质,思考下列混合物除杂的方法和所需试剂
混合物(括号内的为杂质) 除杂方法或试剂
Na2CO3 固体(NaHCO3)
Na2CO3 溶液(NaHCO3)
NaHCO3 固体(Na2CO3)
NaHCO3 溶液(Na2CO3)
加热至恒重
加入适量的NaOH溶液
溶于水后通入足量CO2,再蒸发结晶
通入足量CO2气体
微项目 探秘膨松剂
第1章 认识化学科学
1.了解膨松剂的定义及其分类。
2.掌握碳酸氢钠的物理性质、主要化学性质。
什么是膨松剂?
(1)概念
膨松剂是在食品加工过程中加入的,能使面胚发起形成多孔组织,从而使食品具有柔软或蓬松特点的一类物质。
(2)分类
(3)化学膨松剂中基本上都含有一种化学物质 —— 碳酸氢钠 NaHCO3 。
膨松剂及其类别
膨松剂
生物膨松剂(酵头)
化学膨松剂
单一膨松剂
复合膨松剂
一、探究碳酸氢钠用作膨松剂的作用原理
推测的具体依据 推测的碳酸氢钠的作用原理
碳酸氢钠可单独作为蒸馒头膨松剂
碳酸氢钠受热分解产生CO2气体
加入食醋后蓬松效果更好
碳酸氢钠与酸反应生成CO2气体
请同学们仔细阅读课本P34-35相关填写下表:
补充实验:取出剩余的白色固体中加入盐酸,用澄清石灰水检验产生的气体 现象:澄清石灰水变浑浊
实验方案 实验现象 结论或有关反应的化学方程式
试管口附近有较多的水珠,生成的气体使澄清石灰水变浑浊
思考:管内剩余白色固体是什么?
Na2CO3+CO2↑+H2O
思考:能不能在面团里直接加入纯碱做膨松剂?为什么?
但Na2CO3受热难以分解,加之碱性较强,因而不能单独用作膨松剂
二、设计并使用复合膨松剂
资料:厨房常用作添加到食品中的酸,比如白醋、柠檬酸。
1、白醋是烹调的酸味辅料,含3%~5%醋酸和水。其中醋酸是有机酸,分子式C2H4O2,无色液体,1mol醋酸能和1mol碳酸氢钠反应生成醋酸钠、水、二氧化碳。
2、柠檬酸常用作食品添加剂,是一种重要的有机酸,分子式为C6H8O7,无色晶体,易溶于水,1mol柠檬酸与3mol碳酸氢钠恰好反应,生成柠檬酸钠、水和二氧化碳。
碳酸盐:
碳酸氢钠、碳酸钙
酸性物质:
焦磷酸二氢二钠、
磷酸二氢钙、
酒石酸氢钾
反应产生二氧化碳,提升膨松效果。
助剂:
淀粉
防止膨松剂吸潮结块而失效,也具有调节气体产生速率,使气体均匀产生。
碳酸钠和碳酸氢钠
Na2CO3白色粉末
NaHCO3白色细小晶体
苏打、纯碱
小苏打
实验步骤 Na2CO3 NaHCO3
①观察两支试管中碳酸钠、碳酸氢钠的形态 _________ 细小的白色晶体
②加几滴水并将温度计伸入其中 加水后_____________,温度计示数_____ 加水后_____溶解,温度计示数_____
③加5 mL水 振荡一段时间后可溶解 固体量减少
④加1~2滴酚酞 溶液_____,溶液碱性较强 溶液_______,溶液碱性较弱
白色粉末
结块变成晶体
升高
部分
降低
变红
变浅红
初步结论 碳酸钠、碳酸氢钠均___溶于水,在水中的溶解度:________
>________,Na2CO3溶于水___热,NaHCO3溶于水___热,水溶液均显___性,碱性:________>________
易
Na2CO3
NaHCO3
放
吸
碱
Na2CO3
NaHCO3
鉴别碳酸钠和碳酸氢钠常用方法:加热
物质 装置图 现象或说明
Na2CO3
NaHCO3
注意:验证NaHCO3和Na2CO3热稳定性时,必须在小试管中装入
NaHCO3,大试管中装入Na2CO3。
无明显现象
生成能使澄清石灰水变浑浊的气体
鉴别碳酸钠和碳酸氢钠常用方法:与少量的稀盐酸反应
现象 化学方程式
N
NaHCO3 + HCl = NaCl + H2O + CO2↑
反应剧烈,立即有气泡产生
Na2CO3 + HCl = NaHCO3 + NaCl
Na2CO3
NaHCO3
无气泡产生
思考:有两瓶无色溶液HCl和Na2CO3,不使用任何其它的试剂,如何利用化学性质区分出二者?
盐酸逐滴加入碳酸钠溶液中
CO3 2 - + 2H+ = H2O + CO2↑
CO3 2 - + H+ = HCO3 -
HCO3 - + H+ = H2O + CO2↑
碳酸钠溶液逐滴加入盐酸中
现象:开始无明显现象,逐渐出现气泡。
现象:立刻出现气泡。
互滴法
鉴别碳酸钠和碳酸氢钠常用方法:与碱溶液反应
(1)与氢氧化钠反应:
①Na2CO3与NaOH不反应
②NaHCO3与NaOH反应
化学方程式:NaHCO3+NaOH = Na2CO3 + H2O
离子方程式:HCO3- + OH- = CO32- + H2O
(2)与氢氧化钙反应:
①Na2CO3与Ca(OH)2反应
化学方程式:Na2CO3+Ca(OH)2 = CaCO3 ↓+ 2NaOH
②NaHCO3与Ca(OH)2反应
化学方程式:2NaHCO3+Ca(OH)2(少量) = CaCO3 ↓+ Na2CO3 +2 H2O
化学方程式:NaHCO3+Ca(OH)2(过量) =CaCO3 ↓+ NaOH + H2O
Ca(OH)2溶液的量不同,反应产物不同
鉴别碳酸钠和碳酸氢钠常用方法:与可溶性钙盐溶液反应
与CaCl2(或BaCl2)反应:
①Na2CO3与CaCl2(或BaCl2)反应
化学方程式:Na2CO3+CaCl2 = CaCO3 ↓+ 2NaCl
离子方程式:CO32- + Ca2+= CaCO3 ↓
②NaHCO3与CaCl2(或BaCl2)不反应
碳酸钠和碳酸氢钠相互转化
Na2CO3 NaHCO3
①通CO2:Na2CO3 + CO2 + H2O = 2 NaHCO3↓
②加适量盐酸:Na2CO3 + HCl = NaHCO3 + NaCl
NaHCO3 Na2CO3
②加适量NaOH溶液:NaHCO3 + NaOH = Na2CO3 + H2O
①直接加热:2NaHCO3 == Na2CO3 + CO2↑ + H2O
△
制玻璃
制肥皂
造纸
纺织
发酵剂
灭火剂
Na2CO3
NaHCO3
制胃药
Na2CO3和NaHCO3的性质
外观、水溶性
1、水溶液的碱性比较
2、热稳定性比较
3、与足量或少量的稀盐酸反应
4、与碱(NaOH、Ca(OH)2溶液)反应
5、与可溶性钙盐(CaCl2溶液)反应
物理性质
化学性质
回顾碳酸钠及碳酸氢钠的性质,思考下列混合物除杂的方法和所需试剂
混合物(括号内的为杂质) 除杂方法或试剂
Na2CO3 固体(NaHCO3)
Na2CO3 溶液(NaHCO3)
NaHCO3 固体(Na2CO3)
NaHCO3 溶液(Na2CO3)
加热至恒重
加入适量的NaOH溶液
溶于水后通入足量CO2,再蒸发结晶
通入足量CO2气体
