1.1.2 物质的转化和化学反应的分类 课件(共20张ppt) 2024-2025学年高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 1.1.2 物质的转化和化学反应的分类 课件(共20张ppt) 2024-2025学年高一化学苏教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 13:13:19 | ||
图片预览




文档简介
(共20张PPT)
一、物质的转化
木炭在氧气中燃烧
铁丝在氧气中燃烧
硫在氧气中燃烧
知识回顾
知识回顾
单质
氧气
氧化物
有何共性
交流讨论--P5
不同类别的物质在一定条件下通过化学反应相互转化。探索物质的转化规律,可以帮助人们制备更多生产、生活需要的物质。
请用碳、钙的单质和化合物为例,写出需要的化学方程式(注明反应条件)。
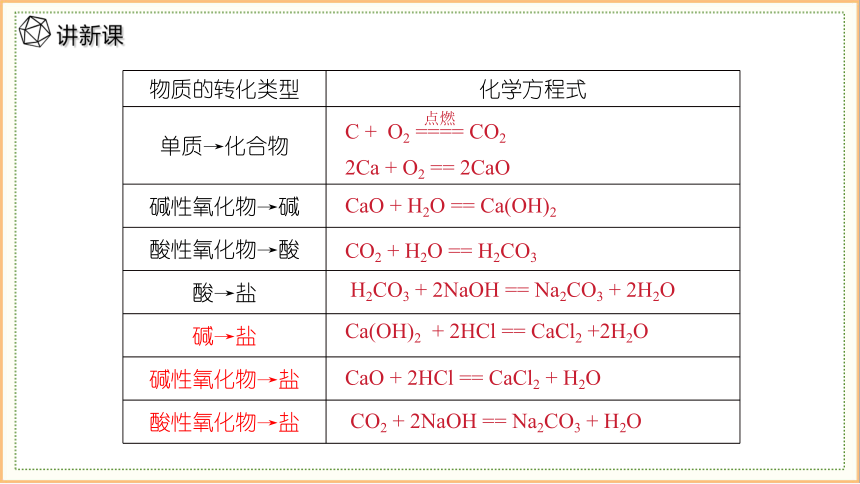
物质的转化类型 化学方程式
单质→化合物
碱性氧化物→碱
酸性氧化物→酸
酸→盐
碱→盐
碱性氧化物→盐
酸性氧化物→盐
C + O2 ==== CO2
点燃
2Ca + O2 == 2CaO
CaO + H2O == Ca(OH)2
CO2 + H2O == H2CO3
H2CO3 + 2NaOH == Na2CO3 + 2H2O
Ca(OH)2 + 2HCl == CaCl2 +2H2O
CaO + 2HCl == CaCl2 + H2O
CO2 + 2NaOH == Na2CO3 + H2O
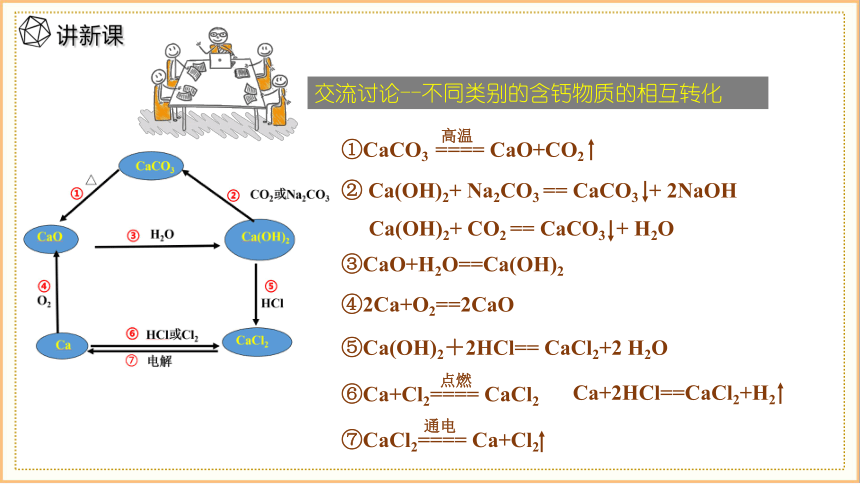
交流讨论--不同类别的含钙物质的相互转化
①CaCO3 ==== CaO+CO2
高温
② Ca(OH)2+ Na2CO3 == CaCO3 + 2NaOH
Ca(OH)2+ CO2 == CaCO3 + H2O
③CaO+H2O==Ca(OH)2
④2Ca+O2==2CaO
⑤Ca(OH)2+2HCl== CaCl2+2 H2O
⑥Ca+Cl2==== CaCl2
点燃
Ca+2HCl==CaCl2+H2
⑦CaCl2==== Ca+Cl2
通电
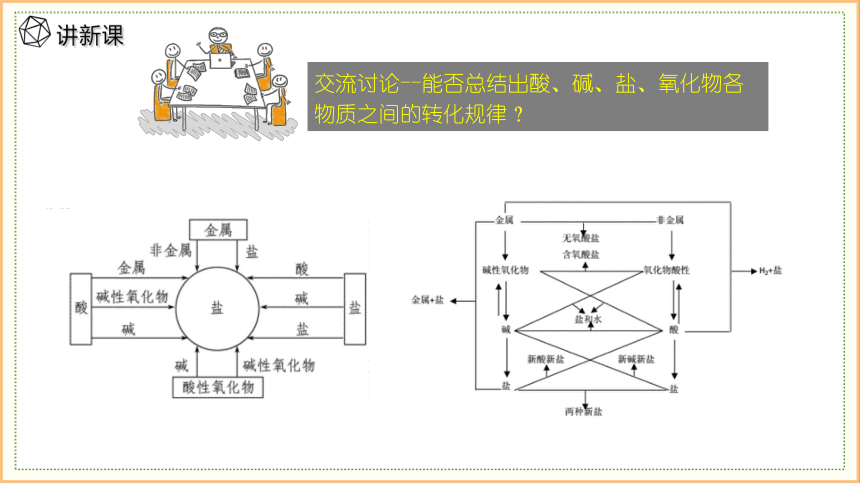
交流讨论--能否总结出酸、碱、盐、氧化物各物质之间的转化规律?
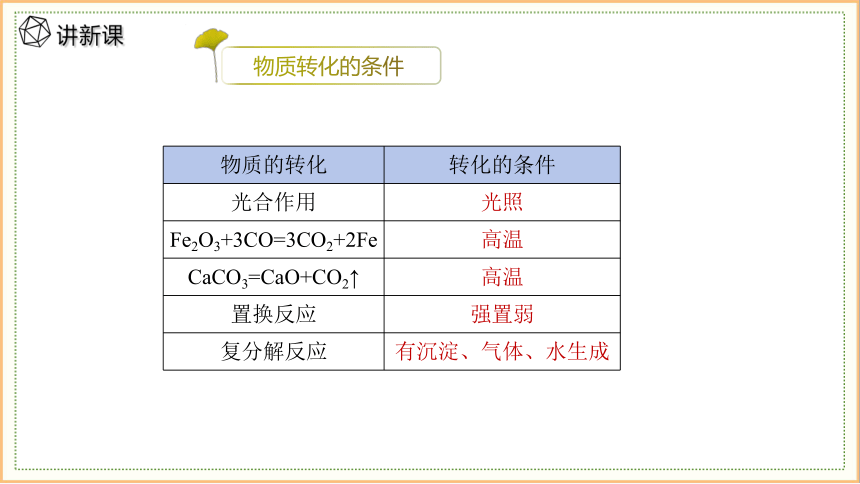
物质的转化 转化的条件
光合作用 光照
Fe2O3+3CO=3CO2+2Fe 高温
CaCO3=CaO+CO2↑ 高温
置换反应 强置弱
复分解反应 有沉淀、气体、水生成
物质转化的条件
人类首次将无机化合物转化为有机化合物
历史上人们一度认为,有机化合物只能由生物的细胞在一种特殊力量——生命力的作用下产生,人工合成有机物是不可能的。1828年,德国化学家维勒通过蒸发氰酸铵(NH4CNO)一种无机化合物,可由氯化铵和氰酸银反应制得)水溶液得到了尿素[CO(NH2)2]。尿素的合成揭开了人工合成有机化合物的序幕。
尿素的分子结构
科学史话
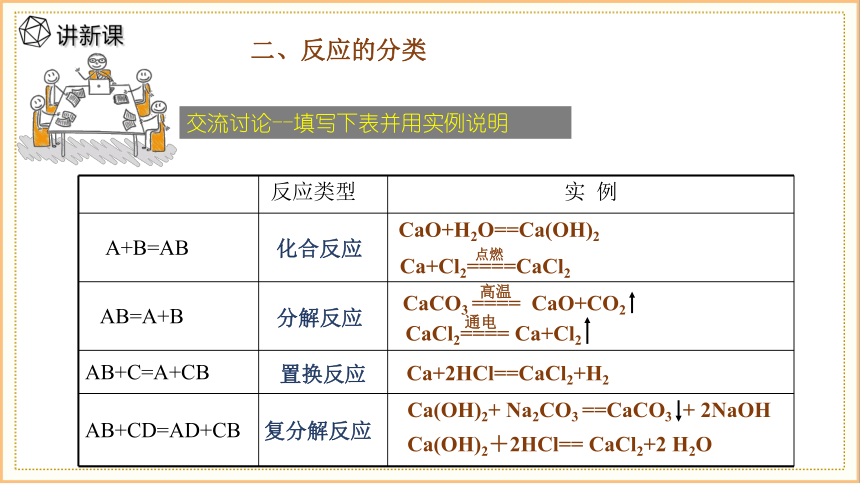
反应类型 实 例
A+B=AB
AB=A+B
AB+C=A+CB
AB+CD=AD+CB
化合反应
分解反应
复分解反应
置换反应
CaO+H2O==Ca(OH)2
Ca+Cl2====CaCl2
点燃
CaCO3 ==== CaO+CO2
高温
CaCl2==== Ca+Cl2
通电
Ca+2HCl==CaCl2+H2
Ca(OH)2+ Na2CO3 ==CaCO3 + 2NaOH
Ca(OH)2+2HCl== CaCl2+2 H2O
二、反应的分类
交流讨论--填写下表并用实例说明
一氧化碳与氧化铁的反应:
属于四大基本反应的哪一类呢?
四种基本反应类型不能包括所有反应!
氧化还原反应
从反应中是否有化合价升降分
非氧化还原反应
有元素化合价变化的化学反应
氧化还原反应
没有任何元素化合价变化的化学反应
看各元素的化合价是否发生变化
判断方法
【练一练】下列反应中,哪些是氧化还原反应?
√
√
四种基本反应与氧化还原反应的关系
反应类型 实 例 化合价是否变化
化合反应
分解反应
复分解反应
置换反应
CaO+H2O==Ca(OH)2
Ca+Cl2====CaCl2
点燃
CaCO3 ==== CaO+CO2
高温
CaCl2==== Ca+Cl2
通电
Ca+2HCl==CaCl2+H2
Ca(OH)2+ Na2CO3 ==CaCO3 + 2NaOH
Ca(OH)2+2HCl== CaCl2+2 H2O
不一定
不一定
一定变
一定不变
氧化还原反应与四种基本反应类型之间的关系
B.没有单质参加的化合反应一定不是氧化还原反应
不正确,例: Na2O2 + SO2 = Na2SO4
C.有单质生成的分解反应一定是氧化还原反应
不正确,例: 2FeSO4 = Fe2O3+SO2↑+SO3↑
E.有单质参加或生成的反应一定是氧化还原反应
不正确,例:4P(红磷) = P4 (白磷)
A.有单质参加的化合反应一定是氧化还原反应
D.没有单质生成的分解反应一定不是氧化还原反应
正确
正确
判断下列说法是否正确?
1、对于下列反应的反应类型的判断不正确的是( )
A.CO2+H2O===H2CO3 化合反应;非氧化还原反应
B.Cu2(OH)2CO3 2CuO+CO2↑+H2O 分解反应;非氧化还原反应
C.CuO+CO Cu+CO2 置换反应;氧化还原反应
D.MgCO3+H2SO4===MgSO4+CO2↑+H2O 复分解反应;非氧化还原反应
C
2.下列反应既是化合反应又是氧化还原反应的是( )
A.2CO+O2 2CO2
B.CaO+H2O===Ca(OH)2
C.C+H2O(g) CO+H2
D.CO2+Ca(OH)2===CaCO3↓+H2O
A
3.铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是( )
A.复分解反应、复分解反应、化合反应、置换反应
B.中和反应、置换反应、复分解反应、置换反应
C.复分解反应、复分解反应、置换反应、置换反应
D.分解反应、复分解反应、置换反应、置换反应
C
4.如图所示的微观变化,其基本反应类型是( )
A.化合反应
B.置换反应
C.分解反应
D.复分解反应
B
① ;
② ;
③ ;
④ ;
⑤ ;
⑥ ;
⑦ 。
5.选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转化用化学方程式表示(所写化学方程式不得重复)。
CO2+H2O===H2CO3
CO2+Ca(OH)2===CaCO3↓+H2O
Fe+2HCl===FeCl2+H2↑
CaO+2HCl===CaCl2+H2O
Ca(OH)2+2HCl===CaCl2+2H2O
CaO+H2O===Ca(OH)2
C+O2====CO2
点燃
一、物质的转化
木炭在氧气中燃烧
铁丝在氧气中燃烧
硫在氧气中燃烧
知识回顾
知识回顾
单质
氧气
氧化物
有何共性
交流讨论--P5
不同类别的物质在一定条件下通过化学反应相互转化。探索物质的转化规律,可以帮助人们制备更多生产、生活需要的物质。
请用碳、钙的单质和化合物为例,写出需要的化学方程式(注明反应条件)。
物质的转化类型 化学方程式
单质→化合物
碱性氧化物→碱
酸性氧化物→酸
酸→盐
碱→盐
碱性氧化物→盐
酸性氧化物→盐
C + O2 ==== CO2
点燃
2Ca + O2 == 2CaO
CaO + H2O == Ca(OH)2
CO2 + H2O == H2CO3
H2CO3 + 2NaOH == Na2CO3 + 2H2O
Ca(OH)2 + 2HCl == CaCl2 +2H2O
CaO + 2HCl == CaCl2 + H2O
CO2 + 2NaOH == Na2CO3 + H2O
交流讨论--不同类别的含钙物质的相互转化
①CaCO3 ==== CaO+CO2
高温
② Ca(OH)2+ Na2CO3 == CaCO3 + 2NaOH
Ca(OH)2+ CO2 == CaCO3 + H2O
③CaO+H2O==Ca(OH)2
④2Ca+O2==2CaO
⑤Ca(OH)2+2HCl== CaCl2+2 H2O
⑥Ca+Cl2==== CaCl2
点燃
Ca+2HCl==CaCl2+H2
⑦CaCl2==== Ca+Cl2
通电
交流讨论--能否总结出酸、碱、盐、氧化物各物质之间的转化规律?
物质的转化 转化的条件
光合作用 光照
Fe2O3+3CO=3CO2+2Fe 高温
CaCO3=CaO+CO2↑ 高温
置换反应 强置弱
复分解反应 有沉淀、气体、水生成
物质转化的条件
人类首次将无机化合物转化为有机化合物
历史上人们一度认为,有机化合物只能由生物的细胞在一种特殊力量——生命力的作用下产生,人工合成有机物是不可能的。1828年,德国化学家维勒通过蒸发氰酸铵(NH4CNO)一种无机化合物,可由氯化铵和氰酸银反应制得)水溶液得到了尿素[CO(NH2)2]。尿素的合成揭开了人工合成有机化合物的序幕。
尿素的分子结构
科学史话
反应类型 实 例
A+B=AB
AB=A+B
AB+C=A+CB
AB+CD=AD+CB
化合反应
分解反应
复分解反应
置换反应
CaO+H2O==Ca(OH)2
Ca+Cl2====CaCl2
点燃
CaCO3 ==== CaO+CO2
高温
CaCl2==== Ca+Cl2
通电
Ca+2HCl==CaCl2+H2
Ca(OH)2+ Na2CO3 ==CaCO3 + 2NaOH
Ca(OH)2+2HCl== CaCl2+2 H2O
二、反应的分类
交流讨论--填写下表并用实例说明
一氧化碳与氧化铁的反应:
属于四大基本反应的哪一类呢?
四种基本反应类型不能包括所有反应!
氧化还原反应
从反应中是否有化合价升降分
非氧化还原反应
有元素化合价变化的化学反应
氧化还原反应
没有任何元素化合价变化的化学反应
看各元素的化合价是否发生变化
判断方法
【练一练】下列反应中,哪些是氧化还原反应?
√
√
四种基本反应与氧化还原反应的关系
反应类型 实 例 化合价是否变化
化合反应
分解反应
复分解反应
置换反应
CaO+H2O==Ca(OH)2
Ca+Cl2====CaCl2
点燃
CaCO3 ==== CaO+CO2
高温
CaCl2==== Ca+Cl2
通电
Ca+2HCl==CaCl2+H2
Ca(OH)2+ Na2CO3 ==CaCO3 + 2NaOH
Ca(OH)2+2HCl== CaCl2+2 H2O
不一定
不一定
一定变
一定不变
氧化还原反应与四种基本反应类型之间的关系
B.没有单质参加的化合反应一定不是氧化还原反应
不正确,例: Na2O2 + SO2 = Na2SO4
C.有单质生成的分解反应一定是氧化还原反应
不正确,例: 2FeSO4 = Fe2O3+SO2↑+SO3↑
E.有单质参加或生成的反应一定是氧化还原反应
不正确,例:4P(红磷) = P4 (白磷)
A.有单质参加的化合反应一定是氧化还原反应
D.没有单质生成的分解反应一定不是氧化还原反应
正确
正确
判断下列说法是否正确?
1、对于下列反应的反应类型的判断不正确的是( )
A.CO2+H2O===H2CO3 化合反应;非氧化还原反应
B.Cu2(OH)2CO3 2CuO+CO2↑+H2O 分解反应;非氧化还原反应
C.CuO+CO Cu+CO2 置换反应;氧化还原反应
D.MgCO3+H2SO4===MgSO4+CO2↑+H2O 复分解反应;非氧化还原反应
C
2.下列反应既是化合反应又是氧化还原反应的是( )
A.2CO+O2 2CO2
B.CaO+H2O===Ca(OH)2
C.C+H2O(g) CO+H2
D.CO2+Ca(OH)2===CaCO3↓+H2O
A
3.铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是( )
A.复分解反应、复分解反应、化合反应、置换反应
B.中和反应、置换反应、复分解反应、置换反应
C.复分解反应、复分解反应、置换反应、置换反应
D.分解反应、复分解反应、置换反应、置换反应
C
4.如图所示的微观变化,其基本反应类型是( )
A.化合反应
B.置换反应
C.分解反应
D.复分解反应
B
① ;
② ;
③ ;
④ ;
⑤ ;
⑥ ;
⑦ 。
5.选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转化用化学方程式表示(所写化学方程式不得重复)。
CO2+H2O===H2CO3
CO2+Ca(OH)2===CaCO3↓+H2O
Fe+2HCl===FeCl2+H2↑
CaO+2HCl===CaCl2+H2O
Ca(OH)2+2HCl===CaCl2+2H2O
CaO+H2O===Ca(OH)2
C+O2====CO2
点燃
