1.1.2 物质的转化和化学反应的分类 课件(共26张ppt) 2024-2025学年高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 1.1.2 物质的转化和化学反应的分类 课件(共26张ppt) 2024-2025学年高一化学苏教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 13:15:38 | ||
图片预览







文档简介
(共26张PPT)
1.能从元素和原子、分子水平认识物质间的相互转化。
2.能从不同角度对化学反应进行分类。
3.认识无机物和有机物之间的相互转化,能依据实际条件并运用化学知识和方法解决生产、生活中简单的问题。
亚硫酸钠,是一种无机物,化学式Na2SO3,是钠的亚硫酸盐,主要用作人造纤维稳定剂、织物漂白剂、照相显影剂、染漂脱氧剂、香料和染料还原剂、造纸木质素脱除剂等。但亚硫酸钠在空气中容易被氧化,因此自然界几乎不能稳定存在,只能通过制备来获得。
资料在线
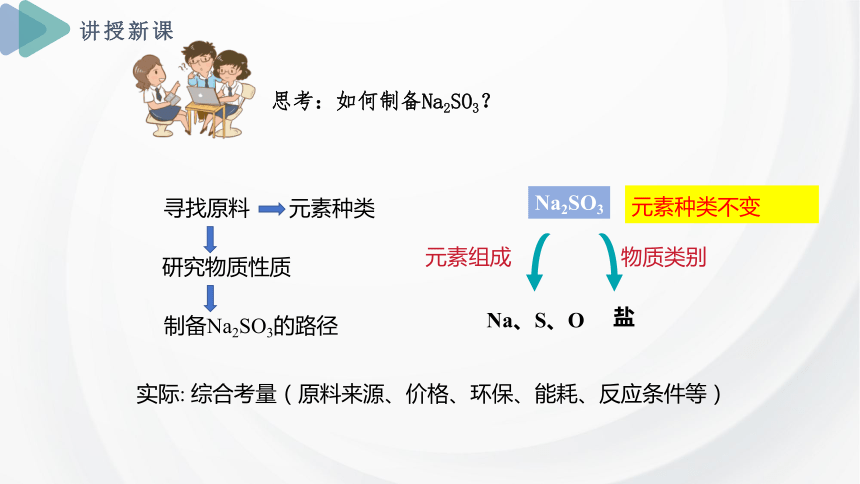
思考:如何制备Na2SO3?
寻找原料
研究物质性质
制备Na2SO3的路径
元素种类
实际: 综合考量(原料来源、价格、环保、能耗、反应条件等)
Na2SO3
元素组成
Na、S、O
元素种类不变
物质类别
盐
探究一:寻找原料
①根据物质的根据物质的组成和性质分类研究
(1)非金属单质:
(2)金属单质:
(3)氧化物:
S、O2
Na
H2SO3
K2SO4
NaCl
S
NaO
O2
SO2
NaOH
SO3
H2SO4
K2SO3
Na
Na2CO3
SO2
SO3
Na2O
(4)酸:
(5)碱:
(6)盐:
H2SO3
H2SO4
NaOH
K2SO4
K2SO3
Na2CO3
分析物质组成
确定物质类别
预测物质性质
确认物质性质
依据类别共性
类比典型代表物
实验验证
②基于物质类别研究物质性质的认知模型
回忆初中金属的性质
①在金属活动性顺序表中,金属Na排在氢前。
②铁与酸反应时,生成+2价的铁的化合物。
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
金属单质Na
金属 + 氧气 → 金属氧化物
金属 + 酸 → 盐 + 氢气
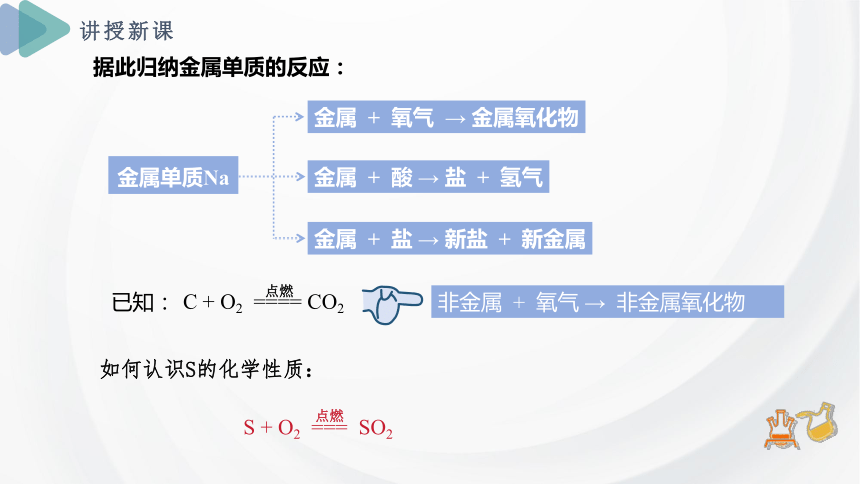
金属 + 盐 → 新盐 + 新金属
据此归纳金属单质的反应:
已知:
C + O2 ==== CO2
非金属 + 氧气 → 非金属氧化物
如何认识S的化学性质:
S + O2 === SO2
点燃
点燃
酸性氧化物SO2
酸性氧化物 + 水 → 酸
酸性氧化物 + 碱 → 盐 + 水
碱性氧化物 + 水 → 碱
碱性氧化物 + 酸 → 盐 + 水
碱性氧化物Na2O
酸性氧化物 + 碱性氧化物 → 盐
复习旧知
酸
H2CO3
H2SO4
酸碱指示剂(紫色石蕊试液)
盐(AgNO3)
碱(NaOH)
碱性氧化物(CaO)
活泼金属(Fe)
变红
盐+ H2↑
盐+ H2O
新盐+ 新酸
盐+ H2O
碱
NaOH
酸碱指示剂
盐(MgCl2)
酸性氧化物(CO2)
酸 (HCl)
变红
盐+ H2O
新盐+ 新碱
盐+ H2O
紫色石蕊试液
酚酞试液
变蓝
盐
Na2CO3
K2SO4
K2SO3
盐 (BaCl2)
碱 Ba (OH)2
新盐+ 新酸
新盐+ 新盐
新盐+ 新碱
金属单质
新盐+ 新金属
酸 HCl
互换成分的复分解反应:沉淀、气体、水
含钠物质
Na
Na2O
NaOH
Na2CO3
单质
碱性氧化物
碱
盐
含硫物质
S
SO2,SO3
H2SO3,H2SO4
K2SO3,K2SO4
单质
酸性氧化物
酸
盐
探究一:寻找原料
H2SO3
K2SO4
NaCl
S
NaO
O2
SO2
NaOH
SO3
H2SO4
K2SO3
Na
Na2CO3
不同类别物质之间的反应和转化关系图
金属单质
碱性氧化物
碱
盐
非金属单质
酸性氧化物
酸
盐
盐
盐+水
盐+碱
盐+酸
盐+盐
金属+盐
盐+氢气
运用“各类物质关系图”设计以Na为原料制备Na2SO3的转化路径图
Na
Na2O2
NaOH
盐
S
SO2
H2SO3
盐
盐
盐+水
盐+碱
盐+酸
盐+盐
金属+盐
盐+氢气
物质制备的一般思路
原料
元素组成
物质类别
产物
元素组成
物质类别
元素种类不变
反应规律
核心元素传递
物质类别的转化
实际: 综合考量(原料来源、价格、环保、能耗、反应条件等)
以碳、钙的单质和化合物为例,写出所列的化学方程式
物质的转化反应 实例(化学方程式)
单质→化合物
碱性氧化物→碱
酸性氧化物→酸
酸→盐
酸性氧化物→盐
2Ca+O2=2CaO
C+O2==== CO2
CaO+H2O=Ca(OH)2
CO2+H2O=H2CO3
H2CO3+Ca(OH)2=CaCO3↓+2H2O
CO2+Ca(OH)2=CaCO3↓+H2O
物质的转化需要一定的条件
点燃
【科学史话】
1828年,德国化学家维勒通过蒸发氰酸铵(NH4CNO,一种无机化合物,可由氯化铵和氰酸银反应制得)水溶液得到了尿素[CO(NH2) 2]。
尿素的合成揭开 了人工合成有机化合物的序幕。
无机物
有机物
反应类型 实例
A+B=AB
AB=A+B
AB+C=A+CB
AB+CD=AD+CB
置换反应
分解反应
化合反应
复分解反应
CaO+H2O=Ca(OH)2
CaCO3=CaO+CO2↑
Fe+CuCl2=Cu+FeCl2
H2SO4+2NaOH=Na2SO4+2H2O
写出下俩反应类型的实例
1774年,法国化学家拉瓦锡提出燃烧的氧化学说后,人们把物质与氧结合的反应叫氧化反应;把氧化物失去氧的反应叫还原反应。
探究二:认识氧化还原反应的特征。
根据初中学过的氧化反应和还原反应的知识,分析以下反应,判断反应类型。
Cu + O2 = 2CuO
2CuO + C = 2Cu + CO2↑
氧化反应
还原反应
Cu + O2 = 2CuO
2CuO + C = 2Cu + CO2↑
氧化反应
还原反应
Cu
CuO
O2
氧化
还原
C
氧化
还原
CO2
氧化反应和还原反应是同时发生的,这样的反应称为氧化还原反应。
请观察下列反应中铜元素的变化,寻找氧化还原反应的特征。
Cu + O2 = 2CuO
2CuO + C = 2Cu + CO2↑
Fe + CuSO4 = FeSO4 + Cu
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
氧化还原反应
非氧化还原反应
氧化还原反应元素化合价有升有降。
元素化合价升高总数与降低总数相等。
氧化还原反应中有的元素化合价可能不变。
小结:
氧化还原反应的重要特征是反应前后有化合价的变化。
化学反应
有无化合价变化
有
氧化还原反应
非氧化还原反应
无
氧化还原反应
置换反应
化合反应
分解反应
复分解反应
氧化还原反应和四大基本反应类型的关系
思考:有单质参加和生成的反应肯定是氧化还原反应吗?
不一定!
如:O2→O3、金刚石→石墨
1、根据反应物和生成物类别和数量
化合反应
分解反应
置换反应
复分解反应
2、根据反应过程中元素化合价是否发生变化
氧化还原反应
非氧化还原反应
3.四种基本类型的反应与氧化还原反应的关系
1.下列反应方程式中有一个与其他三个在分类上不同,这个反应方程式是( )
A.3Fe+2O2=Fe3O4 B.CO2+C=2CO
C.NH4HS=NH3+H2S D.Na2CO3+CO2+H2O=2NaHCO3
C
2.下列反应中,属于氧化还原反应的是( )
A. CaCO3+2HCl=CaCl2+CO2 +H2O
B. CaO+H2O=Ca(OH)2
C. 2KMnO4=K2MnO4 +MnO2 +3O2
D. CaCO3=CaO + CO2
E. N2 + 3H2 =2NH3
F. 6NO + 4NH3 =5N2 + 6H2O
C E F
1.能从元素和原子、分子水平认识物质间的相互转化。
2.能从不同角度对化学反应进行分类。
3.认识无机物和有机物之间的相互转化,能依据实际条件并运用化学知识和方法解决生产、生活中简单的问题。
亚硫酸钠,是一种无机物,化学式Na2SO3,是钠的亚硫酸盐,主要用作人造纤维稳定剂、织物漂白剂、照相显影剂、染漂脱氧剂、香料和染料还原剂、造纸木质素脱除剂等。但亚硫酸钠在空气中容易被氧化,因此自然界几乎不能稳定存在,只能通过制备来获得。
资料在线
思考:如何制备Na2SO3?
寻找原料
研究物质性质
制备Na2SO3的路径
元素种类
实际: 综合考量(原料来源、价格、环保、能耗、反应条件等)
Na2SO3
元素组成
Na、S、O
元素种类不变
物质类别
盐
探究一:寻找原料
①根据物质的根据物质的组成和性质分类研究
(1)非金属单质:
(2)金属单质:
(3)氧化物:
S、O2
Na
H2SO3
K2SO4
NaCl
S
NaO
O2
SO2
NaOH
SO3
H2SO4
K2SO3
Na
Na2CO3
SO2
SO3
Na2O
(4)酸:
(5)碱:
(6)盐:
H2SO3
H2SO4
NaOH
K2SO4
K2SO3
Na2CO3
分析物质组成
确定物质类别
预测物质性质
确认物质性质
依据类别共性
类比典型代表物
实验验证
②基于物质类别研究物质性质的认知模型
回忆初中金属的性质
①在金属活动性顺序表中,金属Na排在氢前。
②铁与酸反应时,生成+2价的铁的化合物。
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
金属单质Na
金属 + 氧气 → 金属氧化物
金属 + 酸 → 盐 + 氢气
金属 + 盐 → 新盐 + 新金属
据此归纳金属单质的反应:
已知:
C + O2 ==== CO2
非金属 + 氧气 → 非金属氧化物
如何认识S的化学性质:
S + O2 === SO2
点燃
点燃
酸性氧化物SO2
酸性氧化物 + 水 → 酸
酸性氧化物 + 碱 → 盐 + 水
碱性氧化物 + 水 → 碱
碱性氧化物 + 酸 → 盐 + 水
碱性氧化物Na2O
酸性氧化物 + 碱性氧化物 → 盐
复习旧知
酸
H2CO3
H2SO4
酸碱指示剂(紫色石蕊试液)
盐(AgNO3)
碱(NaOH)
碱性氧化物(CaO)
活泼金属(Fe)
变红
盐+ H2↑
盐+ H2O
新盐+ 新酸
盐+ H2O
碱
NaOH
酸碱指示剂
盐(MgCl2)
酸性氧化物(CO2)
酸 (HCl)
变红
盐+ H2O
新盐+ 新碱
盐+ H2O
紫色石蕊试液
酚酞试液
变蓝
盐
Na2CO3
K2SO4
K2SO3
盐 (BaCl2)
碱 Ba (OH)2
新盐+ 新酸
新盐+ 新盐
新盐+ 新碱
金属单质
新盐+ 新金属
酸 HCl
互换成分的复分解反应:沉淀、气体、水
含钠物质
Na
Na2O
NaOH
Na2CO3
单质
碱性氧化物
碱
盐
含硫物质
S
SO2,SO3
H2SO3,H2SO4
K2SO3,K2SO4
单质
酸性氧化物
酸
盐
探究一:寻找原料
H2SO3
K2SO4
NaCl
S
NaO
O2
SO2
NaOH
SO3
H2SO4
K2SO3
Na
Na2CO3
不同类别物质之间的反应和转化关系图
金属单质
碱性氧化物
碱
盐
非金属单质
酸性氧化物
酸
盐
盐
盐+水
盐+碱
盐+酸
盐+盐
金属+盐
盐+氢气
运用“各类物质关系图”设计以Na为原料制备Na2SO3的转化路径图
Na
Na2O2
NaOH
盐
S
SO2
H2SO3
盐
盐
盐+水
盐+碱
盐+酸
盐+盐
金属+盐
盐+氢气
物质制备的一般思路
原料
元素组成
物质类别
产物
元素组成
物质类别
元素种类不变
反应规律
核心元素传递
物质类别的转化
实际: 综合考量(原料来源、价格、环保、能耗、反应条件等)
以碳、钙的单质和化合物为例,写出所列的化学方程式
物质的转化反应 实例(化学方程式)
单质→化合物
碱性氧化物→碱
酸性氧化物→酸
酸→盐
酸性氧化物→盐
2Ca+O2=2CaO
C+O2==== CO2
CaO+H2O=Ca(OH)2
CO2+H2O=H2CO3
H2CO3+Ca(OH)2=CaCO3↓+2H2O
CO2+Ca(OH)2=CaCO3↓+H2O
物质的转化需要一定的条件
点燃
【科学史话】
1828年,德国化学家维勒通过蒸发氰酸铵(NH4CNO,一种无机化合物,可由氯化铵和氰酸银反应制得)水溶液得到了尿素[CO(NH2) 2]。
尿素的合成揭开 了人工合成有机化合物的序幕。
无机物
有机物
反应类型 实例
A+B=AB
AB=A+B
AB+C=A+CB
AB+CD=AD+CB
置换反应
分解反应
化合反应
复分解反应
CaO+H2O=Ca(OH)2
CaCO3=CaO+CO2↑
Fe+CuCl2=Cu+FeCl2
H2SO4+2NaOH=Na2SO4+2H2O
写出下俩反应类型的实例
1774年,法国化学家拉瓦锡提出燃烧的氧化学说后,人们把物质与氧结合的反应叫氧化反应;把氧化物失去氧的反应叫还原反应。
探究二:认识氧化还原反应的特征。
根据初中学过的氧化反应和还原反应的知识,分析以下反应,判断反应类型。
Cu + O2 = 2CuO
2CuO + C = 2Cu + CO2↑
氧化反应
还原反应
Cu + O2 = 2CuO
2CuO + C = 2Cu + CO2↑
氧化反应
还原反应
Cu
CuO
O2
氧化
还原
C
氧化
还原
CO2
氧化反应和还原反应是同时发生的,这样的反应称为氧化还原反应。
请观察下列反应中铜元素的变化,寻找氧化还原反应的特征。
Cu + O2 = 2CuO
2CuO + C = 2Cu + CO2↑
Fe + CuSO4 = FeSO4 + Cu
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
氧化还原反应
非氧化还原反应
氧化还原反应元素化合价有升有降。
元素化合价升高总数与降低总数相等。
氧化还原反应中有的元素化合价可能不变。
小结:
氧化还原反应的重要特征是反应前后有化合价的变化。
化学反应
有无化合价变化
有
氧化还原反应
非氧化还原反应
无
氧化还原反应
置换反应
化合反应
分解反应
复分解反应
氧化还原反应和四大基本反应类型的关系
思考:有单质参加和生成的反应肯定是氧化还原反应吗?
不一定!
如:O2→O3、金刚石→石墨
1、根据反应物和生成物类别和数量
化合反应
分解反应
置换反应
复分解反应
2、根据反应过程中元素化合价是否发生变化
氧化还原反应
非氧化还原反应
3.四种基本类型的反应与氧化还原反应的关系
1.下列反应方程式中有一个与其他三个在分类上不同,这个反应方程式是( )
A.3Fe+2O2=Fe3O4 B.CO2+C=2CO
C.NH4HS=NH3+H2S D.Na2CO3+CO2+H2O=2NaHCO3
C
2.下列反应中,属于氧化还原反应的是( )
A. CaCO3+2HCl=CaCl2+CO2 +H2O
B. CaO+H2O=Ca(OH)2
C. 2KMnO4=K2MnO4 +MnO2 +3O2
D. CaCO3=CaO + CO2
E. N2 + 3H2 =2NH3
F. 6NO + 4NH3 =5N2 + 6H2O
C E F
