1.2 课时2 气体摩尔体积((共33张PPT)) 课件 2024-2025学年高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 1.2 课时2 气体摩尔体积((共33张PPT)) 课件 2024-2025学年高一化学苏教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 13:17:53 | ||
图片预览









文档简介
(共33张PPT)
第二节 物质的化学计量
/ 课时2 气体摩尔体积 /
学习目标
1.知道固态、液态、气态物质体积的影响因素,进而理解气体摩尔体积的概念,养成宏观辨识与微观探析的学科素养。
2.会用气体摩尔体积进行物质的量与气体体积之间的转化计算。
3.了解阿伏加德罗定律及其推论,并能运用阿伏加德罗定律进行简单问题推导。
课堂导入
一个班在操场上列队的面积与什么有关?
学生人数
学生之间的距离
学生胖瘦
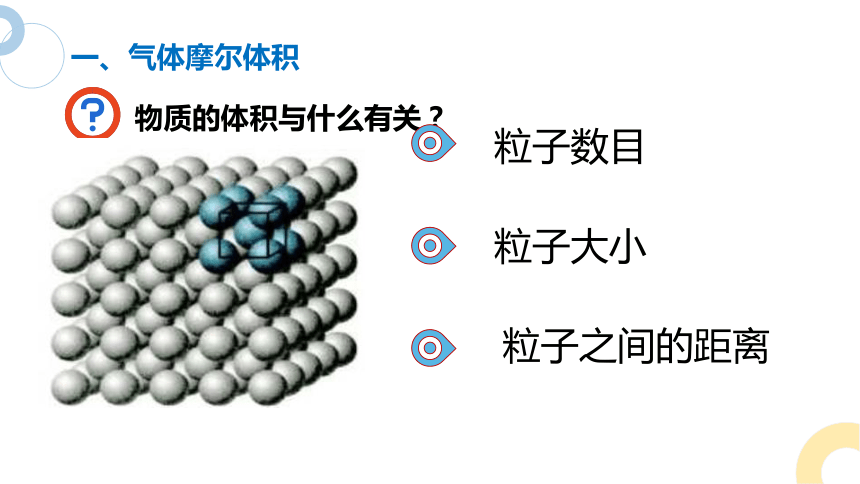
一、气体摩尔体积
物质的体积与什么有关?
粒子数目
粒子大小
粒子之间的距离
1.定义:是用来描述一定数目微观粒子的集合体的物理量。
3.单位:摩尔 ,符号:mol
2.符号:n
Amount of substance
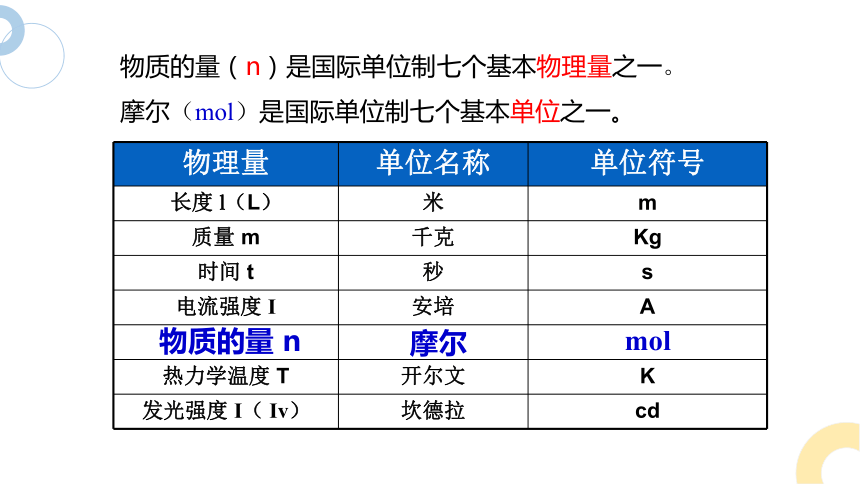
一、物质的量
物理量 单位名称 单位符号
长度 l(L) 米 m
质量 m 千克 Kg
时间 t 秒 s
电流强度 I 安培 A
热力学温度 T 开尔文 K
发光强度 I( Iv) 坎德拉 cd
物质的量 n
摩尔
mol
物质的量(n)是国际单位制七个基本物理量之一。
摩尔(mol)是国际单位制七个基本单位之一。
注意事项:
1.“物质的量(Amount of substance)”是一个物理量的全称,是一个专有名词;物质的量不能当成物质的数量或质量来理解。
2.物质的量只能用来描述微观粒子 ,像分子、离子、原子、质子、电子、中子之类,不能用来描述宏观物体。
注意事项:
3.用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。如:1 mol H、1 mol H+、1 mol H2 ,不能用 “1 mol 氢”这样含糊无意义的表示。
4.物质的量是一个巨大数量粒子的集合体,可以是整数,也可以是小数,如可以有0.5molO2、0.01molH2SO4等。
指出下列符号的含义
5 mol Cu
3 mol CO32-
4 mol H2O
4 mol水分子
5 mol铜原子
3 mol碳酸根离子
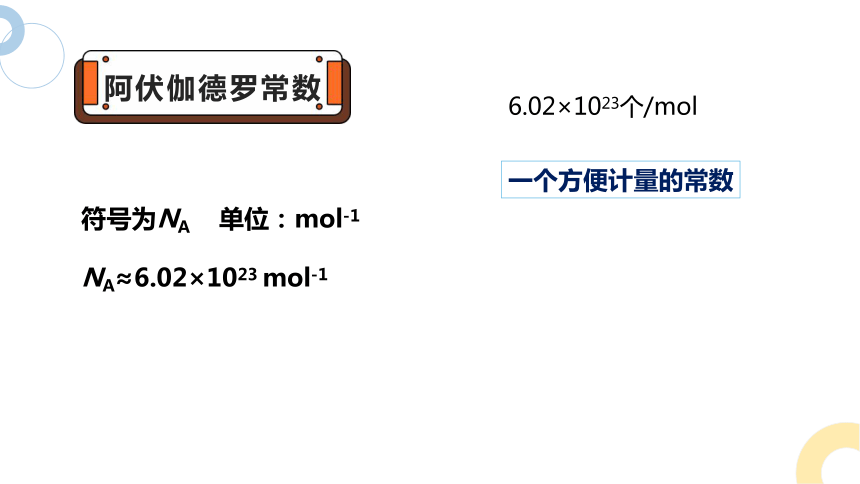
阿伏伽德罗常数
6.02×1023个/mol
一个方便计量的常数
符号为NA 单位:mol-1
NA≈6.02×1023 mol-1
阿伏伽德罗微微一笑
科学上把0.012kg12C所含原子数称为阿伏加德罗常数,作为衡量微粒的集合体(即1mol)。
12克碳原子所含有的个数=
12×10-3千克
1.992643×10-26千克
≈6.02×1023 个
阿伏加德罗常数是一个基准,即每mol物质所含微粒的数目约为6.02×1023 个,如筷子是每双为2根,鞋子每双为2只等。
1mol C 约有多少个碳原子?
1mol H2O约有多少个水分子?
1mol不同物质所含微粒的个数相同。
约为6.02×1023 个
n(物质的量)
N(粒子总数)
1mol H
NA个H
2mol H
2×NA个H
……
……
n mol H
n×NA个H
=
×
N
n
NA
微粒
1摩尔: 阿伏加德罗常数
物质的量
个数(N)
1堆的量(NA)
堆数(n)
掌握一个“分堆”的思想,即“化大为小”
本质
1molH2O含有 个水分子,或约 个水分子
NA
6.02× 1023
molH2O含有 个水分子,或约 个水分子
2NA
1.204× 1024
物质的量(n)、阿伏加德罗常数(NA)、微粒数(N)之间的关系:
N
NA
n
N
n
NA
N
n × NA
或
或
2
1、0.1molCH4中有 mol H;
1个CH4中有4个H→1mol CH4中有4mol H
→0.1mol CH4中有0.4mol H
2、含有0.12mol O的SO3的物质的量为 mol;
1个SO3中有3个O→1mol SO3中有3mol O
→0.04molSO3中有0.12mol O
3、0.2mol CuSO4·5H2O中含有 mol O
1个CuSO4·5H2O中含有9个O→1mol CuSO4·5H2O中含有9mol O→0.2mol CuSO4·5H2O中含有1.8 mol的O
课堂练习
2 : 1 : 2
2mol : 1mol : 2mol
(2 NA) : (NA) : ( 2NA)
2CO + O2 ==== 2CO2
分子个数比:
物质的量比:
扩大NA倍
化学反应方程式中,各物质的化学计量数之比等于其微粒数之比,等于其物质的量之比。
化学计量数比:
2 : 1 : 2
粒子 符号 物质的Ar或Mr 每个粒子的质量(g/个) 1mol物质含有的粒子数(个) 1mol物质质量(g)
C 12 1.993×10-23
Fe 56 9.302×10-23
6.02×1023
6.02×1023
12
56
结论:
二、摩尔质量
1mol任何原子的质量在数值上等于这种原子的相对原子质量。
粒子 符号 物质的Ar或Mr 每个粒子的质量(g/个) 1mol物质含有的粒子数(个) 1mol物质质量(g)
H2SO4 98 1.628×10-22
H2O 18 2.990×10-23
6.02×1023
6.02×1023
98
18
结论:
二、摩尔质量
1mol任何分子的质量在数值上等于这种分子的相对分子质量。
粒子 符号 物质的Ar或Mr 每个粒子的质量(g/个) 1mol物质含有的粒子数(个) 1mol物质质量(g)
Na+ 23 3.821×10-23
OH- 17 2.824×10-23
6.02×1023
6.02×1023
23
17
结论:
二、摩尔质量
1mol任何离子的质量在数值上等于这种离子的相对原子质量或相对分子质量。
1.定义:单位物质的量的物质所具有的质量。即每mol物质具有的质量。
3.单位:g/mol,g·mol-1
2.符号:M 。
当摩尔质量以“g·mol-1”为单位时,与相对原子(分子)质量在数值上相等。
二、摩尔质量
摩尔质量与相对分子质量(或相对原子质量)是否等同?
不等同。
摩尔质量与相对分子质量(或相对原子质量)是两个不同的概念。
当摩尔质量以“g·mol-1”为单位时,两者在数值上相等,但前者单位是g·mol-1,后者单位是1,故两者不等同。
①等值性:摩尔质量以g·mol-1作单位时,在数值上与其相对分子质量或相对原子质量相等。
②确定性:对于指定的物质来说,其摩尔质量的值是一个定值,不随物质的物质的量的多少而改变。
特性
18g·mol-1
n(物质的量)
m(物质质量)
1mol H2O
18g
2mol H2O
36g
……
……
n mol H2O
18ng
=
×
n
M
M(摩尔质量)
3mol H2O
54g
m
n
=
m
M
物质的量
(单位:mol)
物质质量
(单位:g)
摩尔质量
(单位:g/mol)
M
=
m
n
=
×
n
M
m
计算方法
例:已知氨气的相对分子质量为17,则氨气的摩尔质量为 。
17 g·mol-1
①已知任意状态物质的相对原子质量或分子质量时:
M=Ar或Mr 。
②已知任意状态物质的质量时: (定义式)。
M
=
m
n
例:(1) 24.5gH2SO4的物质的量是多少?
(2) 1.50molNa2CO3的质量是多少?
nH2SO4= =
mH2SO4
MH2SO4
24.5g
98g.mol-1
=0.25mol
mNa2CO3= =1.5mol×106g.mol-1 =159g
nNa2CO3 MNa2CO3
计算方法
例:已知一个铁原子的质量为b g,则铁的摩尔质量为 。
③已知一个分子的质量时:M=m(分子)×NA。
bNA g·mol-1
计算方法
=
N
NA
摩尔质量(M)与微粒总数(N)有什么计算关系?
n
=
m
M
g·mol-1
1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为 。
用NA代表阿伏加德罗常数的值,已知a g某气体中含分子数为b,则该气体的摩尔质量为 。
64 g·mol-1
b
aNA
课堂练习
课堂练习
已知1.505×1023个X气体分子的质量为8 g,则X气体的摩尔质量是( )
A.16 g B.32 g
C.64 g·mol-1 D.32 g·mol-1
D
课堂小结
物质的量
摩尔质量
不良反应
物质的量判断
阿伏伽德罗常数
相关计算
定义及判断
相关计算
第二节 物质的化学计量
/ 课时2 气体摩尔体积 /
学习目标
1.知道固态、液态、气态物质体积的影响因素,进而理解气体摩尔体积的概念,养成宏观辨识与微观探析的学科素养。
2.会用气体摩尔体积进行物质的量与气体体积之间的转化计算。
3.了解阿伏加德罗定律及其推论,并能运用阿伏加德罗定律进行简单问题推导。
课堂导入
一个班在操场上列队的面积与什么有关?
学生人数
学生之间的距离
学生胖瘦
一、气体摩尔体积
物质的体积与什么有关?
粒子数目
粒子大小
粒子之间的距离
1.定义:是用来描述一定数目微观粒子的集合体的物理量。
3.单位:摩尔 ,符号:mol
2.符号:n
Amount of substance
一、物质的量
物理量 单位名称 单位符号
长度 l(L) 米 m
质量 m 千克 Kg
时间 t 秒 s
电流强度 I 安培 A
热力学温度 T 开尔文 K
发光强度 I( Iv) 坎德拉 cd
物质的量 n
摩尔
mol
物质的量(n)是国际单位制七个基本物理量之一。
摩尔(mol)是国际单位制七个基本单位之一。
注意事项:
1.“物质的量(Amount of substance)”是一个物理量的全称,是一个专有名词;物质的量不能当成物质的数量或质量来理解。
2.物质的量只能用来描述微观粒子 ,像分子、离子、原子、质子、电子、中子之类,不能用来描述宏观物体。
注意事项:
3.用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。如:1 mol H、1 mol H+、1 mol H2 ,不能用 “1 mol 氢”这样含糊无意义的表示。
4.物质的量是一个巨大数量粒子的集合体,可以是整数,也可以是小数,如可以有0.5molO2、0.01molH2SO4等。
指出下列符号的含义
5 mol Cu
3 mol CO32-
4 mol H2O
4 mol水分子
5 mol铜原子
3 mol碳酸根离子
阿伏伽德罗常数
6.02×1023个/mol
一个方便计量的常数
符号为NA 单位:mol-1
NA≈6.02×1023 mol-1
阿伏伽德罗微微一笑
科学上把0.012kg12C所含原子数称为阿伏加德罗常数,作为衡量微粒的集合体(即1mol)。
12克碳原子所含有的个数=
12×10-3千克
1.992643×10-26千克
≈6.02×1023 个
阿伏加德罗常数是一个基准,即每mol物质所含微粒的数目约为6.02×1023 个,如筷子是每双为2根,鞋子每双为2只等。
1mol C 约有多少个碳原子?
1mol H2O约有多少个水分子?
1mol不同物质所含微粒的个数相同。
约为6.02×1023 个
n(物质的量)
N(粒子总数)
1mol H
NA个H
2mol H
2×NA个H
……
……
n mol H
n×NA个H
=
×
N
n
NA
微粒
1摩尔: 阿伏加德罗常数
物质的量
个数(N)
1堆的量(NA)
堆数(n)
掌握一个“分堆”的思想,即“化大为小”
本质
1molH2O含有 个水分子,或约 个水分子
NA
6.02× 1023
molH2O含有 个水分子,或约 个水分子
2NA
1.204× 1024
物质的量(n)、阿伏加德罗常数(NA)、微粒数(N)之间的关系:
N
NA
n
N
n
NA
N
n × NA
或
或
2
1、0.1molCH4中有 mol H;
1个CH4中有4个H→1mol CH4中有4mol H
→0.1mol CH4中有0.4mol H
2、含有0.12mol O的SO3的物质的量为 mol;
1个SO3中有3个O→1mol SO3中有3mol O
→0.04molSO3中有0.12mol O
3、0.2mol CuSO4·5H2O中含有 mol O
1个CuSO4·5H2O中含有9个O→1mol CuSO4·5H2O中含有9mol O→0.2mol CuSO4·5H2O中含有1.8 mol的O
课堂练习
2 : 1 : 2
2mol : 1mol : 2mol
(2 NA) : (NA) : ( 2NA)
2CO + O2 ==== 2CO2
分子个数比:
物质的量比:
扩大NA倍
化学反应方程式中,各物质的化学计量数之比等于其微粒数之比,等于其物质的量之比。
化学计量数比:
2 : 1 : 2
粒子 符号 物质的Ar或Mr 每个粒子的质量(g/个) 1mol物质含有的粒子数(个) 1mol物质质量(g)
C 12 1.993×10-23
Fe 56 9.302×10-23
6.02×1023
6.02×1023
12
56
结论:
二、摩尔质量
1mol任何原子的质量在数值上等于这种原子的相对原子质量。
粒子 符号 物质的Ar或Mr 每个粒子的质量(g/个) 1mol物质含有的粒子数(个) 1mol物质质量(g)
H2SO4 98 1.628×10-22
H2O 18 2.990×10-23
6.02×1023
6.02×1023
98
18
结论:
二、摩尔质量
1mol任何分子的质量在数值上等于这种分子的相对分子质量。
粒子 符号 物质的Ar或Mr 每个粒子的质量(g/个) 1mol物质含有的粒子数(个) 1mol物质质量(g)
Na+ 23 3.821×10-23
OH- 17 2.824×10-23
6.02×1023
6.02×1023
23
17
结论:
二、摩尔质量
1mol任何离子的质量在数值上等于这种离子的相对原子质量或相对分子质量。
1.定义:单位物质的量的物质所具有的质量。即每mol物质具有的质量。
3.单位:g/mol,g·mol-1
2.符号:M 。
当摩尔质量以“g·mol-1”为单位时,与相对原子(分子)质量在数值上相等。
二、摩尔质量
摩尔质量与相对分子质量(或相对原子质量)是否等同?
不等同。
摩尔质量与相对分子质量(或相对原子质量)是两个不同的概念。
当摩尔质量以“g·mol-1”为单位时,两者在数值上相等,但前者单位是g·mol-1,后者单位是1,故两者不等同。
①等值性:摩尔质量以g·mol-1作单位时,在数值上与其相对分子质量或相对原子质量相等。
②确定性:对于指定的物质来说,其摩尔质量的值是一个定值,不随物质的物质的量的多少而改变。
特性
18g·mol-1
n(物质的量)
m(物质质量)
1mol H2O
18g
2mol H2O
36g
……
……
n mol H2O
18ng
=
×
n
M
M(摩尔质量)
3mol H2O
54g
m
n
=
m
M
物质的量
(单位:mol)
物质质量
(单位:g)
摩尔质量
(单位:g/mol)
M
=
m
n
=
×
n
M
m
计算方法
例:已知氨气的相对分子质量为17,则氨气的摩尔质量为 。
17 g·mol-1
①已知任意状态物质的相对原子质量或分子质量时:
M=Ar或Mr 。
②已知任意状态物质的质量时: (定义式)。
M
=
m
n
例:(1) 24.5gH2SO4的物质的量是多少?
(2) 1.50molNa2CO3的质量是多少?
nH2SO4= =
mH2SO4
MH2SO4
24.5g
98g.mol-1
=0.25mol
mNa2CO3= =1.5mol×106g.mol-1 =159g
nNa2CO3 MNa2CO3
计算方法
例:已知一个铁原子的质量为b g,则铁的摩尔质量为 。
③已知一个分子的质量时:M=m(分子)×NA。
bNA g·mol-1
计算方法
=
N
NA
摩尔质量(M)与微粒总数(N)有什么计算关系?
n
=
m
M
g·mol-1
1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为 。
用NA代表阿伏加德罗常数的值,已知a g某气体中含分子数为b,则该气体的摩尔质量为 。
64 g·mol-1
b
aNA
课堂练习
课堂练习
已知1.505×1023个X气体分子的质量为8 g,则X气体的摩尔质量是( )
A.16 g B.32 g
C.64 g·mol-1 D.32 g·mol-1
D
课堂小结
物质的量
摩尔质量
不良反应
物质的量判断
阿伏伽德罗常数
相关计算
定义及判断
相关计算
