1.2 课时1 物质的量 课件 (共25张PPT)2024-2025学年高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 1.2 课时1 物质的量 课件 (共25张PPT)2024-2025学年高一化学苏教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 5.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 13:19:47 | ||
图片预览








文档简介
(共25张PPT)
1.了解物质的量及其单位、认识物质的质量与摩尔质量、阿伏加德罗常数的含义与应用。
2.能从物质的量的角度认识物质的组成及变化,建立物质的量、物质的质量和微观粒子数之间计算的思维模型。
水是生命的源泉,水是由水分子构成的,成年人每天需喝多少水?
相当于多少个水分子?
平均2000 mL/天,相当于2 kg
新课导入
一个碳原子质量约1.993×10-23g,12 g 金刚石约含有多少个碳原子?
宏 观
(质量)
微 观
(微粒数目)
物质的量
1971年第14届国际计量大会正式通过物质的量的单位———摩尔
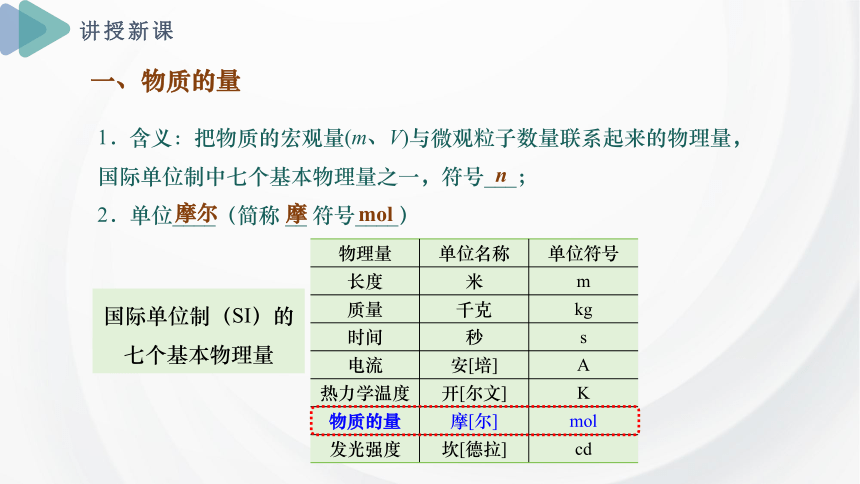
一、物质的量
1.含义:把物质的宏观量(m、V)与微观粒子数量联系起来的物理量,国际单位制中七个基本物理量之一,符号___;
2.单位____(简称 __ 符号____)
n
摩尔
mol
摩
物理量 单位名称 单位符号
长度 米 m
质量 千克 kg
时间 秒 s
电流 安[培] A
热力学温度 开[尔文] K
物质的量 摩[尔] mol
发光强度 坎[德拉] cd
国际单位制(SI)的七个基本物理量
个H2O分子?
宏 观
(m、V)
微 观
(原子、分子、离子、质子、中子、电子)
物质的量
1、物质的量表示的是微观粒子的集合体,不表示宏观物质的数目
2、物质由不同的微粒构成,因此,我们在使用摩尔表示物质的量时,一般用化学式指明粒子的种类
3、粒子的种类可以是分子、原子、离子;也可以是质子、中子、电子等
二、阿伏加德罗常数
国际上规定,1 mol粒子集合体所含粒子数与0.012 kg 12C中所含碳原子数相同。
1. 定义:0.012 kg 12C中所含碳原子数称为阿伏加德罗常数
2. 符号:NA,近似为 6.02×1023 mol-1
微观粒子:
分子、原子、离子、电子、质子、中子以及它们的特定组合等。
即不能表示宏观物质!
探究讨论
已知1个12C原子质量1.993×10-26 kg,0.012 kg12C中有多少个碳原子?
──────────
0.012 kg
1.993×10-26 kg
≈ 6.02×1023
1 mol 任何粒子所含粒子数NA个,约6.02×1023个。
填空:
1 mol O2中约含———————个氧分子;1 mol Fe中约含———————个铁原子;
1 mol H2SO4中约含 ————————个硫酸分子;
1 mol C2H5OH中约含 ———————个酒精分子,———————个氢原子;
1 mol Al2 (SO4) 3中约含———————个Al3+铝离子,———————个;
n mol 某种微粒集合体中所含微粒数约为——————————。
6.02×1023
6.02×1023
1.806×1024
6.02×1023
6.02×1023
3.612×1024
1.204×1024
n×6.02×1023
思考交流
物质的量(n)、阿伏加德罗常数(NA)、粒子数(N)之间有何关系?
xmol 某种微粒集合体中所含微粒数为x×6.02×1023.
n
NA
N
微粒数(单位:个)
(单位:个/mol)
阿伏加德罗常数
物质的量
(单位:mol)
n =
NA
N
n、N、NA 关系:
假设一粒米的质量0.02 g,那么 1 mol米粒的质量是多少?能养活多少人?
0.02×6.02×1023=1.204×1022 g=1.204×1016 (吨)
全球60亿人吃,每人每天吃一斤,吃14万年
但也要珍惜粮食哦!
探究讨论
将6.02×1023个一角硬币排起来,可来回地球和太阳间400亿次之多。
1 mol 一角硬币得有多少?
物质的量不适合宏观物质
探究讨论
微粒
1摩尔:阿伏加德罗常数
物质的量
个数(N)
1堆的量(NA)
堆数(n)
认识本质
正确认识物质的量
物质的量的计量对象:只适用于微观粒子!!!不适合宏观物质;
1 mol H2O 1.5 mol H 0.5 mol OH- 5 mol e- … …
物质的量是一个专有名词,不得简化或增添任何字;
摩尔不是物理量,是物质的量的单位,符号“mol”;
阿伏加德罗常数NA是定值,NA ≈ 6.02×1023 mol-1
1.判断正误
(1)物质的量可以理解为物质的数量 ( )
(2)摩尔是国际单位制中七个基本物理量之一 ( )
(3)1 mol H2中含有2 mol氢原子和 2 mol 电子 ( )
(4)阿伏加德罗常数就是6.02×1023 ( )
2.填空
(2)2 mol O2与1 mol H2SO4所含O (填“相等”或“不相等”)。
(3)1 mol OH-含 个原子, 个质子, 个电子。
×
√
×
×
1.204×1024
5.418×1024
6.02×1024
相等
意大利物理学家、化学家。1792年都灵大学学习法学,1796年获法学博士,以后从事律师工作。1800~1805年又专门攻读数学和物理学。1811年,提出分子学说:分子由原子组成,并推出同体积气体在同温同压下含有同数目的分子,又称阿伏加德罗定律。
阿伏加德罗对6.02×1023这个数据得出有着重大贡献,故用其名字表示该常数以示纪念,将6.02×1023 mol-1叫做阿伏加德罗常数,用NA表示。
Amedeo Avogadro
1776~1856
阿伏加德罗
科学史话
1 mol 不同物质所含的微粒数相等,1 mol 不同物质的质量是否也相等呢?
不一定相同。因为每一个微粒的质量不一定相等。
1 mol 微粒的质量有什么规律
思考交流
O Al H2 H2O
一个微粒的质量 2.657×10-23g 4.485×10-23g 3.294×10-24g 2.990×10-23g
物质的量 1 mol 1 mol 1 mol 1 mol
1 mol微粒的质量
相对分子或原子质量
16 g 27 g 2 g 18 g
16 27 2 18
1 mol任何微粒的质量以克为单位时,其数值都等于该物质的相对分子质量或相对原子质量。
一个微粒的质量× 6.02×1023 mol-1 ≈ 1 mol微粒的质量
三、摩尔质量
符号M ,单位g· mol-1 或 kg· mol-1
1.定义:单位物质的量的物质所具有的质量,
2.数值:等于该物质的式量或相对原子质量
3.公式:
物质的量 n
(mol)
m 物质的质量 (g)
M 摩尔质量 (g/mol)
= ——
m = M × n
m
M = ——
n
例1 下列说法正确的是( )
A.Na的摩尔质量为23 g B.Na的摩尔质量为23
C.Na的摩尔质量为23 g·mol-1 D.Na的摩尔质量为2.3×10-2 kg·mol-1
注意摩尔质量的单位
C
例2 水的摩尔质量是__________ ;OH-的摩尔质量是_________;
NaCl的摩尔质量是 _________ ;
11.7 g NaCl的物质的量是 _________。
0.2 mol
18 g · mol-1
58.5 g · mol-1
17 g · mol-1
数值:摩尔质量等于相对原子或分子质量,单位和意义不同
1. 下列说法正确的是( )
A.摩尔是国际单位制中的一个基本物理量
B.摩尔是表示物质量的单位,每摩尔物质含有6.02×1023个分子
C.2 mol H表示2 mol氢原子
D.1 mol氯含有6.02×1023个氯原子
C
B
2. a mol硫酸中含有b个氧原子,则阿伏加德罗常数可以表示为( )
3. (1)O2、SO2、SO3的质量之比为1∶2∶5,则它们所含的氧原子数之比为 。
(2) 40.5 g某金属氯化物MCl2中含有0.6 mol Cl-,则MCl2的摩尔质量为 ,M的相对原子质量为 。
1∶1∶3
135 g·mol-1
64
1.了解物质的量及其单位、认识物质的质量与摩尔质量、阿伏加德罗常数的含义与应用。
2.能从物质的量的角度认识物质的组成及变化,建立物质的量、物质的质量和微观粒子数之间计算的思维模型。
水是生命的源泉,水是由水分子构成的,成年人每天需喝多少水?
相当于多少个水分子?
平均2000 mL/天,相当于2 kg
新课导入
一个碳原子质量约1.993×10-23g,12 g 金刚石约含有多少个碳原子?
宏 观
(质量)
微 观
(微粒数目)
物质的量
1971年第14届国际计量大会正式通过物质的量的单位———摩尔
一、物质的量
1.含义:把物质的宏观量(m、V)与微观粒子数量联系起来的物理量,国际单位制中七个基本物理量之一,符号___;
2.单位____(简称 __ 符号____)
n
摩尔
mol
摩
物理量 单位名称 单位符号
长度 米 m
质量 千克 kg
时间 秒 s
电流 安[培] A
热力学温度 开[尔文] K
物质的量 摩[尔] mol
发光强度 坎[德拉] cd
国际单位制(SI)的七个基本物理量
个H2O分子?
宏 观
(m、V)
微 观
(原子、分子、离子、质子、中子、电子)
物质的量
1、物质的量表示的是微观粒子的集合体,不表示宏观物质的数目
2、物质由不同的微粒构成,因此,我们在使用摩尔表示物质的量时,一般用化学式指明粒子的种类
3、粒子的种类可以是分子、原子、离子;也可以是质子、中子、电子等
二、阿伏加德罗常数
国际上规定,1 mol粒子集合体所含粒子数与0.012 kg 12C中所含碳原子数相同。
1. 定义:0.012 kg 12C中所含碳原子数称为阿伏加德罗常数
2. 符号:NA,近似为 6.02×1023 mol-1
微观粒子:
分子、原子、离子、电子、质子、中子以及它们的特定组合等。
即不能表示宏观物质!
探究讨论
已知1个12C原子质量1.993×10-26 kg,0.012 kg12C中有多少个碳原子?
──────────
0.012 kg
1.993×10-26 kg
≈ 6.02×1023
1 mol 任何粒子所含粒子数NA个,约6.02×1023个。
填空:
1 mol O2中约含———————个氧分子;1 mol Fe中约含———————个铁原子;
1 mol H2SO4中约含 ————————个硫酸分子;
1 mol C2H5OH中约含 ———————个酒精分子,———————个氢原子;
1 mol Al2 (SO4) 3中约含———————个Al3+铝离子,———————个;
n mol 某种微粒集合体中所含微粒数约为——————————。
6.02×1023
6.02×1023
1.806×1024
6.02×1023
6.02×1023
3.612×1024
1.204×1024
n×6.02×1023
思考交流
物质的量(n)、阿伏加德罗常数(NA)、粒子数(N)之间有何关系?
xmol 某种微粒集合体中所含微粒数为x×6.02×1023.
n
NA
N
微粒数(单位:个)
(单位:个/mol)
阿伏加德罗常数
物质的量
(单位:mol)
n =
NA
N
n、N、NA 关系:
假设一粒米的质量0.02 g,那么 1 mol米粒的质量是多少?能养活多少人?
0.02×6.02×1023=1.204×1022 g=1.204×1016 (吨)
全球60亿人吃,每人每天吃一斤,吃14万年
但也要珍惜粮食哦!
探究讨论
将6.02×1023个一角硬币排起来,可来回地球和太阳间400亿次之多。
1 mol 一角硬币得有多少?
物质的量不适合宏观物质
探究讨论
微粒
1摩尔:阿伏加德罗常数
物质的量
个数(N)
1堆的量(NA)
堆数(n)
认识本质
正确认识物质的量
物质的量的计量对象:只适用于微观粒子!!!不适合宏观物质;
1 mol H2O 1.5 mol H 0.5 mol OH- 5 mol e- … …
物质的量是一个专有名词,不得简化或增添任何字;
摩尔不是物理量,是物质的量的单位,符号“mol”;
阿伏加德罗常数NA是定值,NA ≈ 6.02×1023 mol-1
1.判断正误
(1)物质的量可以理解为物质的数量 ( )
(2)摩尔是国际单位制中七个基本物理量之一 ( )
(3)1 mol H2中含有2 mol氢原子和 2 mol 电子 ( )
(4)阿伏加德罗常数就是6.02×1023 ( )
2.填空
(2)2 mol O2与1 mol H2SO4所含O (填“相等”或“不相等”)。
(3)1 mol OH-含 个原子, 个质子, 个电子。
×
√
×
×
1.204×1024
5.418×1024
6.02×1024
相等
意大利物理学家、化学家。1792年都灵大学学习法学,1796年获法学博士,以后从事律师工作。1800~1805年又专门攻读数学和物理学。1811年,提出分子学说:分子由原子组成,并推出同体积气体在同温同压下含有同数目的分子,又称阿伏加德罗定律。
阿伏加德罗对6.02×1023这个数据得出有着重大贡献,故用其名字表示该常数以示纪念,将6.02×1023 mol-1叫做阿伏加德罗常数,用NA表示。
Amedeo Avogadro
1776~1856
阿伏加德罗
科学史话
1 mol 不同物质所含的微粒数相等,1 mol 不同物质的质量是否也相等呢?
不一定相同。因为每一个微粒的质量不一定相等。
1 mol 微粒的质量有什么规律
思考交流
O Al H2 H2O
一个微粒的质量 2.657×10-23g 4.485×10-23g 3.294×10-24g 2.990×10-23g
物质的量 1 mol 1 mol 1 mol 1 mol
1 mol微粒的质量
相对分子或原子质量
16 g 27 g 2 g 18 g
16 27 2 18
1 mol任何微粒的质量以克为单位时,其数值都等于该物质的相对分子质量或相对原子质量。
一个微粒的质量× 6.02×1023 mol-1 ≈ 1 mol微粒的质量
三、摩尔质量
符号M ,单位g· mol-1 或 kg· mol-1
1.定义:单位物质的量的物质所具有的质量,
2.数值:等于该物质的式量或相对原子质量
3.公式:
物质的量 n
(mol)
m 物质的质量 (g)
M 摩尔质量 (g/mol)
= ——
m = M × n
m
M = ——
n
例1 下列说法正确的是( )
A.Na的摩尔质量为23 g B.Na的摩尔质量为23
C.Na的摩尔质量为23 g·mol-1 D.Na的摩尔质量为2.3×10-2 kg·mol-1
注意摩尔质量的单位
C
例2 水的摩尔质量是__________ ;OH-的摩尔质量是_________;
NaCl的摩尔质量是 _________ ;
11.7 g NaCl的物质的量是 _________。
0.2 mol
18 g · mol-1
58.5 g · mol-1
17 g · mol-1
数值:摩尔质量等于相对原子或分子质量,单位和意义不同
1. 下列说法正确的是( )
A.摩尔是国际单位制中的一个基本物理量
B.摩尔是表示物质量的单位,每摩尔物质含有6.02×1023个分子
C.2 mol H表示2 mol氢原子
D.1 mol氯含有6.02×1023个氯原子
C
B
2. a mol硫酸中含有b个氧原子,则阿伏加德罗常数可以表示为( )
3. (1)O2、SO2、SO3的质量之比为1∶2∶5,则它们所含的氧原子数之比为 。
(2) 40.5 g某金属氯化物MCl2中含有0.6 mol Cl-,则MCl2的摩尔质量为 ,M的相对原子质量为 。
1∶1∶3
135 g·mol-1
64
