1.3.2 电解质溶液 课件(共20张ppt)2024-2025学年高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 1.3.2 电解质溶液 课件(共20张ppt)2024-2025学年高一化学苏教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 38.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 13:20:22 | ||
图片预览







文档简介
(共20张PPT)
1.了解物质导电的原因及导电条件。
2.掌握电解质、非电解质及电离的概念,能从宏观和微观相结合的视角重新认识 酸、碱、盐的概念。
3.通过归纳总结,学会用电离方程式表示某些酸、碱、盐的电离,培养证据推理与模型认知的意识。
新课导入
溶液 现象
NaCl溶液
KCl溶液
水
NaCl固体
KCl固体
灯泡亮
灯泡亮
灯泡不亮
灯泡不亮
灯泡不亮
结论:氯化钠、氯化钾水溶液能够导电;NaCl固体、NaCl固体不能导电。
实验现象:
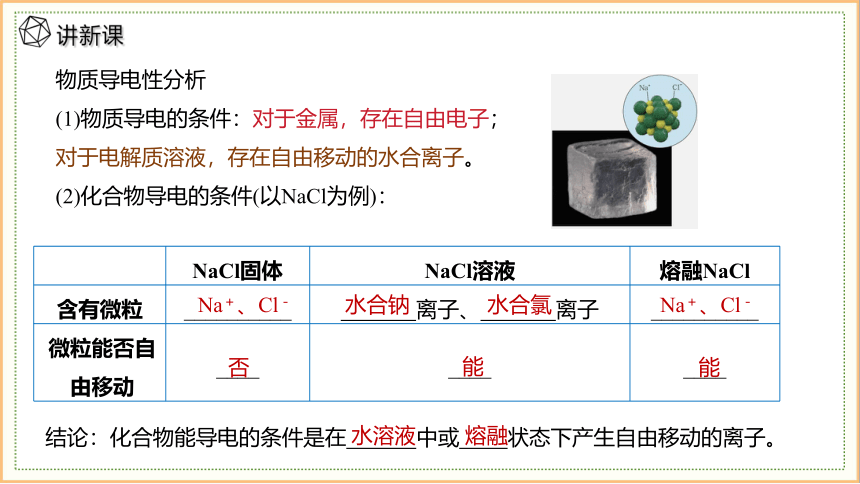
物质导电性分析
(1)物质导电的条件:对于金属,存在自由电子;对于电解质溶液,存在自由移动的水合离子。
(2)化合物导电的条件(以NaCl为例):
NaCl固体 NaCl溶液 熔融NaCl
含有微粒 __________ 离子、 离子 __________
微粒能否自由移动 ____ ____ ____
Na+、Cl-
水合钠
水合氯
Na+、Cl-
否
能
能
结论:化合物能导电的条件是在 中或 状态下产生自由移动的离子。
水溶液
熔融
电解质:在水溶液中或熔融状态下能导电的化合物。
一、电解质、非电解质
酸:HNO3、H2SO4、HCl ……
碱:NaOH、Mg(OH)2、NH3 H2O ……
大部分盐:NaCl、MgSO4、BaSO4 ……
活泼金属氧化物:Na2O、MgO、Al2O3 ……
水 H2O
非电解质:在水溶液中和熔融状态下都不能导电的化合物。
大多数有机化合物:CH4、CH3CH2OH、C6H12O6 ……
大多数非金属氧化物:CO2、CO、SO2 ……
非酸性气态氢化物:NH3、PH3 ……
(1)电解质、非电解质都是化合物。Cu、石墨(C)与NaCl溶液既不是电解质也不是非电解质;
(2)水溶液里或熔融状态下能导电。如:BaSO4(难溶于水)虽然其水溶液几乎不导电,但在熔融状态下导电,因此它是电解质;
(3)电解质本身不一定导电,能导电的不一定是电解质。如:NaCl固体并不能导电,NaCl溶液才能导电,但是NaCl溶液属于混合物。
(4)电解质必须是本身能电离出自由移动的离子而导电。一些物质溶于水后与水反应生成的化合物能电离出自由移动的离子而导电,像CO2、SO2等,但这些物质本身不能电离出自由移动的离子,故不是电解质。
1.现有下列物质:①蔗糖 ②熔融NaCl ③HCl的水溶液 ④Fe
⑤NaOH固体 ⑥SO2的水溶液 ⑦NH3 ⑧SO3 ⑨氨水 ⑩液态H2SO4
请思考并回答下列问题:
(1)上述状态下可导电的是____________(填序号,下同)。
(2)属于电解质的是________。
(3)属于非电解质的是________。
(4)上述状态下的电解质不能导电的是______。
②③④⑥⑨
②⑤⑩
①⑦⑧
⑤⑩
(5)SO2的水溶液导电能说明SO2是电解质吗?为什么?____________
___________________________________________________________
不能,因为
SO2溶于水生成了H2SO3,H2SO3在水分子作用下产生自由移动的离子,
①定义:电解质在水溶液中或熔融状态下产生自由移动的离子的过程。
②表示方法:电离方程式
NaCl = Na+ + Cl-
KNO3 = K+ + NO3-
NaOH = Na+ + OH-
电离与是否通电无关
二、电离
③书写时注意事项:
适用范围:电解质的电离。
用的是等号(或可逆号)。
根据化合价写离子符号
根据右下角系数写离子个数。
原子团不能拆开写
写出下列物质的电离方程式:
HCl =
Al2(SO4)3 =
BaCl2 =
AgNO3 =
H+ + Cl-
2Al3+ + 3SO42-
Ba2+ + 2Cl-
Ag+ + NO3-
NaHSO4 =
NaHCO3 =
H2SO4 =
Ba(OH)2 =
Na+ + H+ + SO42-
Na+ + HCO3-
2H+ + SO42-
Ba2+ + 2OH-
H2SO4是强酸,
H2CO3是弱酸。
强酸可以完全电离
电解质的溶液中所有阳离子所带的正电荷数与所有阳离子所带的负电荷数相等,故显电中性,常称电荷守恒。
电解质溶液不显电性(电荷守恒)
三、酸、碱、盐
电离方程式:
HNO3 = H+ + NO3-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
酸:电解质电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
KOH = K+ + OH-
Ba(OH)2 = Ba2+ + 2OH-
NaOH = Na+ + OH-
碱:电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
电离方程式:
理解酸、碱概念时注意“全部”两个字。
如NaHSO4、Cu2(OH)2CO3虽分别能电离产生H+、OH-,但都属于盐。
Na2CO3 = 2Na+ + CO32-
MgSO4 = Mg2+ + SO42-
BaCl2 = Ba2+ + 2Cl-
盐:电离时生成金属离子和酸根离子的化合物叫做盐。
电离方程式:
盐中不一定含有金属元素,如NH4Cl。
1.正误判断
(1)电解质发生电离,是在通电条件下才发生的
(2)NH4HSO4在水溶液中可以电离出H+,所以NH4HSO4属于酸
(3)液态硫酸无法电离,只有在溶于水形成水溶液时才发生电离
(4)盐中不一定含有金属元素
√
×
×
√
2.下列物质在水中的电离方程式书写正确的是
A.NaHCO3===Na++H++
B.NaOH===Na++O2-+H+
C.KClO3===K++Cl-+3O2-
D.Al2(SO4)3===2Al3++
√
3.Ⅰ.下列物质中:①铜,②稀硫酸,③氯化氢,④氨气,⑤空气,⑥二氧化碳,
⑦金属汞(俗称水银),⑧氯化钾,⑨碳酸钙,⑩氯气。
(1)属于混合物的是_______(填序号,下同)。
②⑤
(2)属于电解质的是________。
③⑧⑨
(3)能导电的是_________。
①②⑦
Ⅱ.写出下列物质在水溶液中的电离方程式
(1)BaCl2:____________________;
(2)(NH4)2SO4:________________________;
(3)HNO3:__________________;
(4) NaHCO3:______________________。
BaCl2===Ba2++2Cl-
1.物质导电性分析
(1)物质导电的条件:对于金属,存在自由电子;对于电解质 ,存在自由移动的阴阳离子。
化合物
非电解质:
电解质:
2.电解质和非电解质
在水溶液或熔融状态能导电的化合物
①酸②碱③盐 ④金属氧化物 ⑤水
在水溶液和熔融状态不能导电的化合物
①有机物(除了CH3COOH)②非金属氧化物③NH3
3.电离方程式的书写
H2SO4===2H++
Ca(OH)2===Ca2++2OH-
注意:单质和混合物既不是电解质也不是非电解质
1.了解物质导电的原因及导电条件。
2.掌握电解质、非电解质及电离的概念,能从宏观和微观相结合的视角重新认识 酸、碱、盐的概念。
3.通过归纳总结,学会用电离方程式表示某些酸、碱、盐的电离,培养证据推理与模型认知的意识。
新课导入
溶液 现象
NaCl溶液
KCl溶液
水
NaCl固体
KCl固体
灯泡亮
灯泡亮
灯泡不亮
灯泡不亮
灯泡不亮
结论:氯化钠、氯化钾水溶液能够导电;NaCl固体、NaCl固体不能导电。
实验现象:
物质导电性分析
(1)物质导电的条件:对于金属,存在自由电子;对于电解质溶液,存在自由移动的水合离子。
(2)化合物导电的条件(以NaCl为例):
NaCl固体 NaCl溶液 熔融NaCl
含有微粒 __________ 离子、 离子 __________
微粒能否自由移动 ____ ____ ____
Na+、Cl-
水合钠
水合氯
Na+、Cl-
否
能
能
结论:化合物能导电的条件是在 中或 状态下产生自由移动的离子。
水溶液
熔融
电解质:在水溶液中或熔融状态下能导电的化合物。
一、电解质、非电解质
酸:HNO3、H2SO4、HCl ……
碱:NaOH、Mg(OH)2、NH3 H2O ……
大部分盐:NaCl、MgSO4、BaSO4 ……
活泼金属氧化物:Na2O、MgO、Al2O3 ……
水 H2O
非电解质:在水溶液中和熔融状态下都不能导电的化合物。
大多数有机化合物:CH4、CH3CH2OH、C6H12O6 ……
大多数非金属氧化物:CO2、CO、SO2 ……
非酸性气态氢化物:NH3、PH3 ……
(1)电解质、非电解质都是化合物。Cu、石墨(C)与NaCl溶液既不是电解质也不是非电解质;
(2)水溶液里或熔融状态下能导电。如:BaSO4(难溶于水)虽然其水溶液几乎不导电,但在熔融状态下导电,因此它是电解质;
(3)电解质本身不一定导电,能导电的不一定是电解质。如:NaCl固体并不能导电,NaCl溶液才能导电,但是NaCl溶液属于混合物。
(4)电解质必须是本身能电离出自由移动的离子而导电。一些物质溶于水后与水反应生成的化合物能电离出自由移动的离子而导电,像CO2、SO2等,但这些物质本身不能电离出自由移动的离子,故不是电解质。
1.现有下列物质:①蔗糖 ②熔融NaCl ③HCl的水溶液 ④Fe
⑤NaOH固体 ⑥SO2的水溶液 ⑦NH3 ⑧SO3 ⑨氨水 ⑩液态H2SO4
请思考并回答下列问题:
(1)上述状态下可导电的是____________(填序号,下同)。
(2)属于电解质的是________。
(3)属于非电解质的是________。
(4)上述状态下的电解质不能导电的是______。
②③④⑥⑨
②⑤⑩
①⑦⑧
⑤⑩
(5)SO2的水溶液导电能说明SO2是电解质吗?为什么?____________
___________________________________________________________
不能,因为
SO2溶于水生成了H2SO3,H2SO3在水分子作用下产生自由移动的离子,
①定义:电解质在水溶液中或熔融状态下产生自由移动的离子的过程。
②表示方法:电离方程式
NaCl = Na+ + Cl-
KNO3 = K+ + NO3-
NaOH = Na+ + OH-
电离与是否通电无关
二、电离
③书写时注意事项:
适用范围:电解质的电离。
用的是等号(或可逆号)。
根据化合价写离子符号
根据右下角系数写离子个数。
原子团不能拆开写
写出下列物质的电离方程式:
HCl =
Al2(SO4)3 =
BaCl2 =
AgNO3 =
H+ + Cl-
2Al3+ + 3SO42-
Ba2+ + 2Cl-
Ag+ + NO3-
NaHSO4 =
NaHCO3 =
H2SO4 =
Ba(OH)2 =
Na+ + H+ + SO42-
Na+ + HCO3-
2H+ + SO42-
Ba2+ + 2OH-
H2SO4是强酸,
H2CO3是弱酸。
强酸可以完全电离
电解质的溶液中所有阳离子所带的正电荷数与所有阳离子所带的负电荷数相等,故显电中性,常称电荷守恒。
电解质溶液不显电性(电荷守恒)
三、酸、碱、盐
电离方程式:
HNO3 = H+ + NO3-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
酸:电解质电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
KOH = K+ + OH-
Ba(OH)2 = Ba2+ + 2OH-
NaOH = Na+ + OH-
碱:电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
电离方程式:
理解酸、碱概念时注意“全部”两个字。
如NaHSO4、Cu2(OH)2CO3虽分别能电离产生H+、OH-,但都属于盐。
Na2CO3 = 2Na+ + CO32-
MgSO4 = Mg2+ + SO42-
BaCl2 = Ba2+ + 2Cl-
盐:电离时生成金属离子和酸根离子的化合物叫做盐。
电离方程式:
盐中不一定含有金属元素,如NH4Cl。
1.正误判断
(1)电解质发生电离,是在通电条件下才发生的
(2)NH4HSO4在水溶液中可以电离出H+,所以NH4HSO4属于酸
(3)液态硫酸无法电离,只有在溶于水形成水溶液时才发生电离
(4)盐中不一定含有金属元素
√
×
×
√
2.下列物质在水中的电离方程式书写正确的是
A.NaHCO3===Na++H++
B.NaOH===Na++O2-+H+
C.KClO3===K++Cl-+3O2-
D.Al2(SO4)3===2Al3++
√
3.Ⅰ.下列物质中:①铜,②稀硫酸,③氯化氢,④氨气,⑤空气,⑥二氧化碳,
⑦金属汞(俗称水银),⑧氯化钾,⑨碳酸钙,⑩氯气。
(1)属于混合物的是_______(填序号,下同)。
②⑤
(2)属于电解质的是________。
③⑧⑨
(3)能导电的是_________。
①②⑦
Ⅱ.写出下列物质在水溶液中的电离方程式
(1)BaCl2:____________________;
(2)(NH4)2SO4:________________________;
(3)HNO3:__________________;
(4) NaHCO3:______________________。
BaCl2===Ba2++2Cl-
1.物质导电性分析
(1)物质导电的条件:对于金属,存在自由电子;对于电解质 ,存在自由移动的阴阳离子。
化合物
非电解质:
电解质:
2.电解质和非电解质
在水溶液或熔融状态能导电的化合物
①酸②碱③盐 ④金属氧化物 ⑤水
在水溶液和熔融状态不能导电的化合物
①有机物(除了CH3COOH)②非金属氧化物③NH3
3.电离方程式的书写
H2SO4===2H++
Ca(OH)2===Ca2++2OH-
注意:单质和混合物既不是电解质也不是非电解质
