2.2 化学平衡(影响化学平衡的因素)课件 (共38张PPT) 2024-2025学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2 化学平衡(影响化学平衡的因素)课件 (共38张PPT) 2024-2025学年高二上学期化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 62.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 16:51:11 | ||
图片预览






文档简介
(共38张PPT)
第二节 化学平衡
第三课时 影响化学平衡的因素
第二章 化学反应速率与化学平衡
2019人教版选择性必修一
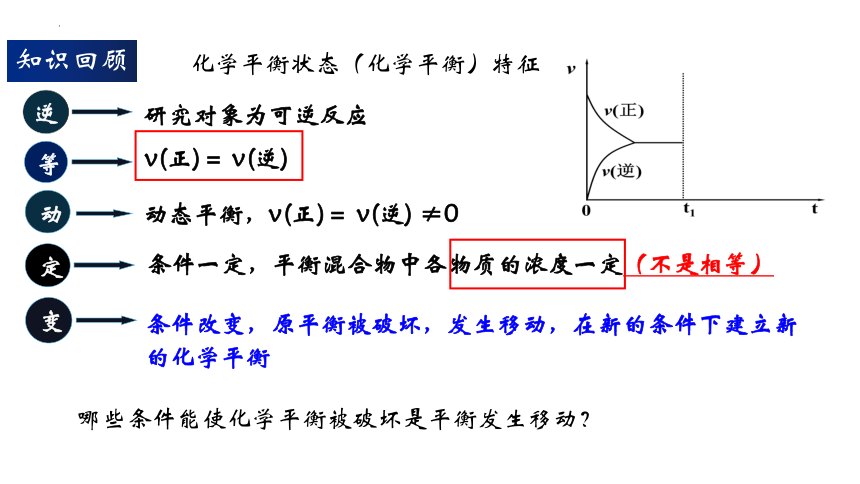
条件改变,原平衡被破坏,发生移动,在新的条件下建立新的化学平衡
研究对象为可逆反应
逆
等
v(正)= v(逆)
动
动态平衡,v(正)= v(逆) ≠0
定
条件一定,平衡混合物中各物质的浓度一定(不是相等)
变
知识回顾
化学平衡状态(化学平衡)特征
哪些条件能使化学平衡被破坏是平衡发生移动?
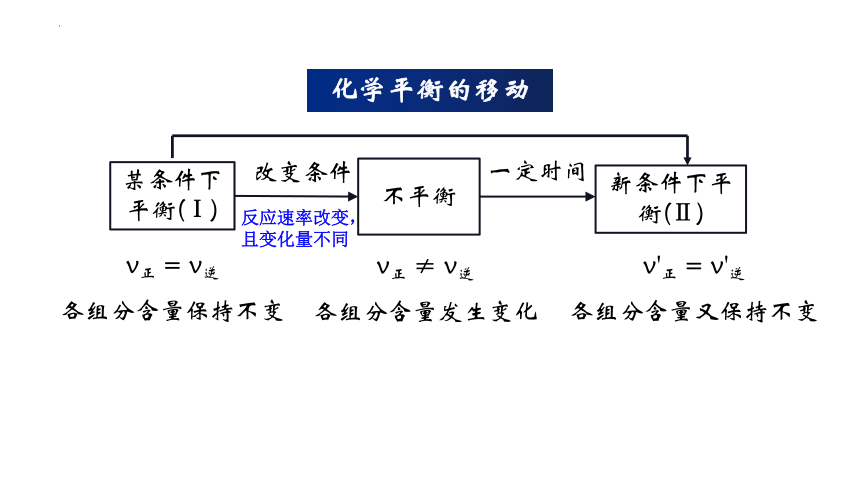
某条件下平衡(Ⅰ)
不平衡
新条件下平衡(Ⅱ)
改变条件
一定时间
v正 = v逆
各组分含量保持不变
v正 ≠ v逆
各组分含量发生变化
v'正 = v'逆
各组分含量又保持不变
化学平衡的移动
反应速率改变,且变化量不同
一、化学平衡的移动
可逆反应中旧化学平衡被破坏,新化学平衡建立的过程,叫化学平衡的移动。
1.定义:
2.研究对象:
已建立平衡状态的体系。
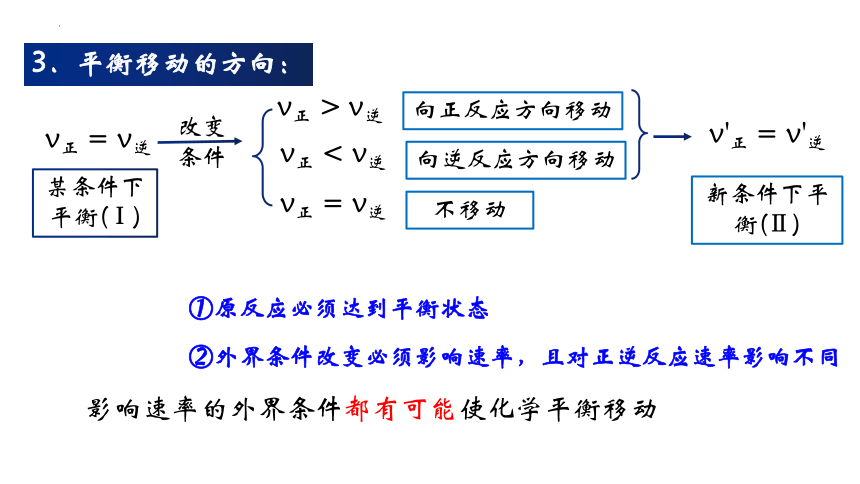
3.平衡移动的方向:
v正 = v逆
某条件下平衡(Ⅰ)
改变条件
v正 > v逆
v正 < v逆
v正 = v逆
向正反应方向移动
向逆反应方向移动
不移动
新条件下平衡(Ⅱ)
v'正 = v'逆
①原反应必须达到平衡状态
②外界条件改变必须影响速率,且对正逆反应速率影响不同
影响速率的外界条件都有可能使化学平衡移动
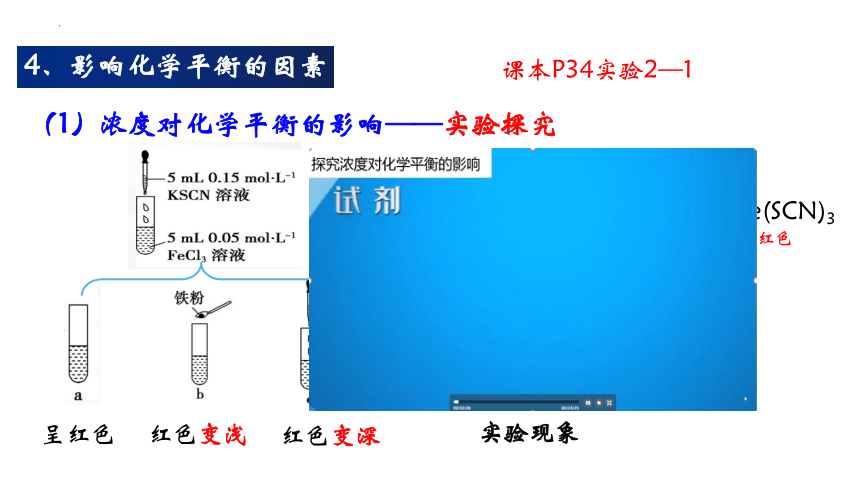
4、影响化学平衡的因素
(1)浓度对化学平衡的影响——实验探究
课本P34实验2—1
实验原理
Fe3+ + 3SCN- Fe(SCN)3
浅黄色 无色 红色
实验现象
呈红色
红色变浅
红色变深
实验结论
其他条件不变时:减小反应物的浓度,平衡向逆反应方向移动,增大反应物的浓度,平衡向正反应方向移动。
规律:其他条件不变时
增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;
减小反应物浓度或增大生成物浓度,平衡向逆反应方向移动。
增减减增
浓度对化学平衡的影响——理论分析
Fe3+ + 3SCN- Fe(SCN)3
Q
=
增大反应物浓度
增大生成物浓度
减小反应物浓度
减小生成物浓度
在等温条件下,平衡常数定值K
Q平衡向正反应方向移动
Q>K
平衡向逆反应方向移动
Q>K
平衡向逆反应方向移动
Q平衡向正反应方向移动
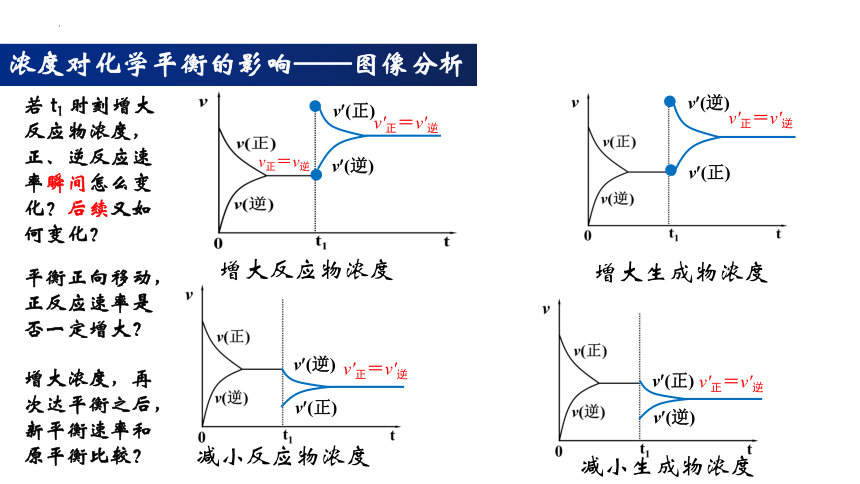
浓度对化学平衡的影响——图像分析
增大反应物浓度
v (正)
v (逆)
增大生成物浓度
v'正=v'逆
v正=v逆
v (逆)
v (正)
v'正=v'逆
减小反应物浓度
减小生成物浓度
v (逆)
v (正)
v (逆)
v (正)
v'正=v'逆
v'正=v'逆
若 t1 时刻增大反应物浓度,正、逆反应速率瞬间怎么变化?后续又如何变化?
平衡正向移动,正反应速率是否一定增大?
增大浓度,再次达平衡之后,新平衡速率和原平衡比较?
①速率变化—看外界条件(C/T/P/催化剂等)如何改变
平衡移动—看v'正和v'逆的相对大小
②只要是增大浓度,不论增大的是反应物浓度,还是生成物浓度,
新平衡状态下的反应速率一定大于原平衡状态;
减小浓度,新平衡状态下的速率一定小于原平衡状态。
③改变固体或纯液体的量,其浓度不变,速率不变,平衡不移动。
④反应物有两种或两种以上, 增加一种物质的浓度,
该物质的平衡转化率降低, 而其他物质的转化率提高。
课堂练习1、可逆反应H2O(g) + C(s) CO(g) + H2(g)在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO的浓度有何变化?
①增大水蒸气浓度
②加入更多的碳
③增加H2浓度
①平衡正向移动,CO浓度增大
②平衡不移动,CO浓度不变
③平衡逆向移动,CO浓度减小
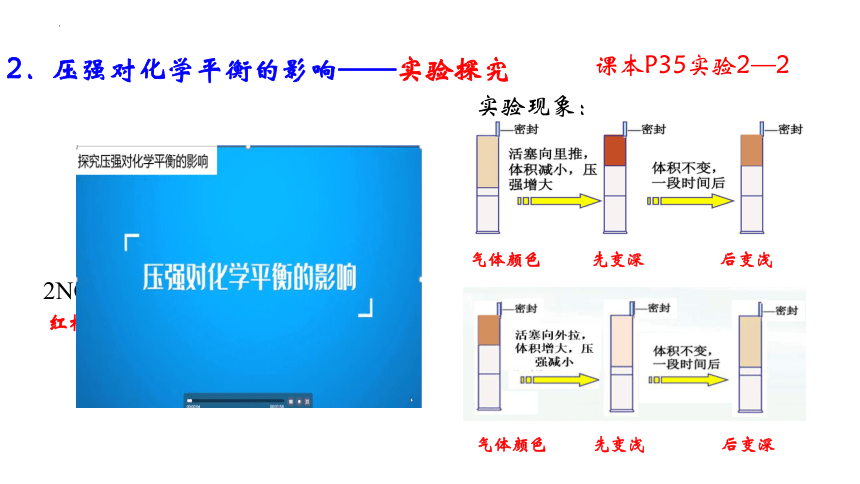
2.压强对化学平衡的影响——实验探究
实验原理
2NO2(g) N2O4(g)
红棕色 无色
实验现象:
气体颜色 先变深 后变浅
气体颜色 先变浅 后变深
课本P35实验2—2
压缩体积(压强增大), 颜色先变深 后变浅
c(NO2)变大 c(NO2)变小(消耗NO2 )
平衡向正反应即气体体积减小的方向移动
增大体积(压强减小) 颜色先变浅 后变深
c(NO2)变小 c(NO2) 变大(生成NO2 )
平衡向逆反应即气体体积增大的方向移动
2NO2(g) N2O4(g)
红棕色 无色
实验结论及解释:
说明:
体积减小:即气体分子数目减少
体积增大:即气体分子数目增多
实验 (同温度下) 压强 各物质浓度 (mol·L-1) 浓度商 (Q ) 平衡移动方向
NO2 N2O4 原化学平衡容器容积为V p a b
增大压强缩小容积至V /2时
减小压强扩大容积至2V 时
2NO2(g) N2O4(g)
2P
Q1==K
2a
2b
Q2===
压强对化学平衡的影响——理论分析
Q3===2K
正反应(气体分子数减小)方向移动
逆反应(气体分子数增加)方向移动
2NH3(g) N2(g)+3H2 (g)
同样方法研究:当温度不变时K不变
增大压强体积缩小
减小压强体积扩大
Q>K平衡逆反应(气体分子数减小)方向移动
Qv (正)
v (逆)
v'正=v'逆
v正=v逆
v (逆)
v (正)
v'正=v'逆
压强对化学平衡的影响——图像分析
增大压强
v (正)
v (逆)
v'正=v'逆
v正=v逆
v (逆)
v (正)
v'正=v'逆
减小压强
2NO2(g) N2O4(g)
2NH3(g) N2(g) + 3H2 (g)
提示——压强对气体分子数大的方向速率影响大
N
v'正=v'逆
压强对化学平衡的影响——图像分析
增大压强
v'正=v'逆
减小压强
H2(g)+I2(g) 2HI(g)
提示——压强对气体分子数大的方向速率影响大
H2(g)+I2(g) 2HI(g)
同样方法研究:当温度不变时K不变
增大压强体积缩小
减小压强体积扩大
Q=K平衡不移动
Q=K平衡不移动
现以mA(g)+nB(g) pC(g)+qD(g)为例进行说明。
若m+n=p+g,增大压强,平衡_______________;
若m+n>p+q,增大压强,平衡_______________;
若m+n对于有气体参与的可逆反应,当达到平衡时,在其他条件不变的情况下:增大压强(减小容器的容积),化学平衡向气体体积减小的方向移动;减小压强(增大容器的体积),化学平衡向气体体积增大的方向移动。反应后气体的总体积没有变化,改变压强,平衡不发生移动。
结论:
说明:
体积减小:即气体分子数目减少
体积增大:即气体分子数目增多
增减减增
压强对化学平衡的影响注意事项
在一定温度下的密闭容器中存在2NO2(气) N2O4(气)平衡,先保持容器容积不变,充入Ar气以增大压强后,正逆反应速率将如何变化?平衡将如何移动?
若保持压强不变,充入Ar气,正逆反应速率如何变化?平衡如何移动?
⑴正逆反应速率均不变;平衡不移动。
⑵正逆反应速率均减小;平衡逆向移动。
压强的改变必须影响气体的浓度才影响速率,当正逆反应速率改变不同时,平衡才会发生移动
课堂练习2、 在一定温度下的密闭容器中发生反应
xA(g)+y B(g) zC(g) , 平衡后时测得A的浓度为0.5mol/L。保持温度不变,将容器的容积扩大到原来的2倍,再达平衡,测得A的浓度为0.3mol/L下列有关判断的是( )
A.x+yC.B的转化率降低 D.C的体积分数减小
CD
提示:容积扩大2倍,A的浓度先变为0.25mol/L,平衡向逆反应方向移动,达平衡为0.3mol/L。正反应气体体积缩小。
3.温度对化学平衡的影响——实验探究
实验原理
热水
冰水
实验现象:
颜色变深
2NO2(g) N2O4(g) ΔH=-56.9 kJ·mol-1
颜色变浅
受热 颜色变深 C(NO2)增大,即平衡向逆反应(吸热反应)方向移动;
遇冷 颜色变浅 C(NO2)减小,即平衡向正反应(放热反应)方向移动。
解释:
2NO2(g) N2O4(g) ΔH=-56.9 kJ·mol-1
在其他条件不变的情况下:
升高温度,平衡向吸热反应方向移动;
降低温度,平衡向放热反应方向移动。
实验结论
升吸降放
对于放热反应,升温使K减小,Q>K,平衡向逆反应方向(吸热方向)移动。
对于吸热反应,升温使K增大,Q浓度以及压强改变首先影响Q(浓度商),进而促使化学平衡移动,温度的改变首先影响的是K(平衡常数)。
温度对化学平衡的影响——理论分析
温度 623K 698K 763K
平衡常数 66 .9 54.4 45.9
不同温度下 的平衡常数
H2(g) + I2(g) 2HI(g) △H<0
区分
正反应是吸热反应
v (正)
v (逆)
v'正=v'逆
v正=v逆
v (逆)
v (正)
v'正=v'逆
温度对化学平衡的影响——图像分析
正反应是放热反应
升高温度
正反应是吸热反应
v (正)
v (逆)
v'正=v'逆
v正=v逆
v (逆)
v (正)
v'正=v'逆
正反应是放热反应
降低温度
课堂练习3、关节炎是因为在关节滑液中形成了尿酸钠晶体,尤其是在寒冷季节易诱发关节疼痛,其化学机理如下:
①HUr(尿酸)+H2O Ur-(尿酸根离子)+H3O+,
②Ur-(aq)+Na+(aq) NaUr(s)。
下列对反应②的叙述正确的是( )
A.正反应为吸热反应
B.正反应为放热反应
C.升高温度,平衡向正反应方向移动
D.降低温度,平衡向逆反应方向移动
B
催化剂降低了反应的活化能,正反应的活化能降低,逆反应的活化能也降低,正逆反应的活化分子百分数增加倍数相同,正逆反应速率增加的倍数也相等。不能改变达到平衡状态的反应混合物的组成,只改变到达平衡的时间。
催化剂同等程度地改变正反应速率和逆反应速率(v'正=v'逆)
平衡不移动,但会改变反应到达平衡所需要的时间(反应速率)。
4、催化剂对化学平衡的影响——理论分析
v'正=v'逆
催化剂对化学平衡的影响图像分析
课堂练习4、 对某一可逆反应来说,使用催化剂的作用是( )
A. 提高反应物的平衡转化率
B. 以同样程度改变正逆反应的速率
C. 增大正反应速率,降低逆反应速率
D. 改变平衡混合物的组成
B
外界条件的改变 平衡移动方向 平衡移动结果
浓度 增大反应物浓度 / 减小生成物浓度 向正反应方向移动 反应物浓度减小
/ 生成物浓度增大
减小反应物浓度 / 增大生成物浓度 向逆反应方向移动 反应物浓度增大
/ 生成物浓度减小
温度 升高温度 向吸热反应方向移动 体系温度降低
降低温度 向放热反应方向移动 体系温度升高
压强 反应前后 气体分子总数改变 增大压强 向气体分子总数减小 的方向移动 体系压强减小
减小压强 向气体分子总数增大 的方向移动 体系压强增大
反应前后 气体分子总数不变 改变压强 平衡不移动
催化剂 使用催化剂 平衡不移动
四、勒沙特列原理:
如果改变影响平衡的一个条件(如浓度、压强、温度)平衡就向能够减弱这种改变的方向移动。这就是勒沙特列原理。
注:①此原理只适用于已达平衡的体系
②原理的适用范围是只有一项条件变化的情况(温度或压强或一种物质的浓度),当多项条件同时发生变化时,情况比较复杂;
③平衡移动的结果只能减弱(不可能抵消)外界条件的变化。
增谁减谁
增(减)者必增(减)
移动方向
移动结果
总结
减谁增谁
实验原理
2NO2(g) N2O4(g)
红棕色 无色
实验现象:
气体颜色先变深,后变浅,最终比原来深
气体颜色先变浅,后变深,最终比原来浅
课本P35实验2—2
实例
讨论:反应N2(g)+3H2 (g) 2NH3 (g) △H<0 ,达到化学平衡,改变下列条件,根据反应体系中的变化填空:
①若N2的平衡浓度为a mol/L,其他条件不变时,充入N2使其浓度增大到b mol/L后平衡向——————方向移动,达到新平衡后, N2的浓度为c mol/L,则a、b、c的大小为———————;
②若平衡体系的压强为P1 ,之后缩小反应体系体积使压强增大到P2 ,此时平衡向——————方向移动,达到新平衡后 体系的压强为P3 ,则P1 、 P2、 P3 的大小为——————————;
③若平衡体系的温度为T1 ,之后将温度升高到 T2 ,此时平衡向——————方向移动,达到新平衡后 体系的温度为T3 ,则T1 、 T2、 T3 的大小为——————————。
正反应
a< c < b
正反应
P1 < P3< P2
逆反应
T1 < T3< T2
课堂小结
化学平衡的移动
原因
方向
改变条件使v正 ≠ v逆
v正 >v逆 Qv正 K逆反应方向移动
影响化学平衡的因素
浓度
压强
温度
增减减增
增减减增
升吸降放
1、已知在氨水中存在下列平衡:
NH3 + H2O
NH3· H2O
NH4+ + OH-
(1)、向氨水中加入MgCl2固体,平衡向 _______________ 移动,
OH-浓度 _______ , NH4+ 浓度_________ 。
(2)、向氨水中加入浓盐酸,平衡向 _____________移动,
此时溶液中浓度减小的粒子有__________________________。
(3)、向氨水中加入少量NaOH固体,平衡向_____________移动,
此时发生的现象是__________________ 。
正反应方向
减小
增大
正反应方向
OH-、NH3·H2O、NH3
逆反应方向
有气体放出
课堂小练
2、将5mL0.005mol·L-1FeCl3溶液和5mL0.015mol·L-1KSCN溶液混合,达到平衡后混合液呈红色。再将混合液分为5等份,分别进行如下实验:
下列说法不正确的是( )
A.实验②中溶液颜色比实验①中深
B.对比实验①和③,可证明增加反应物中某些离子的浓度,平衡发生逆向移动
C.对比实验①和④,可证明增加反应物浓度,平衡发生正向移动
D.对比实验①和⑤,可证明减少反应物浓度,平衡发生逆向移动
B
3、一定量的混合气体在密闭容器中发生反应:
m A (g) + n B (g) p C (g)
达到平衡后,温度不变,将气体体积缩小到原来的1/2但达到平衡时,C的浓度为原来的1.8倍,则下列说法正确的是( )
A、m + n > p
B、A 的转化率降低
C、平衡向正反应方向移动
D、C的体积分数增加
B
4、反应:A(g)+3B(g) 2C(g) ΔH<0 达平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率都变小,平衡向正反应方向移动
D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动
C
V’正
v
t
V正
V逆
V’逆
V’正=V’逆
5、有反应aA + bB cC + dD其中反应物与生成物均为气体,达到平衡后其他条件不变,改变压强,则下图适合哪种情况( )
A、a+bc+d,加压
C、a+bc+d,减压
B
第二节 化学平衡
第三课时 影响化学平衡的因素
第二章 化学反应速率与化学平衡
2019人教版选择性必修一
条件改变,原平衡被破坏,发生移动,在新的条件下建立新的化学平衡
研究对象为可逆反应
逆
等
v(正)= v(逆)
动
动态平衡,v(正)= v(逆) ≠0
定
条件一定,平衡混合物中各物质的浓度一定(不是相等)
变
知识回顾
化学平衡状态(化学平衡)特征
哪些条件能使化学平衡被破坏是平衡发生移动?
某条件下平衡(Ⅰ)
不平衡
新条件下平衡(Ⅱ)
改变条件
一定时间
v正 = v逆
各组分含量保持不变
v正 ≠ v逆
各组分含量发生变化
v'正 = v'逆
各组分含量又保持不变
化学平衡的移动
反应速率改变,且变化量不同
一、化学平衡的移动
可逆反应中旧化学平衡被破坏,新化学平衡建立的过程,叫化学平衡的移动。
1.定义:
2.研究对象:
已建立平衡状态的体系。
3.平衡移动的方向:
v正 = v逆
某条件下平衡(Ⅰ)
改变条件
v正 > v逆
v正 < v逆
v正 = v逆
向正反应方向移动
向逆反应方向移动
不移动
新条件下平衡(Ⅱ)
v'正 = v'逆
①原反应必须达到平衡状态
②外界条件改变必须影响速率,且对正逆反应速率影响不同
影响速率的外界条件都有可能使化学平衡移动
4、影响化学平衡的因素
(1)浓度对化学平衡的影响——实验探究
课本P34实验2—1
实验原理
Fe3+ + 3SCN- Fe(SCN)3
浅黄色 无色 红色
实验现象
呈红色
红色变浅
红色变深
实验结论
其他条件不变时:减小反应物的浓度,平衡向逆反应方向移动,增大反应物的浓度,平衡向正反应方向移动。
规律:其他条件不变时
增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;
减小反应物浓度或增大生成物浓度,平衡向逆反应方向移动。
增减减增
浓度对化学平衡的影响——理论分析
Fe3+ + 3SCN- Fe(SCN)3
Q
=
增大反应物浓度
增大生成物浓度
减小反应物浓度
减小生成物浓度
在等温条件下,平衡常数定值K
Q
Q>K
平衡向逆反应方向移动
Q>K
平衡向逆反应方向移动
Q
浓度对化学平衡的影响——图像分析
增大反应物浓度
v (正)
v (逆)
增大生成物浓度
v'正=v'逆
v正=v逆
v (逆)
v (正)
v'正=v'逆
减小反应物浓度
减小生成物浓度
v (逆)
v (正)
v (逆)
v (正)
v'正=v'逆
v'正=v'逆
若 t1 时刻增大反应物浓度,正、逆反应速率瞬间怎么变化?后续又如何变化?
平衡正向移动,正反应速率是否一定增大?
增大浓度,再次达平衡之后,新平衡速率和原平衡比较?
①速率变化—看外界条件(C/T/P/催化剂等)如何改变
平衡移动—看v'正和v'逆的相对大小
②只要是增大浓度,不论增大的是反应物浓度,还是生成物浓度,
新平衡状态下的反应速率一定大于原平衡状态;
减小浓度,新平衡状态下的速率一定小于原平衡状态。
③改变固体或纯液体的量,其浓度不变,速率不变,平衡不移动。
④反应物有两种或两种以上, 增加一种物质的浓度,
该物质的平衡转化率降低, 而其他物质的转化率提高。
课堂练习1、可逆反应H2O(g) + C(s) CO(g) + H2(g)在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO的浓度有何变化?
①增大水蒸气浓度
②加入更多的碳
③增加H2浓度
①平衡正向移动,CO浓度增大
②平衡不移动,CO浓度不变
③平衡逆向移动,CO浓度减小
2.压强对化学平衡的影响——实验探究
实验原理
2NO2(g) N2O4(g)
红棕色 无色
实验现象:
气体颜色 先变深 后变浅
气体颜色 先变浅 后变深
课本P35实验2—2
压缩体积(压强增大), 颜色先变深 后变浅
c(NO2)变大 c(NO2)变小(消耗NO2 )
平衡向正反应即气体体积减小的方向移动
增大体积(压强减小) 颜色先变浅 后变深
c(NO2)变小 c(NO2) 变大(生成NO2 )
平衡向逆反应即气体体积增大的方向移动
2NO2(g) N2O4(g)
红棕色 无色
实验结论及解释:
说明:
体积减小:即气体分子数目减少
体积增大:即气体分子数目增多
实验 (同温度下) 压强 各物质浓度 (mol·L-1) 浓度商 (Q ) 平衡移动方向
NO2 N2O4 原化学平衡容器容积为V p a b
增大压强缩小容积至V /2时
减小压强扩大容积至2V 时
2NO2(g) N2O4(g)
2P
Q1==K
2a
2b
Q2===
压强对化学平衡的影响——理论分析
Q3===2K
正反应(气体分子数减小)方向移动
逆反应(气体分子数增加)方向移动
2NH3(g) N2(g)+3H2 (g)
同样方法研究:当温度不变时K不变
增大压强体积缩小
减小压强体积扩大
Q>K平衡逆反应(气体分子数减小)方向移动
Q
v (逆)
v'正=v'逆
v正=v逆
v (逆)
v (正)
v'正=v'逆
压强对化学平衡的影响——图像分析
增大压强
v (正)
v (逆)
v'正=v'逆
v正=v逆
v (逆)
v (正)
v'正=v'逆
减小压强
2NO2(g) N2O4(g)
2NH3(g) N2(g) + 3H2 (g)
提示——压强对气体分子数大的方向速率影响大
N
v'正=v'逆
压强对化学平衡的影响——图像分析
增大压强
v'正=v'逆
减小压强
H2(g)+I2(g) 2HI(g)
提示——压强对气体分子数大的方向速率影响大
H2(g)+I2(g) 2HI(g)
同样方法研究:当温度不变时K不变
增大压强体积缩小
减小压强体积扩大
Q=K平衡不移动
Q=K平衡不移动
现以mA(g)+nB(g) pC(g)+qD(g)为例进行说明。
若m+n=p+g,增大压强,平衡_______________;
若m+n>p+q,增大压强,平衡_______________;
若m+n
结论:
说明:
体积减小:即气体分子数目减少
体积增大:即气体分子数目增多
增减减增
压强对化学平衡的影响注意事项
在一定温度下的密闭容器中存在2NO2(气) N2O4(气)平衡,先保持容器容积不变,充入Ar气以增大压强后,正逆反应速率将如何变化?平衡将如何移动?
若保持压强不变,充入Ar气,正逆反应速率如何变化?平衡如何移动?
⑴正逆反应速率均不变;平衡不移动。
⑵正逆反应速率均减小;平衡逆向移动。
压强的改变必须影响气体的浓度才影响速率,当正逆反应速率改变不同时,平衡才会发生移动
课堂练习2、 在一定温度下的密闭容器中发生反应
xA(g)+y B(g) zC(g) , 平衡后时测得A的浓度为0.5mol/L。保持温度不变,将容器的容积扩大到原来的2倍,再达平衡,测得A的浓度为0.3mol/L下列有关判断的是( )
A.x+y
CD
提示:容积扩大2倍,A的浓度先变为0.25mol/L,平衡向逆反应方向移动,达平衡为0.3mol/L。正反应气体体积缩小。
3.温度对化学平衡的影响——实验探究
实验原理
热水
冰水
实验现象:
颜色变深
2NO2(g) N2O4(g) ΔH=-56.9 kJ·mol-1
颜色变浅
受热 颜色变深 C(NO2)增大,即平衡向逆反应(吸热反应)方向移动;
遇冷 颜色变浅 C(NO2)减小,即平衡向正反应(放热反应)方向移动。
解释:
2NO2(g) N2O4(g) ΔH=-56.9 kJ·mol-1
在其他条件不变的情况下:
升高温度,平衡向吸热反应方向移动;
降低温度,平衡向放热反应方向移动。
实验结论
升吸降放
对于放热反应,升温使K减小,Q>K,平衡向逆反应方向(吸热方向)移动。
对于吸热反应,升温使K增大,Q
温度对化学平衡的影响——理论分析
温度 623K 698K 763K
平衡常数 66 .9 54.4 45.9
不同温度下 的平衡常数
H2(g) + I2(g) 2HI(g) △H<0
区分
正反应是吸热反应
v (正)
v (逆)
v'正=v'逆
v正=v逆
v (逆)
v (正)
v'正=v'逆
温度对化学平衡的影响——图像分析
正反应是放热反应
升高温度
正反应是吸热反应
v (正)
v (逆)
v'正=v'逆
v正=v逆
v (逆)
v (正)
v'正=v'逆
正反应是放热反应
降低温度
课堂练习3、关节炎是因为在关节滑液中形成了尿酸钠晶体,尤其是在寒冷季节易诱发关节疼痛,其化学机理如下:
①HUr(尿酸)+H2O Ur-(尿酸根离子)+H3O+,
②Ur-(aq)+Na+(aq) NaUr(s)。
下列对反应②的叙述正确的是( )
A.正反应为吸热反应
B.正反应为放热反应
C.升高温度,平衡向正反应方向移动
D.降低温度,平衡向逆反应方向移动
B
催化剂降低了反应的活化能,正反应的活化能降低,逆反应的活化能也降低,正逆反应的活化分子百分数增加倍数相同,正逆反应速率增加的倍数也相等。不能改变达到平衡状态的反应混合物的组成,只改变到达平衡的时间。
催化剂同等程度地改变正反应速率和逆反应速率(v'正=v'逆)
平衡不移动,但会改变反应到达平衡所需要的时间(反应速率)。
4、催化剂对化学平衡的影响——理论分析
v'正=v'逆
催化剂对化学平衡的影响图像分析
课堂练习4、 对某一可逆反应来说,使用催化剂的作用是( )
A. 提高反应物的平衡转化率
B. 以同样程度改变正逆反应的速率
C. 增大正反应速率,降低逆反应速率
D. 改变平衡混合物的组成
B
外界条件的改变 平衡移动方向 平衡移动结果
浓度 增大反应物浓度 / 减小生成物浓度 向正反应方向移动 反应物浓度减小
/ 生成物浓度增大
减小反应物浓度 / 增大生成物浓度 向逆反应方向移动 反应物浓度增大
/ 生成物浓度减小
温度 升高温度 向吸热反应方向移动 体系温度降低
降低温度 向放热反应方向移动 体系温度升高
压强 反应前后 气体分子总数改变 增大压强 向气体分子总数减小 的方向移动 体系压强减小
减小压强 向气体分子总数增大 的方向移动 体系压强增大
反应前后 气体分子总数不变 改变压强 平衡不移动
催化剂 使用催化剂 平衡不移动
四、勒沙特列原理:
如果改变影响平衡的一个条件(如浓度、压强、温度)平衡就向能够减弱这种改变的方向移动。这就是勒沙特列原理。
注:①此原理只适用于已达平衡的体系
②原理的适用范围是只有一项条件变化的情况(温度或压强或一种物质的浓度),当多项条件同时发生变化时,情况比较复杂;
③平衡移动的结果只能减弱(不可能抵消)外界条件的变化。
增谁减谁
增(减)者必增(减)
移动方向
移动结果
总结
减谁增谁
实验原理
2NO2(g) N2O4(g)
红棕色 无色
实验现象:
气体颜色先变深,后变浅,最终比原来深
气体颜色先变浅,后变深,最终比原来浅
课本P35实验2—2
实例
讨论:反应N2(g)+3H2 (g) 2NH3 (g) △H<0 ,达到化学平衡,改变下列条件,根据反应体系中的变化填空:
①若N2的平衡浓度为a mol/L,其他条件不变时,充入N2使其浓度增大到b mol/L后平衡向——————方向移动,达到新平衡后, N2的浓度为c mol/L,则a、b、c的大小为———————;
②若平衡体系的压强为P1 ,之后缩小反应体系体积使压强增大到P2 ,此时平衡向——————方向移动,达到新平衡后 体系的压强为P3 ,则P1 、 P2、 P3 的大小为——————————;
③若平衡体系的温度为T1 ,之后将温度升高到 T2 ,此时平衡向——————方向移动,达到新平衡后 体系的温度为T3 ,则T1 、 T2、 T3 的大小为——————————。
正反应
a< c < b
正反应
P1 < P3< P2
逆反应
T1 < T3< T2
课堂小结
化学平衡的移动
原因
方向
改变条件使v正 ≠ v逆
v正 >v逆 Q
影响化学平衡的因素
浓度
压强
温度
增减减增
增减减增
升吸降放
1、已知在氨水中存在下列平衡:
NH3 + H2O
NH3· H2O
NH4+ + OH-
(1)、向氨水中加入MgCl2固体,平衡向 _______________ 移动,
OH-浓度 _______ , NH4+ 浓度_________ 。
(2)、向氨水中加入浓盐酸,平衡向 _____________移动,
此时溶液中浓度减小的粒子有__________________________。
(3)、向氨水中加入少量NaOH固体,平衡向_____________移动,
此时发生的现象是__________________ 。
正反应方向
减小
增大
正反应方向
OH-、NH3·H2O、NH3
逆反应方向
有气体放出
课堂小练
2、将5mL0.005mol·L-1FeCl3溶液和5mL0.015mol·L-1KSCN溶液混合,达到平衡后混合液呈红色。再将混合液分为5等份,分别进行如下实验:
下列说法不正确的是( )
A.实验②中溶液颜色比实验①中深
B.对比实验①和③,可证明增加反应物中某些离子的浓度,平衡发生逆向移动
C.对比实验①和④,可证明增加反应物浓度,平衡发生正向移动
D.对比实验①和⑤,可证明减少反应物浓度,平衡发生逆向移动
B
3、一定量的混合气体在密闭容器中发生反应:
m A (g) + n B (g) p C (g)
达到平衡后,温度不变,将气体体积缩小到原来的1/2但达到平衡时,C的浓度为原来的1.8倍,则下列说法正确的是( )
A、m + n > p
B、A 的转化率降低
C、平衡向正反应方向移动
D、C的体积分数增加
B
4、反应:A(g)+3B(g) 2C(g) ΔH<0 达平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率都变小,平衡向正反应方向移动
D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动
C
V’正
v
t
V正
V逆
V’逆
V’正=V’逆
5、有反应aA + bB cC + dD其中反应物与生成物均为气体,达到平衡后其他条件不变,改变压强,则下图适合哪种情况( )
A、a+b
C、a+b
B
