人教版九年级上 第三单元 课题2 原子的构成 课件(共34张PPT)
文档属性
| 名称 | 人教版九年级上 第三单元 课题2 原子的构成 课件(共34张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-01-07 22:33:59 | ||
图片预览










文档简介
(共33张PPT)
课题二
教法分析
教材分析
教学过程
学法指导
板书设计
本课题可以帮助学生更深入地认识物质的微观构成,是学生学习离子及相关化学计算的理论基础,有着重要的地位。
一、教材分析
(一)地位与作用
(二)教学重点和难点:
1、教学重点:
①原子的构成
②原子中各粒子之间的数量关系
2、教学难点:
帮助学生建立“原子构成”的模型
一、教材分析
(三)教学目标
3、情感态度与价值观
利用探究激发学生学习化学的兴趣,感受探究学习的历程,树立学习的自 信心。
对学生进行物质的可分性的辩证唯物主义观点教育,和情感教育。
2、过程与方法
学会从史料、图片、表格中运用观察、分析归纳的方法获取信息,并对收集的信息进行加工处理,提高自主探究的能力。
1、知识与技能
了解原子是由质子、中子和电子构成的。
初步了解相对原子质量的概念,并学会查 相对原子质量表。
一、教材分析
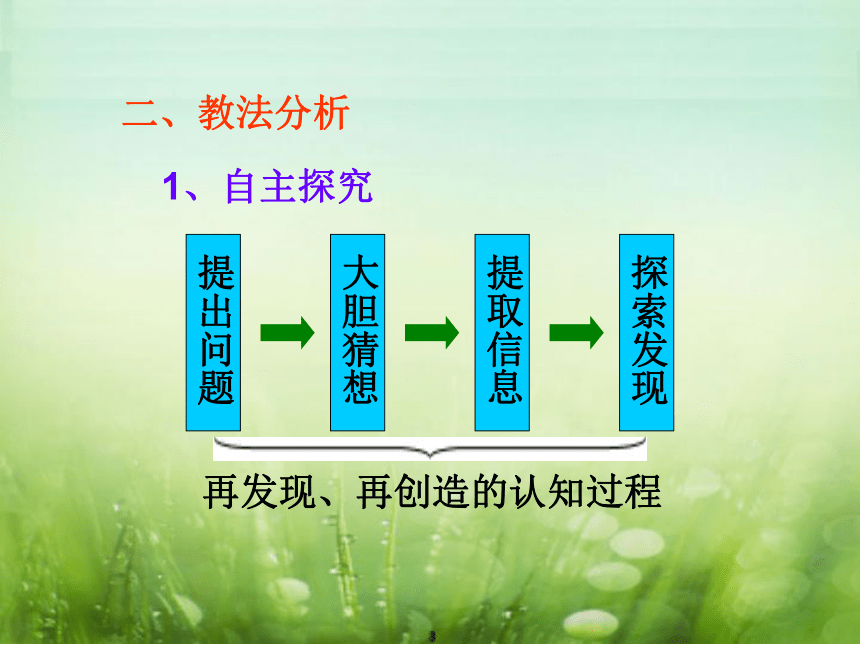
1、自主探究
提出问题
大胆猜想
提取信息
探索发现
再发现、再创造的认知过程
二、教法分析
以学案为载体,为学生的探究活动导航,以培养他们建构知识的能力。
二、教法分析
2、学案导学
提供多种形式的资料
增强感性认识
二、教法分析
3、多媒体辅助教学
学生在教师创设的各种情景下,主动参与建立原子微观模型的过程,理解相对原子质量并会查阅,领悟自主学习和科学探究的方法。
三、学法指导
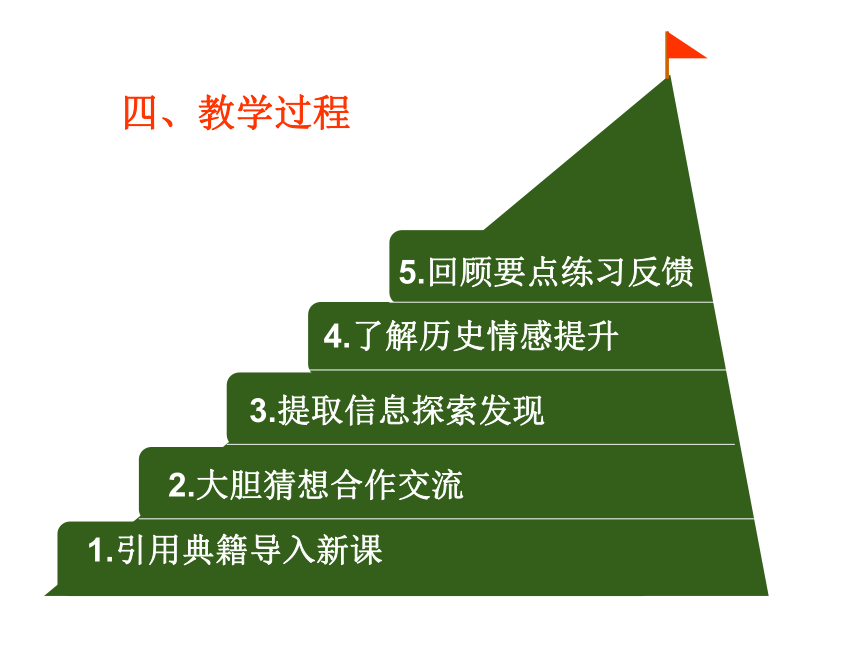
4.了解历史情感提升
1.引用典籍导入新课
2.大胆猜想合作交流
3.提取信息探索发现
5.回顾要点练习反馈
四、教学过程
一尺之棰(木棍),日取其半,万世不竭。
庄子
……
如果将木棍一直分下去,你认为可以分到什么程度?
原子是否可以再分?
你想象中的原子是什么样的
原子就象太阳系一样……
原子就象乒乓球一样……
大多数带正电的α粒子能够穿透金箔而不改变方向,说明原子是否为实心球体?
少数带正电的α粒子发生方向上的偏转,极少数带正电的α粒子被反弹,说明原子的构成是否像乒乓球一样,内部完全是空的?
根据实验现象,你认为相对来说,原子核外的空间是否很大?
假如“我”是卢瑟福,该怎样解释这些现象?
原子内部的空间“很大”
原子
原子核
从中你能获得关于原子构成的哪些信息
原子的构成示意图
原子核中有带正电的粒子和不带电的粒子…
原子
原子核
核外电子
质子
中子
(每个质子带一个单位正电荷)
(不带电)
(每个电子带一个单位的负电荷)
学案一(用于总结原子构成)
学案一、用“包含与被包含”的形式表示原子的构成
学案二、
(用于研究原子中各粒子之间的数量关系)
学案二、
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
铁 26 30 26
不同种类的原子,核内质子数不同,其核外电子数也不同。此外,你还有哪些发现?
氢原子的原子核内没有中子
原子中质子数等于电子数
质子数与中子数不一定相等……
原子的质量太小了,给计算和书写带来不便,该怎样解决呢?
原子 实际质量
氢 1.674×10-27Kg
氧 2.657×10-26Kg
铁 9.288×10-26Kg
二、相对原子质量
国际上以一种碳原子(原子核中有6个质子和6个中子)质量的1/12为标准,其它原子质量跟它相比较所得的比,作为这种原子的相对原子质量。
原子 实际质量 相对原子质量
氢 1.674×10-27Kg 1
氧 2.657×10-26Kg 16
铁 9.288×10-26Kg 56
张青莲教授是我国科学院院士,于1983年当选为国际原子量委员会委员,主持测定了铟、铱、锌等元素的相对原子质量,为相对原子质量的测定作出了卓越贡献。这是国际上第一次采用中国测定的相对原子质量数据。这不仅说明中国人的科学水平有国际竞争能力,更重要的是为中国人民长了志气。
学案三、
(用于研究相对原子质量的数值与哪些粒子数有关)
原子种类 质子数 中子数 核外电子数 相对原子质量
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
铁 26 30 26
1.利用P75“常见元素的名称、符号和相对原子质量表”填写表中“相对原子质量”一栏。
2.仔细观察上表,你又有什么新发现?
学案四、
(用于得出“原子的质量主要集中在原子核上”的结论,并修正前面的错误结论。)
粒子种类 质量(kg)
质子 1.6726×10-27
中子 1.6749×10-27
电子 质子质量的1/1836
仔细分析表中的数据,你发现了什么?
实验证明,质子和中子是由更小的微粒“夸克”构成。有关夸克的结构和性质仍有探索和研究中……
从原子结构模型的演变你想到了些什么?
本节课我们要知道什么?
1、原子的内部结构,构成原子的各种微粒 数之间的数量关系。
2、表示原子质量的方法——相对原子质量
1.原子核由( )
A.电子和质子构成
B.质子和中子构成
C.电子和中子构成
D.质子、中子和电子构成
2.1934年,卢瑟福等科学家通过核反应发现氢的同位素原子——氚。 氚原子的模型如图所示,图中“●”表示的粒子是
A.原子核 B.质子
C.中子 D.核外电子
3.我国著名化学家张青莲教授与另一位科学家合作,测定了铟元素的相对原子质量新值。铟元素的核电荷数为49,相对原子质量为115。铟原子的核外电子数为( )
A.115 B.49 C.66 D.164
4.碳的相对原子质量为( )
A.12/g B.12
C.1.66×10-27kg D.1/12g
5.据中央电视台对云南某湖底古城考古的现场报道,科学家曾通过测定古生物遗骸中的碳-14含量来推断古城年代。碳-14原子的核电荷数为6,相对原子质量为14,下列关于碳-14原子的说法中,错误的是( )
A.中子数为6 B.质子数为6
C.电子数为6 D.质子数与中子数之和为14
五、板书设计
课题一 原子的构成
1、原子
原子核
核外电子(每个电子带一个单位的负电荷)
质子(每个质子带一个单位的正电荷)
中子
2、核电荷数=质子数=电子数
一 、 原子的构成
二、相对原子质量(Ar)
1、Ar =
碳原子质量的1/12
该原子的实际质量
2、相对原子质量的数值近似
等于质子数与中子数之和。
课题二
教法分析
教材分析
教学过程
学法指导
板书设计
本课题可以帮助学生更深入地认识物质的微观构成,是学生学习离子及相关化学计算的理论基础,有着重要的地位。
一、教材分析
(一)地位与作用
(二)教学重点和难点:
1、教学重点:
①原子的构成
②原子中各粒子之间的数量关系
2、教学难点:
帮助学生建立“原子构成”的模型
一、教材分析
(三)教学目标
3、情感态度与价值观
利用探究激发学生学习化学的兴趣,感受探究学习的历程,树立学习的自 信心。
对学生进行物质的可分性的辩证唯物主义观点教育,和情感教育。
2、过程与方法
学会从史料、图片、表格中运用观察、分析归纳的方法获取信息,并对收集的信息进行加工处理,提高自主探究的能力。
1、知识与技能
了解原子是由质子、中子和电子构成的。
初步了解相对原子质量的概念,并学会查 相对原子质量表。
一、教材分析
1、自主探究
提出问题
大胆猜想
提取信息
探索发现
再发现、再创造的认知过程
二、教法分析
以学案为载体,为学生的探究活动导航,以培养他们建构知识的能力。
二、教法分析
2、学案导学
提供多种形式的资料
增强感性认识
二、教法分析
3、多媒体辅助教学
学生在教师创设的各种情景下,主动参与建立原子微观模型的过程,理解相对原子质量并会查阅,领悟自主学习和科学探究的方法。
三、学法指导
4.了解历史情感提升
1.引用典籍导入新课
2.大胆猜想合作交流
3.提取信息探索发现
5.回顾要点练习反馈
四、教学过程
一尺之棰(木棍),日取其半,万世不竭。
庄子
……
如果将木棍一直分下去,你认为可以分到什么程度?
原子是否可以再分?
你想象中的原子是什么样的
原子就象太阳系一样……
原子就象乒乓球一样……
大多数带正电的α粒子能够穿透金箔而不改变方向,说明原子是否为实心球体?
少数带正电的α粒子发生方向上的偏转,极少数带正电的α粒子被反弹,说明原子的构成是否像乒乓球一样,内部完全是空的?
根据实验现象,你认为相对来说,原子核外的空间是否很大?
假如“我”是卢瑟福,该怎样解释这些现象?
原子内部的空间“很大”
原子
原子核
从中你能获得关于原子构成的哪些信息
原子的构成示意图
原子核中有带正电的粒子和不带电的粒子…
原子
原子核
核外电子
质子
中子
(每个质子带一个单位正电荷)
(不带电)
(每个电子带一个单位的负电荷)
学案一(用于总结原子构成)
学案一、用“包含与被包含”的形式表示原子的构成
学案二、
(用于研究原子中各粒子之间的数量关系)
学案二、
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
铁 26 30 26
不同种类的原子,核内质子数不同,其核外电子数也不同。此外,你还有哪些发现?
氢原子的原子核内没有中子
原子中质子数等于电子数
质子数与中子数不一定相等……
原子的质量太小了,给计算和书写带来不便,该怎样解决呢?
原子 实际质量
氢 1.674×10-27Kg
氧 2.657×10-26Kg
铁 9.288×10-26Kg
二、相对原子质量
国际上以一种碳原子(原子核中有6个质子和6个中子)质量的1/12为标准,其它原子质量跟它相比较所得的比,作为这种原子的相对原子质量。
原子 实际质量 相对原子质量
氢 1.674×10-27Kg 1
氧 2.657×10-26Kg 16
铁 9.288×10-26Kg 56
张青莲教授是我国科学院院士,于1983年当选为国际原子量委员会委员,主持测定了铟、铱、锌等元素的相对原子质量,为相对原子质量的测定作出了卓越贡献。这是国际上第一次采用中国测定的相对原子质量数据。这不仅说明中国人的科学水平有国际竞争能力,更重要的是为中国人民长了志气。
学案三、
(用于研究相对原子质量的数值与哪些粒子数有关)
原子种类 质子数 中子数 核外电子数 相对原子质量
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
铁 26 30 26
1.利用P75“常见元素的名称、符号和相对原子质量表”填写表中“相对原子质量”一栏。
2.仔细观察上表,你又有什么新发现?
学案四、
(用于得出“原子的质量主要集中在原子核上”的结论,并修正前面的错误结论。)
粒子种类 质量(kg)
质子 1.6726×10-27
中子 1.6749×10-27
电子 质子质量的1/1836
仔细分析表中的数据,你发现了什么?
实验证明,质子和中子是由更小的微粒“夸克”构成。有关夸克的结构和性质仍有探索和研究中……
从原子结构模型的演变你想到了些什么?
本节课我们要知道什么?
1、原子的内部结构,构成原子的各种微粒 数之间的数量关系。
2、表示原子质量的方法——相对原子质量
1.原子核由( )
A.电子和质子构成
B.质子和中子构成
C.电子和中子构成
D.质子、中子和电子构成
2.1934年,卢瑟福等科学家通过核反应发现氢的同位素原子——氚。 氚原子的模型如图所示,图中“●”表示的粒子是
A.原子核 B.质子
C.中子 D.核外电子
3.我国著名化学家张青莲教授与另一位科学家合作,测定了铟元素的相对原子质量新值。铟元素的核电荷数为49,相对原子质量为115。铟原子的核外电子数为( )
A.115 B.49 C.66 D.164
4.碳的相对原子质量为( )
A.12/g B.12
C.1.66×10-27kg D.1/12g
5.据中央电视台对云南某湖底古城考古的现场报道,科学家曾通过测定古生物遗骸中的碳-14含量来推断古城年代。碳-14原子的核电荷数为6,相对原子质量为14,下列关于碳-14原子的说法中,错误的是( )
A.中子数为6 B.质子数为6
C.电子数为6 D.质子数与中子数之和为14
五、板书设计
课题一 原子的构成
1、原子
原子核
核外电子(每个电子带一个单位的负电荷)
质子(每个质子带一个单位的正电荷)
中子
2、核电荷数=质子数=电子数
一 、 原子的构成
二、相对原子质量(Ar)
1、Ar =
碳原子质量的1/12
该原子的实际质量
2、相对原子质量的数值近似
等于质子数与中子数之和。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
