1.6物质的分离 同步练习(含解析)
文档属性
| 名称 | 1.6物质的分离 同步练习(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 165.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-08-09 00:00:00 | ||
图片预览



文档简介
1.6物质的分离 同步练习
、选择题
小明在做过滤操作时,看到实验桌上有如下仪器:漏斗、烧杯、滤纸、玻璃棒、铁架台,他还需要( )
A.蒸发皿 B.铁圈 C.天平 D.酒精灯
据文字记载,我们的祖先在神农氏时代就开始利用海水晒盐。海水晒盐的原理是( )
A.日晒风吹使海水中的氯化钠蒸发
B.日晒风吹使溶液由饱和变为不饱和
C.日晒风吹使氯化钠的溶解度变小
D.日晒风吹使水分蒸发晶体析出
水是人类生活不可缺少的物质。日常生活中不少人喜欢喝纯净水,市售的纯净水有些就是蒸馏水。有关这类纯净水的下列说法正确的是( )
A.它是纯天然饮品,不含任何化学物质
B.它清洁、纯净,长期饮用对健康有益而无害
C.它含有人体所需的矿物质和多种微量元素
D.它可以通过自来水加热产生的水蒸气冷却而获得
《本草纲目》中“黄连”条目下记载:“吐血不止,取黄连一两,捣碎,加鼓二十粒,水煎去渣,温服。”该过程中没有涉及的操作是( )
A.加热 B.称量 C.过滤 D.蒸发结晶
饮用水受污染或短缺时,下列几个步骤将河水转化为饮用水:①化学沉降(用明矾)②消毒杀菌 (用漂白粉)③自然沉降④加热煮沸。以上处理过程最合理的顺序是( )
A.③②①④ B.③①②④ C.③①④② D.①③②④
下表是氯化钠和硝酸钾在不同温度下的溶解度,有关说法错误的是( )
温度/ ℃ 0 10 20 30 40 50 60 70 80
溶解度/克 氯化钠 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4
硝酸钾 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169
A.20 ℃时,氯化钠的溶解度为 36.0 克
B.两种物质溶解度相等的温度在 20 ℃~30 ℃之间
C.60 ℃时,11 克硝酸钾加入 10 克水中充分溶解,溶液刚好饱和
D.氯化钠中混有硝酸钾,可用冷却热饱和溶液结晶法得到较纯的氯化钠
下列各组混合物的分离,可选用蒸馏法的是( )。
A.从海水中分离蒸馏水
B.从粗盐中分离食盐和泥沙
C.从食盐和蔗糖的混合物中分离蔗糖
D.从硝酸钾溶液中分离硝酸钾
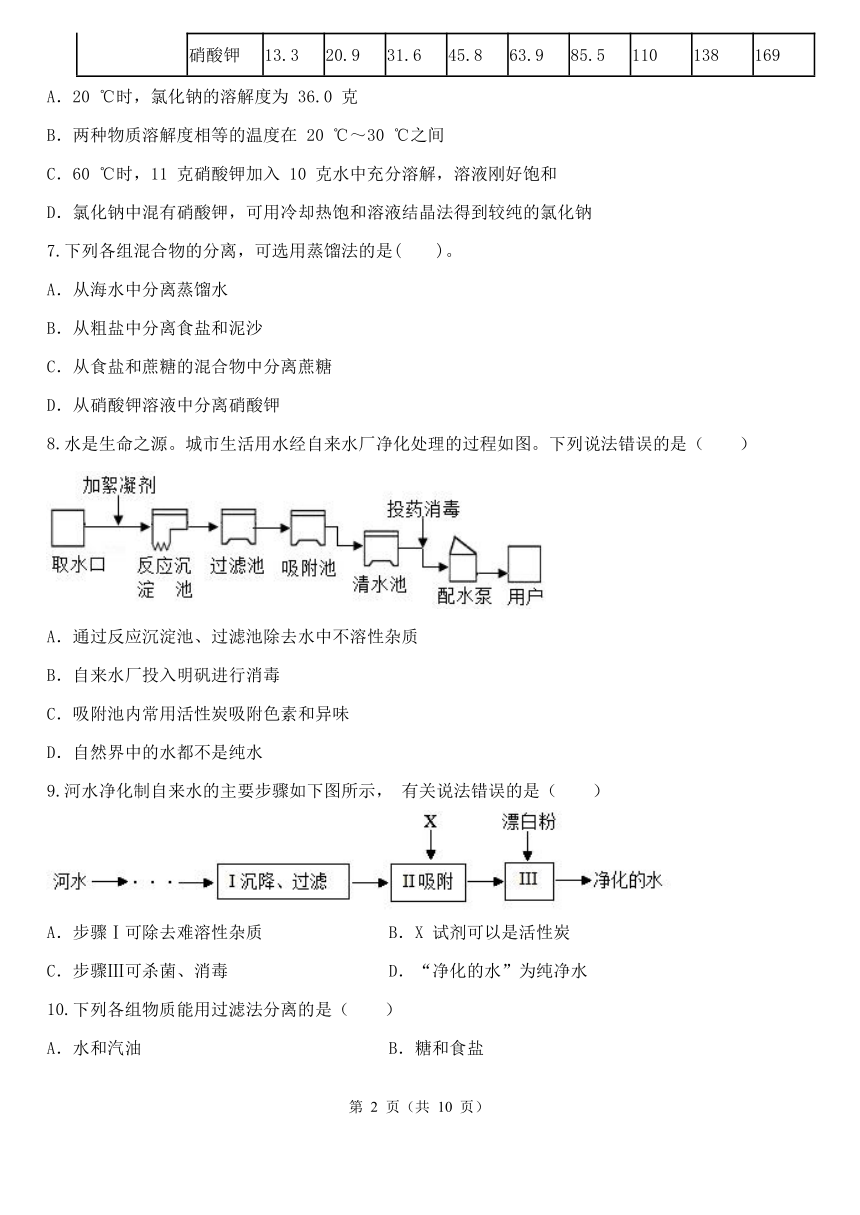
水是生命之源。城市生活用水经自来水厂净化处理的过程如图。下列说法错误的是( )
A.通过反应沉淀池、过滤池除去水中不溶性杂质
B.自来水厂投入明矾进行消毒
C.吸附池内常用活性炭吸附色素和异味
D.自然界中的水都不是纯水
河水净化制自来水的主要步骤如下图所示, 有关说法错误的是( )
A.步骤Ⅰ可除去难溶性杂质 B.X 试剂可以是活性炭
C.步骤Ⅲ可杀菌、消毒 D.“净化的水”为纯净水
下列各组物质能用过滤法分离的是( )
A.水和汽油 B.糖和食盐
C.沙子和硫酸铜 D.氧气和氮气
、填空题
氯化钠是生活必需品,也是重要的化工原料。提纯含少量泥沙的粗盐,一般经过以下操作流程:
(1)操作①中必须用到的一种仪器是________(填序号)。
A.研钵 B.量筒 C.烧杯 D.试管
(2)操作⑤中容易造成食盐飞溅,为减少飞溅,除连续搅拌外还可采取 等措施。
(3)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是________(填序号)。
A.食盐没有全部溶解即过滤
B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿
D.器皿上沾有的精盐没全部转移到称量纸上
某同学制作了如图所示的净化装置,实验时他设计了如下表格。
水体指标 水中漂浮物 水体的浑浊度 食盐含量 …
净化前
净化后
(1)利用该装置净化水后,表中三项水体指标在净化前后有明显变化的是 。
(2)你认为经过该装置得到的水能否直接饮用 ?请说明理由。
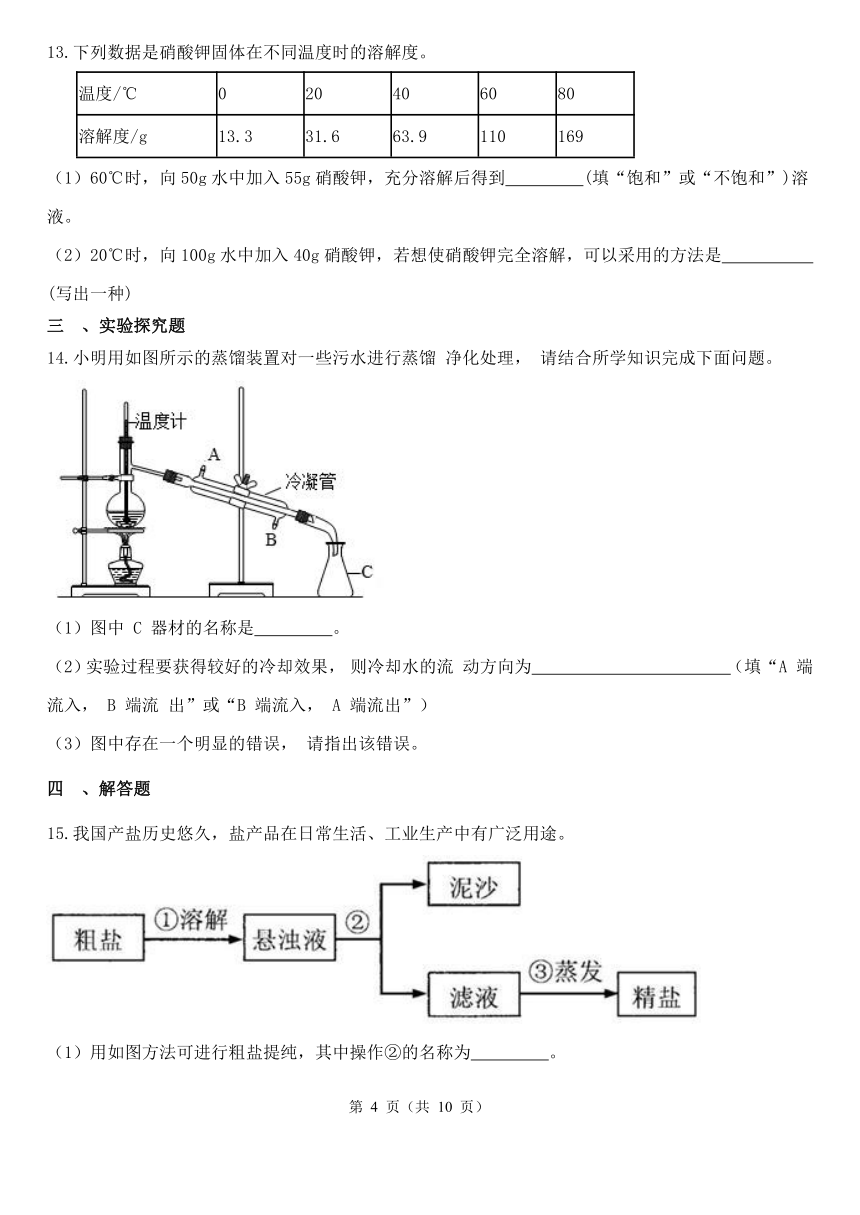
下列数据是硝酸钾固体在不同温度时的溶解度。
温度/℃ 0 20 40 60 80
溶解度/g 13.3 31.6 63.9 110 169
(1)60℃时,向50g水中加入55g硝酸钾,充分溶解后得到 (填“饱和”或“不饱和”)溶液。
(2)20℃时,向100g水中加入40g硝酸钾,若想使硝酸钾完全溶解,可以采用的方法是 (写出一种)
、实验探究题
小明用如图所示的蒸馏装置对一些污水进行蒸馏 净化处理, 请结合所学知识完成下面问题。
(1)图中 C 器材的名称是 。
(2)实验过程要获得较好的冷却效果, 则冷却水的流 动方向为 (填“A 端流入, B 端流 出”或“B 端流入, A 端流出”)
(3)图中存在一个明显的错误, 请指出该错误。
、解答题
我国产盐历史悠久,盐产品在日常生活、工业生产中有广泛用途。
(1)用如图方法可进行粗盐提纯,其中操作②的名称为 。
(2)现有10kg溶质质量分数为25%的食盐水,其溶液中溶质质量为 。
(3)若将20千克溶质质量分数为25%的食盐水,将其稀释到20%,需加水多少千克?
1.6物质的分离 同步练习答案解析
、选择题
B
【解析】根据过滤所需仪器进行分析。
过滤所需仪器有 漏斗、烧杯、滤纸、玻璃棒、铁架台 、铁圈;
故答案为:B。
D
【解析】溶液中的溶质结晶有两种方法:①冷却热饱和溶液;②蒸发溶剂,据此分析即可。
A.日晒风吹使海水中的水分蒸发,而不是氯化钠蒸发,故A错误;
B.日晒风吹使溶剂水的质量减小,那么溶液由不饱和溶液变为饱和溶液,故B错误;
C.日晒风吹时,溶液的温度没有改变,因此氯化钠的溶解度不变,故C错误;
D.日晒风吹使水分蒸发晶体析出,故D正确。
故选D。
D
【解析】根据蒸馏水为纯净的水,不含有其他杂质分析;根据蒸馏水的形成分析。
A.水本身就是一种化学物质,不符合题意;
B.蒸馏水是纯净的水,缺少人体所需矿物质,不能长期饮用,不符合题意;
C.蒸馏水不含其他杂质,不符合题意;
D.蒸馏水可以通过自来水加热产生的水蒸气冷却而获得,符合题意;
故答案为:D。
D
【解析】 利用物质的溶解性差异,将液体和不溶于液体的固体分离开来的一种方法。如用过滤法除去粗食盐中少量的泥沙 ; 蒸发结晶:加热蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出,叫蒸发结晶。
取黄连一两,捣碎,加鼓二十粒,水煎去渣,温服,含有称量、加热、过滤等从操作,没有涉及的操作是蒸发结晶;
故答案为:D.
B
【解析】根据水的净化的知识分析判断。
水的净化的基本环节包括:
③自然沉降,通过过滤去除其中的泥沙;
①化学沉降(用明矾),生成絮状物,除去水中的细小的颗粒;
②消毒杀菌 ,除去水中的细菌等微生物;
④加热煮沸,除去水中的钙、镁离子。
那么正确的顺序为③①②④。
故选B。
D
【解析】A.根据表中数据分析;
B、根据表中两种物质同温度下的溶解度分析;
C、根据溶解度计算一定量溶剂中最多溶解溶质质量分析;
D、根据结晶的原理及方法分析。
A. 20 ℃时,氯化钠的溶解度为 36.0 克 ,不符合题意;
B、由表中数据可知, 两种物质溶解度相等的温度在 20 ℃~30 ℃之间 ,不符合题意;
C、 60 ℃时,硝酸钾的溶解度为110g,所以11 克硝酸钾加入 10 克水中充分溶解,溶液刚好饱和 ,不符合题意;
D、 硝酸钾的溶解度受温度影响很大,氯化钠的溶解度受温度影响小,所以氯化钠中混有硝酸钾,可用蒸发结晶法得到较纯的氯化钠,不符合题意;
故答案为:D。
A
【解析】根据蒸馏的原理分析,结合过滤、结晶等分离方法解答。
A.从海水中分离蒸馏水需用蒸馏法,符合题意;
B、从粗盐中分离食盐和泥沙可用过滤法 ,不符合题意;
C、从食盐和蔗糖的混合物中分离蔗糖可用结晶 ,不符合题意;
D、从硝酸钾溶液中分离硝酸钾可用结晶法,不符合题意;
故选A.
B
【解析】根据对水的净化过程的认识分析判断。
A.通过反应沉淀池、过滤池除去水中不溶性杂质,故A正确不合题意;
B.自来水厂投入明矾,吸附水中不溶性的微小颗粒物,故B错误符合题意;
C.吸附池内常用活性炭吸附色素和异味,故C正确不合题意;
D.自然界中的水都不是纯水,故D正确不合题意。
故选B。
D
【解析】根据水的净化的过程分析判断。
A.步骤Ⅰ可除去难溶性杂质和固体颗粒物,故A正确不合题意;
B.X 试剂可以是活性炭,活性炭具有吸附性,可以吸附色素和异味,故B正确不合题意;
C.步骤Ⅲ中的漂白粉可杀菌、消毒,故C正确不合题意;
D.“净化的水”中仍然存在大量的可溶性的矿物质,属于混合物,而不是纯净物,故D错误符合题意。
故选D。
C
【解析】根据过滤的原理分析,过滤是固体和液体分离的一种操作。
A. 水和汽油都是液体,不能用过滤分离,不符合题意;
B、 糖和食盐都是可溶性固体,不符合题意;
C、沙子不溶于水,硫酸铜易溶于水,可用过滤方法分离,符合题意;
D、氧气和氮气都属于气体,不能用过滤分离,不符合题意;
故选C。
、填空题
(1)A
(2)间断加热
(3)A;B;D
【解析】(1)根据改变固体颗粒大小的方法来分析;
(2)在蒸发结晶的过程中,如果温度过高,散热不够,那么会造成飞溅,此时可以加热一会后拿去酒精灯,然后再进行加热的方法,从而减小飞溅的情形。
(3)根据计算精盐制得率的方法来分析。
(1)操作①把大颗粒的粗盐加工成小颗粒,可用研钵研磨,故选A;
(2)操作⑤中容易造成食盐飞溅,为减少飞溅,除连续搅拌外还可采取间断加热等措施。
(3)A.食盐没有全部溶解即过滤会造成制得率较低,故A符合题意;
B.蒸发时食盐飞溅剧烈会造成制得率较低,故B符合题意;
C.蒸发后,所得精盐很潮湿会造成制得率较高,故C不合题意;
D.器皿沾有的精盐没全部转移到称量纸上会造成制得率较低,故D不合题意。
故选ABD。
(1)水中漂浮物、水体的浑浊度
(2)不能。因为这样得到的水中含有微生物,还可能含有一些可溶性物质。
【解析】图中是简单的净水器,石头、棉花可以除去水中难容的杂质,活性炭可以吸附色素和异味。
(1)如图为净化装置,使用该装置净化水后,净化后的水中漂浮物和水体的浑浊度有明显变化。
(2)虽然经过该净化装置的水清洁度提高,但水中依旧存在各种微生物,因此不适合直接饮用。
故答案为:(1)水中漂浮物、水体的浑浊度(2)不能。因为这样得到的水中含有微生物,还可能含有一些可溶性物质。
(1)饱和
(2)升高温度(增加溶剂)
【解析】(1)相同温度下,饱和溶液的溶质质量分数相等,据此计算出60℃时50g水中溶解硝酸钾的最大质量,然后与55g进行比较,从而确定是否饱和。
(2)在相同温度下,硝酸钾的溶解度不变,则硝酸钾的溶解量与溶剂水的质量成正比。当溶剂水的质量不变时,增大硝酸钾的溶解度,也能增大硝酸钾的溶解量,据此分析解答。
(1)根据表格可知,60℃时硝酸钾的溶解度为110g,则50g水中溶解硝酸钾的最大质量:,那么充分溶解后得到饱和溶液。
(2)20℃时,向100g水中加入40g硝酸钾,若想使硝酸钾完全溶解,可以采用的方法是:升高温度(增加溶剂)。
、实验探究题
(1)锥形瓶
(2)B 端流入,A 端流出
(3)温度计的玻璃泡没放在烧瓶支管口处(只要提到温度计的玻璃泡位置不对即给分)
【解析】(1)根据所指仪器的名称解答;
(2)让冷却水从下面的管流入,从上面的管流出,可以延长水的停留时间,从而增强冷凝效果;
(3)蒸馏是将液体沸腾产生的蒸气导入冷凝管,使之冷却凝结成液体的一种蒸发、冷凝的过程。蒸馏的时候温度计水银球的位置应该与蒸馏烧瓶支管口的下沿平齐。
(1)图中 C 器材的名称是锥形瓶。
(2)实验过程要获得较好的冷却效果, 则冷却水的流动方向为B 端流入,A 端流出;
(3)图中存在一个明显的错误, 错误为:温度计的玻璃泡没放在烧瓶支管口处。
、解答题
(1)过滤
(2)2.5kg
(3)设需要加水的质量为x,根据溶液稀释前后,溶质的质量不变,
则20kg×25%=(x+20)×20%
x=5kg
【解析】(1)根据过滤操作原理分析;
(2)根据溶质质量=溶液质量×溶质质量分数分析;
(3)根据溶液稀释前后溶质质量相等分析。
(1) 操作②为固体与液体分离的操作,名称为过滤;
(2) 10kg溶质质量分数为25%的食盐水中溶质质量为10kg×25%=2.5kg;
(3) 设将20千克溶质质量分数为25%的食盐水稀释到20%后溶液质量为x
20kg×25%=20%x
x=25kg,则需加水质量为5kg;
故答案为:(1)过滤;(2)2.5kg;(3)5kg。
第 1 页(共 1 页)
、选择题
小明在做过滤操作时,看到实验桌上有如下仪器:漏斗、烧杯、滤纸、玻璃棒、铁架台,他还需要( )
A.蒸发皿 B.铁圈 C.天平 D.酒精灯
据文字记载,我们的祖先在神农氏时代就开始利用海水晒盐。海水晒盐的原理是( )
A.日晒风吹使海水中的氯化钠蒸发
B.日晒风吹使溶液由饱和变为不饱和
C.日晒风吹使氯化钠的溶解度变小
D.日晒风吹使水分蒸发晶体析出
水是人类生活不可缺少的物质。日常生活中不少人喜欢喝纯净水,市售的纯净水有些就是蒸馏水。有关这类纯净水的下列说法正确的是( )
A.它是纯天然饮品,不含任何化学物质
B.它清洁、纯净,长期饮用对健康有益而无害
C.它含有人体所需的矿物质和多种微量元素
D.它可以通过自来水加热产生的水蒸气冷却而获得
《本草纲目》中“黄连”条目下记载:“吐血不止,取黄连一两,捣碎,加鼓二十粒,水煎去渣,温服。”该过程中没有涉及的操作是( )
A.加热 B.称量 C.过滤 D.蒸发结晶
饮用水受污染或短缺时,下列几个步骤将河水转化为饮用水:①化学沉降(用明矾)②消毒杀菌 (用漂白粉)③自然沉降④加热煮沸。以上处理过程最合理的顺序是( )
A.③②①④ B.③①②④ C.③①④② D.①③②④
下表是氯化钠和硝酸钾在不同温度下的溶解度,有关说法错误的是( )
温度/ ℃ 0 10 20 30 40 50 60 70 80
溶解度/克 氯化钠 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4
硝酸钾 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169
A.20 ℃时,氯化钠的溶解度为 36.0 克
B.两种物质溶解度相等的温度在 20 ℃~30 ℃之间
C.60 ℃时,11 克硝酸钾加入 10 克水中充分溶解,溶液刚好饱和
D.氯化钠中混有硝酸钾,可用冷却热饱和溶液结晶法得到较纯的氯化钠
下列各组混合物的分离,可选用蒸馏法的是( )。
A.从海水中分离蒸馏水
B.从粗盐中分离食盐和泥沙
C.从食盐和蔗糖的混合物中分离蔗糖
D.从硝酸钾溶液中分离硝酸钾
水是生命之源。城市生活用水经自来水厂净化处理的过程如图。下列说法错误的是( )
A.通过反应沉淀池、过滤池除去水中不溶性杂质
B.自来水厂投入明矾进行消毒
C.吸附池内常用活性炭吸附色素和异味
D.自然界中的水都不是纯水
河水净化制自来水的主要步骤如下图所示, 有关说法错误的是( )
A.步骤Ⅰ可除去难溶性杂质 B.X 试剂可以是活性炭
C.步骤Ⅲ可杀菌、消毒 D.“净化的水”为纯净水
下列各组物质能用过滤法分离的是( )
A.水和汽油 B.糖和食盐
C.沙子和硫酸铜 D.氧气和氮气
、填空题
氯化钠是生活必需品,也是重要的化工原料。提纯含少量泥沙的粗盐,一般经过以下操作流程:
(1)操作①中必须用到的一种仪器是________(填序号)。
A.研钵 B.量筒 C.烧杯 D.试管
(2)操作⑤中容易造成食盐飞溅,为减少飞溅,除连续搅拌外还可采取 等措施。
(3)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是________(填序号)。
A.食盐没有全部溶解即过滤
B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿
D.器皿上沾有的精盐没全部转移到称量纸上
某同学制作了如图所示的净化装置,实验时他设计了如下表格。
水体指标 水中漂浮物 水体的浑浊度 食盐含量 …
净化前
净化后
(1)利用该装置净化水后,表中三项水体指标在净化前后有明显变化的是 。
(2)你认为经过该装置得到的水能否直接饮用 ?请说明理由。
下列数据是硝酸钾固体在不同温度时的溶解度。
温度/℃ 0 20 40 60 80
溶解度/g 13.3 31.6 63.9 110 169
(1)60℃时,向50g水中加入55g硝酸钾,充分溶解后得到 (填“饱和”或“不饱和”)溶液。
(2)20℃时,向100g水中加入40g硝酸钾,若想使硝酸钾完全溶解,可以采用的方法是 (写出一种)
、实验探究题
小明用如图所示的蒸馏装置对一些污水进行蒸馏 净化处理, 请结合所学知识完成下面问题。
(1)图中 C 器材的名称是 。
(2)实验过程要获得较好的冷却效果, 则冷却水的流 动方向为 (填“A 端流入, B 端流 出”或“B 端流入, A 端流出”)
(3)图中存在一个明显的错误, 请指出该错误。
、解答题
我国产盐历史悠久,盐产品在日常生活、工业生产中有广泛用途。
(1)用如图方法可进行粗盐提纯,其中操作②的名称为 。
(2)现有10kg溶质质量分数为25%的食盐水,其溶液中溶质质量为 。
(3)若将20千克溶质质量分数为25%的食盐水,将其稀释到20%,需加水多少千克?
1.6物质的分离 同步练习答案解析
、选择题
B
【解析】根据过滤所需仪器进行分析。
过滤所需仪器有 漏斗、烧杯、滤纸、玻璃棒、铁架台 、铁圈;
故答案为:B。
D
【解析】溶液中的溶质结晶有两种方法:①冷却热饱和溶液;②蒸发溶剂,据此分析即可。
A.日晒风吹使海水中的水分蒸发,而不是氯化钠蒸发,故A错误;
B.日晒风吹使溶剂水的质量减小,那么溶液由不饱和溶液变为饱和溶液,故B错误;
C.日晒风吹时,溶液的温度没有改变,因此氯化钠的溶解度不变,故C错误;
D.日晒风吹使水分蒸发晶体析出,故D正确。
故选D。
D
【解析】根据蒸馏水为纯净的水,不含有其他杂质分析;根据蒸馏水的形成分析。
A.水本身就是一种化学物质,不符合题意;
B.蒸馏水是纯净的水,缺少人体所需矿物质,不能长期饮用,不符合题意;
C.蒸馏水不含其他杂质,不符合题意;
D.蒸馏水可以通过自来水加热产生的水蒸气冷却而获得,符合题意;
故答案为:D。
D
【解析】 利用物质的溶解性差异,将液体和不溶于液体的固体分离开来的一种方法。如用过滤法除去粗食盐中少量的泥沙 ; 蒸发结晶:加热蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出,叫蒸发结晶。
取黄连一两,捣碎,加鼓二十粒,水煎去渣,温服,含有称量、加热、过滤等从操作,没有涉及的操作是蒸发结晶;
故答案为:D.
B
【解析】根据水的净化的知识分析判断。
水的净化的基本环节包括:
③自然沉降,通过过滤去除其中的泥沙;
①化学沉降(用明矾),生成絮状物,除去水中的细小的颗粒;
②消毒杀菌 ,除去水中的细菌等微生物;
④加热煮沸,除去水中的钙、镁离子。
那么正确的顺序为③①②④。
故选B。
D
【解析】A.根据表中数据分析;
B、根据表中两种物质同温度下的溶解度分析;
C、根据溶解度计算一定量溶剂中最多溶解溶质质量分析;
D、根据结晶的原理及方法分析。
A. 20 ℃时,氯化钠的溶解度为 36.0 克 ,不符合题意;
B、由表中数据可知, 两种物质溶解度相等的温度在 20 ℃~30 ℃之间 ,不符合题意;
C、 60 ℃时,硝酸钾的溶解度为110g,所以11 克硝酸钾加入 10 克水中充分溶解,溶液刚好饱和 ,不符合题意;
D、 硝酸钾的溶解度受温度影响很大,氯化钠的溶解度受温度影响小,所以氯化钠中混有硝酸钾,可用蒸发结晶法得到较纯的氯化钠,不符合题意;
故答案为:D。
A
【解析】根据蒸馏的原理分析,结合过滤、结晶等分离方法解答。
A.从海水中分离蒸馏水需用蒸馏法,符合题意;
B、从粗盐中分离食盐和泥沙可用过滤法 ,不符合题意;
C、从食盐和蔗糖的混合物中分离蔗糖可用结晶 ,不符合题意;
D、从硝酸钾溶液中分离硝酸钾可用结晶法,不符合题意;
故选A.
B
【解析】根据对水的净化过程的认识分析判断。
A.通过反应沉淀池、过滤池除去水中不溶性杂质,故A正确不合题意;
B.自来水厂投入明矾,吸附水中不溶性的微小颗粒物,故B错误符合题意;
C.吸附池内常用活性炭吸附色素和异味,故C正确不合题意;
D.自然界中的水都不是纯水,故D正确不合题意。
故选B。
D
【解析】根据水的净化的过程分析判断。
A.步骤Ⅰ可除去难溶性杂质和固体颗粒物,故A正确不合题意;
B.X 试剂可以是活性炭,活性炭具有吸附性,可以吸附色素和异味,故B正确不合题意;
C.步骤Ⅲ中的漂白粉可杀菌、消毒,故C正确不合题意;
D.“净化的水”中仍然存在大量的可溶性的矿物质,属于混合物,而不是纯净物,故D错误符合题意。
故选D。
C
【解析】根据过滤的原理分析,过滤是固体和液体分离的一种操作。
A. 水和汽油都是液体,不能用过滤分离,不符合题意;
B、 糖和食盐都是可溶性固体,不符合题意;
C、沙子不溶于水,硫酸铜易溶于水,可用过滤方法分离,符合题意;
D、氧气和氮气都属于气体,不能用过滤分离,不符合题意;
故选C。
、填空题
(1)A
(2)间断加热
(3)A;B;D
【解析】(1)根据改变固体颗粒大小的方法来分析;
(2)在蒸发结晶的过程中,如果温度过高,散热不够,那么会造成飞溅,此时可以加热一会后拿去酒精灯,然后再进行加热的方法,从而减小飞溅的情形。
(3)根据计算精盐制得率的方法来分析。
(1)操作①把大颗粒的粗盐加工成小颗粒,可用研钵研磨,故选A;
(2)操作⑤中容易造成食盐飞溅,为减少飞溅,除连续搅拌外还可采取间断加热等措施。
(3)A.食盐没有全部溶解即过滤会造成制得率较低,故A符合题意;
B.蒸发时食盐飞溅剧烈会造成制得率较低,故B符合题意;
C.蒸发后,所得精盐很潮湿会造成制得率较高,故C不合题意;
D.器皿沾有的精盐没全部转移到称量纸上会造成制得率较低,故D不合题意。
故选ABD。
(1)水中漂浮物、水体的浑浊度
(2)不能。因为这样得到的水中含有微生物,还可能含有一些可溶性物质。
【解析】图中是简单的净水器,石头、棉花可以除去水中难容的杂质,活性炭可以吸附色素和异味。
(1)如图为净化装置,使用该装置净化水后,净化后的水中漂浮物和水体的浑浊度有明显变化。
(2)虽然经过该净化装置的水清洁度提高,但水中依旧存在各种微生物,因此不适合直接饮用。
故答案为:(1)水中漂浮物、水体的浑浊度(2)不能。因为这样得到的水中含有微生物,还可能含有一些可溶性物质。
(1)饱和
(2)升高温度(增加溶剂)
【解析】(1)相同温度下,饱和溶液的溶质质量分数相等,据此计算出60℃时50g水中溶解硝酸钾的最大质量,然后与55g进行比较,从而确定是否饱和。
(2)在相同温度下,硝酸钾的溶解度不变,则硝酸钾的溶解量与溶剂水的质量成正比。当溶剂水的质量不变时,增大硝酸钾的溶解度,也能增大硝酸钾的溶解量,据此分析解答。
(1)根据表格可知,60℃时硝酸钾的溶解度为110g,则50g水中溶解硝酸钾的最大质量:,那么充分溶解后得到饱和溶液。
(2)20℃时,向100g水中加入40g硝酸钾,若想使硝酸钾完全溶解,可以采用的方法是:升高温度(增加溶剂)。
、实验探究题
(1)锥形瓶
(2)B 端流入,A 端流出
(3)温度计的玻璃泡没放在烧瓶支管口处(只要提到温度计的玻璃泡位置不对即给分)
【解析】(1)根据所指仪器的名称解答;
(2)让冷却水从下面的管流入,从上面的管流出,可以延长水的停留时间,从而增强冷凝效果;
(3)蒸馏是将液体沸腾产生的蒸气导入冷凝管,使之冷却凝结成液体的一种蒸发、冷凝的过程。蒸馏的时候温度计水银球的位置应该与蒸馏烧瓶支管口的下沿平齐。
(1)图中 C 器材的名称是锥形瓶。
(2)实验过程要获得较好的冷却效果, 则冷却水的流动方向为B 端流入,A 端流出;
(3)图中存在一个明显的错误, 错误为:温度计的玻璃泡没放在烧瓶支管口处。
、解答题
(1)过滤
(2)2.5kg
(3)设需要加水的质量为x,根据溶液稀释前后,溶质的质量不变,
则20kg×25%=(x+20)×20%
x=5kg
【解析】(1)根据过滤操作原理分析;
(2)根据溶质质量=溶液质量×溶质质量分数分析;
(3)根据溶液稀释前后溶质质量相等分析。
(1) 操作②为固体与液体分离的操作,名称为过滤;
(2) 10kg溶质质量分数为25%的食盐水中溶质质量为10kg×25%=2.5kg;
(3) 设将20千克溶质质量分数为25%的食盐水稀释到20%后溶液质量为x
20kg×25%=20%x
x=25kg,则需加水质量为5kg;
故答案为:(1)过滤;(2)2.5kg;(3)5kg。
第 1 页(共 1 页)
同课章节目录
- 第1章 水和水的溶液
- 第1节 地球上的水
- 第2节 水的组成
- 第3节 水的浮力
- 第4节 物质在水中的分散状况
- 第5节 物质的溶解
- 第6节 物质的分离
- 第7节 水资源的利用、开发和保护
- 第2章 天气与气候
- 第1节 大气层
- 第2节 气温
- 第3节 大气的压强
- 第4节 风和降水
- 第5节 天气预报
- 第6节 气候和影响气候的因素
- 第7节 我国的气候特征与主要气象灾害
- 第3章 生命活动的调节
- 第1节 植物生命活动的调节
- 第2节 人体的激素调节
- 第3节 神经调节
- 第4节 动物的行为
- 第5节 体温的控制
- 第4章 电路探秘
- 第1节 电荷与电流
- 第2节 电流的测量
- 第3节 物质的导电性与电阻
- 第4节 变阻器
- 第5节 电压的测量
- 第6节 电流与电压、电阻的关系
- 第7节 电路分析与应用
- 研究性学习课题
- 一 测定本地区的“酸雨”情况及分析原因
- 二 太阳黑子活动与本地区降水的关系
- 三 训练小动物建立某种条件反射
- 四 调查在自然界或生命活动中的电现象
