【高中化学人教版(2019必修第一册同步训练】 第二节元素周期律(含答案)
文档属性
| 名称 | 【高中化学人教版(2019必修第一册同步训练】 第二节元素周期律(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-10 19:06:43 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
【高中化学人教版(2019必修第一册同步训练】
第二节元素周期律
一、单选题
1.短周期的两种元素A和B,它们的离子A-和B2+具有相同的电子层结构,下列说法中正确的是( )
A.原子序数A>B B.电子总数A->B2+
C.离子半径A->B2+ D.原子半径A>B
2.根据元素周期律,下列判断正确的是( )
A.碱性:NaOH > KOH > RbOH B.离子半径:Na+ > O2- > F-
C.热稳定性:HF>H2O>NH3 D.还原性:Na < Mg < Al
3.原子是一种很小的微粒。钠原子半径为 ,则a等于( )
A.9 B.10 C.11 D.12
4.短周期元素甲~戊在元素周期表中的相对位置如表所示,戊对应的氧化物具有两性。下列判断正确的是
甲 乙
丙 丁 戊
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.丙与氧元素组成的化合物只能含有离子键
D.丁的基态原子的电子排布式为
5.卤族元素有关性质比较正确的是( )
A.稳定性:HF>HCl>HBr>HI
B.氧化性:F2<Cl2<Br2<I2
C.熔沸点:F2>Cl2>Br2>I2
D.还原性:F﹣>Cl﹣>Br﹣>I﹣
6.短周期主族元素W、X、Y、Z的原子序数依次增大,其中元素W的简单氢化物与其最高价氧化物的水化物能发生反应生成一种盐,X元素在短周期中原子半径最大,Y的离子半径在同周期中最小,W和X的最外层电子数之和等于Z原子核外最外层电子数。下列说法正确的是( )
A.简单离子半径:Z>Y>W>X
B.X、Y、Z三种元素对应的最高价氧化物的水化物可以两两相互反应
C.工业上用电解X、Y对应的熔融氯化物来制取X、Y单质
D.Z的氧化物对应的水化物为强酸
二、多选题
7.短周期主族元素W、R、X、Y、Z的原子序数依次增大,W的原子半径是周期表中所有元素中最小的,R是地壳中含量最多的元素,X与W同主族,Y的最外层电子数是最内层电子数的3倍。下列说法正确的是( )
A.原子半径: R<Y<Z
B.气态氢化物的热稳定性: R>Y
C.R与X只能形成一种化合物
D.最高价氧化物的水化物的酸性: Z>Y
8.关于元素周期表的叙述中正确的是( )
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料元素
B.在过渡元素中可以寻找制备催化剂
C.在元素周期表的右上角可以寻找制备耐高温和耐腐蚀的元素
D.在地球上元素的分布和它们在元素周期表中的位置有密切关系
三、填空题
9.下表是元素周期表的一部分,表中所列字母分别代表某一元素。根据表中所列元素,回答下列问题:
(1)画出E的离子结构示意图: 。
(2)上表短周期元素中,金属性最强的是 (填元素名称);最高价氧化物对应水化物中酸性最强的物质 (填化学式,下同);简单气态氢化物最稳定的是 。
(3)表中E、F、G三元素可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小顺序是 (用离子符号表示)。
(4)H是目前人类使用最广泛的金属元素。B的最高价含氧酸稀溶液与足量H单质发生反应生成BO的离子方程式为 。
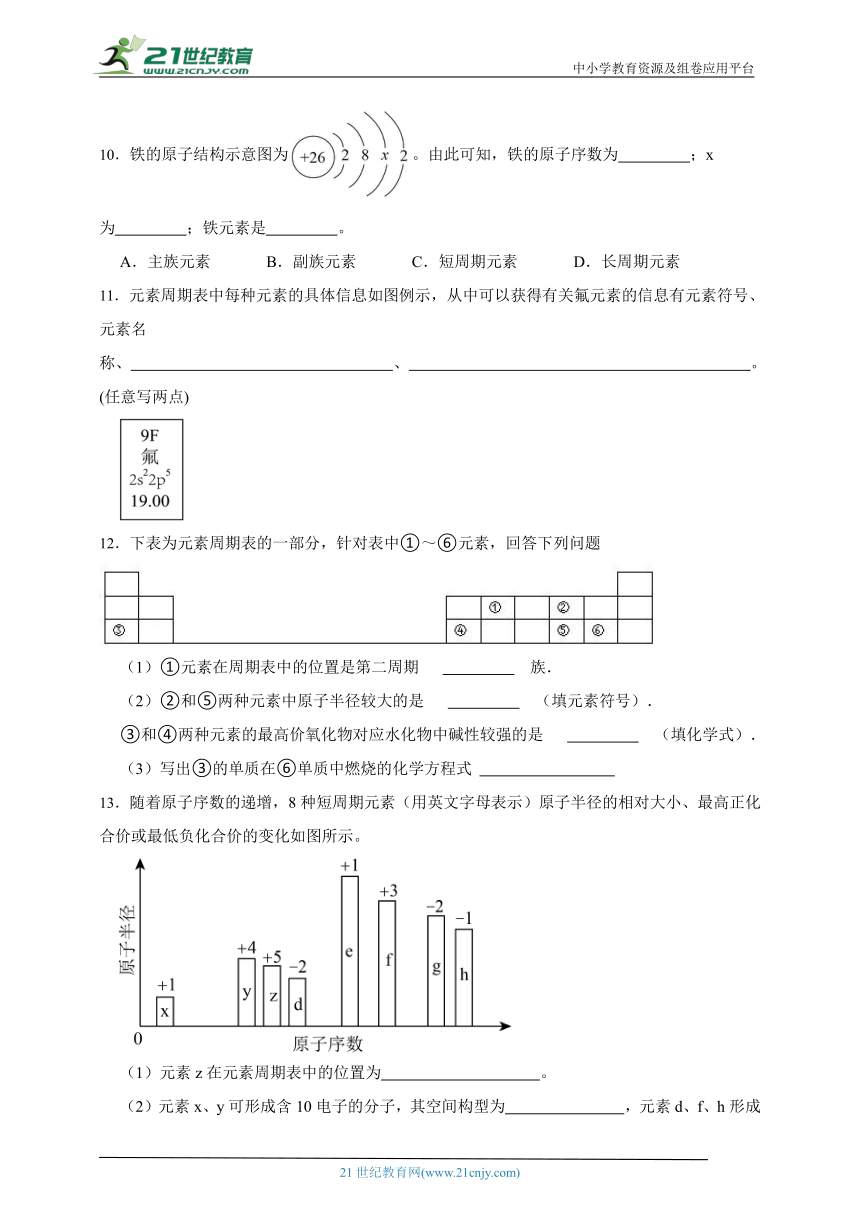
10.铁的原子结构示意图为。由此可知,铁的原子序数为 ;x为 ;铁元素是 。
A.主族元素 B.副族元素 C.短周期元素 D.长周期元素
11.元素周期表中每种元素的具体信息如图例示,从中可以获得有关氟元素的信息有元素符号、元素名称、 、 。(任意写两点)
12.下表为元素周期表的一部分,针对表中①~⑥元素,回答下列问题
(1)①元素在周期表中的位置是第二周期 族.
(2)②和⑤两种元素中原子半径较大的是 (填元素符号).
③和④两种元素的最高价氧化物对应水化物中碱性较强的是 (填化学式).
(3)写出③的单质在⑥单质中燃烧的化学方程式
13.随着原子序数的递增,8种短周期元素(用英文字母表示)原子半径的相对大小、最高正化合价或最低负化合价的变化如图所示。
(1)元素z在元素周期表中的位置为 。
(2)元素x、y可形成含10电子的分子,其空间构型为 ,元素d、f、h形成的简单离子,半径大小顺序为 (写离子符号)。
(3)下列说法不正确的是
A.e单质长期露置在空气中最终转化为碳酸盐
B.元素的氧化物对应水化物的酸性强弱:
C.物质中只含有极性共价键
D.两份等质量的单质分别与足量稀盐酸、溶液充分反应后,产生相同体积的气体(相同条件下)
(4)元素的非金属性:d g(用<、=、>来表示),判断依据是(用一个化学方程式来表示) 。
四、解答题
14.如图的虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它的列数和行数都多于元素周期表.请在下面的虚线框中用实线画出周期表第一至第六周期的轮廓,并画出金属与非金属的分界线.
五、实验探究题
15.探究学习小组同学为验证Cl的非金属性强于S,的氧化性强于,设计如目实验装置:
回答下列问题:
(1)仪器a的名称为 ,A装置中发生反应的离子方程式为 。
(2)能证明Cl的非金属性强于S的反应的离子方程式为 ,从原子结构角度看Cl的非金属性强于S的原因是 。
(3)装置H中的试剂为 。
(4)能证明的氧化性强于的明显实验现象是 ,对应的化学反应方程式为 。
六、综合题
16.为纪念元素周期表诞生150周年,IUPAC等向世界介绍了118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“、、”元素的代言人。请回答下列问题:
(1)上述元素中,属于短周期元素且原子最外层电子数最多的是 (填元素符号),其原子结构示意图是 。
(2)与硫元素同周期的元素,原子半径最大的是 (填元素符号)。其相应离子的电子式是 ;与硫元素同周期的元素,简单离子氧化性最强的是 (填离子符号)。
(3)图1为元素周期表中汞元素的信息示意图:图2为缺少信息的汞的原子结构示意图。
由此判断,汞元素位于元素周期表的第 周期,图1中200.59表示 ,图2中的= 。
(4)氮气分子的结构式是 ,氨气分子的空间结构是 。
(5)中国科学家成功合成了世界上首个“五氮负离子”的盐——。该固体盐中存在的化学键类型有 。1mol“五氮负离子”中所含的电子数目为
(6)我国晋代炼丹家、医学家葛洪所著《抱扑子》一书中记载有“丹砂烧之成水银,积变又还成丹砂”,即加热红色硫化汞(丹砂)分解出汞,而汞和硫黄又能重新变为红色硫化汞。下列说法错误的是___________。
A.上述反应涉及两种基本反应类型
B.汞蒸气有毒,中国古代“炼丹术”并不科学
C.丹砂与水银均可与稀硫酸反应生成氢气
D.应隔绝空气实现上述物质的转化
17.下表为元素周期表的一部分,请参照元素①﹣⑨在表中的位置,用化学用语回答下列问题:
族周期 IA 0
1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨
(1)写出⑧的原子结构示意图 .
(2)④、⑤、⑥的原子半径由大到小的顺序为 (用元素符号回答).
(3)②、③、⑦的最高价含氧酸的酸性由强到弱顺序是 (用化学式回答)
(4)③元素所形成单质的结构式为 .
(5)⑥的单质与①、⑨两种元素形成化合物的水溶液反应的离子方程式为: .
(6)⑤元素与⑨元素形成的化合物中,化学键类型为
七、推断题
18.如表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。试回答下列问题:
(1)基态e原子中电子占据最高能级的符号是 ,占据该能级电子的电子云轮廓图为 形,基态e原子核外共有 种不同运动状态的电子。
(2)元素i位于元素周期表的 区,基态核外电子的空间运动状态有 种。
(3)g的元素符号 ,其基态原子的价电子排布式为 。
(4)元素b、c、d的第一电离能从大到小的顺序是 。(用元素符号表示)
(5)写出元素h的价层电子排布图 。
(6)N能层只有一个电子的元素是
答案解析部分
1.【答案】C
【知识点】元素周期律和元素周期表的综合应用
2.【答案】C
【知识点】元素周期表中原子结构与元素性质的递变规律;微粒半径大小的比较
3.【答案】B
【知识点】微粒半径大小的比较
4.【答案】D
【知识点】原子核外电子排布;元素周期表的结构及其应用;微粒半径大小的比较
5.【答案】A
【知识点】元素周期表中原子结构与元素性质的递变规律;元素周期表的结构及其应用
6.【答案】B
【知识点】元素周期律和元素周期表的综合应用
7.【答案】B,D
【知识点】元素周期律和元素周期表的综合应用
8.【答案】A,B
【知识点】元素周期律和元素周期表的综合应用
9.【答案】(1)
(2)钠;HClO4;HF
(3)
(4)
【知识点】元素周期表中原子结构与元素性质的递变规律;元素周期表的结构及其应用;微粒半径大小的比较
10.【答案】26;14;BD
【知识点】元素周期表的结构及其应用
11.【答案】相对原子质量(答案合理即可);原子序数或价层电子排布(答案合理即可)
【知识点】元素周期表的结构及其应用
12.【答案】ⅣA;S;NaOH;2Na+Cl22NaCl
【知识点】元素周期律和元素周期表的综合应用
13.【答案】(1)第二周期第ⅤA族
(2)正四面体形;
(3)B;C
(4)>;
【知识点】元素周期表中原子结构与元素性质的递变规律;元素周期表的结构及其应用;元素周期律和元素周期表的综合应用;微粒半径大小的比较
14.【答案】解:
【知识点】元素周期律和元素周期表的综合应用
15.【答案】(1)圆底烧瓶;
(2);原子半径 小于 ,核电荷数Cl大于S,原子核对外层电子的吸引力Cl大于S
(3)碱石灰
(4)E中干燥管内产生大量白烟,干燥管内液面上升;
【知识点】氯气的实验室制法;元素周期律和元素周期表的综合应用
16.【答案】(1)S;
(2)Na;Na+;Al3+
(3)六;汞的相对原子质量;2
(4)N≡N;三角锥形
(5)共价键;36NA
(6)C
【知识点】原子结构示意图;元素周期表中原子结构与元素性质的递变规律;元素周期表的结构及其应用;微粒半径大小的比较
17.【答案】(1)
(2)Na>Al>O
(3)HNO3>H2CO3>H2SiO3
(4)N≡N
(5)2Al+6H+=2Al3++3H2↑
(6)离子键
【知识点】元素周期律和元素周期表的综合应用
18.【答案】(1)3p;哑铃;17
(2)ds;14
(3)K;4s 1
(4)N>O>C
(5)
(6)K、Cr、Cu
【知识点】元素周期表中原子结构与元素性质的递变规律;元素周期表的结构及其应用
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
【高中化学人教版(2019必修第一册同步训练】
第二节元素周期律
一、单选题
1.短周期的两种元素A和B,它们的离子A-和B2+具有相同的电子层结构,下列说法中正确的是( )
A.原子序数A>B B.电子总数A->B2+
C.离子半径A->B2+ D.原子半径A>B
2.根据元素周期律,下列判断正确的是( )
A.碱性:NaOH > KOH > RbOH B.离子半径:Na+ > O2- > F-
C.热稳定性:HF>H2O>NH3 D.还原性:Na < Mg < Al
3.原子是一种很小的微粒。钠原子半径为 ,则a等于( )
A.9 B.10 C.11 D.12
4.短周期元素甲~戊在元素周期表中的相对位置如表所示,戊对应的氧化物具有两性。下列判断正确的是
甲 乙
丙 丁 戊
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.丙与氧元素组成的化合物只能含有离子键
D.丁的基态原子的电子排布式为
5.卤族元素有关性质比较正确的是( )
A.稳定性:HF>HCl>HBr>HI
B.氧化性:F2<Cl2<Br2<I2
C.熔沸点:F2>Cl2>Br2>I2
D.还原性:F﹣>Cl﹣>Br﹣>I﹣
6.短周期主族元素W、X、Y、Z的原子序数依次增大,其中元素W的简单氢化物与其最高价氧化物的水化物能发生反应生成一种盐,X元素在短周期中原子半径最大,Y的离子半径在同周期中最小,W和X的最外层电子数之和等于Z原子核外最外层电子数。下列说法正确的是( )
A.简单离子半径:Z>Y>W>X
B.X、Y、Z三种元素对应的最高价氧化物的水化物可以两两相互反应
C.工业上用电解X、Y对应的熔融氯化物来制取X、Y单质
D.Z的氧化物对应的水化物为强酸
二、多选题
7.短周期主族元素W、R、X、Y、Z的原子序数依次增大,W的原子半径是周期表中所有元素中最小的,R是地壳中含量最多的元素,X与W同主族,Y的最外层电子数是最内层电子数的3倍。下列说法正确的是( )
A.原子半径: R<Y<Z
B.气态氢化物的热稳定性: R>Y
C.R与X只能形成一种化合物
D.最高价氧化物的水化物的酸性: Z>Y
8.关于元素周期表的叙述中正确的是( )
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料元素
B.在过渡元素中可以寻找制备催化剂
C.在元素周期表的右上角可以寻找制备耐高温和耐腐蚀的元素
D.在地球上元素的分布和它们在元素周期表中的位置有密切关系
三、填空题
9.下表是元素周期表的一部分,表中所列字母分别代表某一元素。根据表中所列元素,回答下列问题:
(1)画出E的离子结构示意图: 。
(2)上表短周期元素中,金属性最强的是 (填元素名称);最高价氧化物对应水化物中酸性最强的物质 (填化学式,下同);简单气态氢化物最稳定的是 。
(3)表中E、F、G三元素可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小顺序是 (用离子符号表示)。
(4)H是目前人类使用最广泛的金属元素。B的最高价含氧酸稀溶液与足量H单质发生反应生成BO的离子方程式为 。
10.铁的原子结构示意图为。由此可知,铁的原子序数为 ;x为 ;铁元素是 。
A.主族元素 B.副族元素 C.短周期元素 D.长周期元素
11.元素周期表中每种元素的具体信息如图例示,从中可以获得有关氟元素的信息有元素符号、元素名称、 、 。(任意写两点)
12.下表为元素周期表的一部分,针对表中①~⑥元素,回答下列问题
(1)①元素在周期表中的位置是第二周期 族.
(2)②和⑤两种元素中原子半径较大的是 (填元素符号).
③和④两种元素的最高价氧化物对应水化物中碱性较强的是 (填化学式).
(3)写出③的单质在⑥单质中燃烧的化学方程式
13.随着原子序数的递增,8种短周期元素(用英文字母表示)原子半径的相对大小、最高正化合价或最低负化合价的变化如图所示。
(1)元素z在元素周期表中的位置为 。
(2)元素x、y可形成含10电子的分子,其空间构型为 ,元素d、f、h形成的简单离子,半径大小顺序为 (写离子符号)。
(3)下列说法不正确的是
A.e单质长期露置在空气中最终转化为碳酸盐
B.元素的氧化物对应水化物的酸性强弱:
C.物质中只含有极性共价键
D.两份等质量的单质分别与足量稀盐酸、溶液充分反应后,产生相同体积的气体(相同条件下)
(4)元素的非金属性:d g(用<、=、>来表示),判断依据是(用一个化学方程式来表示) 。
四、解答题
14.如图的虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它的列数和行数都多于元素周期表.请在下面的虚线框中用实线画出周期表第一至第六周期的轮廓,并画出金属与非金属的分界线.
五、实验探究题
15.探究学习小组同学为验证Cl的非金属性强于S,的氧化性强于,设计如目实验装置:
回答下列问题:
(1)仪器a的名称为 ,A装置中发生反应的离子方程式为 。
(2)能证明Cl的非金属性强于S的反应的离子方程式为 ,从原子结构角度看Cl的非金属性强于S的原因是 。
(3)装置H中的试剂为 。
(4)能证明的氧化性强于的明显实验现象是 ,对应的化学反应方程式为 。
六、综合题
16.为纪念元素周期表诞生150周年,IUPAC等向世界介绍了118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“、、”元素的代言人。请回答下列问题:
(1)上述元素中,属于短周期元素且原子最外层电子数最多的是 (填元素符号),其原子结构示意图是 。
(2)与硫元素同周期的元素,原子半径最大的是 (填元素符号)。其相应离子的电子式是 ;与硫元素同周期的元素,简单离子氧化性最强的是 (填离子符号)。
(3)图1为元素周期表中汞元素的信息示意图:图2为缺少信息的汞的原子结构示意图。
由此判断,汞元素位于元素周期表的第 周期,图1中200.59表示 ,图2中的= 。
(4)氮气分子的结构式是 ,氨气分子的空间结构是 。
(5)中国科学家成功合成了世界上首个“五氮负离子”的盐——。该固体盐中存在的化学键类型有 。1mol“五氮负离子”中所含的电子数目为
(6)我国晋代炼丹家、医学家葛洪所著《抱扑子》一书中记载有“丹砂烧之成水银,积变又还成丹砂”,即加热红色硫化汞(丹砂)分解出汞,而汞和硫黄又能重新变为红色硫化汞。下列说法错误的是___________。
A.上述反应涉及两种基本反应类型
B.汞蒸气有毒,中国古代“炼丹术”并不科学
C.丹砂与水银均可与稀硫酸反应生成氢气
D.应隔绝空气实现上述物质的转化
17.下表为元素周期表的一部分,请参照元素①﹣⑨在表中的位置,用化学用语回答下列问题:
族周期 IA 0
1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨
(1)写出⑧的原子结构示意图 .
(2)④、⑤、⑥的原子半径由大到小的顺序为 (用元素符号回答).
(3)②、③、⑦的最高价含氧酸的酸性由强到弱顺序是 (用化学式回答)
(4)③元素所形成单质的结构式为 .
(5)⑥的单质与①、⑨两种元素形成化合物的水溶液反应的离子方程式为: .
(6)⑤元素与⑨元素形成的化合物中,化学键类型为
七、推断题
18.如表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。试回答下列问题:
(1)基态e原子中电子占据最高能级的符号是 ,占据该能级电子的电子云轮廓图为 形,基态e原子核外共有 种不同运动状态的电子。
(2)元素i位于元素周期表的 区,基态核外电子的空间运动状态有 种。
(3)g的元素符号 ,其基态原子的价电子排布式为 。
(4)元素b、c、d的第一电离能从大到小的顺序是 。(用元素符号表示)
(5)写出元素h的价层电子排布图 。
(6)N能层只有一个电子的元素是
答案解析部分
1.【答案】C
【知识点】元素周期律和元素周期表的综合应用
2.【答案】C
【知识点】元素周期表中原子结构与元素性质的递变规律;微粒半径大小的比较
3.【答案】B
【知识点】微粒半径大小的比较
4.【答案】D
【知识点】原子核外电子排布;元素周期表的结构及其应用;微粒半径大小的比较
5.【答案】A
【知识点】元素周期表中原子结构与元素性质的递变规律;元素周期表的结构及其应用
6.【答案】B
【知识点】元素周期律和元素周期表的综合应用
7.【答案】B,D
【知识点】元素周期律和元素周期表的综合应用
8.【答案】A,B
【知识点】元素周期律和元素周期表的综合应用
9.【答案】(1)
(2)钠;HClO4;HF
(3)
(4)
【知识点】元素周期表中原子结构与元素性质的递变规律;元素周期表的结构及其应用;微粒半径大小的比较
10.【答案】26;14;BD
【知识点】元素周期表的结构及其应用
11.【答案】相对原子质量(答案合理即可);原子序数或价层电子排布(答案合理即可)
【知识点】元素周期表的结构及其应用
12.【答案】ⅣA;S;NaOH;2Na+Cl22NaCl
【知识点】元素周期律和元素周期表的综合应用
13.【答案】(1)第二周期第ⅤA族
(2)正四面体形;
(3)B;C
(4)>;
【知识点】元素周期表中原子结构与元素性质的递变规律;元素周期表的结构及其应用;元素周期律和元素周期表的综合应用;微粒半径大小的比较
14.【答案】解:
【知识点】元素周期律和元素周期表的综合应用
15.【答案】(1)圆底烧瓶;
(2);原子半径 小于 ,核电荷数Cl大于S,原子核对外层电子的吸引力Cl大于S
(3)碱石灰
(4)E中干燥管内产生大量白烟,干燥管内液面上升;
【知识点】氯气的实验室制法;元素周期律和元素周期表的综合应用
16.【答案】(1)S;
(2)Na;Na+;Al3+
(3)六;汞的相对原子质量;2
(4)N≡N;三角锥形
(5)共价键;36NA
(6)C
【知识点】原子结构示意图;元素周期表中原子结构与元素性质的递变规律;元素周期表的结构及其应用;微粒半径大小的比较
17.【答案】(1)
(2)Na>Al>O
(3)HNO3>H2CO3>H2SiO3
(4)N≡N
(5)2Al+6H+=2Al3++3H2↑
(6)离子键
【知识点】元素周期律和元素周期表的综合应用
18.【答案】(1)3p;哑铃;17
(2)ds;14
(3)K;4s 1
(4)N>O>C
(5)
(6)K、Cr、Cu
【知识点】元素周期表中原子结构与元素性质的递变规律;元素周期表的结构及其应用
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
