2.4 化学反应的调控高二上学期化学人教版(2019)选择性必修1(共28张PPT)
文档属性
| 名称 | 2.4 化学反应的调控高二上学期化学人教版(2019)选择性必修1(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 838.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-11 20:27:42 | ||
图片预览








文档简介
(共28张PPT)
第二章化学反应速率和化学平衡 第二节化学平衡
2.4化学反应的调控
学习目标
1.认识化学反应速率和化学平衡的综合调控在生产、生活和科学研 究领域中的重要作用。
2. 知道催化剂可以改变反应历程,对调控反应速率具有重要意义。 3.能运用温度、浓度、压强和催化剂对化学反应速率的影响规律解 释生产、生活、实验室中的实际问题,能讨论化学反应条件的选择 和优化。
经济效益、社会效益 (综合经济效应)
1、假如你是一个化工厂的老板对工业生产你主要应考虑哪些问题
思考
提高单位时间里产品的产量
(从化学反应的速率考虑)
提高平衡混合物中产品的含量
(从化学平衡的移动考虑)
从生产成本、动力、材料、设备等对上述理 论探讨进一步论证,以得出合理的结论。
提高综合经济效益
理 论 实际
1、影响化学反应速率的因素有哪些
反应物表面积、反应物浓度、温度、能引起气体 反应物浓度改变的压强、催化剂
2、影响化学平衡移动的因素有哪些
浓度、压强、温度
勒夏特列原理:如果改变影响平衡的一个条件(如 浓度、压强或温度等),平衡就向能够减弱这种改 变的方向移动。
忆一忆
合成氨反应:N (g)+3H (g)=2NH (g)
△S=-198.2 Jomol-1●K-1
(1)可逆性:反应为可逆反应。
(2)体积变化:正反应是气体体积缩小的反应。
(3)焓变:△H<0, 熵变:△S<0。
(4)自发性:常温(298 K) 下,△G=△H-T△S <0, 能自发进行
一、合成氨反应的原理分析
已知298 K时:△H=-92.4 kJ mol-1
1、合成氨反应的特点
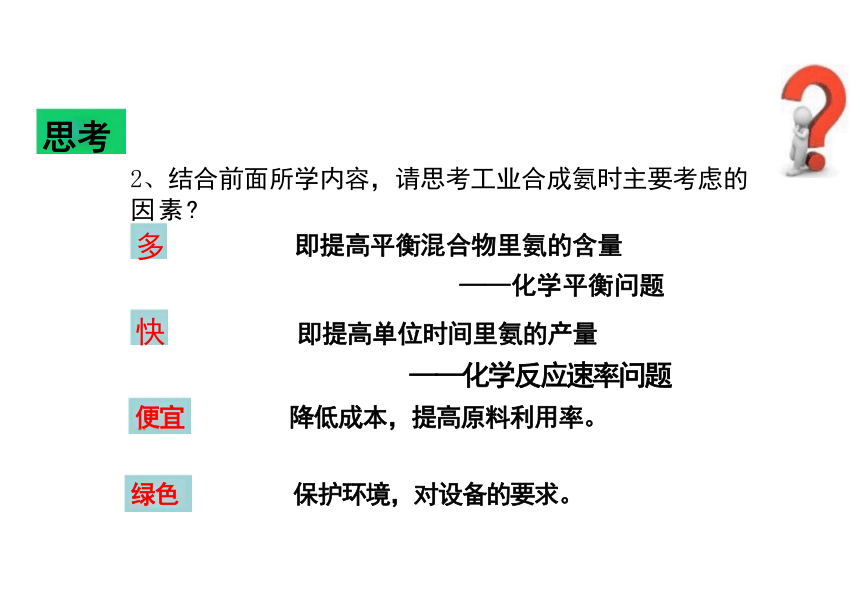
2、结合前面所学内容,请思考工业合成氨时主要考虑的 因素
多 即提高平衡混合物里氨的含量
——化学平衡问题
快 即提高单位时间里氨的产量
——化学反应速率问题
便宜 降低成本,提高原料利用率。
绿色 保护环境,对设备的要求。
思考
(1)尽量增大反应物的转化率,充分利用原料;
(2)选择较快的化学反应速率,提高单位时间内的产量;
(3)考虑设备的要求和技术条件。
2、合成氨反应条件的选择原则
条件 提高反应 速率 提高平衡转化率
综合结果
压强
温度
催化剂
浓度
原理分析:根据合成氨反应的特点,利 用我们学过的影响反应速 率的因素和勒夏特列原理分析应如何选择反应条件,以增 大合成 氨的反应速率、提高平衡混合物中氨的含量
3、提高合成氨反应速率和平衡转化率的条件比较
工业合成氨的条件
需要高温,高压,高反应物浓度,催化剂等
0.6
0.5-
0.42
0.3
0.2
0.1-
1:1 1:2 1:3 1:4 1:5 1:6
二、工业合成氨的适宜条件
1、从浓度、压强、温度、催化剂等方面考虑合成氨的适宜条件 NH3%
增大N 、H 的浓度,
其物质的量之比为
1:3时,NH 的含量 最高
N2:H
N H 含 量 / % 温度/℃ 压强 /MPa 0.1 10 20 30 60
100
200 81.5 86.4 89.9 95.4
98.8
300 2.高 52.0 64.2 71.0 84.2
92.6
压强增 25.1 大,氨 38.2 的含量 47.0 增大 400 0.氢 65.2
79.8
500 i 10.6 19.1 26.4 42.2
57.5
600 0 4.5 9.1 13.8 23.1
31.4
达到平衡时平衡混合物中NH 的含量体积分数) [起始V(N ):V(H )=1:3]
(1)压强①原理分析:压强越大越好②选用条件:目前,我国合成 氨厂一般采用的压强为10~30 MPa ③合成氨时不采用更高压强的
理由:压强越大 ,对材料的强度和设备的制造要求也越高,需要的 动力也越大,这将会大大增加生产投资,并可能降低综合经济效益
(2)温度①原理分析 :低温有 利于提高原料的平衡转化率②选用条件 :目前,在实际生产中一般采用的温度为400~500 ℃ ③不采用低
温的理由:温度降低会使化学反应速率减小,达到平衡所需时间变 长,这在工业生产中是很不经济的④升高温度能提高化学反应速率 ,但工业合成氨温度不能太高的理由是:合成氨反应为放热反应, 升高温度,转化率降低;400~500_℃催化剂活性最大,升高温度
,催化剂活性减弱(催化剂失活)
(3)催化剂①原理分析:在高温、高压下,N, 和H, 的反应速率仍然很
慢②选用条件:通常采用加入以铁为主体的多成分催化剂,又称铁触
媒③选择催化剂的理由:改变反应历程,降低反应的活化能,使反应 物在较低温度时能较快地进行反应另外,为了防止混有的杂质使催化 剂“中毒”,原料气必须经过净化
(4)浓度①原理分析:在500℃和30 MPa 时 ,平衡混合物中NH 的
体积分数及平衡时N 和H 的转化率仍较低②采取的措施:采取迅速 冷却的方法,使气态氨变成液氨后及时从平衡混合物中分离出去;应 将NH 分离后的原料气循环使用 ,并及时补充N 和H , 使反应物保 持一定的浓度(及时移走产物,补充原料)③采取该措施的理由:分 离出NH 以促使平衡向生成NH 的方向移动,此外原料气的循环使用 并及时补充原料气,既提高了原料的利用率,又提高了反应速率,有 利于合成氨反应
外部条件
工业合成氨的适宜条件
压强
根据反应器可使用的钢材质量及综合指标来选择压强
(10~30 MPa)
温度
适宜温度,400~500℃
催化剂
使用铁触媒做催化剂
浓度
N 和H 的物质的量之比为1:2.8的投料比,氨及时从混
合气中分离出去,剩余气体循环使用;及时补充N 和H
2、工业合成氨的适宜条件
热交换
N +H WWWWw-
10~30 MPa
N +H YNH +N
+H
冷却
液态NH NH +N +H
3、合成氨的工艺流程
干燥 N +H 净化
铁触媒
400~500℃
压缩机
加压
N +H
N +H
压缩机
水冷器
氢氮混合气
合成氨流程简图
氨分离器
循环压缩机
合 成 塔
循环气体
流程分析
1、原料气干燥、净化:除去原料气中的水蒸气及其他气体杂质, 防止与催化剂接触时,导致催化剂“中毒”而降低或丧失催化活性 2、压缩机加压:增大压强
3、热交换:合成氨反应为放热反应,反应体系温度逐渐升高,为 原料气反应提供热量,故热交换可充分利用能源,提高经济效益。 4、冷却:生成物NH 的液化需较低温度采取迅速冷却的方法,可 使气态氨变成液氨后及时从平衡混合物中分离出来,以促使平衡向 生成NH 的方向移动。
5、循环使用原料气:因合成氨反应为可逆反应,平衡混合物中含 有原料气,将NH 分离后的原料气循环利用,并及时补充N 和H 使反应物保持一定的浓度,以利于合成氨反应,提高经济效益。
练一练
1、利用原料气在合成塔中合成NH , 为提高N 的转化率所采取的措施 是( B )
A. 高温 B.高压
C.使用催化剂 D.增大N 的浓度
2、有关合成氨工业的说法中,正确的是( B )
A.增大H 的浓度,可提高H 的转化率
B.由于氨易液化,N 、H 在实际生产中会循环使用,所以总体来说氨的 产率很高
C.合成氨工业的反应温度控制在400~500℃,目的是使化学平衡向正 反应方向移动
D.合成氨厂采用的压强是10 MPa~30 MPa,因为该压强下铁触媒的
活性最大
练一练
3、合成氨工业有下列流程:①原料气制备;②氨的合成;③原 料气净化和压缩;④氨的分离。其先后顺序为( B )
A.①②③④ B.①③②④ C.④③②① D.②③④① 4、NH 是一种重要的工业原料。下列关于合成氨的说法中,不 正确的是(D )
A. 工艺涉及催化技术
B. 工艺涉及高温高压技术
C.原料之一的氮气来自空气
D.从合成塔出来的气体中,氨的体积分数为100%
(1)考虑参加反应的物质组成、结构和性质等本身因素
(2)考虑影响化学反应速率和平衡的温度、压强、浓度、催化剂等反 应条件
(3)选择适宜的生产条件还要考虑设备条件、安全操作、经济成本等 情况
(4)选择适宜的生产条件还要考虑环境保护及社会效益等方面的规定 和要求
三、工业合成适宜条件的选择
1、选择工业合成适宜条件的原则
分析角度 原则要求 从化学反应速率分析 既不能过快,又不能太慢 从化学平衡移动分析 既要注意外界条件对速率和平衡影响的一 致性,又要注意三者影响的矛盾性 从原料的利用率分析 增加易得廉价原料,提高难得高价原料的 利用率,从而降低生产成本 从实际生产能力分析 如设备承受高温、高压能力等 从催化剂的使用活性 分析 注意催化剂的活性对温度的限制
2、选择工业合成适宜条件的分析角度
(1)分析反应特点。主要分析反应的方向性、可逆性、反应热和熵变等
(2)原理分析。根据反应特点,利用影响反应速率的因素和勒夏特列原 理分析增大反应速率、提高原料转化率的反应条件
(3)根据实验数据进一步分析反应条件,确定适宜条件的范围及催化剂 的筛选
(4)根据工业生产的实际情况、经济效益及环保要求等最终确定适宜的 条件
3、选择适宜工业生产条件的流程
外界 条件 有利于加快速 率的条件控制 有利于平衡正向移动的 条件控制
综合分析结果
实际可操作方法
浓度 增大反应物的 浓度 增大反应物的浓度、同 时减小生成物的浓度
不断地补充反应物、及时地分离出 生成物
催化 剂 加合适的催化 剂 不需要
加合适的催化剂
温度 高温 △H<0 低温
兼顾速率和平衡,考虑催化剂的适 宜温度
△H>0 高温
在设备条件允许的前提下,尽量采 取高温并考虑催化剂的活性
压强 高压(有气体 参加) △Vg<0 高压
在设备条件允许的前提下,尽量采
取高压
△Vg>0 低压
兼顾速率和平衡,选取适宜的压强
4、选择工业合成适宜条件的参考依据
1、定义:就是通过改变反应条件使一个可能发生的反应按照某 一方向进行。
2、考虑因素:在实际生产中常常需要结合设备条件、安全操作、 经济成本等情况,综合考虑影响化学反应速率和化学平衡的因素 ,寻找适宜的生产条件。此外,还要根据环境保护及社会效益等 方面的规定和要求做出分析,权衡利弊,才能实施生产。
3、控制反应条件的目的
(1)促进有利的化学反应:通过控制反应条件,可以加快化学反应 速率,提高反应物的转化率,从而促进有利的化学反应进行。
(2)抑制有害的化学反应:通过控制反应条件,也可以减缓化学反 应速率,减少甚至消除有害物质的产生或控制副反应的发生,从而 抑制有害的化学反应继续进行。
四、化学反应的调控
(1)控制化学反应速率的措施:通过改变反应体系的温度、溶 液的浓度、气体的压强(或浓度)、固体的表面积以及使用催化 剂等途径调控反应速率。
(2)提高转化率的措施:通过改变可逆反应体系的温度、溶液 的浓度、气体的压强(或浓度)等改变可逆反应的限度,从而提 高转化率。
4、控制反应条件的基本措施
【练一练】
5、判断正误(正确的打“ √”,错误的打“×”)
(1)温度越高越利于合成氨反应平衡正向移动。(× )
(2)合成氨反应中,压强越大越利于增大反应速率和平衡正向移动。(√ )
(3)使用催化剂能提高合成氨反应物的平衡转化率。( × )
(4)充入的N 越多越有利于NH 的合成。( × )
(5)恒容条件下充入稀有气体有利于NH 的合成。 ( × )
(6)工业合成氨的反应是熵增加的放热反应,在任何温度下都可自发进行。
【练一练】
6、某工业生产中发生反应:2A(g)+B(g)=2M(g)△H<0 。下列有关 该工业生产的说法正确的是( D )
A. 工业上合成M 时,一定采用高压条件,因为高压有利于M 的生成
B.若物质B价廉易得,工业上一般采用加入过量的B以提高A和B的转化率 C.工业上一般采用较高温度合成M, 因温度越高,反应物的转化率越高
D.工业生产中常采用催化剂,因为生产中使用催化剂可提高M 的日产量
第二章化学反应速率和化学平衡 第二节化学平衡
2.4化学反应的调控
学习目标
1.认识化学反应速率和化学平衡的综合调控在生产、生活和科学研 究领域中的重要作用。
2. 知道催化剂可以改变反应历程,对调控反应速率具有重要意义。 3.能运用温度、浓度、压强和催化剂对化学反应速率的影响规律解 释生产、生活、实验室中的实际问题,能讨论化学反应条件的选择 和优化。
经济效益、社会效益 (综合经济效应)
1、假如你是一个化工厂的老板对工业生产你主要应考虑哪些问题
思考
提高单位时间里产品的产量
(从化学反应的速率考虑)
提高平衡混合物中产品的含量
(从化学平衡的移动考虑)
从生产成本、动力、材料、设备等对上述理 论探讨进一步论证,以得出合理的结论。
提高综合经济效益
理 论 实际
1、影响化学反应速率的因素有哪些
反应物表面积、反应物浓度、温度、能引起气体 反应物浓度改变的压强、催化剂
2、影响化学平衡移动的因素有哪些
浓度、压强、温度
勒夏特列原理:如果改变影响平衡的一个条件(如 浓度、压强或温度等),平衡就向能够减弱这种改 变的方向移动。
忆一忆
合成氨反应:N (g)+3H (g)=2NH (g)
△S=-198.2 Jomol-1●K-1
(1)可逆性:反应为可逆反应。
(2)体积变化:正反应是气体体积缩小的反应。
(3)焓变:△H<0, 熵变:△S<0。
(4)自发性:常温(298 K) 下,△G=△H-T△S <0, 能自发进行
一、合成氨反应的原理分析
已知298 K时:△H=-92.4 kJ mol-1
1、合成氨反应的特点
2、结合前面所学内容,请思考工业合成氨时主要考虑的 因素
多 即提高平衡混合物里氨的含量
——化学平衡问题
快 即提高单位时间里氨的产量
——化学反应速率问题
便宜 降低成本,提高原料利用率。
绿色 保护环境,对设备的要求。
思考
(1)尽量增大反应物的转化率,充分利用原料;
(2)选择较快的化学反应速率,提高单位时间内的产量;
(3)考虑设备的要求和技术条件。
2、合成氨反应条件的选择原则
条件 提高反应 速率 提高平衡转化率
综合结果
压强
温度
催化剂
浓度
原理分析:根据合成氨反应的特点,利 用我们学过的影响反应速 率的因素和勒夏特列原理分析应如何选择反应条件,以增 大合成 氨的反应速率、提高平衡混合物中氨的含量
3、提高合成氨反应速率和平衡转化率的条件比较
工业合成氨的条件
需要高温,高压,高反应物浓度,催化剂等
0.6
0.5-
0.42
0.3
0.2
0.1-
1:1 1:2 1:3 1:4 1:5 1:6
二、工业合成氨的适宜条件
1、从浓度、压强、温度、催化剂等方面考虑合成氨的适宜条件 NH3%
增大N 、H 的浓度,
其物质的量之比为
1:3时,NH 的含量 最高
N2:H
N H 含 量 / % 温度/℃ 压强 /MPa 0.1 10 20 30 60
100
200 81.5 86.4 89.9 95.4
98.8
300 2.高 52.0 64.2 71.0 84.2
92.6
压强增 25.1 大,氨 38.2 的含量 47.0 增大 400 0.氢 65.2
79.8
500 i 10.6 19.1 26.4 42.2
57.5
600 0 4.5 9.1 13.8 23.1
31.4
达到平衡时平衡混合物中NH 的含量体积分数) [起始V(N ):V(H )=1:3]
(1)压强①原理分析:压强越大越好②选用条件:目前,我国合成 氨厂一般采用的压强为10~30 MPa ③合成氨时不采用更高压强的
理由:压强越大 ,对材料的强度和设备的制造要求也越高,需要的 动力也越大,这将会大大增加生产投资,并可能降低综合经济效益
(2)温度①原理分析 :低温有 利于提高原料的平衡转化率②选用条件 :目前,在实际生产中一般采用的温度为400~500 ℃ ③不采用低
温的理由:温度降低会使化学反应速率减小,达到平衡所需时间变 长,这在工业生产中是很不经济的④升高温度能提高化学反应速率 ,但工业合成氨温度不能太高的理由是:合成氨反应为放热反应, 升高温度,转化率降低;400~500_℃催化剂活性最大,升高温度
,催化剂活性减弱(催化剂失活)
(3)催化剂①原理分析:在高温、高压下,N, 和H, 的反应速率仍然很
慢②选用条件:通常采用加入以铁为主体的多成分催化剂,又称铁触
媒③选择催化剂的理由:改变反应历程,降低反应的活化能,使反应 物在较低温度时能较快地进行反应另外,为了防止混有的杂质使催化 剂“中毒”,原料气必须经过净化
(4)浓度①原理分析:在500℃和30 MPa 时 ,平衡混合物中NH 的
体积分数及平衡时N 和H 的转化率仍较低②采取的措施:采取迅速 冷却的方法,使气态氨变成液氨后及时从平衡混合物中分离出去;应 将NH 分离后的原料气循环使用 ,并及时补充N 和H , 使反应物保 持一定的浓度(及时移走产物,补充原料)③采取该措施的理由:分 离出NH 以促使平衡向生成NH 的方向移动,此外原料气的循环使用 并及时补充原料气,既提高了原料的利用率,又提高了反应速率,有 利于合成氨反应
外部条件
工业合成氨的适宜条件
压强
根据反应器可使用的钢材质量及综合指标来选择压强
(10~30 MPa)
温度
适宜温度,400~500℃
催化剂
使用铁触媒做催化剂
浓度
N 和H 的物质的量之比为1:2.8的投料比,氨及时从混
合气中分离出去,剩余气体循环使用;及时补充N 和H
2、工业合成氨的适宜条件
热交换
N +H WWWWw-
10~30 MPa
N +H YNH +N
+H
冷却
液态NH NH +N +H
3、合成氨的工艺流程
干燥 N +H 净化
铁触媒
400~500℃
压缩机
加压
N +H
N +H
压缩机
水冷器
氢氮混合气
合成氨流程简图
氨分离器
循环压缩机
合 成 塔
循环气体
流程分析
1、原料气干燥、净化:除去原料气中的水蒸气及其他气体杂质, 防止与催化剂接触时,导致催化剂“中毒”而降低或丧失催化活性 2、压缩机加压:增大压强
3、热交换:合成氨反应为放热反应,反应体系温度逐渐升高,为 原料气反应提供热量,故热交换可充分利用能源,提高经济效益。 4、冷却:生成物NH 的液化需较低温度采取迅速冷却的方法,可 使气态氨变成液氨后及时从平衡混合物中分离出来,以促使平衡向 生成NH 的方向移动。
5、循环使用原料气:因合成氨反应为可逆反应,平衡混合物中含 有原料气,将NH 分离后的原料气循环利用,并及时补充N 和H 使反应物保持一定的浓度,以利于合成氨反应,提高经济效益。
练一练
1、利用原料气在合成塔中合成NH , 为提高N 的转化率所采取的措施 是( B )
A. 高温 B.高压
C.使用催化剂 D.增大N 的浓度
2、有关合成氨工业的说法中,正确的是( B )
A.增大H 的浓度,可提高H 的转化率
B.由于氨易液化,N 、H 在实际生产中会循环使用,所以总体来说氨的 产率很高
C.合成氨工业的反应温度控制在400~500℃,目的是使化学平衡向正 反应方向移动
D.合成氨厂采用的压强是10 MPa~30 MPa,因为该压强下铁触媒的
活性最大
练一练
3、合成氨工业有下列流程:①原料气制备;②氨的合成;③原 料气净化和压缩;④氨的分离。其先后顺序为( B )
A.①②③④ B.①③②④ C.④③②① D.②③④① 4、NH 是一种重要的工业原料。下列关于合成氨的说法中,不 正确的是(D )
A. 工艺涉及催化技术
B. 工艺涉及高温高压技术
C.原料之一的氮气来自空气
D.从合成塔出来的气体中,氨的体积分数为100%
(1)考虑参加反应的物质组成、结构和性质等本身因素
(2)考虑影响化学反应速率和平衡的温度、压强、浓度、催化剂等反 应条件
(3)选择适宜的生产条件还要考虑设备条件、安全操作、经济成本等 情况
(4)选择适宜的生产条件还要考虑环境保护及社会效益等方面的规定 和要求
三、工业合成适宜条件的选择
1、选择工业合成适宜条件的原则
分析角度 原则要求 从化学反应速率分析 既不能过快,又不能太慢 从化学平衡移动分析 既要注意外界条件对速率和平衡影响的一 致性,又要注意三者影响的矛盾性 从原料的利用率分析 增加易得廉价原料,提高难得高价原料的 利用率,从而降低生产成本 从实际生产能力分析 如设备承受高温、高压能力等 从催化剂的使用活性 分析 注意催化剂的活性对温度的限制
2、选择工业合成适宜条件的分析角度
(1)分析反应特点。主要分析反应的方向性、可逆性、反应热和熵变等
(2)原理分析。根据反应特点,利用影响反应速率的因素和勒夏特列原 理分析增大反应速率、提高原料转化率的反应条件
(3)根据实验数据进一步分析反应条件,确定适宜条件的范围及催化剂 的筛选
(4)根据工业生产的实际情况、经济效益及环保要求等最终确定适宜的 条件
3、选择适宜工业生产条件的流程
外界 条件 有利于加快速 率的条件控制 有利于平衡正向移动的 条件控制
综合分析结果
实际可操作方法
浓度 增大反应物的 浓度 增大反应物的浓度、同 时减小生成物的浓度
不断地补充反应物、及时地分离出 生成物
催化 剂 加合适的催化 剂 不需要
加合适的催化剂
温度 高温 △H<0 低温
兼顾速率和平衡,考虑催化剂的适 宜温度
△H>0 高温
在设备条件允许的前提下,尽量采 取高温并考虑催化剂的活性
压强 高压(有气体 参加) △Vg<0 高压
在设备条件允许的前提下,尽量采
取高压
△Vg>0 低压
兼顾速率和平衡,选取适宜的压强
4、选择工业合成适宜条件的参考依据
1、定义:就是通过改变反应条件使一个可能发生的反应按照某 一方向进行。
2、考虑因素:在实际生产中常常需要结合设备条件、安全操作、 经济成本等情况,综合考虑影响化学反应速率和化学平衡的因素 ,寻找适宜的生产条件。此外,还要根据环境保护及社会效益等 方面的规定和要求做出分析,权衡利弊,才能实施生产。
3、控制反应条件的目的
(1)促进有利的化学反应:通过控制反应条件,可以加快化学反应 速率,提高反应物的转化率,从而促进有利的化学反应进行。
(2)抑制有害的化学反应:通过控制反应条件,也可以减缓化学反 应速率,减少甚至消除有害物质的产生或控制副反应的发生,从而 抑制有害的化学反应继续进行。
四、化学反应的调控
(1)控制化学反应速率的措施:通过改变反应体系的温度、溶 液的浓度、气体的压强(或浓度)、固体的表面积以及使用催化 剂等途径调控反应速率。
(2)提高转化率的措施:通过改变可逆反应体系的温度、溶液 的浓度、气体的压强(或浓度)等改变可逆反应的限度,从而提 高转化率。
4、控制反应条件的基本措施
【练一练】
5、判断正误(正确的打“ √”,错误的打“×”)
(1)温度越高越利于合成氨反应平衡正向移动。(× )
(2)合成氨反应中,压强越大越利于增大反应速率和平衡正向移动。(√ )
(3)使用催化剂能提高合成氨反应物的平衡转化率。( × )
(4)充入的N 越多越有利于NH 的合成。( × )
(5)恒容条件下充入稀有气体有利于NH 的合成。 ( × )
(6)工业合成氨的反应是熵增加的放热反应,在任何温度下都可自发进行。
【练一练】
6、某工业生产中发生反应:2A(g)+B(g)=2M(g)△H<0 。下列有关 该工业生产的说法正确的是( D )
A. 工业上合成M 时,一定采用高压条件,因为高压有利于M 的生成
B.若物质B价廉易得,工业上一般采用加入过量的B以提高A和B的转化率 C.工业上一般采用较高温度合成M, 因温度越高,反应物的转化率越高
D.工业生产中常采用催化剂,因为生产中使用催化剂可提高M 的日产量
