6.2化学反应速率 高一下化学人教版(2019)必修第二册(共42张PPT)
文档属性
| 名称 | 6.2化学反应速率 高一下化学人教版(2019)必修第二册(共42张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-11 20:29:54 | ||
图片预览









文档简介
(共42张PPT)
人教版必修第二册
必修二 第六章
第二节化学反应的速率和限度
第一课时 化学反应速率
Na S O +H SO =Na SO +SI+SO 个+ H 0
失1×2e-
离子方程式为:S O 2-+2H+=Sl+SO 个+ H O。
4、标况下,将O 和NO按体积比3:4充满一干燥烧瓶,将烧瓶倒置 于水中,瓶液面逐渐上升。最后烧瓶内溶质的c是 0.026mol/L 0
早读默写答案:
1、含58.5 g NaCl的溶液中,溶质的分子数约为6.02×1023(×)
NaCl由离子构成,无分子
2、HCl(分子)、SiO (原子)、 CO (分子)
3、标双线桥: 得1×2e-
早读默写答案:
5、反应3A(g)+B(g)=2C(g)+2D(g) 在四种不同情况下的反应
速率为:① v(A)=0.6 mol-L-1 ·min-1 ②v(B)=0.45 mol-L-1 ·min-1
③ v(C)=0.015 mol-L-1.s-1 ④v (D)=0.45 mol-L-1·min-1 则该反应速率的快慢顺序为 ②=③>④>①
6、某温度下,将等物质的量的气体A、B 混合于2L的密闭容器中, 发生反应:A(g)+3B(g)==2C(g)+xD(g), 经2min后测得A的转化 率为12.5%,C 的浓度为0.5mol/L,v(D)=0.25mol/(L ·min),计 算 :
①气体A、B的初始物质的量 n(A)=n(B)=4 mol
②2min时 ,B 的物质的量浓度 c(B)=1.25 mol/L
③物质D 的化学计量数x x=2
·
④2 m in内 ,A 的平均化学反应速率 v(A)=0.125mol/(Lmin)
土产日期:见中缝标注
保质期:常温密闭条件下60天
贮存条件:常温密闭储存,避免 阳光直晒及高温
营养成分表
发现问题【思考与交流】
图片为学校超市购买的早餐奶的保质期以及贮存条件说明,你能得到什么启示
王产日期:见中缝标注
保质期:常温密闭 条件下60天 贮存条件:常温密闭储存,避免
阳光直晒及高温
营差成分表
【思考与交流】
图片为学校超市购买的早餐奶的保质期以及贮存条件说明,你能得到什么启示
化学反应速率可以通过控制条件而改变!
影响化学反应速率的内部因素
主要因素(本质因素):反应物自身的结构和性质
例 1 :在相同条件下,等质量(金属颗粒大小相当)的下列金属与足量
1 mol /L盐酸反应时,速率最快的是( B )
A、镁 B、钠 C、铁 D、铝
练习:
Zn 与等浓度的HCl、CH COOH 反应,化学反应速率快慢
HCl>CH COOH
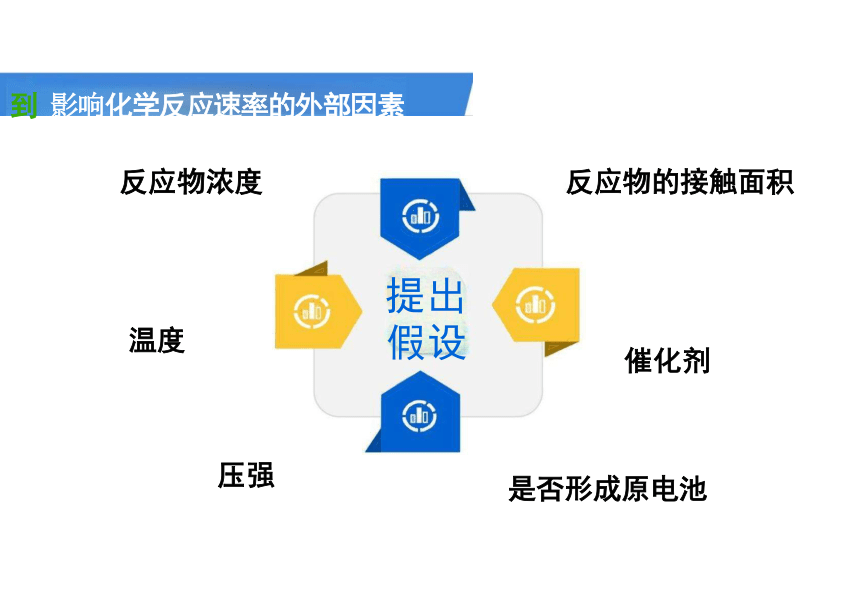
催化剂
是否形成原电池
温度
压强
到 影响化学反应速率的外部因素
反应物浓度 反应物的接触面积
提出 假设
探究浓度对化学反应速率的影响
失1×2e-
【实验用品】
0.1 mol/L Na S O 溶液、0.1mol/L H SO 溶液、蒸馏水、试管、 试管架、量筒等
Na S O 与H SO 的反应
得1×2e-
Na S O +H SQ =Na Sl +SO 个+ H O
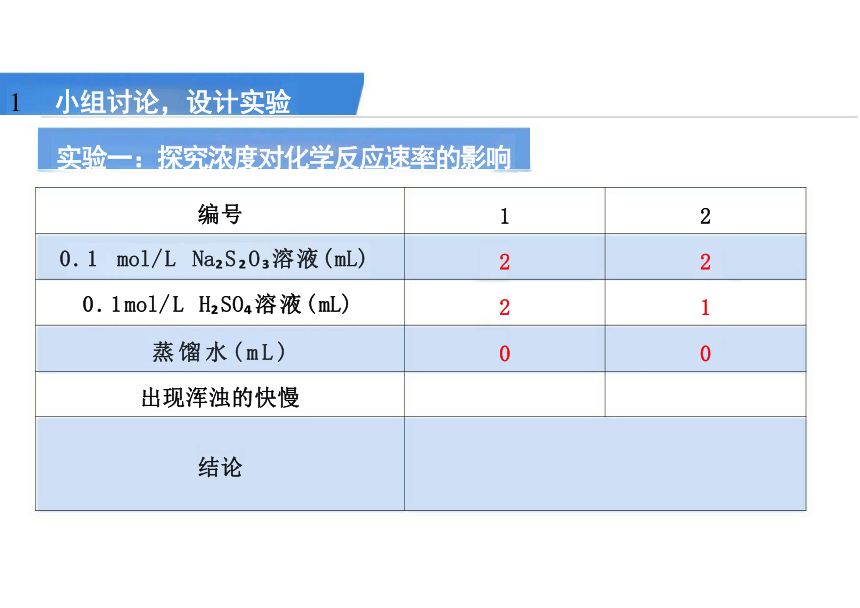
实验一:探究浓度对化学反应速率的影响
小组讨论,设计实验
编号 1
2
0.1 mol/L Na S O 溶液(mL) 2
2
0.1mol/L H SO 溶液(mL) 2
1
蒸馏水(mL) 0
0
出现浑浊的快慢
结论
实验一:探究浓度对化学反应速率的影响
1 小组讨论,设计实验
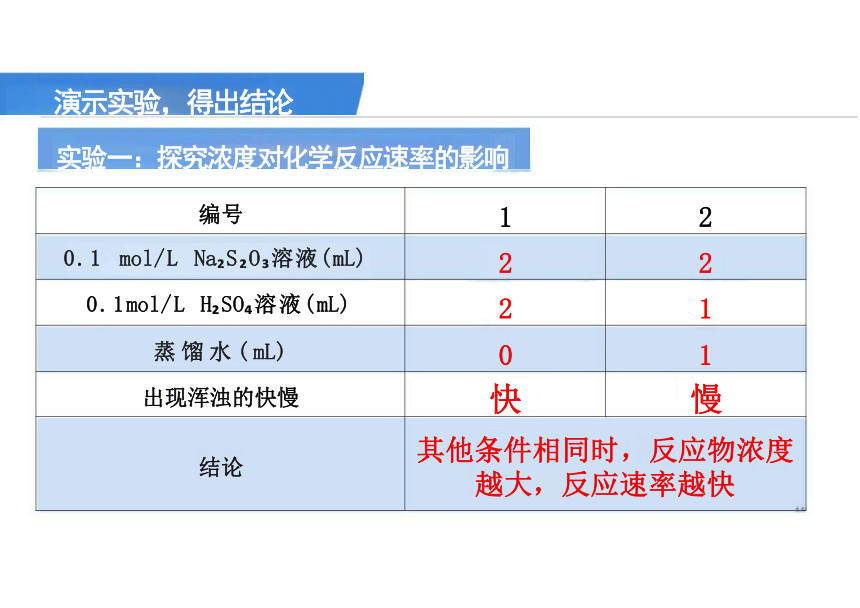
编号 1
2
0.1 mol/L Na S O 溶液(mL) 2
2
0.1mol/L H SO 溶液(mL) 2
1
蒸馏水(mL) 0
1
出现浑浊的快慢 快
慢
结论 其他条件相同时,反应物浓度 越大,反应速率越快
实验一:探究浓度对化学反应速率的影响
演示实验,得出结论
小试牛刀01:
练习1:常温下,分别将四块形状相同、质量相同的铁块同时投入下列
四种溶液中,铁块首先溶解的是( B)
A、150 mL 2 mol/L HCl
B、50 mL 2 mol/L H SO
C、50 mL 3 mol/L HCl
D、20 mL 18.4 mol/L H SO
只和参与反应的离子浓度大小有关,与体积无关。
小试牛刀02:
练习2:把下列四种X 溶液分别加入四个盛有20 mL 2 mol/L盐酸的 烧杯中,再立马加水稀释至50 mL, 此时X 和盐酸和缓地进行反应。
其中反应速率最大的是( A )
3moL/L的X溶液
2moL/L的X溶液 4mol/L的X 溶液 2mol/L的X溶液
(A)20
(B)20 (C)10
(D)10
mL
mL mL mL
注意是否被稀释
小试牛刀03:
练习3:对于在一密闭容器中进行的下列反应C(s)+O (g)=CO (g),
下列说法中正确的是( A )
(A) 提高O 的浓度可以加快速率
(B) 提高CO 的浓度可以加快速率
(C) 通入CO可以加快反应速率
(D) 增加木炭的量可以加快反应速率
固体、纯液体的浓度为常数,改变固体、纯液体的量不影响 化学反应速率。
1 小结
浓度对化学反应速率的影响
· 其他条件相同时,c 增 大 ,v 增 大 ;c 减 小 ,v 减小。
· 在一定温度下,固体、纯液体的浓度视为定值,改变固体、 纯液体的量不影响化学反应速率。
· 离子反应中,影响速率的是参与反应的离子的浓度。
S O 2-+2H+=SI+SO 个+H O
压强对化学反应速率的影响
压强对化学反应速率的影响
图6-16压强增大,气体浓度增大
17
(a )压强对化学反应速率的影响只针对有气体参与的反应
(b) 压强对速率的影响本质上是浓度对速率的影响
(c) 恒温时,P 增大→V减小→反应物c 增大→ v 增大
18
图6-16压强增大,气体浓度增大
压强对化学反应速率的影响
(a)恒温时,P 增大→V 减小→反应物c增大→v 增大 (b) 恒温恒容:
充入气体反应物→反应物c → v ;
充入惰性气体→p →反应物c →v ;
(d) 恒温恒压:
充入惰性气体 →体积V →反应物c →v 。
压 强 对 化 学 反 应 速 率 的 影 响
19
(a)恒温时,P 增大→V 减小→反应物c增大→v 增大 (b) 恒温恒容:
充入气体反应物 →反应物c增大→ v 增大;
充入惰性气体→p 增大→ 反应物c不变→ v 不变;
(d) 恒温恒压:
充入惰性气体 →体积V 增大 →反应物c减小→v不变。
压 强 对 化 学 反 应 速 率 的 影 响
20
小试牛刀04:
练习4:在一密闭容器中进行下列反应:C(s)+H O(g)==CO(g)+H (g),
下列条件的改变对其反应速率几乎无影响的是
(A) 增加C的量
(B) 将容器的体积缩小一半
(C) 保持体积不变,充入N 使压强增大
(D) 保持压强不变,充入N 使体积变大
探究温度对化学反应速率的影响
组别 1
2
0.1 mol/L Na S O 溶液(mL) 2
2
0.1mol/L H SO 溶液(mL) 2
2
温度(℃) 室温
加热
出现浑浊的快慢 慢
快
结论 其他条件相同时,温度越高, 反应速率越快
实验二:探究温度对化学反应速率的影响
真 演示实验
小试牛刀05:
练习5:C+CO =2CO是吸热反应,反应速率为V ,N +3H =2NH 是
放热反应,反应速率为V 。当温度升高时,V 和V 的变化情况为( A )
A. 同时增大 B. 同时减小
C.V 增大,V 减小 D.V 减小,V 增大
温度对化学反应速率的影响对一切反应都成立,不管是吸热反 应还是放热反应,还是可逆反应中的正反应和逆反应。
食用方法 开袋即食,内袋漏气请勿买、食用。 保 质 期 冷冻保存60天
10℃以下30天
20℃以下15天
实验测得,温度每升高10度,
化学反应速率通常增大原来的2~4倍。
拓展
25
1 小结
温度对化学反应速率的影响
· T 升 高 ,v 加 快 ;T 降 低 ,v 减小
· 温度对化学反应速率的影响对一切反应都成立,不管是吸热反
应还是放热反应,还是可逆反应中的正反应和逆反应。
· 温度每升高10度,化学反应速率通常增大原来的2~4倍。
探究催化剂
对化学反应速率的影响
【实验用品】
10% H O 溶液、1 mol/L FeCl 溶液、MnO 粉末、试管、试管 架、烧杯、量筒、胶头滴管、药匙等
2H O ==2H O+O 个
小组讨论,设计实验
28
小组实验,合作探究
实验三:探究催化剂对化学反应速率的影响
H O H O
溶液 溶液
FeCl 溶液
0
MnO 粉末
H O
溶 液
实验 操作
③
29
组别 1组 2组
3组
10%过氧化氢溶液(mL) 5 5
5
1mol/L FeCl 溶液(mL) 0 2滴
0
MnO 粉末 0 0
少量
气泡出现的快慢 慢 较快
非常快
结论 其他条件相同时,催化剂能够 加快反应速率。
催化剂的催化效果:MnO >FeCl
30
实验三:探究催化剂对化学反应速率的影响
更 小组实验,合作探究
催化剂对化学速率影响的本质——降低活化能
深度思考,挖掘本质
Reaction Progress
Energy
31
1 小结
催化剂对化学反应速率的影响
· 催化剂是能加快化学反应速率但在反应前后本身的质量和
化学性质都不变的物质,物理性质可能改变。 · 催化剂具有专一性,没有万能的催化剂。
· 用于改变同一化学反应速率的催化剂可能不止一种。
其他条件对化学反应速率的影响
其他条件对化学反应速率的影响
(a)增加固体物质的量,不影响浓度,化学反应速率不变
(b)增大固体接触面积,化学反应速率增大
eg. 块状研磨成粉末状,线状金属丝变成螺旋状
形成原电池、反应物的状态、光照、搅拌、超声波、电磁 波、激光、溶剂等也能影响化学反应速率。
练习:把除去氧化膜的镁条投入到放有
稀盐酸的试管中,发现 H 发生的速率变 化情况如图,其中 t ~t 速率变化的主 要原因是 ,t ~t 速率变化的主 要原因是_
反应开始后,化学反应速率突然增大的原因可能有:
①反应放热②生成物对反应有催化作用(高锰酸钾+草酸)
趁热打铁 :
课堂小结
关于“化学反应速率”的影响因素
C 内部因素 反应物自身的性质
· 反应物浓度
·温度
外部因素 · 催化剂
· 压强(有气体参与)
· 固体表面积(有固体参与)
C 其他 原、 等、反应物的状态、光照、超声波、电
练习:学习指导 p54 新知探究( 一) . p55 应用体验2.
溶剂
电池
磁波
形成
1、下列条件一定能使化学反应速率增大的是( )
①增加反应物的物质的量 ②升高温度
③缩小反应容器的体积 ④加入生成物
A. 只有② B.②③
C.①② D. 全 部
课后练习
38
2、一定量的盐酸跟过量的铁块反应时,为了减缓反应速率,且
不影响生成氢气的总量,可采取的措施是( )
A. 加入NaOH 固体 B. 加入H O
C. 去掉一部分铁块 D. 加入CH COONa 固体
E. 加入K SO 溶液
课后练习
3、在一个3L的容器中充入A 气体和B 气体发生反应,图像如下:
(1)2s 时 ,A 的平均反应速率应是
(2)写出这个反应方程式 n(mol)
1.2
(3)C 的化学式为
0.9
0.6
0.3
40
课后练习
4 、CaCO 与稀盐酸反应生成CO 的量与反应时间的关系如图。下列不正确的是
A. 反应在2~4 min内平均反应速率最大
B. 反应开始4 min内温度比浓度对反应速率的影响大
C.4 min后,反应速率减小的主要原因是c(H+)减小
D. 反应在2~4 min内生成CO 的平均反应速率为v(CO )=0.1 mol-L-1·min-1
n(CO )/mol
0.4
0.3
0.2
0.1
0 6 t/min
课后练习
练习:学习指导p585.
人教版必修第二册
必修二 第六章
第二节化学反应的速率和限度
第一课时 化学反应速率
Na S O +H SO =Na SO +SI+SO 个+ H 0
失1×2e-
离子方程式为:S O 2-+2H+=Sl+SO 个+ H O。
4、标况下,将O 和NO按体积比3:4充满一干燥烧瓶,将烧瓶倒置 于水中,瓶液面逐渐上升。最后烧瓶内溶质的c是 0.026mol/L 0
早读默写答案:
1、含58.5 g NaCl的溶液中,溶质的分子数约为6.02×1023(×)
NaCl由离子构成,无分子
2、HCl(分子)、SiO (原子)、 CO (分子)
3、标双线桥: 得1×2e-
早读默写答案:
5、反应3A(g)+B(g)=2C(g)+2D(g) 在四种不同情况下的反应
速率为:① v(A)=0.6 mol-L-1 ·min-1 ②v(B)=0.45 mol-L-1 ·min-1
③ v(C)=0.015 mol-L-1.s-1 ④v (D)=0.45 mol-L-1·min-1 则该反应速率的快慢顺序为 ②=③>④>①
6、某温度下,将等物质的量的气体A、B 混合于2L的密闭容器中, 发生反应:A(g)+3B(g)==2C(g)+xD(g), 经2min后测得A的转化 率为12.5%,C 的浓度为0.5mol/L,v(D)=0.25mol/(L ·min),计 算 :
①气体A、B的初始物质的量 n(A)=n(B)=4 mol
②2min时 ,B 的物质的量浓度 c(B)=1.25 mol/L
③物质D 的化学计量数x x=2
·
④2 m in内 ,A 的平均化学反应速率 v(A)=0.125mol/(Lmin)
土产日期:见中缝标注
保质期:常温密闭条件下60天
贮存条件:常温密闭储存,避免 阳光直晒及高温
营养成分表
发现问题【思考与交流】
图片为学校超市购买的早餐奶的保质期以及贮存条件说明,你能得到什么启示
王产日期:见中缝标注
保质期:常温密闭 条件下60天 贮存条件:常温密闭储存,避免
阳光直晒及高温
营差成分表
【思考与交流】
图片为学校超市购买的早餐奶的保质期以及贮存条件说明,你能得到什么启示
化学反应速率可以通过控制条件而改变!
影响化学反应速率的内部因素
主要因素(本质因素):反应物自身的结构和性质
例 1 :在相同条件下,等质量(金属颗粒大小相当)的下列金属与足量
1 mol /L盐酸反应时,速率最快的是( B )
A、镁 B、钠 C、铁 D、铝
练习:
Zn 与等浓度的HCl、CH COOH 反应,化学反应速率快慢
HCl>CH COOH
催化剂
是否形成原电池
温度
压强
到 影响化学反应速率的外部因素
反应物浓度 反应物的接触面积
提出 假设
探究浓度对化学反应速率的影响
失1×2e-
【实验用品】
0.1 mol/L Na S O 溶液、0.1mol/L H SO 溶液、蒸馏水、试管、 试管架、量筒等
Na S O 与H SO 的反应
得1×2e-
Na S O +H SQ =Na Sl +SO 个+ H O
实验一:探究浓度对化学反应速率的影响
小组讨论,设计实验
编号 1
2
0.1 mol/L Na S O 溶液(mL) 2
2
0.1mol/L H SO 溶液(mL) 2
1
蒸馏水(mL) 0
0
出现浑浊的快慢
结论
实验一:探究浓度对化学反应速率的影响
1 小组讨论,设计实验
编号 1
2
0.1 mol/L Na S O 溶液(mL) 2
2
0.1mol/L H SO 溶液(mL) 2
1
蒸馏水(mL) 0
1
出现浑浊的快慢 快
慢
结论 其他条件相同时,反应物浓度 越大,反应速率越快
实验一:探究浓度对化学反应速率的影响
演示实验,得出结论
小试牛刀01:
练习1:常温下,分别将四块形状相同、质量相同的铁块同时投入下列
四种溶液中,铁块首先溶解的是( B)
A、150 mL 2 mol/L HCl
B、50 mL 2 mol/L H SO
C、50 mL 3 mol/L HCl
D、20 mL 18.4 mol/L H SO
只和参与反应的离子浓度大小有关,与体积无关。
小试牛刀02:
练习2:把下列四种X 溶液分别加入四个盛有20 mL 2 mol/L盐酸的 烧杯中,再立马加水稀释至50 mL, 此时X 和盐酸和缓地进行反应。
其中反应速率最大的是( A )
3moL/L的X溶液
2moL/L的X溶液 4mol/L的X 溶液 2mol/L的X溶液
(A)20
(B)20 (C)10
(D)10
mL
mL mL mL
注意是否被稀释
小试牛刀03:
练习3:对于在一密闭容器中进行的下列反应C(s)+O (g)=CO (g),
下列说法中正确的是( A )
(A) 提高O 的浓度可以加快速率
(B) 提高CO 的浓度可以加快速率
(C) 通入CO可以加快反应速率
(D) 增加木炭的量可以加快反应速率
固体、纯液体的浓度为常数,改变固体、纯液体的量不影响 化学反应速率。
1 小结
浓度对化学反应速率的影响
· 其他条件相同时,c 增 大 ,v 增 大 ;c 减 小 ,v 减小。
· 在一定温度下,固体、纯液体的浓度视为定值,改变固体、 纯液体的量不影响化学反应速率。
· 离子反应中,影响速率的是参与反应的离子的浓度。
S O 2-+2H+=SI+SO 个+H O
压强对化学反应速率的影响
压强对化学反应速率的影响
图6-16压强增大,气体浓度增大
17
(a )压强对化学反应速率的影响只针对有气体参与的反应
(b) 压强对速率的影响本质上是浓度对速率的影响
(c) 恒温时,P 增大→V减小→反应物c 增大→ v 增大
18
图6-16压强增大,气体浓度增大
压强对化学反应速率的影响
(a)恒温时,P 增大→V 减小→反应物c增大→v 增大 (b) 恒温恒容:
充入气体反应物→反应物c → v ;
充入惰性气体→p →反应物c →v ;
(d) 恒温恒压:
充入惰性气体 →体积V →反应物c →v 。
压 强 对 化 学 反 应 速 率 的 影 响
19
(a)恒温时,P 增大→V 减小→反应物c增大→v 增大 (b) 恒温恒容:
充入气体反应物 →反应物c增大→ v 增大;
充入惰性气体→p 增大→ 反应物c不变→ v 不变;
(d) 恒温恒压:
充入惰性气体 →体积V 增大 →反应物c减小→v不变。
压 强 对 化 学 反 应 速 率 的 影 响
20
小试牛刀04:
练习4:在一密闭容器中进行下列反应:C(s)+H O(g)==CO(g)+H (g),
下列条件的改变对其反应速率几乎无影响的是
(A) 增加C的量
(B) 将容器的体积缩小一半
(C) 保持体积不变,充入N 使压强增大
(D) 保持压强不变,充入N 使体积变大
探究温度对化学反应速率的影响
组别 1
2
0.1 mol/L Na S O 溶液(mL) 2
2
0.1mol/L H SO 溶液(mL) 2
2
温度(℃) 室温
加热
出现浑浊的快慢 慢
快
结论 其他条件相同时,温度越高, 反应速率越快
实验二:探究温度对化学反应速率的影响
真 演示实验
小试牛刀05:
练习5:C+CO =2CO是吸热反应,反应速率为V ,N +3H =2NH 是
放热反应,反应速率为V 。当温度升高时,V 和V 的变化情况为( A )
A. 同时增大 B. 同时减小
C.V 增大,V 减小 D.V 减小,V 增大
温度对化学反应速率的影响对一切反应都成立,不管是吸热反 应还是放热反应,还是可逆反应中的正反应和逆反应。
食用方法 开袋即食,内袋漏气请勿买、食用。 保 质 期 冷冻保存60天
10℃以下30天
20℃以下15天
实验测得,温度每升高10度,
化学反应速率通常增大原来的2~4倍。
拓展
25
1 小结
温度对化学反应速率的影响
· T 升 高 ,v 加 快 ;T 降 低 ,v 减小
· 温度对化学反应速率的影响对一切反应都成立,不管是吸热反
应还是放热反应,还是可逆反应中的正反应和逆反应。
· 温度每升高10度,化学反应速率通常增大原来的2~4倍。
探究催化剂
对化学反应速率的影响
【实验用品】
10% H O 溶液、1 mol/L FeCl 溶液、MnO 粉末、试管、试管 架、烧杯、量筒、胶头滴管、药匙等
2H O ==2H O+O 个
小组讨论,设计实验
28
小组实验,合作探究
实验三:探究催化剂对化学反应速率的影响
H O H O
溶液 溶液
FeCl 溶液
0
MnO 粉末
H O
溶 液
实验 操作
③
29
组别 1组 2组
3组
10%过氧化氢溶液(mL) 5 5
5
1mol/L FeCl 溶液(mL) 0 2滴
0
MnO 粉末 0 0
少量
气泡出现的快慢 慢 较快
非常快
结论 其他条件相同时,催化剂能够 加快反应速率。
催化剂的催化效果:MnO >FeCl
30
实验三:探究催化剂对化学反应速率的影响
更 小组实验,合作探究
催化剂对化学速率影响的本质——降低活化能
深度思考,挖掘本质
Reaction Progress
Energy
31
1 小结
催化剂对化学反应速率的影响
· 催化剂是能加快化学反应速率但在反应前后本身的质量和
化学性质都不变的物质,物理性质可能改变。 · 催化剂具有专一性,没有万能的催化剂。
· 用于改变同一化学反应速率的催化剂可能不止一种。
其他条件对化学反应速率的影响
其他条件对化学反应速率的影响
(a)增加固体物质的量,不影响浓度,化学反应速率不变
(b)增大固体接触面积,化学反应速率增大
eg. 块状研磨成粉末状,线状金属丝变成螺旋状
形成原电池、反应物的状态、光照、搅拌、超声波、电磁 波、激光、溶剂等也能影响化学反应速率。
练习:把除去氧化膜的镁条投入到放有
稀盐酸的试管中,发现 H 发生的速率变 化情况如图,其中 t ~t 速率变化的主 要原因是 ,t ~t 速率变化的主 要原因是_
反应开始后,化学反应速率突然增大的原因可能有:
①反应放热②生成物对反应有催化作用(高锰酸钾+草酸)
趁热打铁 :
课堂小结
关于“化学反应速率”的影响因素
C 内部因素 反应物自身的性质
· 反应物浓度
·温度
外部因素 · 催化剂
· 压强(有气体参与)
· 固体表面积(有固体参与)
C 其他 原、 等、反应物的状态、光照、超声波、电
练习:学习指导 p54 新知探究( 一) . p55 应用体验2.
溶剂
电池
磁波
形成
1、下列条件一定能使化学反应速率增大的是( )
①增加反应物的物质的量 ②升高温度
③缩小反应容器的体积 ④加入生成物
A. 只有② B.②③
C.①② D. 全 部
课后练习
38
2、一定量的盐酸跟过量的铁块反应时,为了减缓反应速率,且
不影响生成氢气的总量,可采取的措施是( )
A. 加入NaOH 固体 B. 加入H O
C. 去掉一部分铁块 D. 加入CH COONa 固体
E. 加入K SO 溶液
课后练习
3、在一个3L的容器中充入A 气体和B 气体发生反应,图像如下:
(1)2s 时 ,A 的平均反应速率应是
(2)写出这个反应方程式 n(mol)
1.2
(3)C 的化学式为
0.9
0.6
0.3
40
课后练习
4 、CaCO 与稀盐酸反应生成CO 的量与反应时间的关系如图。下列不正确的是
A. 反应在2~4 min内平均反应速率最大
B. 反应开始4 min内温度比浓度对反应速率的影响大
C.4 min后,反应速率减小的主要原因是c(H+)减小
D. 反应在2~4 min内生成CO 的平均反应速率为v(CO )=0.1 mol-L-1·min-1
n(CO )/mol
0.4
0.3
0.2
0.1
0 6 t/min
课后练习
练习:学习指导p585.
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
