3.4羧酸衍生物 高二下化学人教版(2019)选择性必修3(共46张PPT)
文档属性
| 名称 | 3.4羧酸衍生物 高二下化学人教版(2019)选择性必修3(共46张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-11 20:32:43 | ||
图片预览







文档简介
(共46张PPT)
第三章第四节 羧酸羧酸衍生物
一、羧酸
二、羧酸衍生物
第三章第四节
第二课时羧酸衍生物
一、酯
二、油脂
三、胺和酰胺
定义 羧酸分子中羧基上的羟基被其它原子或原子团取代后的生成物 构成 O 必有酰基(RCO-或 R C )
酰基与卤素原子(-X)、烃氧基 (RO-)和氨基(-NH )等相连构 成
常见的羧 酸衍生物 酰卤(如乙酰氯)、酯(如乙酸乙酯)和酰胺(如乙酰胺)等
羧酸衍生物
概述
O O O
H C C Cl H C C OC H H C C NH
酯
■定义:酯是羧酸分子羧基中的-OH 被-OR′取代后的产物,简写为 RCOOR'(R和R'可以相同,也可以不相同);
■官能团:酯基(-COOR') O
■最简单的酯:甲酸甲酯(HCOOCH )
■饱和一元羧酸和饱和一元醇形成的酯的通式:C,H nO (n≥2)
>“饱和一元羧酸和饱和一元醇形成的酯”与“饱和一元羧酸”通式相同,同
碳数时,羧酸和酯互为同分异构体!
乙酸乙酯:CH COOCH CH
正丁酸:CH CH CH COOH
C OR'
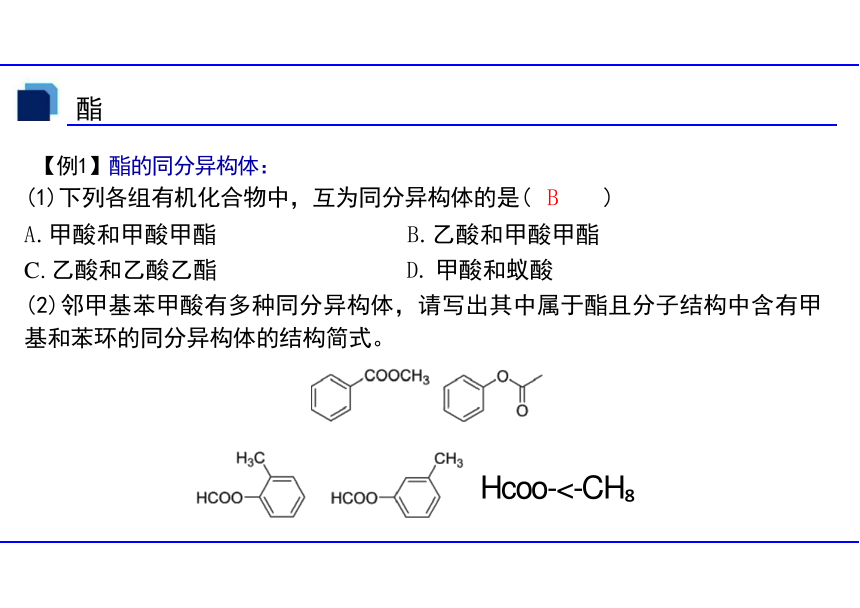
【例1】酯的同分异构体:
(1)下列各组有机化合物中,互为同分异构体的是( B )
A.甲酸和甲酸甲酯 B.乙酸和甲酸甲酯
C. 乙酸和乙酸乙酯 D. 甲酸和蚁酸
(2)邻甲基苯甲酸有多种同分异构体,请写出其中属于酯且分子结构中含有甲 基和苯环的同分异构体的结构简式。
Hcoo-<-CH
酯
酯
酯广泛存在与自然界中,低级酯是有芳香气味的液体,不溶于水,密度小于 水,存在于各种水果和花草中。
戊酸戊酯 丁酸乙酯 乙酸异戊酯
酯
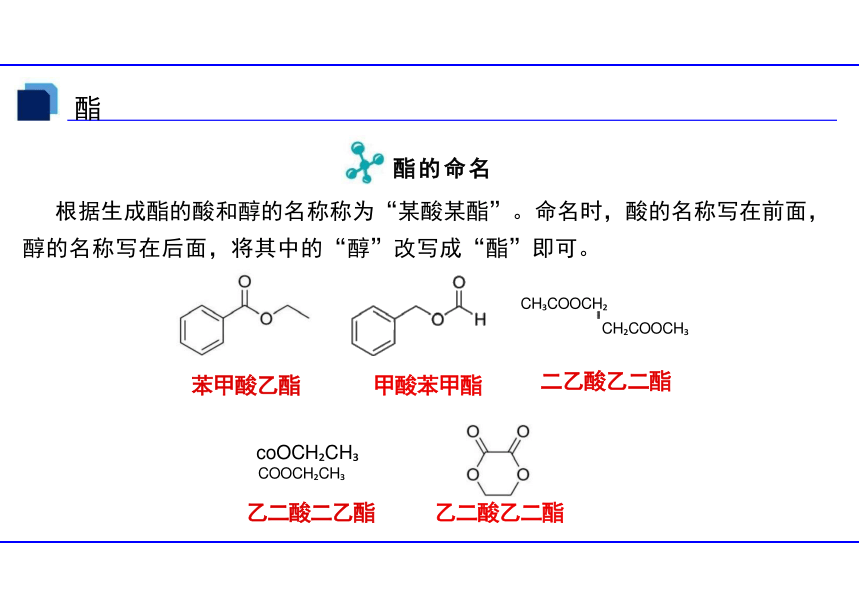
酯的命名
根据生成酯的酸和醇的名称称为“某酸某酯”。命名时,酸的名称写在前面, 醇的名称写在后面,将其中的“醇”改写成“酯”即可。
coOCH CH
COOCH CH
乙二酸二乙酯 乙二酸乙二酯
CH COOCH
CH COOCH
二乙酸乙二酯
苯甲酸乙酯 甲酸苯甲酯
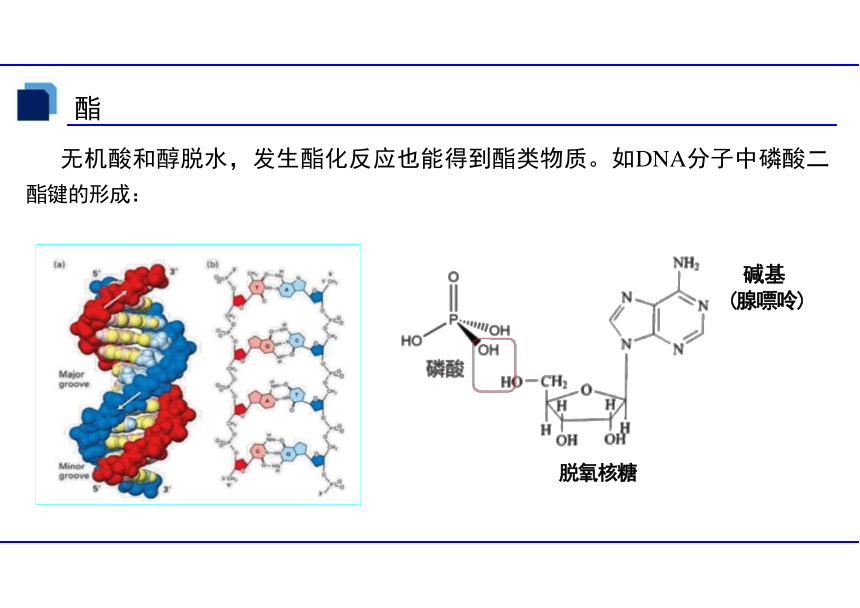
无机酸和醇脱水,发生酯化反应也能得到酯类物质。如DNA分子中磷酸二
酯键的形成:
酯
碱基
(腺嘌呤)
脱氧核糖
酯
温故而知新
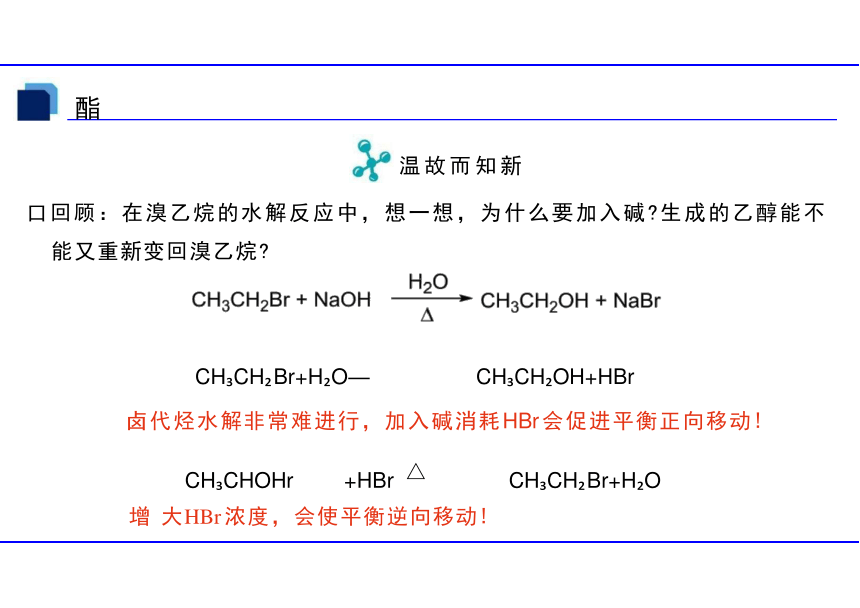
口回顾:在溴乙烷的水解反应中,想一想,为什么要加入碱 生成的乙醇能不 能又重新变回溴乙烷
CH CH Br+H O— CH CH OH+HBr
卤代烃水解非常难进行,加入碱消耗HBr 会促进平衡正向移动!
增 大HBr 浓度,会使平衡逆向移动!
CH CHOHr +HBr
CH CH Br+H O
△
酯
温故而知新
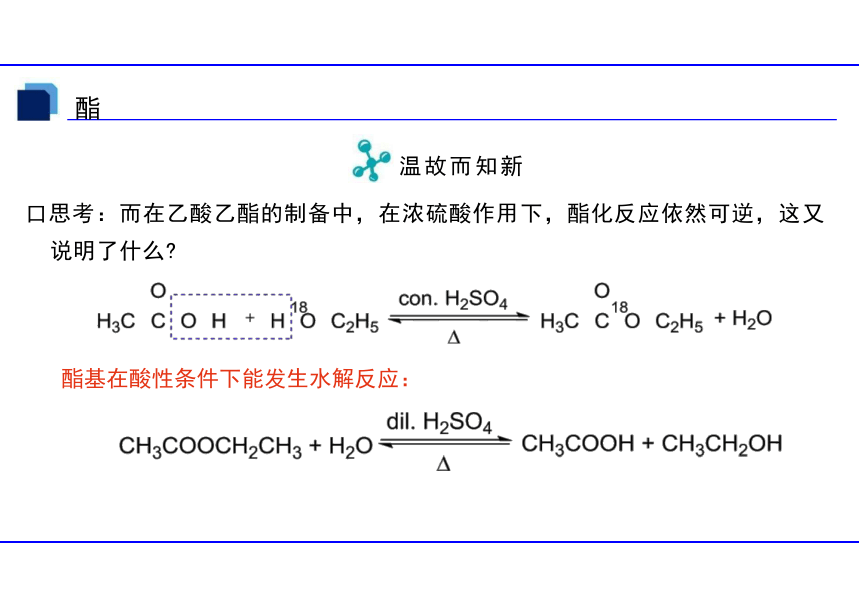
口思考:而在乙酸乙酯的制备中,在浓硫酸作用下,酯化反应依然可逆,这又 说明了什么
酯基在酸性条件下能发生水解反应:
加热,水解是吸热过程,升温可促进反应正向进行,同时也可提高反应速 率;
口分析一:若要加快酯的水解速率,且尽可能让酯的水解进行的更彻底,可以
采取哪些措施
加入碱,中和乙酸,使平衡正向移动;
酯
CH cOOCH CH +H oiH S CHsCOOH+CH CH OH
产物是
碱性条件: 羧酸盐
△→CH COONa+CH CH OH
CH COOCH CH +NaOH
酯类水解的影响因素:①温度;②溶液酸碱性
稀酸,且
酸性条件: 可逆
酯的水解反应 O
R C O
酯
D/
酯
酯的水解反应
口思考:通过设计实验验证温度、溶液酸碱性对酯类水解速率的影响,需要注
意什么
CH COOCH CH +NaOH → CH COONa+CH CH O
>控制变量;
水浴加热,便于控制温度;
寻找便于观测的水解现象(可以通过酯层消失的时间差异来判断)!
【探究一】溶液酸碱性对乙酸乙酯水解的影响:
实验步骤:
√在三支试管中各加入1 mL 乙酸乙酯,再分别加入等浓度等体积稀硫酸、蒸馏 水和含酚酞的NaOH 溶液;
√水浴加热,记录酯层消失和酯香味消失的时间。
口分析二:为什么可比较酯层消失时间来判断 5 mL|0.2 mol-L-
的稀H SO 5 mL
水解速率 0.2 mol·L-
5 mLH O 的 NaOH
乙酸乙酯在水中溶解度小,酯层位于水层之上。 a b C 溶液
其水解产物易溶于水,故酯层消失即表示乙酸
乙酯水解完全!
70℃水 浴5 min
变量控制
酯
【探究一】溶液酸碱性对乙酸乙酯水解的影响: 实验现象: √稀硫酸:酯层和酯香味消失慢; √蒸馏水:分层,酯层无明显现象; √含有酚酞的NaOH溶液:酯层和酯香味消失快,酚酞褪色; 实验结论:其他条件不变时,在酸或碱存在下,酯
中性 都可以发生水解,但碱性条件下水解比酸性条件快! 酸性
碱性
酯层变薄
几乎无变化
酯
5 min后
酯层最薄
【探究二】温度对乙酸乙酯水解的影响:
实验步骤:
√ 向两支试管中各加入1 mL 乙酸乙酯,再分别加入等浓度等体积含酚酞的 NaOH 溶液;
√ 两支试管分别置于40℃和80℃水浴中,记录酯层消失和酯香味消失的时间。
5 mL 0.2 mol·L- NaOH
+l mL乙酸乙酯 a b
40 80 ℃
酯
【探究二】温度对乙酸乙酯水解的影响:
实验现象:
√40℃水浴:酯层几乎没有变化;
√80℃水浴:酯层基本消失;
实验结论:其他条件不变时,温度越高水解速率越快!
酯
【例2】酯水解方程式的书写:分别写出苯甲酸甲酯在稀硫酸和KOH 溶液中的
水解方程式。
dil.H SO
COOCH +H O COOH+CH OH
COOCH +KOH COOK+CH OH
酯
【变式】写出下列有机物与足量NaOH 溶液反应的化学方程式:
COOCH 0OCCH
COOH COOH
定量分析
1份羧酸钠
1份NaOH
1份NaOH
1份羟基
1份酯基
酚羟基
醇羟基
酚钠
酯
酯
定量分析
能和NaOH 反应的基团:羧基、酚羟基、碳卤键、酯基、酰胺基;而醇羟基 不能与NaOH 反应!
【例3】判断1 mol下列有机物最多消耗多少摩尔NaOH
4 mol
8 mol
6 mol
随堂练习
1.下列说法正确的是( B )
A.1 mol甲醛与足量银氨溶液反应可以生成2 molAg
B. 在酸性条件下,CH CO 8OC H 的水解产物是CH COOH和C H 8OH
C. 乙醛、乙酸和乙酸乙酯都能和氢气加成
D.所有的酯类都有果香味
酯基
饱和烃基 O
C 7H 5 C O CH C 7H 5COOCH
C 7H35 C O CH
O
硬脂酸甘油酯
(属于高级脂肪酸甘油酯)
口思考:下列物质为油脂中的某种成分,想一想在酸性环境下它的水解后产物
是什么
HO CH
C H COOH+HO CH
硬脂酸 HO CH
丙三醇(甘油)
油脂
稀酸
油脂
油脂概述
■定义:油脂包括油和脂肪,是混合物,主要成分是高级脂肪酸(C 0以上的链 状羧酸)与丙三醇形成的高级脂肪酸甘油三脂,也属于酯类
R、R'、R”代表高级脂肪酸的烃基;
>可以相同,也可以不相同;
可以饱和也不可以不饱和;
■相似性:都难溶于水,易溶于有机溶剂、密度比水小、粘度大且有油腻感;
■差异性:常温下,液态的属于油,固态的属于脂肪;天然油脂属于混合物, 无固定沸点;
动物油含饱和高级脂 肪酸甘油酯的比例 大,沸点较高!
植物油含不饱和高级脂
肪酸甘油酯的比例大, 沸点较低!
油脂
油脂的物理性质
口分析一:油脂的形成
组成油脂的高级脂肪酸的种类较多,如饱和的硬脂酸(C H COOH)、 不饱和的 油酸(C H COOH)等。请写出硬脂酸、油酸分别与丙三醇反应的化学方程式。
油脂
油脂
口分析二:预测油脂的化学性质
油酸甘油酯的结构简式如图所示,判断以下物质能否与该油脂反应
CH3(CH2)7CH=CH(CH2)7COOCH2
CH3(CH2)7CH=CH(CH2)7COOCH
CH3(CH2)7CH=CH(CH2)7COOCH2
①NaOH溶液
②溴水
③H
④酸性KMnO 溶液
油脂
口分析二: 预测油脂的化学性质
油酸甘油酯的结构简式如图所示,判断以下物质能否与该油脂反应
CH3(CH2)7CH=CH(CH2)7COOCH2
CH3(CH2)7CH=CH(CH2)7COOCH
CH3(CH2)7CH=CH(CH2)7COOCH2
①NaOH溶液
√ (酯基的碱性水解)
②溴水
√ (碳碳双键的加成)
③H
√ (碳碳双键的加成)
④酸性KMnO 溶液
√ (碳碳双键的氧化)
油脂
油脂的化学性质 >水解反应
酸性环境下的水解
油脂
油脂的化学性质 >水解反应
碱性环境下的水解:油脂在碱性溶液中的水解也被称为“皂化反应”
硬脂酸甘油酯
加热搅拌 高级脂肪酸钠、甘油
和水的混合液(不分层)
溶解度小, 食盐细粒、 得到胶体! 静置分层
过滤、 高级脂肪酸你钠固体、
干燥成型 甘油、食盐水
胶体聚沉)
蒸馏
滤液(甘油、食盐水)
油脂
化学与生活:工业制皂流程
动植物废油与 烧碱溶液
盐析(加入电解质,
成品肥皂
甘油
油脂
油脂的化学性质
氢化(硬化)反应
油酸甘油酯(低沸点) 硬脂酸甘油酯(高沸点)
不饱和程度较高、熔点较低的液态油,通过催化加氢可提高饱和度,转变
为半固态的脂肪,由此制得的油脂叫人造脂肪(又称“硬化油”)。硬化油不易 氧化变质,便于储存和运输,可作为制造肥皂和人造奶油的原料。
油脂
>氢化(硬化)反应
【生活小贴士】
少吃!少吃!少吃!
油脂的化学性质
油脂的氢化
油 脂
化学与生活:油酸和亚油酸
天然油脂水解得到的油酸和亚油酸是顺式结构,而将植物油氢化时,如果 氢化不够彻底,则可能得到反式脂肪酸,容易导致动脉硬化、冠心病等。
油酸(C H O )的两种同分异构体
顺,顺-9,12-十八碳二烯酸(亚油酸)
顺-9-十八碳烯酸(油酸)
顺式油酸
反式油酸
我是生活家
长期放置的植物油容易产生一股“哈喇”味,加入叔丁基对 苯二酚(TBHQ)能有效防治变质。你能从化学角度进行解释吗
植物油中含有较多的碳碳双键,容易被空气氧化产生环氧化
物、醛类、羧酸等小分子物质!
叔丁基对苯二酚
(TBHQ)
油脂
TBHQ 中含有酚羟基,可代替碳碳双键被氧化,起到了抗氧化剂的作用!
随堂练习
2.下列说法正确的是( D )
A. 植物油不能使溴的四氯化碳溶液褪色
B.油脂容易与空气发生加成反应而变质
C. 油脂属于天然高分子,都是混合物
D. 油脂在碱性条件下水解的反应,也叫皂化反应
随堂练习
3.能区别地沟油与矿物油的方法是( D )
A. 点燃,能燃烧的是矿物油
B.测定沸点,有固定沸点的是矿物油
C. 加入水中,浮在水面上的是地沟油
D. 加入足量NaOH溶液共热,最后液体不分层的是地沟油
胺和酰胺
胺
■定义:烃基取代NH 中的氢原子而形成的化合物,胺也可以看作是烃分子中 的氢原子被氨基所替代得到的化合物;
■官能团:氨基(-NH )
■结构通式:R-NH (包括R-NR R ,R R 可以是氢原子或烃基)
■命名:和“醇”类似
官能团次序规则:羧基>酯基>酰胺基>氰基>醛基>醇羟基>酚羟基>氨基>碳 碳三键>碳碳双键>烷氧基>苯基>烷基>卤原子>硝基
NH NH
CH -NH
甲胺 苯胺 cOOH
邻氨基苯甲酸
胺和酰胺
胺
■物理性质:有亲水基团氨基,饱和的低级胺能溶于水,且氨基越多,水溶
性越好;
■化学性质:“ 碱 性 ”
>NH +HCl=NH Cl
CH NH +HCl→CH NH Cl (甲胺盐酸盐)
NH +HCl→ NH CI(苯胺盐酸盐)
十
胺和酰胺
酰胺
■定义:羧酸分子中羟基被氨基或取代的氨基取代得到的化合物;
R C 酰基
0
substitute -NH with -OH O 酰胺基 C NH
R C NH
■常见的酰胺:
O
H C C NH
乙酰胺
O
C NH
苯甲酰胺
H O C
CH N
\
CH
N,N-二甲基甲酰胺(DMF)
remove -OH O
OH
OH
O
C
O C
R
R
R N
O
C
胺和酰胺
酰胺
【拓展】下列常见有机物的名称
O
H C CH C NH
丙烯酰胺
O
H N C NH
碳酰胺
(又称脲,俗称尿素)
2-甲基丙烯酰胺
O
NH
H N
O
口思考:根据酰胺的结构,联系酯的化学性质,预测酰胺可能具有哪些化学
性质 O
水解反应 R C NH 2
■酰胺比酯类稳定,一般不水解,在强碱或强酸并加热时能水解:
胺和酰胺
酰胺
胺和酰胺
酰胺
【例4】酰胺水解方程式的书写:写出N,N-二甲基甲酰胺在酸性(盐酸)、碱性 (NaOH 溶液)条件下水解的化学方程式。
胺和酰胺
酰胺
【例5】酰胺水解定量分析:1 mol药物贝诺酯最多能消耗多少摩尔NaOH 得 到哪些产物
水解产物:
CH COONa
COONa
H
C CH
O
5 mol NaOH
ONa H N
ONa
胺和酰胺
化学与生活:尿素
尿素是人类第一个合成的有机物(1828年,维勒),打破了有机物和无机物不 能互相制备的观点。
哺乳动物和某些鱼类体内蛋白质代谢分解的产物中含尿素。它易保存,使 用方便,相比铵盐的酸性,尿素对土壤的破坏作用小,是目前使用量较大,含 氮量最高的一种中性氮肥。
尿素在水中加热时发生水解反应,放出两种气体,写出相应的化学方程式。 若在酸性或碱性环境下水解,产物相同吗
acid condition:CO +NH +;base condition:CO -+NH
氨 胺 酰胺
铵盐
结构特点 NH R-NH 等 含有氨基 R-CONH 等 含有酰胺基
含有NH +
化学性质 碱性,与酸 反应生成铵盐 碱性,与酸 反应成盐 酸/碱性并加热可 以发生水解反应
受热分解,与碱 共热产生氨
用途 制冷剂、 生产硝酸和尿素 合成医药、 农药和染料 溶剂和化工原料
生产化肥和 炸药
胺和酰胺
酰胺
【例6】请举例说明氨、胺、酰胺和铵盐这四类物质在组成、结构、性质和用 途上的不同,并设计表格进行比较。
列有关瑞德西韦的说法错误的是( D )
O H
已 知H: 与酯基的性质类似, P N 与酰胺基的性质类似。
A. 可以与H2发生加成反应
B. 不能与FeCl3溶液发生显色反应
C. 合成原料之一可能为苯
D. 在碱性条件下水解后生成4种物质
h
4.瑞德西韦是一种具有抗病毒活性的药物,其结构简式如图所示,下
随堂练习
第三章第四节 羧酸羧酸衍生物
一、羧酸
二、羧酸衍生物
第三章第四节
第二课时羧酸衍生物
一、酯
二、油脂
三、胺和酰胺
定义 羧酸分子中羧基上的羟基被其它原子或原子团取代后的生成物 构成 O 必有酰基(RCO-或 R C )
酰基与卤素原子(-X)、烃氧基 (RO-)和氨基(-NH )等相连构 成
常见的羧 酸衍生物 酰卤(如乙酰氯)、酯(如乙酸乙酯)和酰胺(如乙酰胺)等
羧酸衍生物
概述
O O O
H C C Cl H C C OC H H C C NH
酯
■定义:酯是羧酸分子羧基中的-OH 被-OR′取代后的产物,简写为 RCOOR'(R和R'可以相同,也可以不相同);
■官能团:酯基(-COOR') O
■最简单的酯:甲酸甲酯(HCOOCH )
■饱和一元羧酸和饱和一元醇形成的酯的通式:C,H nO (n≥2)
>“饱和一元羧酸和饱和一元醇形成的酯”与“饱和一元羧酸”通式相同,同
碳数时,羧酸和酯互为同分异构体!
乙酸乙酯:CH COOCH CH
正丁酸:CH CH CH COOH
C OR'
【例1】酯的同分异构体:
(1)下列各组有机化合物中,互为同分异构体的是( B )
A.甲酸和甲酸甲酯 B.乙酸和甲酸甲酯
C. 乙酸和乙酸乙酯 D. 甲酸和蚁酸
(2)邻甲基苯甲酸有多种同分异构体,请写出其中属于酯且分子结构中含有甲 基和苯环的同分异构体的结构简式。
Hcoo-<-CH
酯
酯
酯广泛存在与自然界中,低级酯是有芳香气味的液体,不溶于水,密度小于 水,存在于各种水果和花草中。
戊酸戊酯 丁酸乙酯 乙酸异戊酯
酯
酯的命名
根据生成酯的酸和醇的名称称为“某酸某酯”。命名时,酸的名称写在前面, 醇的名称写在后面,将其中的“醇”改写成“酯”即可。
coOCH CH
COOCH CH
乙二酸二乙酯 乙二酸乙二酯
CH COOCH
CH COOCH
二乙酸乙二酯
苯甲酸乙酯 甲酸苯甲酯
无机酸和醇脱水,发生酯化反应也能得到酯类物质。如DNA分子中磷酸二
酯键的形成:
酯
碱基
(腺嘌呤)
脱氧核糖
酯
温故而知新
口回顾:在溴乙烷的水解反应中,想一想,为什么要加入碱 生成的乙醇能不 能又重新变回溴乙烷
CH CH Br+H O— CH CH OH+HBr
卤代烃水解非常难进行,加入碱消耗HBr 会促进平衡正向移动!
增 大HBr 浓度,会使平衡逆向移动!
CH CHOHr +HBr
CH CH Br+H O
△
酯
温故而知新
口思考:而在乙酸乙酯的制备中,在浓硫酸作用下,酯化反应依然可逆,这又 说明了什么
酯基在酸性条件下能发生水解反应:
加热,水解是吸热过程,升温可促进反应正向进行,同时也可提高反应速 率;
口分析一:若要加快酯的水解速率,且尽可能让酯的水解进行的更彻底,可以
采取哪些措施
加入碱,中和乙酸,使平衡正向移动;
酯
CH cOOCH CH +H oiH S CHsCOOH+CH CH OH
产物是
碱性条件: 羧酸盐
△→CH COONa+CH CH OH
CH COOCH CH +NaOH
酯类水解的影响因素:①温度;②溶液酸碱性
稀酸,且
酸性条件: 可逆
酯的水解反应 O
R C O
酯
D/
酯
酯的水解反应
口思考:通过设计实验验证温度、溶液酸碱性对酯类水解速率的影响,需要注
意什么
CH COOCH CH +NaOH → CH COONa+CH CH O
>控制变量;
水浴加热,便于控制温度;
寻找便于观测的水解现象(可以通过酯层消失的时间差异来判断)!
【探究一】溶液酸碱性对乙酸乙酯水解的影响:
实验步骤:
√在三支试管中各加入1 mL 乙酸乙酯,再分别加入等浓度等体积稀硫酸、蒸馏 水和含酚酞的NaOH 溶液;
√水浴加热,记录酯层消失和酯香味消失的时间。
口分析二:为什么可比较酯层消失时间来判断 5 mL|0.2 mol-L-
的稀H SO 5 mL
水解速率 0.2 mol·L-
5 mLH O 的 NaOH
乙酸乙酯在水中溶解度小,酯层位于水层之上。 a b C 溶液
其水解产物易溶于水,故酯层消失即表示乙酸
乙酯水解完全!
70℃水 浴5 min
变量控制
酯
【探究一】溶液酸碱性对乙酸乙酯水解的影响: 实验现象: √稀硫酸:酯层和酯香味消失慢; √蒸馏水:分层,酯层无明显现象; √含有酚酞的NaOH溶液:酯层和酯香味消失快,酚酞褪色; 实验结论:其他条件不变时,在酸或碱存在下,酯
中性 都可以发生水解,但碱性条件下水解比酸性条件快! 酸性
碱性
酯层变薄
几乎无变化
酯
5 min后
酯层最薄
【探究二】温度对乙酸乙酯水解的影响:
实验步骤:
√ 向两支试管中各加入1 mL 乙酸乙酯,再分别加入等浓度等体积含酚酞的 NaOH 溶液;
√ 两支试管分别置于40℃和80℃水浴中,记录酯层消失和酯香味消失的时间。
5 mL 0.2 mol·L- NaOH
+l mL乙酸乙酯 a b
40 80 ℃
酯
【探究二】温度对乙酸乙酯水解的影响:
实验现象:
√40℃水浴:酯层几乎没有变化;
√80℃水浴:酯层基本消失;
实验结论:其他条件不变时,温度越高水解速率越快!
酯
【例2】酯水解方程式的书写:分别写出苯甲酸甲酯在稀硫酸和KOH 溶液中的
水解方程式。
dil.H SO
COOCH +H O COOH+CH OH
COOCH +KOH COOK+CH OH
酯
【变式】写出下列有机物与足量NaOH 溶液反应的化学方程式:
COOCH 0OCCH
COOH COOH
定量分析
1份羧酸钠
1份NaOH
1份NaOH
1份羟基
1份酯基
酚羟基
醇羟基
酚钠
酯
酯
定量分析
能和NaOH 反应的基团:羧基、酚羟基、碳卤键、酯基、酰胺基;而醇羟基 不能与NaOH 反应!
【例3】判断1 mol下列有机物最多消耗多少摩尔NaOH
4 mol
8 mol
6 mol
随堂练习
1.下列说法正确的是( B )
A.1 mol甲醛与足量银氨溶液反应可以生成2 molAg
B. 在酸性条件下,CH CO 8OC H 的水解产物是CH COOH和C H 8OH
C. 乙醛、乙酸和乙酸乙酯都能和氢气加成
D.所有的酯类都有果香味
酯基
饱和烃基 O
C 7H 5 C O CH C 7H 5COOCH
C 7H35 C O CH
O
硬脂酸甘油酯
(属于高级脂肪酸甘油酯)
口思考:下列物质为油脂中的某种成分,想一想在酸性环境下它的水解后产物
是什么
HO CH
C H COOH+HO CH
硬脂酸 HO CH
丙三醇(甘油)
油脂
稀酸
油脂
油脂概述
■定义:油脂包括油和脂肪,是混合物,主要成分是高级脂肪酸(C 0以上的链 状羧酸)与丙三醇形成的高级脂肪酸甘油三脂,也属于酯类
R、R'、R”代表高级脂肪酸的烃基;
>可以相同,也可以不相同;
可以饱和也不可以不饱和;
■相似性:都难溶于水,易溶于有机溶剂、密度比水小、粘度大且有油腻感;
■差异性:常温下,液态的属于油,固态的属于脂肪;天然油脂属于混合物, 无固定沸点;
动物油含饱和高级脂 肪酸甘油酯的比例 大,沸点较高!
植物油含不饱和高级脂
肪酸甘油酯的比例大, 沸点较低!
油脂
油脂的物理性质
口分析一:油脂的形成
组成油脂的高级脂肪酸的种类较多,如饱和的硬脂酸(C H COOH)、 不饱和的 油酸(C H COOH)等。请写出硬脂酸、油酸分别与丙三醇反应的化学方程式。
油脂
油脂
口分析二:预测油脂的化学性质
油酸甘油酯的结构简式如图所示,判断以下物质能否与该油脂反应
CH3(CH2)7CH=CH(CH2)7COOCH2
CH3(CH2)7CH=CH(CH2)7COOCH
CH3(CH2)7CH=CH(CH2)7COOCH2
①NaOH溶液
②溴水
③H
④酸性KMnO 溶液
油脂
口分析二: 预测油脂的化学性质
油酸甘油酯的结构简式如图所示,判断以下物质能否与该油脂反应
CH3(CH2)7CH=CH(CH2)7COOCH2
CH3(CH2)7CH=CH(CH2)7COOCH
CH3(CH2)7CH=CH(CH2)7COOCH2
①NaOH溶液
√ (酯基的碱性水解)
②溴水
√ (碳碳双键的加成)
③H
√ (碳碳双键的加成)
④酸性KMnO 溶液
√ (碳碳双键的氧化)
油脂
油脂的化学性质 >水解反应
酸性环境下的水解
油脂
油脂的化学性质 >水解反应
碱性环境下的水解:油脂在碱性溶液中的水解也被称为“皂化反应”
硬脂酸甘油酯
加热搅拌 高级脂肪酸钠、甘油
和水的混合液(不分层)
溶解度小, 食盐细粒、 得到胶体! 静置分层
过滤、 高级脂肪酸你钠固体、
干燥成型 甘油、食盐水
胶体聚沉)
蒸馏
滤液(甘油、食盐水)
油脂
化学与生活:工业制皂流程
动植物废油与 烧碱溶液
盐析(加入电解质,
成品肥皂
甘油
油脂
油脂的化学性质
氢化(硬化)反应
油酸甘油酯(低沸点) 硬脂酸甘油酯(高沸点)
不饱和程度较高、熔点较低的液态油,通过催化加氢可提高饱和度,转变
为半固态的脂肪,由此制得的油脂叫人造脂肪(又称“硬化油”)。硬化油不易 氧化变质,便于储存和运输,可作为制造肥皂和人造奶油的原料。
油脂
>氢化(硬化)反应
【生活小贴士】
少吃!少吃!少吃!
油脂的化学性质
油脂的氢化
油 脂
化学与生活:油酸和亚油酸
天然油脂水解得到的油酸和亚油酸是顺式结构,而将植物油氢化时,如果 氢化不够彻底,则可能得到反式脂肪酸,容易导致动脉硬化、冠心病等。
油酸(C H O )的两种同分异构体
顺,顺-9,12-十八碳二烯酸(亚油酸)
顺-9-十八碳烯酸(油酸)
顺式油酸
反式油酸
我是生活家
长期放置的植物油容易产生一股“哈喇”味,加入叔丁基对 苯二酚(TBHQ)能有效防治变质。你能从化学角度进行解释吗
植物油中含有较多的碳碳双键,容易被空气氧化产生环氧化
物、醛类、羧酸等小分子物质!
叔丁基对苯二酚
(TBHQ)
油脂
TBHQ 中含有酚羟基,可代替碳碳双键被氧化,起到了抗氧化剂的作用!
随堂练习
2.下列说法正确的是( D )
A. 植物油不能使溴的四氯化碳溶液褪色
B.油脂容易与空气发生加成反应而变质
C. 油脂属于天然高分子,都是混合物
D. 油脂在碱性条件下水解的反应,也叫皂化反应
随堂练习
3.能区别地沟油与矿物油的方法是( D )
A. 点燃,能燃烧的是矿物油
B.测定沸点,有固定沸点的是矿物油
C. 加入水中,浮在水面上的是地沟油
D. 加入足量NaOH溶液共热,最后液体不分层的是地沟油
胺和酰胺
胺
■定义:烃基取代NH 中的氢原子而形成的化合物,胺也可以看作是烃分子中 的氢原子被氨基所替代得到的化合物;
■官能团:氨基(-NH )
■结构通式:R-NH (包括R-NR R ,R R 可以是氢原子或烃基)
■命名:和“醇”类似
官能团次序规则:羧基>酯基>酰胺基>氰基>醛基>醇羟基>酚羟基>氨基>碳 碳三键>碳碳双键>烷氧基>苯基>烷基>卤原子>硝基
NH NH
CH -NH
甲胺 苯胺 cOOH
邻氨基苯甲酸
胺和酰胺
胺
■物理性质:有亲水基团氨基,饱和的低级胺能溶于水,且氨基越多,水溶
性越好;
■化学性质:“ 碱 性 ”
>NH +HCl=NH Cl
CH NH +HCl→CH NH Cl (甲胺盐酸盐)
NH +HCl→ NH CI(苯胺盐酸盐)
十
胺和酰胺
酰胺
■定义:羧酸分子中羟基被氨基或取代的氨基取代得到的化合物;
R C 酰基
0
substitute -NH with -OH O 酰胺基 C NH
R C NH
■常见的酰胺:
O
H C C NH
乙酰胺
O
C NH
苯甲酰胺
H O C
CH N
\
CH
N,N-二甲基甲酰胺(DMF)
remove -OH O
OH
OH
O
C
O C
R
R
R N
O
C
胺和酰胺
酰胺
【拓展】下列常见有机物的名称
O
H C CH C NH
丙烯酰胺
O
H N C NH
碳酰胺
(又称脲,俗称尿素)
2-甲基丙烯酰胺
O
NH
H N
O
口思考:根据酰胺的结构,联系酯的化学性质,预测酰胺可能具有哪些化学
性质 O
水解反应 R C NH 2
■酰胺比酯类稳定,一般不水解,在强碱或强酸并加热时能水解:
胺和酰胺
酰胺
胺和酰胺
酰胺
【例4】酰胺水解方程式的书写:写出N,N-二甲基甲酰胺在酸性(盐酸)、碱性 (NaOH 溶液)条件下水解的化学方程式。
胺和酰胺
酰胺
【例5】酰胺水解定量分析:1 mol药物贝诺酯最多能消耗多少摩尔NaOH 得 到哪些产物
水解产物:
CH COONa
COONa
H
C CH
O
5 mol NaOH
ONa H N
ONa
胺和酰胺
化学与生活:尿素
尿素是人类第一个合成的有机物(1828年,维勒),打破了有机物和无机物不 能互相制备的观点。
哺乳动物和某些鱼类体内蛋白质代谢分解的产物中含尿素。它易保存,使 用方便,相比铵盐的酸性,尿素对土壤的破坏作用小,是目前使用量较大,含 氮量最高的一种中性氮肥。
尿素在水中加热时发生水解反应,放出两种气体,写出相应的化学方程式。 若在酸性或碱性环境下水解,产物相同吗
acid condition:CO +NH +;base condition:CO -+NH
氨 胺 酰胺
铵盐
结构特点 NH R-NH 等 含有氨基 R-CONH 等 含有酰胺基
含有NH +
化学性质 碱性,与酸 反应生成铵盐 碱性,与酸 反应成盐 酸/碱性并加热可 以发生水解反应
受热分解,与碱 共热产生氨
用途 制冷剂、 生产硝酸和尿素 合成医药、 农药和染料 溶剂和化工原料
生产化肥和 炸药
胺和酰胺
酰胺
【例6】请举例说明氨、胺、酰胺和铵盐这四类物质在组成、结构、性质和用 途上的不同,并设计表格进行比较。
列有关瑞德西韦的说法错误的是( D )
O H
已 知H: 与酯基的性质类似, P N 与酰胺基的性质类似。
A. 可以与H2发生加成反应
B. 不能与FeCl3溶液发生显色反应
C. 合成原料之一可能为苯
D. 在碱性条件下水解后生成4种物质
h
4.瑞德西韦是一种具有抗病毒活性的药物,其结构简式如图所示,下
随堂练习
