4.1原电池 高二上学期化学人教版(2019)选择性必修1(共28张PPT)
文档属性
| 名称 | 4.1原电池 高二上学期化学人教版(2019)选择性必修1(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 942.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-11 20:33:26 | ||
图片预览







文档简介
(共28张PPT)
选必1第四章化学反应与电能
第一节原电池
课时1 原电池的工作原理
1、通过原电池实验,认识电极反应、电极材料、 离子导体、电子导体是电池构成的四个基本要素, 能设计简单的原电池。
2、在分析锌铜原电池的过程中,逐渐建立原电 池的系统分析思路;能根据电极反应、电流方向或 离子的移动方向判断原电池的正极和负极。
锌片:Zn -2e-=Zn +
铜片:2H++2e-=H 个
把化学能直 接转变为电 能的装置 .
氧化反应
还原反应
Zn+2H+=Zn ++H 个
二、原电池
总反应式:
负极 正极
→Zn +H
so so
图6-7 原电池原理示意图
H
稀硫酸
Zn Cu
H
形成条件一:活泼性不同的两种材料作电极
负极:较活泼金属
正极:较不活泼金属或非金属导体等
形成条件二:有电解质溶液/熔融电解质
形成条件三:必须形成闭合回路
形成条件四:必须存在自发的氧化还原反应
1、构成原电池的条件
二、原电池
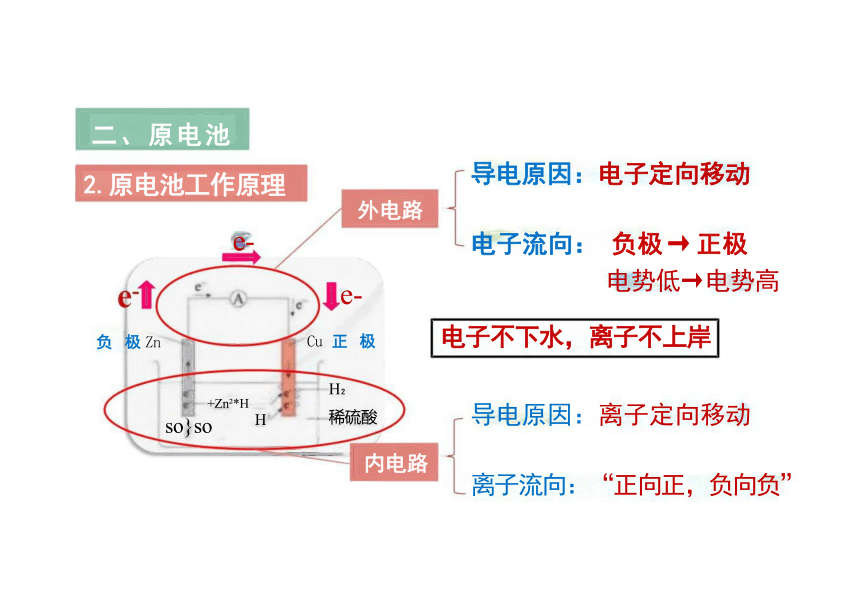
导电原因:电子定向移动
电子流向: 负极 → 正极
电势低→电势高
电子不下水,离子不上岸
导电原因:离子定向移动
离子流向:“正向正,负向负”
二、原电池
2.原电池工作原理
e-
负 极 Zn
外电路
e-
Cu 正 极
H
稀硫酸
内电路
+Zn *H
so}so
H
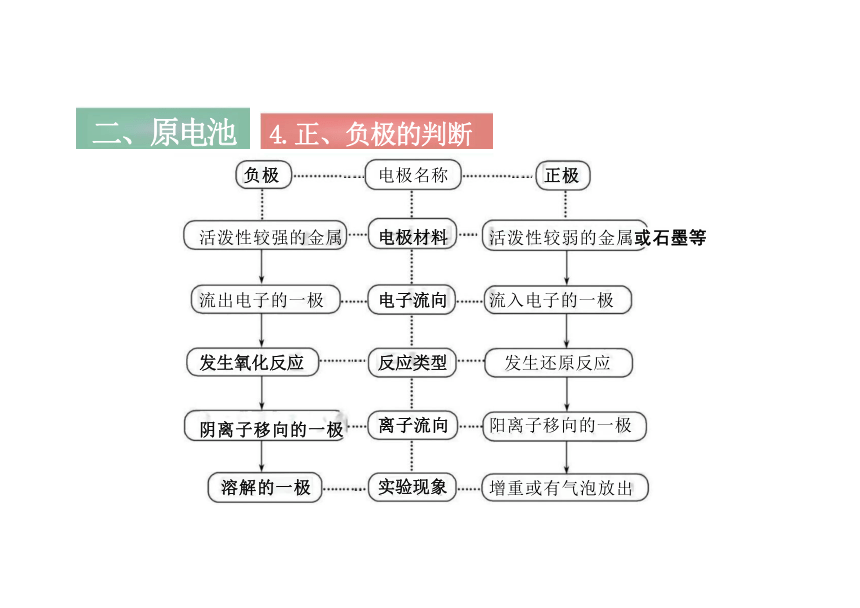
电极 正极
负极
电极材料 较不活泼金 属 、碳棒
较活泼金属
反应类型 还原反应
氧化反应
电子移向 电子由负极→正极 电流方向 电流由正极→负极 离子移向 阳离子→正极 阴离子→负极 电极现象 产生气泡、质量变重等 溶解
稀 H SO
AgNO 溶液
3.原电池正负极的特征
正极材料一般不参与反应
CuSO 溶液
稀 H SO
正极
活泼性较弱的金属或石墨等
流入电子的一极
发生还原反应
阳离子移向的一极
增重或有气泡放出
活泼性较强的金属
流出电子的一极
发生氧化反应
阴离子移向的一极
溶解的一极
电极名称
电极材料
电子流向
反应类型
离子流向
实验现象
4.正、负极的判断
二、原电池
负极
1、锌铜原电池产生电流时,阳离子( B )
A. 移向Zn 极,阴离子移向Cu 极 B. 移 向Cu极,阴离子移向Zn 极 C. 和阴离子都移向Zn 极
D. 和阴离子都移向Cu 极
【练习】
2、在用锌片、铜片和稀硫酸组成的原电池装置中,
经过一段时间工作后,下列说法中正确的是( C )
A. 锌片是正极,铜片上有气泡产生
B. 电流方向是从锌片流向铜片
C. 溶液中硫酸的物质的量减小
D. 电解液的酸碱性保持不变
【练习】
稀H SO
C
C(石墨)
NaCl溶液
G
稀H SO
B
Cu
酒精
稀H SO
3、下列装置中,能组成原电池的是(ABCH )
Fe C(石墨)Zn Cu
【练习】
稀H SO
D
Zn Cu
CuSO 溶液
稀H SO
Cu
H
E
F
1、加快反应速率
实验室制H 时,由于锌太纯,反应一般较慢,可加入少 量CuSO 以加快反应速率或 使用粗锌。
2、比较金属活动性的强弱(两个例外 )
3、用于金属保护
要保护轮船的铁制外壳,可在外壳贴上一些锌片,形成 Zn-海水-Fe 原电池,Fe 做正极,不参与反应,被保护起来。
三、原电池原理的应用
负 Fe C 正
负极:Fe -|2e-= Fe2+
正极:2Fe ++ 2e-= 2Fe2+
正负极电极反应式写一起时,得失电子需相等。
FeCl 溶液
4、设计原电池
例题:
请将反应 “Fe+2 Fe +| =3Fe + “设计成原电池。要求:画出装置图,并
写出电极反应式。(材料:铁 片、锌片、铜片、石墨棒、烧杯、导线;试 剂任选。) 负 正
单液原电池
缺点:电流不稳定,寿命短。
原因:负极材料与电
解质溶液直接接触!
3、电流是否衰减 如果是,衰减的原因可能是什么
思考与讨论
e
A
十
电流表
盐桥
ZnSO 溶液 CuSO 溶液
1.负极材料与电解质溶液分开为两池
2.负极池:负极材料及其对应的金属盐溶液
正极池:正极材料及电解质溶液
3.两池用盐桥相连
单液原电池
双液原电池
盐桥:
通常是装有含琼胶的KCl 饱和溶液。 盐桥中的K+、Cl- 是可以自由移动,琼 胶的固定作用可以防止KCl溶液直接流 出来。
e-
A
十
电流表
盐桥
n
ZnSO 溶液
1.负极材料与电解质溶液分开为两池
2.负极池:负极材料及其对应的金属盐溶液
正极池:正极材料及电解质溶液
3.两池用盐桥相连
作用:
1. 连 接 内 电 路
2. 平 衡 电 荷
双液原电池
CuSO 溶液
如图4-1所示,将置有锌片的ZnSO 溶
液和置有铜片的CuSO 溶液用一个盐桥连 接起来,然后将锌片和铜片用导线连接, 并在中间串联一个电流表,观察现象。 取出盐桥,观察电流表的指针有何变化。
e-
A
十
电流表
盐桥
n
ZnSO 溶液 CuSO 溶 液
实验探究
图4-1锌铜原电池示意图
1、图4-1所示的锌铜原电池工作时,电子在导线中的运动方向是怎样的 阴离 子和阳离子在电解质溶液中的运动方向是怎样的
2、锌铜原电池可看作由两个半电池组成,一个发生氧化反应,另一个发生还 原反应。试分别写出两个电极上的反应及总反应的离子方程式
A-
电流表
盐桥
ZnSO 溶液 CuSO 溶 液
思考与讨论
图4-1锌铜原电池示意图
例1、一个完整的氧化还原反应可以拆分,写成两个“半反应”式,一个是“氧化
反应”式,一个是“还原反应”式。如氧化还原反应:2FeCl +Cu =2FeCl +CuCl 。
(1)可以写成氧化反应:Cu -2e-=Cu + 还原反应: 2Fe ++2e-=2Fe +
(2)请将此反应设计成带盐桥的原电池,画出装置图
电流计
A-
盐桥
Cu C
CuCl 溶液 FeCl 溶液
电流计
盐桥
C
KI溶液 FeCl 溶液
例2:依据反应2Fe ++2I-=I +2Fe +, 设计双液原电池,实现化
学能转化为电能,并概括设计原电池的一般思路。
正极:2Fe ++2e-=2Fe +
负极:2I--2e-=I
正极
负极
C
设计原电池的思路
选择
与电极反应
正极区、负极区
租对应
的电解液
分析
氧化反应和
还原反应
选择
电极材科
练习1、判断下列说法是否正确。
(1)原电池中电流的方向是负极→导线→正极( × )
(2)原电池中负极发生的反应是还原反应( × )
(3)锌铜原电池中电子由锌电极经过电解质溶液流向铜电极( × )
(4)在原电池中阳离子移向正极,阴离子移向负极( √ )
(5)原电池的正极一定是化学性质不活泼的金属( × )
A.外电路的电流方向为:X→ 外电路→Y
B.若两电极分别为Zn 和碳棒,则X 为碳棒,Y 为Zn
C.若两电极都是金属,则它们的活动性为X>Y
D.X极上发生的是还原反应,Y 极上发生的是氧化反应
练习2、如下图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,
外电路中的电子流向如图所示,对此装置的下列说法正确的是( C )
CuSO 溶 液 Y 溶液
(1)电极X的材料是 铜 ;电解质溶液Y是 A g N O 溶 液
(2)银电极为电池的 正 极,电极反应为 2Ag++2e-=2Ag ;X 电极上发 生的电极反应为 Cu-2e-=Cu + ;
(3)外电路中的电子是从 Cu 电极流向 Ag 电极。
(4)盐桥中装有含氯化钾饱和溶液的琼胶,其作用是形成闭合回路、平衡电荷
示。请回答下列问题:
X
练习3、依据氧化还原反应:2Ag++Cu =Cu ++2Ag设计的原电池如右图所
电流计 A
盐桥
Ag
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO -)减小
C.电池工作一段时间后,乙池溶液的总质量增加1()
练习4、锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分
子通过,下列有关叙述正确的是( C )
D.阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
1 mol·L-
CuSO (aq)
交换膜
1、阳离子交换膜:只允许阳离子通过
2、阴离子交换膜:只允许阴离子通过
3、质子交换膜:只允许H+ 通过
CuSO 溶液
ZnSO 溶液 CuSO 溶液
高中常见的三种离子交换膜
优点:电流稳定
缺点:电流小
ZnSO 溶液 CuSO 溶液
优点:电流大且稳定
双液原电池
单液原电池
隔膜原电池
缺点:电流不稳定
Thank you!
感谢观看!
盐桥:
通常是装有含琼胶的KCl 饱和溶液。 盐桥中的K+、Cl- 是可以自由移动,琼 胶的固定作用可以防止KCl溶液直接流 出来。
e-
A
十
电流表
盐桥
n
ZnSO 溶液
1.负极材料与电解质溶液分开为两池
2.负极池:负极材料及其对应的金属盐溶液
正极池:正极材料及电解质溶液
3.两池用盐桥相连
作用:
1. 连 接 内 电 路
2. 平 衡 电 荷
双液原电池
CuSO 溶液
Zn Cu
稀硫酸
选必1第四章化学反应与电能
第一节原电池
课时1 原电池的工作原理
1、通过原电池实验,认识电极反应、电极材料、 离子导体、电子导体是电池构成的四个基本要素, 能设计简单的原电池。
2、在分析锌铜原电池的过程中,逐渐建立原电 池的系统分析思路;能根据电极反应、电流方向或 离子的移动方向判断原电池的正极和负极。
锌片:Zn -2e-=Zn +
铜片:2H++2e-=H 个
把化学能直 接转变为电 能的装置 .
氧化反应
还原反应
Zn+2H+=Zn ++H 个
二、原电池
总反应式:
负极 正极
→Zn +H
so so
图6-7 原电池原理示意图
H
稀硫酸
Zn Cu
H
形成条件一:活泼性不同的两种材料作电极
负极:较活泼金属
正极:较不活泼金属或非金属导体等
形成条件二:有电解质溶液/熔融电解质
形成条件三:必须形成闭合回路
形成条件四:必须存在自发的氧化还原反应
1、构成原电池的条件
二、原电池
导电原因:电子定向移动
电子流向: 负极 → 正极
电势低→电势高
电子不下水,离子不上岸
导电原因:离子定向移动
离子流向:“正向正,负向负”
二、原电池
2.原电池工作原理
e-
负 极 Zn
外电路
e-
Cu 正 极
H
稀硫酸
内电路
+Zn *H
so}so
H
电极 正极
负极
电极材料 较不活泼金 属 、碳棒
较活泼金属
反应类型 还原反应
氧化反应
电子移向 电子由负极→正极 电流方向 电流由正极→负极 离子移向 阳离子→正极 阴离子→负极 电极现象 产生气泡、质量变重等 溶解
稀 H SO
AgNO 溶液
3.原电池正负极的特征
正极材料一般不参与反应
CuSO 溶液
稀 H SO
正极
活泼性较弱的金属或石墨等
流入电子的一极
发生还原反应
阳离子移向的一极
增重或有气泡放出
活泼性较强的金属
流出电子的一极
发生氧化反应
阴离子移向的一极
溶解的一极
电极名称
电极材料
电子流向
反应类型
离子流向
实验现象
4.正、负极的判断
二、原电池
负极
1、锌铜原电池产生电流时,阳离子( B )
A. 移向Zn 极,阴离子移向Cu 极 B. 移 向Cu极,阴离子移向Zn 极 C. 和阴离子都移向Zn 极
D. 和阴离子都移向Cu 极
【练习】
2、在用锌片、铜片和稀硫酸组成的原电池装置中,
经过一段时间工作后,下列说法中正确的是( C )
A. 锌片是正极,铜片上有气泡产生
B. 电流方向是从锌片流向铜片
C. 溶液中硫酸的物质的量减小
D. 电解液的酸碱性保持不变
【练习】
稀H SO
C
C(石墨)
NaCl溶液
G
稀H SO
B
Cu
酒精
稀H SO
3、下列装置中,能组成原电池的是(ABCH )
Fe C(石墨)Zn Cu
【练习】
稀H SO
D
Zn Cu
CuSO 溶液
稀H SO
Cu
H
E
F
1、加快反应速率
实验室制H 时,由于锌太纯,反应一般较慢,可加入少 量CuSO 以加快反应速率或 使用粗锌。
2、比较金属活动性的强弱(两个例外 )
3、用于金属保护
要保护轮船的铁制外壳,可在外壳贴上一些锌片,形成 Zn-海水-Fe 原电池,Fe 做正极,不参与反应,被保护起来。
三、原电池原理的应用
负 Fe C 正
负极:Fe -|2e-= Fe2+
正极:2Fe ++ 2e-= 2Fe2+
正负极电极反应式写一起时,得失电子需相等。
FeCl 溶液
4、设计原电池
例题:
请将反应 “Fe+2 Fe +| =3Fe + “设计成原电池。要求:画出装置图,并
写出电极反应式。(材料:铁 片、锌片、铜片、石墨棒、烧杯、导线;试 剂任选。) 负 正
单液原电池
缺点:电流不稳定,寿命短。
原因:负极材料与电
解质溶液直接接触!
3、电流是否衰减 如果是,衰减的原因可能是什么
思考与讨论
e
A
十
电流表
盐桥
ZnSO 溶液 CuSO 溶液
1.负极材料与电解质溶液分开为两池
2.负极池:负极材料及其对应的金属盐溶液
正极池:正极材料及电解质溶液
3.两池用盐桥相连
单液原电池
双液原电池
盐桥:
通常是装有含琼胶的KCl 饱和溶液。 盐桥中的K+、Cl- 是可以自由移动,琼 胶的固定作用可以防止KCl溶液直接流 出来。
e-
A
十
电流表
盐桥
n
ZnSO 溶液
1.负极材料与电解质溶液分开为两池
2.负极池:负极材料及其对应的金属盐溶液
正极池:正极材料及电解质溶液
3.两池用盐桥相连
作用:
1. 连 接 内 电 路
2. 平 衡 电 荷
双液原电池
CuSO 溶液
如图4-1所示,将置有锌片的ZnSO 溶
液和置有铜片的CuSO 溶液用一个盐桥连 接起来,然后将锌片和铜片用导线连接, 并在中间串联一个电流表,观察现象。 取出盐桥,观察电流表的指针有何变化。
e-
A
十
电流表
盐桥
n
ZnSO 溶液 CuSO 溶 液
实验探究
图4-1锌铜原电池示意图
1、图4-1所示的锌铜原电池工作时,电子在导线中的运动方向是怎样的 阴离 子和阳离子在电解质溶液中的运动方向是怎样的
2、锌铜原电池可看作由两个半电池组成,一个发生氧化反应,另一个发生还 原反应。试分别写出两个电极上的反应及总反应的离子方程式
A-
电流表
盐桥
ZnSO 溶液 CuSO 溶 液
思考与讨论
图4-1锌铜原电池示意图
例1、一个完整的氧化还原反应可以拆分,写成两个“半反应”式,一个是“氧化
反应”式,一个是“还原反应”式。如氧化还原反应:2FeCl +Cu =2FeCl +CuCl 。
(1)可以写成氧化反应:Cu -2e-=Cu + 还原反应: 2Fe ++2e-=2Fe +
(2)请将此反应设计成带盐桥的原电池,画出装置图
电流计
A-
盐桥
Cu C
CuCl 溶液 FeCl 溶液
电流计
盐桥
C
KI溶液 FeCl 溶液
例2:依据反应2Fe ++2I-=I +2Fe +, 设计双液原电池,实现化
学能转化为电能,并概括设计原电池的一般思路。
正极:2Fe ++2e-=2Fe +
负极:2I--2e-=I
正极
负极
C
设计原电池的思路
选择
与电极反应
正极区、负极区
租对应
的电解液
分析
氧化反应和
还原反应
选择
电极材科
练习1、判断下列说法是否正确。
(1)原电池中电流的方向是负极→导线→正极( × )
(2)原电池中负极发生的反应是还原反应( × )
(3)锌铜原电池中电子由锌电极经过电解质溶液流向铜电极( × )
(4)在原电池中阳离子移向正极,阴离子移向负极( √ )
(5)原电池的正极一定是化学性质不活泼的金属( × )
A.外电路的电流方向为:X→ 外电路→Y
B.若两电极分别为Zn 和碳棒,则X 为碳棒,Y 为Zn
C.若两电极都是金属,则它们的活动性为X>Y
D.X极上发生的是还原反应,Y 极上发生的是氧化反应
练习2、如下图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,
外电路中的电子流向如图所示,对此装置的下列说法正确的是( C )
CuSO 溶 液 Y 溶液
(1)电极X的材料是 铜 ;电解质溶液Y是 A g N O 溶 液
(2)银电极为电池的 正 极,电极反应为 2Ag++2e-=2Ag ;X 电极上发 生的电极反应为 Cu-2e-=Cu + ;
(3)外电路中的电子是从 Cu 电极流向 Ag 电极。
(4)盐桥中装有含氯化钾饱和溶液的琼胶,其作用是形成闭合回路、平衡电荷
示。请回答下列问题:
X
练习3、依据氧化还原反应:2Ag++Cu =Cu ++2Ag设计的原电池如右图所
电流计 A
盐桥
Ag
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO -)减小
C.电池工作一段时间后,乙池溶液的总质量增加1()
练习4、锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分
子通过,下列有关叙述正确的是( C )
D.阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
1 mol·L-
CuSO (aq)
交换膜
1、阳离子交换膜:只允许阳离子通过
2、阴离子交换膜:只允许阴离子通过
3、质子交换膜:只允许H+ 通过
CuSO 溶液
ZnSO 溶液 CuSO 溶液
高中常见的三种离子交换膜
优点:电流稳定
缺点:电流小
ZnSO 溶液 CuSO 溶液
优点:电流大且稳定
双液原电池
单液原电池
隔膜原电池
缺点:电流不稳定
Thank you!
感谢观看!
盐桥:
通常是装有含琼胶的KCl 饱和溶液。 盐桥中的K+、Cl- 是可以自由移动,琼 胶的固定作用可以防止KCl溶液直接流 出来。
e-
A
十
电流表
盐桥
n
ZnSO 溶液
1.负极材料与电解质溶液分开为两池
2.负极池:负极材料及其对应的金属盐溶液
正极池:正极材料及电解质溶液
3.两池用盐桥相连
作用:
1. 连 接 内 电 路
2. 平 衡 电 荷
双液原电池
CuSO 溶液
Zn Cu
稀硫酸
