2.1影响化学反应速率的因素 高二上学期化学人教版(2019)选择性必修1(共31张PPT)
文档属性
| 名称 | 2.1影响化学反应速率的因素 高二上学期化学人教版(2019)选择性必修1(共31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 424.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-11 20:34:13 | ||
图片预览









文档简介
(共31张PPT)
第二章化学反应速率和化学平衡 第一节化学反应速率
2.1.2 影响化学反应速率的因素
学习目标
1、掌握影响化学反应速率的主要因素
2、理 解外界条件(浓度、温度、压强、催化剂等)对化学反应速率的 影响。
3.了解催化剂在生产、生活和科学研究领域中的重大作用,培养科学 态度与社会责任。
1、在通常情况下,Na 与水的反应和Mg 与水的反应哪个剧烈(反应 速率快) 为什么
Na与水反应更剧烈,因为钠比镁更活泼
2、将等物质的量的碳酸钠放入等体积等浓度的盐酸和醋酸中,产生 CO 的速率哪个较快 为什么
与盐酸反应产生CO 的速率更快,因为等体积等浓度的盐酸电离出的氢离子比 醋酸多
3、石油的形成要多少年 炸药的爆炸呢
石油的形成需要几干年甚至更久,而炸药的爆炸只需要几微秒至几十微秒
4、以上说明化学反应速率的决定因素是什么
结 论 :决定化学反应速率的因素是参加反应的物质本身的 化学性质(即反应物的组成、结构和性质等因素)。
思考
不同的化学反应,具有不同的反应速率,因此,参加反应的物 质的本身性质(组成、结构和性质)是决定化学反应速率的最主要 因素。如:形状大小相同的铁、铝分别与等浓度的盐酸反应生 成氢气的速率:铁小于铝
一.影响化学反应速率的主要因素(内因)
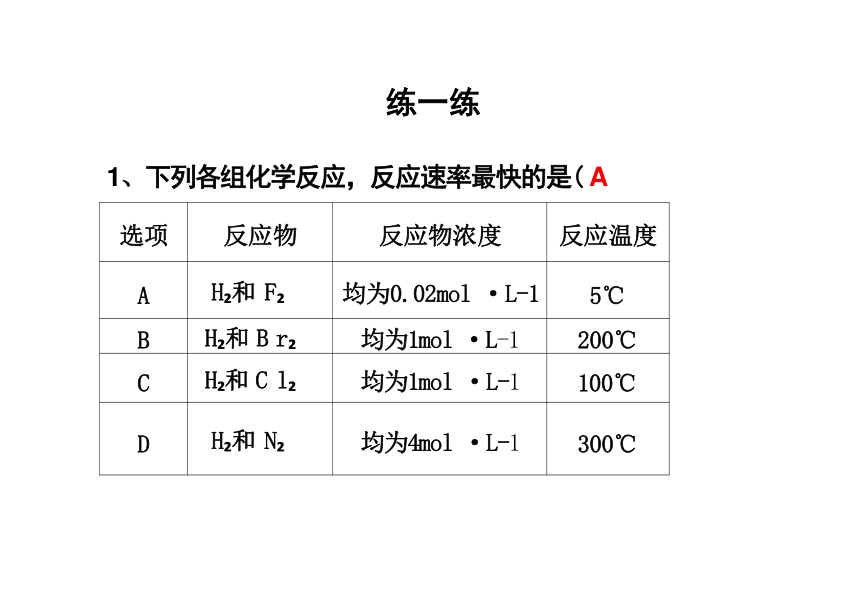
选项 反应物 反应物浓度
反应温度
A H 和 F 均为0.02mol ·L-1
5℃
B H 和 B r 均为1mol ·L-1
200℃
C H 和 C l 均为1mol ·L-1
100℃
D H 和 N 均为4mol ·L-1
300℃
练一练
1、下列各组化学反应,反应速率最快的是( A
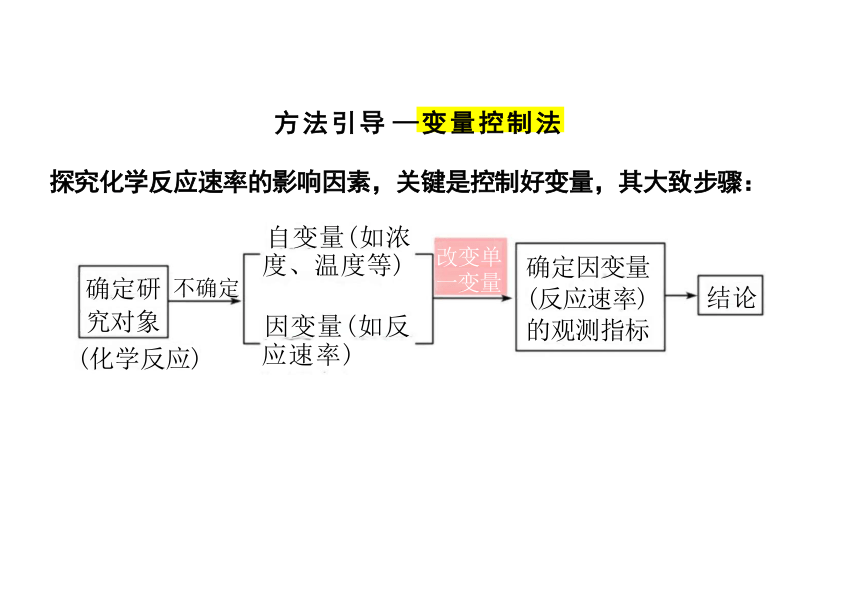
自变量(如浓
度、温度等)
结论
因变量(如反
应速率)
方法引导 —变量控制法
探究化学反应速率的影响因素,关键是控制好变量,其大致步骤:
确定研 不确定
究对象
(化学反应)
确定因变量 (反应速率) 的观测指标
改变单 一变量
实验过 程 取两支大小相同的试管,分别加入5 mL 0.1mol/L Na S O 溶液,向其中一支试管(左图)加 入5 mL 0.1mol/L H SO 溶液,另一支试管(右图)加入5 mL 0.5mol/L H SO 溶液,振荡。 观察、比较两支试管中溶液出现浑浊的快慢 实验装 置 0.1 mol ·L- H S0.5mL 0.1 mol ·L Na,S 0,5mL
0.5 mol ·L
H S0.5mL
0.1 mol ·L
Na S O 5mL
化学方 程式 实验现 象 两支试管中的溶液均变 ,滴加 mol · L- H SO 溶液的试管先变浑浊 实验结 论
二.影响化学反应速率的外界因素(外因
1、浓度对化学反应速率的影响
S O 2-+2H+=SO T+Sl+H O
以硫代硫酸钠与硫酸的反应为例
影响规律①:在其他条件不变时,增大反应物浓度,可以 增大反应速率;减小反应物的浓度,可以减小化学反应的 速率。
1 、浓度对化学反应速率的影响
【几点注意】
①浓度对化学反应速率的影响只适用于气体或溶液的反应,对于 纯固体或液体的反应物,一般情况下其浓度是常数,因此改变它 们的量不会改变化学反应速率②固体物质的反应速率与接触面积 有关,颗粒越细,表面积越大,反应速率就越快。块状固体可以 通过研细来增大表面积,从而加快化学反应速率③对于离子反应, 只有实际参加反应的各离子浓度发生变化,才会引起化学反应速 率的改变④随着化学反应的进行,反应物的浓度会逐渐减小,因 此一般反应速率也会逐渐减小
练一练
2、一定条件下,在CaCO (块状)+2HCl=CaCl +H O+CO
反应中,为了加快反应的速率,下列那些方法可行( AD )
A、增加HCl的浓度
B、加水
C、增加同浓度盐酸的量
D、改 加CaCO 粉末
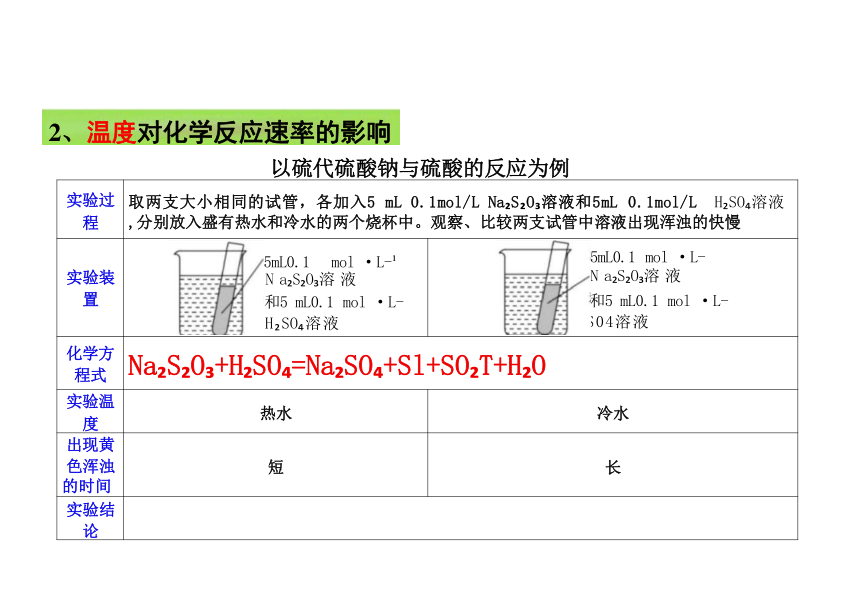
实验过 程 取两支大小相同的试管,各加入5 mL 0.1mol/L Na S O 溶液和5mL 0.1mol/L H SO 溶液 ,分别放入盛有热水和冷水的两个烧杯中。观察、比较两支试管中溶液出现浑浊的快慢 实验装 置 5mL0.1 mol ·L- N a S O 溶 液 和5 mL0.1 mol ·L- H SO 溶液
5mL0.1 mol ·L-
N a S O 溶 液
和5 mL0.1 mol ·L- S04溶液
化学方 程式 Na S O +H SO =Na SO +Sl+SO T+H O 实验温 度 热水
冷水
出现黄 色浑浊 的时间 短
长
实验结 论
2、温度对化学反应速率的影响
以硫代硫酸钠与硫酸的反应为例
影响规律②:当其他条件不变时,升高温度,可以增大化 学反应速率;降低温度,可以减小化学反应速率
2、温 度对化学反应速率的影响
【几点注意】
①温度对反应速率的影响不受反应物聚集状态的限制,不论是吸 热反应还是放热反应,升高温度都能增大化学反应速率,故不能 认为升高温度只会增大吸热反应的反应速率,如:木炭燃烧是放 热反应,温度越高,燃烧越快
②实验测定,温度每升高10℃,化学反应速率通常增大到原来2 ~4倍
练一练
3、设 NO+CO ÷2CO (正反应吸热)反应速率为v ;N +3H ÷2NH ( 正 反应放热)反应速率为v 。对于前述反应,当温度升高时,v 和v 变化 情况为( A
A、同时增大 B、 同时减小
C、v 减少,v 增大 D、v 增大,v 减小
对于气体来说,在一定温度下,一定质量的气体所占的体积与压 强成反比
由图可知:其他条件不变时,增大 压强,气体体积缩小,浓度增大
3、压 强对化学反应速率的影响
气体模型的理解
影响规律③:对于气体反应,当其他条件不变时,增大压 强,气体体积缩小 ,浓度增大,化学反应速率加快;减小 压强,气体体积增大,浓度减小,化学反应速率减慢
2、压 强对化学反应速率的影响
【几点注意】
①压强对化学反应速率的影响只适用有气体参加的反应;由于固 体、液体粒子间的空隙很小,增大压强几乎不能改变它们的浓度 ,因此对只有固体或液体参加的反应,压强的变化对于反应速率 的影响可以忽略不计。
② 压强对于反应速率的影响是通过对浓度的影响实现的,P 增大 →c浓度成比例增大,P减小→c浓度成比例减小
练一练
4、在 N +3H ÷2NH 中,当其他外界条件不变时: I、减小体系压强,该反应的速率怎么变
Ⅱ、在反应中保持体系容积不变,充入N , 反应的速率怎么变 Ⅲ、在反应中保持体系容积不变,充入He, 反应的速率怎么变 IV、在反应中保持体系压强不变,充入He, 反应的速率怎么变
压强影响反应速率,必须伴随体积的改变即浓度的变化。若 容器的体积不变,各气体的浓度不变,则速率不变。
③对于气体有下列几种情况:
1、恒温时:增大压强→体积减少→C增大→反应速率增大
2、恒容时:
A、充入气体反应物→反应物浓度增大→总压增大→反应
速率增大;
B、冲入“无关气体”(如He、N, 等)→ 引起总压增大, 但各反应物的分压不变,各物质的浓度不变→反应速率不
变
3、恒压时:冲入“无关气体”(如He等)→ 引起体积增大, →各反应物浓度减少→反应速率减慢。
练一练
5、对于反应N +O =2NO 在密闭容器中进行,下列条件哪些不能 加快该反应的化学反应速率( DE )
A、缩小体积使压强增大
B、体积不变充入N 使压强增大
C、体积不变充入O 使压强增大
D、使体积增大到原来的2倍
E、体积不变充入氦气使压强增大
以双氧水的催化分解为例
实验过 程 取两支大小相同的试管,分别加入2 mL 5%H O 溶液,向其中一支 试管(右图)滴加2滴1 mol/L FeCl 溶液。观察、比较两支试管中气泡 出现的快慢 实验装 置 H O 溶液
FeCl
溶液
H O
溶液
化学方 程式 2H O2= 2H O+O ↑ 实验现 象 无明显现象
产生大量气泡
解释 H O 分解缓慢
加入FeCl ,H O 分解速率迅速
实验结 论 催化剂能加快化学反应速率
4、催化剂对化学反应速率的影响
影响规律③:当其他条件不变时,使用催化剂,化学反应 速率增大
4、催化剂对化学反应速率的影响
催化剂:能改 变化学反应速率而自身的化学组成和质 量在反应前后保持不变
正催化剂 加快化学反应速率
催
化
剂
负催化剂 减慢化学反应速率
【几点注意】
①使用催化剂同等程度的增大(减慢)正逆反应速率,从而改变 反应到达平衡所需时间。
②没特别指明一般指正催化剂
③催化剂只能催化可能发生的反应,对不发生的反应无作用
④催化剂一定的具有选择性
⑤催化剂中毒:催化剂的活性因接触少量的杂质而明显下降甚至 遭到破坏,这种现象叫催化剂中毒(催化能力降低)。
练一练
6、下列说法正确的是( C )A.催化剂能使不发生反应的物质发生 反应B. 在化学反应前后,催化剂的化学性质不变,质量改变C. 催 化剂能改变化学反应速率D. 电解水时,往水中加入少量N aOH,
可使电解速率明显加快,所以NaOH 是这个反应的催化剂
(1)固体表面积:固体颗粒越小,其单位质量的表面积越大,与其 他反应物的接触面积越大,化学反应速率越大。(2) 反应物状态: 一般来说,配成溶液或反应物是气体,都能增大反应物之间的接 触面积,有利于增大反应速率。 (3) 形成原电池:可以增大氧化还 原反应的反应速率。(4)其它方法:光辐照、放射线辐照、超声波、 电弧、强磁场、高速研磨,均是行之有效的改变化学反应速率的 方法(块状)
5、其他因素对化学反应速率的影响
练一练
7、在密闭容器里,通入x mol H 和y molI (g),改变下列条 件,反应速率将如何改变 H (g)+I (g)÷2HI(g)
(1)升高温度 加快 ;
(2)加入催化剂 加快 ;
(3)充入更多的H 加快;
(4)扩大容器的体积减慢;
(5)容器容积不变,通入氖气不变。
AB段:Zn与盐酸的反应是放热反应,使溶液 的温度升高,化学反应速率逐渐增大
BC段:随着反应的进行,盐酸的浓度逐渐减 小,化学反应速率逐渐减小
三 . 化学反应速率图像
1、全程速率—时间图(v-t图像
(1)Zn与足量盐酸的反应,反应速率随时间的变化如图所示。
(2)H C O 溶液中加入酸性KMnO 溶液,随着反应的进行,反应速 率随时间的变化如图所示
2KMnO +5H C O +3H SO =K SO +2MnSO +10CO 个+8H O
AB 段:反应产生的Mn + 对该反应起催化作用, 化学反应速率逐渐增大
BC 段:随着反应的进行,反应物的浓度逐渐 减小,化学反应速率逐渐减小
0
其他条件一定,反应速率随着温度的升高而增大 其他条件一定,反应速率随着温度的降低而减小
T
0
2、速率—温度图(v-T 图像)
其他条件一定,增大气态反应物的压强(缩小容 器的容积),反应速率随着压强的增大而增大; 其他条件一定,减小气态反应物的压强(增大容 器的容积),反应速率随着压强的减小而减小
3、速率—压强图(v-P 图像)
第二章化学反应速率和化学平衡 第一节化学反应速率
2.1.2 影响化学反应速率的因素
学习目标
1、掌握影响化学反应速率的主要因素
2、理 解外界条件(浓度、温度、压强、催化剂等)对化学反应速率的 影响。
3.了解催化剂在生产、生活和科学研究领域中的重大作用,培养科学 态度与社会责任。
1、在通常情况下,Na 与水的反应和Mg 与水的反应哪个剧烈(反应 速率快) 为什么
Na与水反应更剧烈,因为钠比镁更活泼
2、将等物质的量的碳酸钠放入等体积等浓度的盐酸和醋酸中,产生 CO 的速率哪个较快 为什么
与盐酸反应产生CO 的速率更快,因为等体积等浓度的盐酸电离出的氢离子比 醋酸多
3、石油的形成要多少年 炸药的爆炸呢
石油的形成需要几干年甚至更久,而炸药的爆炸只需要几微秒至几十微秒
4、以上说明化学反应速率的决定因素是什么
结 论 :决定化学反应速率的因素是参加反应的物质本身的 化学性质(即反应物的组成、结构和性质等因素)。
思考
不同的化学反应,具有不同的反应速率,因此,参加反应的物 质的本身性质(组成、结构和性质)是决定化学反应速率的最主要 因素。如:形状大小相同的铁、铝分别与等浓度的盐酸反应生 成氢气的速率:铁小于铝
一.影响化学反应速率的主要因素(内因)
选项 反应物 反应物浓度
反应温度
A H 和 F 均为0.02mol ·L-1
5℃
B H 和 B r 均为1mol ·L-1
200℃
C H 和 C l 均为1mol ·L-1
100℃
D H 和 N 均为4mol ·L-1
300℃
练一练
1、下列各组化学反应,反应速率最快的是( A
自变量(如浓
度、温度等)
结论
因变量(如反
应速率)
方法引导 —变量控制法
探究化学反应速率的影响因素,关键是控制好变量,其大致步骤:
确定研 不确定
究对象
(化学反应)
确定因变量 (反应速率) 的观测指标
改变单 一变量
实验过 程 取两支大小相同的试管,分别加入5 mL 0.1mol/L Na S O 溶液,向其中一支试管(左图)加 入5 mL 0.1mol/L H SO 溶液,另一支试管(右图)加入5 mL 0.5mol/L H SO 溶液,振荡。 观察、比较两支试管中溶液出现浑浊的快慢 实验装 置 0.1 mol ·L- H S0.5mL 0.1 mol ·L Na,S 0,5mL
0.5 mol ·L
H S0.5mL
0.1 mol ·L
Na S O 5mL
化学方 程式 实验现 象 两支试管中的溶液均变 ,滴加 mol · L- H SO 溶液的试管先变浑浊 实验结 论
二.影响化学反应速率的外界因素(外因
1、浓度对化学反应速率的影响
S O 2-+2H+=SO T+Sl+H O
以硫代硫酸钠与硫酸的反应为例
影响规律①:在其他条件不变时,增大反应物浓度,可以 增大反应速率;减小反应物的浓度,可以减小化学反应的 速率。
1 、浓度对化学反应速率的影响
【几点注意】
①浓度对化学反应速率的影响只适用于气体或溶液的反应,对于 纯固体或液体的反应物,一般情况下其浓度是常数,因此改变它 们的量不会改变化学反应速率②固体物质的反应速率与接触面积 有关,颗粒越细,表面积越大,反应速率就越快。块状固体可以 通过研细来增大表面积,从而加快化学反应速率③对于离子反应, 只有实际参加反应的各离子浓度发生变化,才会引起化学反应速 率的改变④随着化学反应的进行,反应物的浓度会逐渐减小,因 此一般反应速率也会逐渐减小
练一练
2、一定条件下,在CaCO (块状)+2HCl=CaCl +H O+CO
反应中,为了加快反应的速率,下列那些方法可行( AD )
A、增加HCl的浓度
B、加水
C、增加同浓度盐酸的量
D、改 加CaCO 粉末
实验过 程 取两支大小相同的试管,各加入5 mL 0.1mol/L Na S O 溶液和5mL 0.1mol/L H SO 溶液 ,分别放入盛有热水和冷水的两个烧杯中。观察、比较两支试管中溶液出现浑浊的快慢 实验装 置 5mL0.1 mol ·L- N a S O 溶 液 和5 mL0.1 mol ·L- H SO 溶液
5mL0.1 mol ·L-
N a S O 溶 液
和5 mL0.1 mol ·L- S04溶液
化学方 程式 Na S O +H SO =Na SO +Sl+SO T+H O 实验温 度 热水
冷水
出现黄 色浑浊 的时间 短
长
实验结 论
2、温度对化学反应速率的影响
以硫代硫酸钠与硫酸的反应为例
影响规律②:当其他条件不变时,升高温度,可以增大化 学反应速率;降低温度,可以减小化学反应速率
2、温 度对化学反应速率的影响
【几点注意】
①温度对反应速率的影响不受反应物聚集状态的限制,不论是吸 热反应还是放热反应,升高温度都能增大化学反应速率,故不能 认为升高温度只会增大吸热反应的反应速率,如:木炭燃烧是放 热反应,温度越高,燃烧越快
②实验测定,温度每升高10℃,化学反应速率通常增大到原来2 ~4倍
练一练
3、设 NO+CO ÷2CO (正反应吸热)反应速率为v ;N +3H ÷2NH ( 正 反应放热)反应速率为v 。对于前述反应,当温度升高时,v 和v 变化 情况为( A
A、同时增大 B、 同时减小
C、v 减少,v 增大 D、v 增大,v 减小
对于气体来说,在一定温度下,一定质量的气体所占的体积与压 强成反比
由图可知:其他条件不变时,增大 压强,气体体积缩小,浓度增大
3、压 强对化学反应速率的影响
气体模型的理解
影响规律③:对于气体反应,当其他条件不变时,增大压 强,气体体积缩小 ,浓度增大,化学反应速率加快;减小 压强,气体体积增大,浓度减小,化学反应速率减慢
2、压 强对化学反应速率的影响
【几点注意】
①压强对化学反应速率的影响只适用有气体参加的反应;由于固 体、液体粒子间的空隙很小,增大压强几乎不能改变它们的浓度 ,因此对只有固体或液体参加的反应,压强的变化对于反应速率 的影响可以忽略不计。
② 压强对于反应速率的影响是通过对浓度的影响实现的,P 增大 →c浓度成比例增大,P减小→c浓度成比例减小
练一练
4、在 N +3H ÷2NH 中,当其他外界条件不变时: I、减小体系压强,该反应的速率怎么变
Ⅱ、在反应中保持体系容积不变,充入N , 反应的速率怎么变 Ⅲ、在反应中保持体系容积不变,充入He, 反应的速率怎么变 IV、在反应中保持体系压强不变,充入He, 反应的速率怎么变
压强影响反应速率,必须伴随体积的改变即浓度的变化。若 容器的体积不变,各气体的浓度不变,则速率不变。
③对于气体有下列几种情况:
1、恒温时:增大压强→体积减少→C增大→反应速率增大
2、恒容时:
A、充入气体反应物→反应物浓度增大→总压增大→反应
速率增大;
B、冲入“无关气体”(如He、N, 等)→ 引起总压增大, 但各反应物的分压不变,各物质的浓度不变→反应速率不
变
3、恒压时:冲入“无关气体”(如He等)→ 引起体积增大, →各反应物浓度减少→反应速率减慢。
练一练
5、对于反应N +O =2NO 在密闭容器中进行,下列条件哪些不能 加快该反应的化学反应速率( DE )
A、缩小体积使压强增大
B、体积不变充入N 使压强增大
C、体积不变充入O 使压强增大
D、使体积增大到原来的2倍
E、体积不变充入氦气使压强增大
以双氧水的催化分解为例
实验过 程 取两支大小相同的试管,分别加入2 mL 5%H O 溶液,向其中一支 试管(右图)滴加2滴1 mol/L FeCl 溶液。观察、比较两支试管中气泡 出现的快慢 实验装 置 H O 溶液
FeCl
溶液
H O
溶液
化学方 程式 2H O2= 2H O+O ↑ 实验现 象 无明显现象
产生大量气泡
解释 H O 分解缓慢
加入FeCl ,H O 分解速率迅速
实验结 论 催化剂能加快化学反应速率
4、催化剂对化学反应速率的影响
影响规律③:当其他条件不变时,使用催化剂,化学反应 速率增大
4、催化剂对化学反应速率的影响
催化剂:能改 变化学反应速率而自身的化学组成和质 量在反应前后保持不变
正催化剂 加快化学反应速率
催
化
剂
负催化剂 减慢化学反应速率
【几点注意】
①使用催化剂同等程度的增大(减慢)正逆反应速率,从而改变 反应到达平衡所需时间。
②没特别指明一般指正催化剂
③催化剂只能催化可能发生的反应,对不发生的反应无作用
④催化剂一定的具有选择性
⑤催化剂中毒:催化剂的活性因接触少量的杂质而明显下降甚至 遭到破坏,这种现象叫催化剂中毒(催化能力降低)。
练一练
6、下列说法正确的是( C )A.催化剂能使不发生反应的物质发生 反应B. 在化学反应前后,催化剂的化学性质不变,质量改变C. 催 化剂能改变化学反应速率D. 电解水时,往水中加入少量N aOH,
可使电解速率明显加快,所以NaOH 是这个反应的催化剂
(1)固体表面积:固体颗粒越小,其单位质量的表面积越大,与其 他反应物的接触面积越大,化学反应速率越大。(2) 反应物状态: 一般来说,配成溶液或反应物是气体,都能增大反应物之间的接 触面积,有利于增大反应速率。 (3) 形成原电池:可以增大氧化还 原反应的反应速率。(4)其它方法:光辐照、放射线辐照、超声波、 电弧、强磁场、高速研磨,均是行之有效的改变化学反应速率的 方法(块状)
5、其他因素对化学反应速率的影响
练一练
7、在密闭容器里,通入x mol H 和y molI (g),改变下列条 件,反应速率将如何改变 H (g)+I (g)÷2HI(g)
(1)升高温度 加快 ;
(2)加入催化剂 加快 ;
(3)充入更多的H 加快;
(4)扩大容器的体积减慢;
(5)容器容积不变,通入氖气不变。
AB段:Zn与盐酸的反应是放热反应,使溶液 的温度升高,化学反应速率逐渐增大
BC段:随着反应的进行,盐酸的浓度逐渐减 小,化学反应速率逐渐减小
三 . 化学反应速率图像
1、全程速率—时间图(v-t图像
(1)Zn与足量盐酸的反应,反应速率随时间的变化如图所示。
(2)H C O 溶液中加入酸性KMnO 溶液,随着反应的进行,反应速 率随时间的变化如图所示
2KMnO +5H C O +3H SO =K SO +2MnSO +10CO 个+8H O
AB 段:反应产生的Mn + 对该反应起催化作用, 化学反应速率逐渐增大
BC 段:随着反应的进行,反应物的浓度逐渐 减小,化学反应速率逐渐减小
0
其他条件一定,反应速率随着温度的升高而增大 其他条件一定,反应速率随着温度的降低而减小
T
0
2、速率—温度图(v-T 图像)
其他条件一定,增大气态反应物的压强(缩小容 器的容积),反应速率随着压强的增大而增大; 其他条件一定,减小气态反应物的压强(增大容 器的容积),反应速率随着压强的减小而减小
3、速率—压强图(v-P 图像)
