化学能与电能高一下学期化学人教版(2019)必修第二册(共25张PPT)
文档属性
| 名称 | 化学能与电能高一下学期化学人教版(2019)必修第二册(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-11 20:34:51 | ||
图片预览






文档简介
(共25张PPT)
人教版必修第二册
第六章
第一节 化学反应与能量变化
第二课时 化学反应与电能
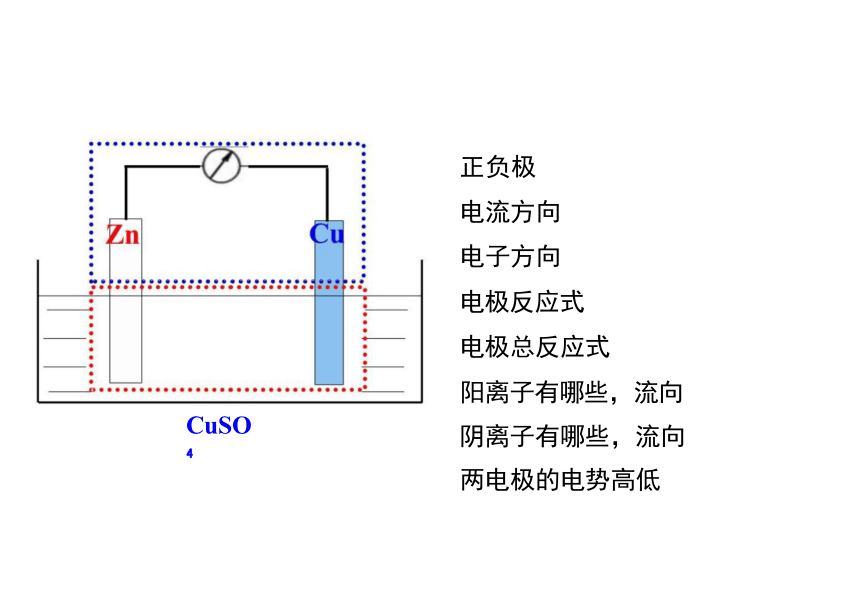
正负极
电流方向
电子方向
电极反应式
电极总反应式
阳离子有哪些,流向 阴离子有哪些,流向 两电极的电势高低
CuSO
①标况下,11.2 L CH CH OH 中含有的分子数目为0.5NA( )
②标况下,22.4 L CO和 CO 混合物中,含碳原子的数目为NA( )
③1 mol Na O 和Na S 的混合物中含有的离子总数为3NA( )
④160 g Cu S和 CuO 的混合物中含有的铜原子数为2NA( )
⑤16 g O 和O 的混合气体中含有的O原子数为
⑥46g NO-和N O4混合气体中,原子的总数目为
⑦100g 质量分数为17%的H O 溶液含有的氧原子数目为NA( )
⑧0.2 mol NO和0 . 1mol O 完全反应后,生成的气体分子数为0.2NA()
⑨12.4g 白磷晶体中含有的P—P键数是0.6 NA( )
⑩11g 超重水(T O) 含中子数为5NA( )
1mol/L Na CO 溶液中含有CO 2-的数目小于NA( )
KCIO +6HCl(浓)=KCl+3Cl T+3H O 中,每生成1mol Cl ,转移电子数 为 2NA( )
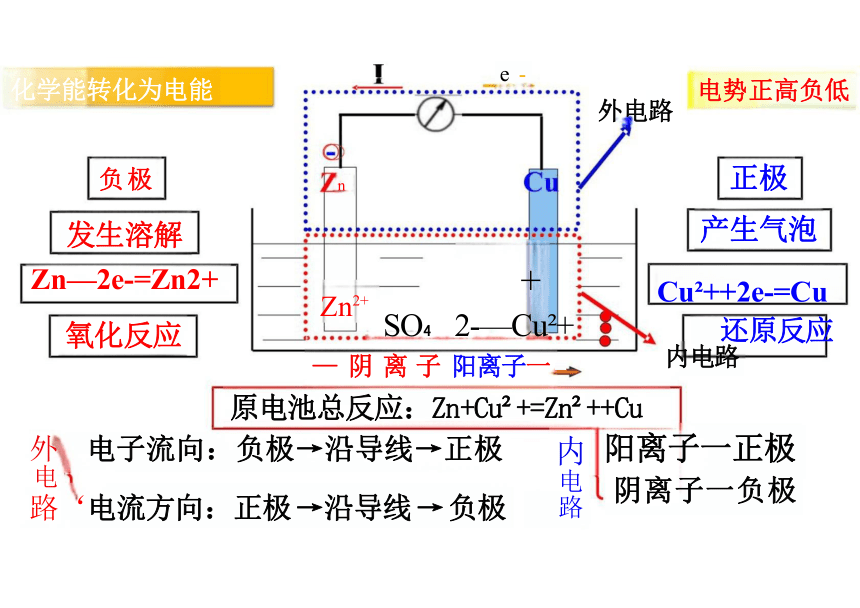
e - 电势正高负低
n 正极
产生气泡
Zn2+ Cu2+ Cu ++2e-=Cu
SO 2-—Cu + 还原反应
— 阴 离 子 阳离子一 内电路
化学能转化为电能
负极
发生溶解
Zn—2e-=Zn2+
氧化反应
外 电子流向:负极→沿导线→正极
电
路‘电流方向:正极 →沿导线 → 负极
阳离子一正极
阴离子一负极
原电池总反应:Zn+Cu +=Zn ++Cu
内电路
外电路
①电极材料:活泼金属为负极,不活泼金属为正极
②电子流向:电子流出的一极是负极,电子流入的一极是正极
③反应类 型 :发生氧化反应的一极是负极;发生还原反应的一极是正极
④离子流向:阴离子移向负极;阳离子移向正极
⑤实验 现 象:逐渐溶解/质量减轻的一极是负极;
有气泡冒出、有金属析出/质量增加的一极是正极
判断:Mg-Al-NaOH 原电池
Fe-Cu-浓HNO 原电池
原电池正负两极的判断方法
学导 p50 活动探究1
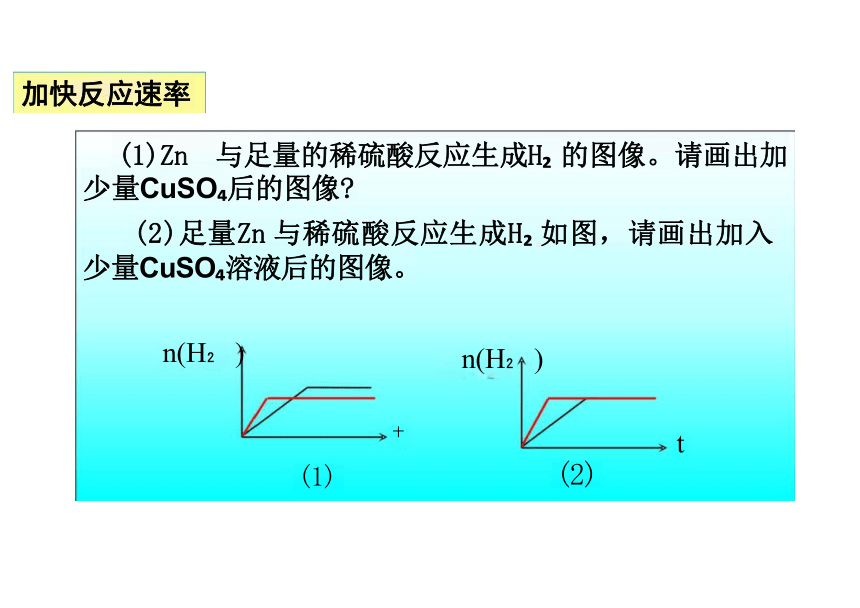
加快反应速率
H SO
H SO
Zn
(1)Zn 与足量的稀硫酸反应生成H 的图像。请画出加 少量CuSO 后的图像
(2)足量Zn 与稀硫酸反应生成H 如图,请画出加入 少量CuSO 溶液后的图像。
n(H ) n(H )
加快反应速率
t
(2)
十
U
(1)
金属的腐蚀速度:
原电池的负极>正常腐蚀>原电池的正极
【 注 】当同为负极时,活动性相差越大,腐蚀越快
如要保护铁闸门,可用导线将其与锌块连接,使锌 做原电池负极,铁闸门做正极,从而使铁闸门受到保护。
用于保护金属
1.先写总反应的离子方程式,画出双线桥 2.拆成半反应,负失氧正得还
① 氧化剂→还原产物,还原剂→氧化产物
② 标电子得失(个数×差价)两极得失电子数相等 负极:M-ne-=Mn+(Fe-2e-=Fe +)
正极:吸引阳离子,反应顺序Ag+>Fe +>Cu +>H+(酸)
( 正极一般不参与电极反应,溶液中的阳离子在正极得电子)
③电荷守恒( 溶 液:H+/OH- ; 熔融 :C O 2-1O -)
④质量守恒(H O)
练 习 :Mg-AI-NaOH 原电池 Fe-Cu-浓HNO 原电池
电极反应式的书写
总反应:2Al+2H O+2NaOH=2NaAlO +3H 个
2AI+2H O+20H=2AlO,+3H N
负极:Al-3e+4OH-=A1O -+2H O
2AI-6e=+80HF=2A1O 4H 0
NaOH 溶液 正极:6 H O+6e=3H 个+60E
两个特殊的原电池
浓硝酸
1.一极的电极反应式绝不能既升又降
2.电极反应式属于离子反应,应按离子方程式进行拆写
3.较难电极反应=总反应-较简单电极反应
4.写两极反应式时得失电子数相等,只写一极时保持最简
电解质溶液为NaCI 溶液或海水时,正极O 发生反应,
电极反应式如下:O +4e=+2H O=40J
注意事项
原电池工作对溶液性质的影响:
· 对电极附近的影响→看电极反应式(H+、OH-)
· 对整个溶液性质影响→看总反应式(H O、H+、OH-
负极(Fe): 2Fe-4e-=2Fe2+
正极( C ):O +2H O+4e-=4OH-
总反应式:2Fe+O +2H O=Fe(OH)
【课堂练习】判断正负极,写出总反应离子方程式和电极反应式
NaCl(aq)
负极(Zn): Zn-2e-=Zn +
正 极(C): 2MnO +2NH ++2e=Mn O +2NH 个+H O
总反应式:Zn+ 2MnO +2NH Cl=ZnCl +Mn O +2NH 个+H O
化学电池
根据原电池原理,人们研制出很多结构和性能各异的化学 电池,满足不同的用电需要
1、锌锰干电池
负极:锌筒
正极:石墨棒 电解质溶液:氯化铵糊
石墨棒 MnO 糊 NH CI糊 锌筒
2、铅酸蓄电池
负极:铅 Pb
正极:二氧化铅PbO
电解质溶液:稀硫酸 二次电池
负极(Pb): Pb+SO --2e-=PbSO
正极(PbO ): PbO +4H++SO -+2er =PbSO +2H O 放电
总反应式:Pb+PbO +4H++2SO 充 电2PbSO +2H O
DDD
田e0
ACaution
-Disposeolthe bateny pO
-Expo ebittery to pnl tould causteploson.
3、其他充电电池:镍氢电池、锂离子电池
锂离子电池:锂电池具有高效、安 全 环保、体积小的优点,多用于手机、 笔记本、照相机和摄像机等电器
负极:通入燃料 正极:通入氧气O
负极:H -2e-=2H+
正极:O +4e-+4H+=2H O
总反应式:2H +O =2H O
4、燃料电池
燃料电池是一种将燃料( 如H 、CH 、 乙 醇 ) 和氧化剂( 如O ) 的 化学能直接转化为电能的电化学反应装置,具有清洁、 安全、高效等特
点。燃料电池的能量转化率可以达到80% 以上。 用电器
—O (空气)
正极
电解质
e
H
e
H →
H O*
→H O
负极一
燃料电池电极反应式的书写方法:
①燃料(H 、CH 、乙醇)作负极,氧化 剂(O 、Cl ) 作正极
②电极为惰性材料(石墨),不参与反应
③总反应一般为燃烧方程式
④酸性环境C→CO , 碱性环境C →CO 2-,含 N→N
酸性条件下
负极:2H -4e-==4H+
正极:O +4H++4e-==2H O
总反应:2H +O =2H O
碱性条件下
负极:2H +4OH--4e-==4H O
正极:O +2H O+4e-==4OH-
总反应:2H +O =2H O
燃料电池---氢氧燃料电池
氢氧燃料电池示意图
H
负 极
正极 电解质
-O (空气)
→H O
H
酸性条件下 负极:CH -8e-+2H O ==CO +8H+
正极:2O +8e-+8H+==4H O
总反应:CH +2O ==CO +2H O
碱性条件下 负极:CH -8e-+10OH-==CO 2-+7H O
正极:2O +8e-+4H O==8OH-
总反应:CH +2O +2OH-==CO 2-+3H O
燃料电池---甲烷燃料电池
化学电源的基本类型
(1)活泼金属作负极,被腐蚀或消耗,发生氧化反应,如锌锰干电池。
(2)两电极都参加反应,如铅蓄电池。
(3)两电极均为惰性电极,电极本身不发生反应,而是由引入到两极 上的物质发生反应,如燃料电池。
归纳总结
负极 正极
电解质溶液
A Cu Zn
CuCl
B Zn Cu
H SO
C Zn C
CuSO
D Zn Al
CuCl
一个原电池的总反应的离子方程式是Zn+Cu +=Zn ++Cu, 该反应的的原电池的正确组成是 ( C )
设计原电池
例.将反应Fe+2Fe +=3Fe +, 设计成原电池装置。画图, 并指出正、负极材料,电解质溶液,写出正负极反应式
Fe 石墨C
Fe (SO ) 或FeCl 溶液
负极:Fe-2e-=Fe +
正极:2Fe ++2e-=2Fe +
设计原电池
Fe Fe Sn Fe Zn Fe &u
海 水
(4)
例 . 下列装置中四块相同的Fe 片,放置 一 段时间后腐蚀速率
由快到慢的顺序是
421 3
海 水
(1)
海 水
(3)
海 水 (2
原电池的相关计算:电子守恒法
等质量的Fe、Cu、硫酸铜组成的原电池,经过一 段时间后,两电极质量差为12g, 则消耗Fe g, 析 出Cu g, 导线上通过 mol 电子。
Pb+Pb0 +2H SO ===2PbSO +2H O
PbO ×
P 正极材料是 PbO ,电解质溶液 H SO4。
(2)工作时,电解质溶液中的H+移向PbO 电(正)极。
(3)工作时,电解质溶液中硫酸的浓度减小 (填“增大”“减小”或“不 变”)。
(4)当铅蓄电池向外电路提供2mole一时,理论上负极板的质量增加96 g。
b
:
列
是
P
b
问
是
下
料
答
)负极材
要求回
(1
按
5.铅酸电池常用作汽车电瓶,其构造如图所示,
工作时该电池总的方程式为:
H SO
溶液
人教版必修第二册
第六章
第一节 化学反应与能量变化
第二课时 化学反应与电能
正负极
电流方向
电子方向
电极反应式
电极总反应式
阳离子有哪些,流向 阴离子有哪些,流向 两电极的电势高低
CuSO
①标况下,11.2 L CH CH OH 中含有的分子数目为0.5NA( )
②标况下,22.4 L CO和 CO 混合物中,含碳原子的数目为NA( )
③1 mol Na O 和Na S 的混合物中含有的离子总数为3NA( )
④160 g Cu S和 CuO 的混合物中含有的铜原子数为2NA( )
⑤16 g O 和O 的混合气体中含有的O原子数为
⑥46g NO-和N O4混合气体中,原子的总数目为
⑦100g 质量分数为17%的H O 溶液含有的氧原子数目为NA( )
⑧0.2 mol NO和0 . 1mol O 完全反应后,生成的气体分子数为0.2NA()
⑨12.4g 白磷晶体中含有的P—P键数是0.6 NA( )
⑩11g 超重水(T O) 含中子数为5NA( )
1mol/L Na CO 溶液中含有CO 2-的数目小于NA( )
KCIO +6HCl(浓)=KCl+3Cl T+3H O 中,每生成1mol Cl ,转移电子数 为 2NA( )
e - 电势正高负低
n 正极
产生气泡
Zn2+ Cu2+ Cu ++2e-=Cu
SO 2-—Cu + 还原反应
— 阴 离 子 阳离子一 内电路
化学能转化为电能
负极
发生溶解
Zn—2e-=Zn2+
氧化反应
外 电子流向:负极→沿导线→正极
电
路‘电流方向:正极 →沿导线 → 负极
阳离子一正极
阴离子一负极
原电池总反应:Zn+Cu +=Zn ++Cu
内电路
外电路
①电极材料:活泼金属为负极,不活泼金属为正极
②电子流向:电子流出的一极是负极,电子流入的一极是正极
③反应类 型 :发生氧化反应的一极是负极;发生还原反应的一极是正极
④离子流向:阴离子移向负极;阳离子移向正极
⑤实验 现 象:逐渐溶解/质量减轻的一极是负极;
有气泡冒出、有金属析出/质量增加的一极是正极
判断:Mg-Al-NaOH 原电池
Fe-Cu-浓HNO 原电池
原电池正负两极的判断方法
学导 p50 活动探究1
加快反应速率
H SO
H SO
Zn
(1)Zn 与足量的稀硫酸反应生成H 的图像。请画出加 少量CuSO 后的图像
(2)足量Zn 与稀硫酸反应生成H 如图,请画出加入 少量CuSO 溶液后的图像。
n(H ) n(H )
加快反应速率
t
(2)
十
U
(1)
金属的腐蚀速度:
原电池的负极>正常腐蚀>原电池的正极
【 注 】当同为负极时,活动性相差越大,腐蚀越快
如要保护铁闸门,可用导线将其与锌块连接,使锌 做原电池负极,铁闸门做正极,从而使铁闸门受到保护。
用于保护金属
1.先写总反应的离子方程式,画出双线桥 2.拆成半反应,负失氧正得还
① 氧化剂→还原产物,还原剂→氧化产物
② 标电子得失(个数×差价)两极得失电子数相等 负极:M-ne-=Mn+(Fe-2e-=Fe +)
正极:吸引阳离子,反应顺序Ag+>Fe +>Cu +>H+(酸)
( 正极一般不参与电极反应,溶液中的阳离子在正极得电子)
③电荷守恒( 溶 液:H+/OH- ; 熔融 :C O 2-1O -)
④质量守恒(H O)
练 习 :Mg-AI-NaOH 原电池 Fe-Cu-浓HNO 原电池
电极反应式的书写
总反应:2Al+2H O+2NaOH=2NaAlO +3H 个
2AI+2H O+20H=2AlO,+3H N
负极:Al-3e+4OH-=A1O -+2H O
2AI-6e=+80HF=2A1O 4H 0
NaOH 溶液 正极:6 H O+6e=3H 个+60E
两个特殊的原电池
浓硝酸
1.一极的电极反应式绝不能既升又降
2.电极反应式属于离子反应,应按离子方程式进行拆写
3.较难电极反应=总反应-较简单电极反应
4.写两极反应式时得失电子数相等,只写一极时保持最简
电解质溶液为NaCI 溶液或海水时,正极O 发生反应,
电极反应式如下:O +4e=+2H O=40J
注意事项
原电池工作对溶液性质的影响:
· 对电极附近的影响→看电极反应式(H+、OH-)
· 对整个溶液性质影响→看总反应式(H O、H+、OH-
负极(Fe): 2Fe-4e-=2Fe2+
正极( C ):O +2H O+4e-=4OH-
总反应式:2Fe+O +2H O=Fe(OH)
【课堂练习】判断正负极,写出总反应离子方程式和电极反应式
NaCl(aq)
负极(Zn): Zn-2e-=Zn +
正 极(C): 2MnO +2NH ++2e=Mn O +2NH 个+H O
总反应式:Zn+ 2MnO +2NH Cl=ZnCl +Mn O +2NH 个+H O
化学电池
根据原电池原理,人们研制出很多结构和性能各异的化学 电池,满足不同的用电需要
1、锌锰干电池
负极:锌筒
正极:石墨棒 电解质溶液:氯化铵糊
石墨棒 MnO 糊 NH CI糊 锌筒
2、铅酸蓄电池
负极:铅 Pb
正极:二氧化铅PbO
电解质溶液:稀硫酸 二次电池
负极(Pb): Pb+SO --2e-=PbSO
正极(PbO ): PbO +4H++SO -+2er =PbSO +2H O 放电
总反应式:Pb+PbO +4H++2SO 充 电2PbSO +2H O
DDD
田e0
ACaution
-Disposeolthe bateny pO
-Expo ebittery to pnl tould causteploson.
3、其他充电电池:镍氢电池、锂离子电池
锂离子电池:锂电池具有高效、安 全 环保、体积小的优点,多用于手机、 笔记本、照相机和摄像机等电器
负极:通入燃料 正极:通入氧气O
负极:H -2e-=2H+
正极:O +4e-+4H+=2H O
总反应式:2H +O =2H O
4、燃料电池
燃料电池是一种将燃料( 如H 、CH 、 乙 醇 ) 和氧化剂( 如O ) 的 化学能直接转化为电能的电化学反应装置,具有清洁、 安全、高效等特
点。燃料电池的能量转化率可以达到80% 以上。 用电器
—O (空气)
正极
电解质
e
H
e
H →
H O*
→H O
负极一
燃料电池电极反应式的书写方法:
①燃料(H 、CH 、乙醇)作负极,氧化 剂(O 、Cl ) 作正极
②电极为惰性材料(石墨),不参与反应
③总反应一般为燃烧方程式
④酸性环境C→CO , 碱性环境C →CO 2-,含 N→N
酸性条件下
负极:2H -4e-==4H+
正极:O +4H++4e-==2H O
总反应:2H +O =2H O
碱性条件下
负极:2H +4OH--4e-==4H O
正极:O +2H O+4e-==4OH-
总反应:2H +O =2H O
燃料电池---氢氧燃料电池
氢氧燃料电池示意图
H
负 极
正极 电解质
-O (空气)
→H O
H
酸性条件下 负极:CH -8e-+2H O ==CO +8H+
正极:2O +8e-+8H+==4H O
总反应:CH +2O ==CO +2H O
碱性条件下 负极:CH -8e-+10OH-==CO 2-+7H O
正极:2O +8e-+4H O==8OH-
总反应:CH +2O +2OH-==CO 2-+3H O
燃料电池---甲烷燃料电池
化学电源的基本类型
(1)活泼金属作负极,被腐蚀或消耗,发生氧化反应,如锌锰干电池。
(2)两电极都参加反应,如铅蓄电池。
(3)两电极均为惰性电极,电极本身不发生反应,而是由引入到两极 上的物质发生反应,如燃料电池。
归纳总结
负极 正极
电解质溶液
A Cu Zn
CuCl
B Zn Cu
H SO
C Zn C
CuSO
D Zn Al
CuCl
一个原电池的总反应的离子方程式是Zn+Cu +=Zn ++Cu, 该反应的的原电池的正确组成是 ( C )
设计原电池
例.将反应Fe+2Fe +=3Fe +, 设计成原电池装置。画图, 并指出正、负极材料,电解质溶液,写出正负极反应式
Fe 石墨C
Fe (SO ) 或FeCl 溶液
负极:Fe-2e-=Fe +
正极:2Fe ++2e-=2Fe +
设计原电池
Fe Fe Sn Fe Zn Fe &u
海 水
(4)
例 . 下列装置中四块相同的Fe 片,放置 一 段时间后腐蚀速率
由快到慢的顺序是
421 3
海 水
(1)
海 水
(3)
海 水 (2
原电池的相关计算:电子守恒法
等质量的Fe、Cu、硫酸铜组成的原电池,经过一 段时间后,两电极质量差为12g, 则消耗Fe g, 析 出Cu g, 导线上通过 mol 电子。
Pb+Pb0 +2H SO ===2PbSO +2H O
PbO ×
P 正极材料是 PbO ,电解质溶液 H SO4。
(2)工作时,电解质溶液中的H+移向PbO 电(正)极。
(3)工作时,电解质溶液中硫酸的浓度减小 (填“增大”“减小”或“不 变”)。
(4)当铅蓄电池向外电路提供2mole一时,理论上负极板的质量增加96 g。
b
:
列
是
P
b
问
是
下
料
答
)负极材
要求回
(1
按
5.铅酸电池常用作汽车电瓶,其构造如图所示,
工作时该电池总的方程式为:
H SO
溶液
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
