3.2溶液的PH及计算 高二上学期化学人教版(2019)选择性必修1(共34张PPT)
文档属性
| 名称 | 3.2溶液的PH及计算 高二上学期化学人教版(2019)选择性必修1(共34张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 951.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-11 20:35:25 | ||
图片预览











文档简介
(共34张PPT)
第三章 水溶液中的离子反应与平衡
第一节 电离平衡
3.2.2溶液的酸碱性与PH
学习目标
1、认识溶液的酸碱性及pH, 掌握检测溶液pH 的方法
2、能进行pH 的简单计算,并能计算各类混合溶液的pH
定性判断:用酸碱指示剂定性测定 定量判断:①粗略测定—pH试纸
②精确测定—PH计
1、如何简单进行判断溶液的酸碱性
思考
2、酸性溶液中是否存在c(OH-), 碱性溶液中是否存在c(H+)
任何溶液中都同时存在c(OH-) 和c(H+)
3、溶液的酸碱性如何确定
思考
c(H+)与c(OH-)相对大小
c(H+)/mol ·L-1的范围(25 ℃)
中性溶液 c(OH-)=c(H+)
c(H+)=1.0×10-7
酸性溶液 c(OH-)c(H+)>1.0×10-7
碱性溶液 c(OH-)>c(H+)
c(H+)<1.0×10-7
(1 )溶液的酸碱性:溶液酸碱性的判断标准是溶液中c(H+)与c(OH-) 的相对大小
一、溶液的酸碱性与pH
(2)溶液的酸碱性与c(H±)和c(OH 三)的关系
1、溶液的酸碱性
任意条件下,溶液酸碱性的判断依据:
若c(H+)=c(OH-),中性
若c(H+)>c(OH-), 酸 性 ,c(H+) 越大,酸性越强
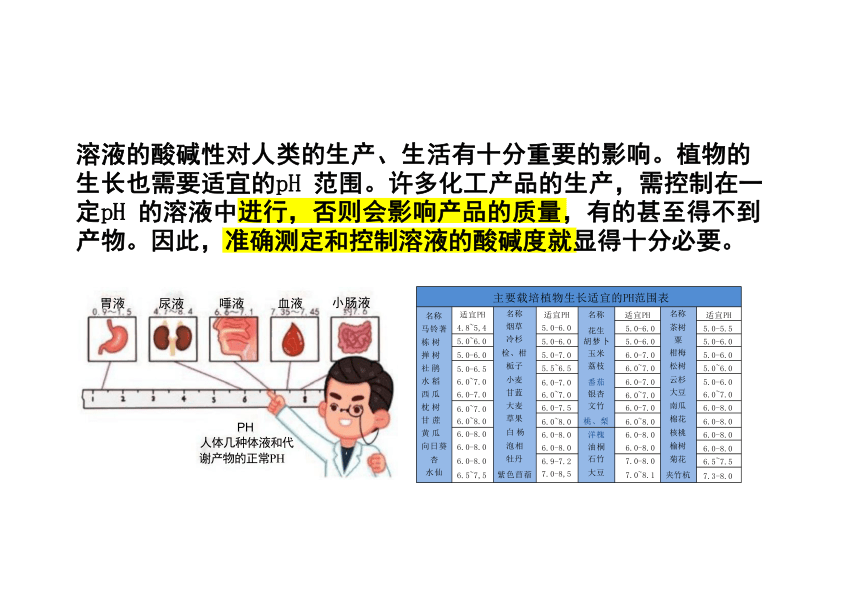
若c(H+)溶液的酸碱性对人类的生产、生活有十分重要的影响。植物的 生长也需要适宜的pH 范围。许多化工产品的生产,需控制在一 定pH 的溶液中进行,否则会影响产品的质量,有的甚至得不到 产物。因此,准确测定和控制溶液的酸碱度就显得十分必要。
主要载培植物生长适宜的PH范围表 名称 马铃著 栋树 掸树 社鹃 水稻 西瓜 枕树 甘蔗 黄瓜 向日葵 杏 水仙 适宜PH 4.8~5,4 名称 烟草 冷杉 检、柑 栀子 小麦 甘蓝 大麦 草果 白 杨 泡相 牡丹 紫色苜蓿 适宜PH 5.0-6.0 名称 花生 胡梦卜 玉米 荔枝 番茄 银杏 文竹 桃、梨 适宜PH 名称 茶树 粟 柑梅 松树 云杉 大豆 南瓜 棉花 核桃 榆树 菊花 夹竹杭
适宜PH
5.0-6.0
5.0-5.5
5.0~6.0 5.0-6.0 5.0-6.0
5.0-6.0
5.0-6.0 5.0-7.0 6.0-7.0
5.0-6.0
5.0-6.5 6.0~7.0 6.0-7.0 5.5~6.5 6.0~7.0
5.0~6.0
6.0-7.0 6.0~7.0 6.0-7.0
5.0-6.0 6.0~7.0
6.0~7.0 6.0~7.0 6.0~8.0 6.0-7.5 6.0-7.0
6.0-8.0
6.0~8.0 6.0~8.0
6.0-8.0
6.0-8.0 6.0-8.0 6.0-8.0 6.5~7,5 6.0-8.0 6.0-8.0 洋槐 油桐 石竹 大豆 6.0-8.0 6.0-8.0
6.0-8.0
6.0-8.0
6.9-7.2 7.0-8,5 7.0-8.0 7.0~8.1
6.5~7.5
7.3-8.0
胃液 尿液 唾液 血液 小肠液
PH
人体几种体液和代
谢产物的正常PH
(3)溶液的pH与c(H±) 及酸碱性的关系
①pH的定义:p H是( H+) 的负对数,其表达式是pH= -Ig c(H二)
②pH 的意义:p H越大,溶液的碱性越强;pH 越小,溶液的酸性越
强
③溶液酸碱性与pH的关系(常温下): pH<7 ,为 酸性溶液;pH = 7 为中性溶液;pH>7, 为 碱性溶液
pH 0 123 45 67 8910 ll 121314
④pH 的适用范围:1×10-14 moloL-1 ≤c(H±)≤1 m o loL=1的溶液
碱性增强
10-10 10-1210-14
酸性增强 10-2 10-4
中性
10-7
(mol-L-1) 0°
【几点强调】
①酸性(碱性)溶液并不一定是酸类(碱类)物质②判断溶液的酸碱性
不能根据c(H+) 和c(OH-) 绝对大小,而应比较二者相对大小 ,
温度影响③溶液的酸碱性也不能只根据pH 来判断,如:p H= 7 的溶
液不一定为中性溶液,100℃时,pH=6 为中性溶液 ④当d(H +) 或
d(OH-) 大于1 mol·L-1 时,通常用c(H+)或c(OH- ) 直接表示⑤当
c(H+) 或c(OH-) 小于或等于1 mol L-1 时,通常用pH 表示
【练一练】
1、下列关于溶液酸碱性的说法正确的是( AC )
A.常温下,pH=7 的溶液呈中性
B.中性溶液中一定有c(H+)=1.0×10-7 mol·L-1
C.c(H+)=c(OH-)的溶液呈中性
D.在100 ℃时,纯水的pH<7, 因此呈酸性
指示剂 变色范围(颜色与pH的关系) 石蕊 <5.0红色 5.0~8.0紫色
>8.0蓝色
酚酞 <8.2无色 8.2~10.0浅红色
>10.0红色
甲基橙 <3.1红色 B.1~4.4橙色
>4.4 黄色
①使用p H 试纸的正确操作:取一小块pH 试纸于干燥洁净的玻 璃片或表面皿上,用干燥洁净的玻璃棒蘸取试液点在试纸上, 当试纸颜色变化稳定后迅速与标准比色卡对照,读出pH
2、溶液酸碱性的测定方法
(1)酸碱指示剂法(只能测定溶液的pH 范围)
(2)利用pH 试纸测定
②pH 试纸分类a .广泛pH 试纸:其pH 范围是1~14 (最常用), 可 以识别的pH差约为1,只能读整数b .精密pH试纸:可判别0.2或
0.3的pH差值c. 专用pH试纸:用于酸性、中性或碱性溶液的专用 pH 试纸
(3)用pH 计测量:pH计也叫酸度计,该仪器可精密测量溶液的
pH。 其量程为0~14 ,可精确测定试液的pH ( 读至小数点后2
【几点强调】
①使用pH 试纸测溶液pH 时不能用蒸馏水润湿,如果检验气体,需 要把试纸润湿
②不能把pH 试纸直接插入待测液中;
③广泛pH 试纸的读数是整数,不能是小数,不估读。
④pH 试纸不能测漂白性的物质 的pH (如:氯水、次氯酸盐、浓硝酸), pH 试纸不能测脱水性的物质的pH( 如:浓硫酸)
1、pH 试纸润湿后测得pH 一定有误差吗
不一定,若原溶液呈中性则无影响
思考
(1)医疗上:血液中的pH 是诊断疾病的一个重要参数,而利用药物 调控血液的pH 是辅助治疗的重要手段之一
(2)生活中:人们使用的护发素的主要功能也是调节头发的pH, 使 之达到适宜的酸碱度
(3)环保领域:酸性和碱性废水的处理常利用中和反应,处理过程 中可利用pH 自动测定仪进行检测和控制
(4)农业生产中:各种农作物生长都对土壤的pH 范围有一定的要求
(5)科学实验和工农业生产中:溶液pH的控制常常是影响实验结果 或产品质量、产量的一个关键因素。如在用于测定酸碱溶液浓度的 酸碱中和反应滴定中,溶液pH 的变化是判断滴定终点的依据
3、pH的应用
【练一练】
2、用 pH 试纸测定溶液pH 的正确操作是(D)
A. 将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准 比色卡对照
B.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测 液点在试纸中央,再与标准比色卡对照
C.将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色 卡对照
D. 将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸中央, 再与标准比色卡对照
先找出溶液中c(H+), 再计算PH
先找出溶液中c(OH-), 再利用Kw 求出c(H+), 最后求PH
二 、pH 的计算(25℃)
1、单一溶液的pH计算
酸性 溶液
碱性 溶液
解题 模板
例:计算25 ℃时1×10-3 mol/L H SO 溶液的pH
例:计算25℃时pH的溶液的物质的量浓度为多少
0.1mol/L
(1)求强酸溶液的pH :
已知c mol·L-1的H,A强酸溶液,则c(H+)=nc mol·L-1;
例:计算25℃时0.1 mol/L Ba(OH) 溶液的pH
例:计算25℃时pH些2的882) 溶液的物质的量浓度为多少
5×10-3mol/L
(2)求强碱溶液的pH :
已知c mol·L-1 B(OH),强碱溶液,则d(OH-)=nc mol·L-1;
解题思路:
利用电离度或者电离平衡常数K计算c(H+), 再 计 算PH
1、已知常温下浓度为0.01 mol/L 的CH COOH 溶液的电离度
为1%,求该溶液的pH 值 2、已知常温下浓度为0.1 m ol/L 的CH COOH 溶液的电离 常数为1.75x10-5, 求该溶液的pH 值
√ 1.75=1.32
PH=3-lg1.32
(3)求一元弱酸溶液的pH
解题思路:
利用电离度或者电离平衡常数K计算c(OH-), 再利用Kw 求 出c(H+), 最后求PH
1、已知常温下浓度为0.01 mol/L 的氨水溶液的电离度为1%,求 该溶液的pH 值 2、已知常温下浓度为0.1 mol/L 的氨水溶液的 电离常数为1.75x10-5, 求该溶液的pH值
(4)求一元弱碱溶液的pH
先找出混合溶液中c(H+), 再计算
PH
先找出混合溶液中c(OH-),再利用 Kw求出c(H+), 最后求PH
①中 性 :PH=7
②酸性:先找出混合溶液中c(H+), 再计算PH
③碱性:先找出混合溶液中c(OH-) 再利用Kw 求出c(H+), 最后求PH
酸溶液
混合
碱溶液 混合
酸碱溶 液混合
先判断混合 溶液酸碱性
2、酸碱溶液混合后pH 的计算
解题 模板
然后再用PH=-lgc(H+) 求pH
速算规律:两种强酸等体积混合,混合后的pH混=pH 示+0.3
(1)强酸与强酸混合(稀溶液体积变化忽略)
两强酸混合:先求混合后的c(H+)混
1、1L 0.2 mol/L HCl与2L 0.2 mol/L HCl混合,求该混合溶液 的pH 值 2 、 将pH=2 的H SO 溶液与pH=4 的H SO 溶液等体积 混合后,求溶液的pH值 PH=lg3-1
PH=2.3
(2)强碱与强碱混合(稀溶液体积变化忽略)
两强碱混合:先求混合后的d(OH-)混
再求c(H+)混
最后再用PH=-lgcd(H+)求pH
速算规律:两种强碱等体积混合,混合后的pH 混三pH 天-0.3
1、1L 0.1 mol/L NaOH与2L 0.2 mol/L Ba(OH) 混合,求该混 合溶液的pH 值2、将pH=11 和pH=13 的NaOH 溶液等体积混合, 求该混合溶液的pH值 PH=13-lg3
PH=12.7
(3)强酸与强碱混合(稀溶液体积变化忽略)
强酸与强碱溶液混合:根 据n(H±)与n(OH 二)的相对大小先判断酸、 碱的过量情况
①恰好完全反应,溶液呈中性,pH=7(25℃)
②若酸过量[ n(H+)>n(OH-)]: 先 求c(H+ )
最后再用PH=-lgd(H+) 求pH
③若碱过量[n(OH-)>n(H+)]: 先求c(OH-)
最后再用PH=-lgc(H+) 求pH
再求c(H+)
1、常温下pH=4 的HCl和pH=10 的NaOH 分别按体积比为1:1, 11:9,9:11混合,分别求三种情况下溶液的pH 值
PH=7,5,9
4、常温下,酸与碱pH 之和为14,等体积混合(1) 若为强酸与强碱,则混合后pH=7 (2)若为强酸与 弱碱,则混合后pH>7 (3)若为弱酸与强碱,则混 合后pH<7
谁弱偏向谁,都强显中性
酸(pH=a) 碱(pH=b) 弱酸 强酸 弱碱
强碱
稀释10n倍 apH>b-n
pH=b-n
无限稀释 pH趋向于7,略小于7 pH趋向于7,略大于7
三、溶液的稀释与pH
1、酸碱溶液稀释时pH 的变化
pH
b
弱碱
7 强碱
稀释过程
(1)pH相等的酸或碱溶液稀释后溶液pH的变化示意图
2、酸碱溶液稀释时pH 的变化图像
稀释过程
ApH
弱酸
强酸
7
(2)c 相 等的酸或碱溶液稀释后溶液pH 的变化示意图
无论是c 相等还是pH 相 等 ,加水稀释相同倍数pH 变化大的都是强酸或强碱
稀释过程 稀释过程
【注意】
第三章 水溶液中的离子反应与平衡
第一节 电离平衡
3.2.2溶液的酸碱性与PH
学习目标
1、认识溶液的酸碱性及pH, 掌握检测溶液pH 的方法
2、能进行pH 的简单计算,并能计算各类混合溶液的pH
定性判断:用酸碱指示剂定性测定 定量判断:①粗略测定—pH试纸
②精确测定—PH计
1、如何简单进行判断溶液的酸碱性
思考
2、酸性溶液中是否存在c(OH-), 碱性溶液中是否存在c(H+)
任何溶液中都同时存在c(OH-) 和c(H+)
3、溶液的酸碱性如何确定
思考
c(H+)与c(OH-)相对大小
c(H+)/mol ·L-1的范围(25 ℃)
中性溶液 c(OH-)=c(H+)
c(H+)=1.0×10-7
酸性溶液 c(OH-)
碱性溶液 c(OH-)>c(H+)
c(H+)<1.0×10-7
(1 )溶液的酸碱性:溶液酸碱性的判断标准是溶液中c(H+)与c(OH-) 的相对大小
一、溶液的酸碱性与pH
(2)溶液的酸碱性与c(H±)和c(OH 三)的关系
1、溶液的酸碱性
任意条件下,溶液酸碱性的判断依据:
若c(H+)=c(OH-),中性
若c(H+)>c(OH-), 酸 性 ,c(H+) 越大,酸性越强
若c(H+)
主要载培植物生长适宜的PH范围表 名称 马铃著 栋树 掸树 社鹃 水稻 西瓜 枕树 甘蔗 黄瓜 向日葵 杏 水仙 适宜PH 4.8~5,4 名称 烟草 冷杉 检、柑 栀子 小麦 甘蓝 大麦 草果 白 杨 泡相 牡丹 紫色苜蓿 适宜PH 5.0-6.0 名称 花生 胡梦卜 玉米 荔枝 番茄 银杏 文竹 桃、梨 适宜PH 名称 茶树 粟 柑梅 松树 云杉 大豆 南瓜 棉花 核桃 榆树 菊花 夹竹杭
适宜PH
5.0-6.0
5.0-5.5
5.0~6.0 5.0-6.0 5.0-6.0
5.0-6.0
5.0-6.0 5.0-7.0 6.0-7.0
5.0-6.0
5.0-6.5 6.0~7.0 6.0-7.0 5.5~6.5 6.0~7.0
5.0~6.0
6.0-7.0 6.0~7.0 6.0-7.0
5.0-6.0 6.0~7.0
6.0~7.0 6.0~7.0 6.0~8.0 6.0-7.5 6.0-7.0
6.0-8.0
6.0~8.0 6.0~8.0
6.0-8.0
6.0-8.0 6.0-8.0 6.0-8.0 6.5~7,5 6.0-8.0 6.0-8.0 洋槐 油桐 石竹 大豆 6.0-8.0 6.0-8.0
6.0-8.0
6.0-8.0
6.9-7.2 7.0-8,5 7.0-8.0 7.0~8.1
6.5~7.5
7.3-8.0
胃液 尿液 唾液 血液 小肠液
PH
人体几种体液和代
谢产物的正常PH
(3)溶液的pH与c(H±) 及酸碱性的关系
①pH的定义:p H是( H+) 的负对数,其表达式是pH= -Ig c(H二)
②pH 的意义:p H越大,溶液的碱性越强;pH 越小,溶液的酸性越
强
③溶液酸碱性与pH的关系(常温下): pH<7 ,为 酸性溶液;pH = 7 为中性溶液;pH>7, 为 碱性溶液
pH 0 123 45 67 8910 ll 121314
④pH 的适用范围:1×10-14 moloL-1 ≤c(H±)≤1 m o loL=1的溶液
碱性增强
10-10 10-1210-14
酸性增强 10-2 10-4
中性
10-7
(mol-L-1) 0°
【几点强调】
①酸性(碱性)溶液并不一定是酸类(碱类)物质②判断溶液的酸碱性
不能根据c(H+) 和c(OH-) 绝对大小,而应比较二者相对大小 ,
温度影响③溶液的酸碱性也不能只根据pH 来判断,如:p H= 7 的溶
液不一定为中性溶液,100℃时,pH=6 为中性溶液 ④当d(H +) 或
d(OH-) 大于1 mol·L-1 时,通常用c(H+)或c(OH- ) 直接表示⑤当
c(H+) 或c(OH-) 小于或等于1 mol L-1 时,通常用pH 表示
【练一练】
1、下列关于溶液酸碱性的说法正确的是( AC )
A.常温下,pH=7 的溶液呈中性
B.中性溶液中一定有c(H+)=1.0×10-7 mol·L-1
C.c(H+)=c(OH-)的溶液呈中性
D.在100 ℃时,纯水的pH<7, 因此呈酸性
指示剂 变色范围(颜色与pH的关系) 石蕊 <5.0红色 5.0~8.0紫色
>8.0蓝色
酚酞 <8.2无色 8.2~10.0浅红色
>10.0红色
甲基橙 <3.1红色 B.1~4.4橙色
>4.4 黄色
①使用p H 试纸的正确操作:取一小块pH 试纸于干燥洁净的玻 璃片或表面皿上,用干燥洁净的玻璃棒蘸取试液点在试纸上, 当试纸颜色变化稳定后迅速与标准比色卡对照,读出pH
2、溶液酸碱性的测定方法
(1)酸碱指示剂法(只能测定溶液的pH 范围)
(2)利用pH 试纸测定
②pH 试纸分类a .广泛pH 试纸:其pH 范围是1~14 (最常用), 可 以识别的pH差约为1,只能读整数b .精密pH试纸:可判别0.2或
0.3的pH差值c. 专用pH试纸:用于酸性、中性或碱性溶液的专用 pH 试纸
(3)用pH 计测量:pH计也叫酸度计,该仪器可精密测量溶液的
pH。 其量程为0~14 ,可精确测定试液的pH ( 读至小数点后2
【几点强调】
①使用pH 试纸测溶液pH 时不能用蒸馏水润湿,如果检验气体,需 要把试纸润湿
②不能把pH 试纸直接插入待测液中;
③广泛pH 试纸的读数是整数,不能是小数,不估读。
④pH 试纸不能测漂白性的物质 的pH (如:氯水、次氯酸盐、浓硝酸), pH 试纸不能测脱水性的物质的pH( 如:浓硫酸)
1、pH 试纸润湿后测得pH 一定有误差吗
不一定,若原溶液呈中性则无影响
思考
(1)医疗上:血液中的pH 是诊断疾病的一个重要参数,而利用药物 调控血液的pH 是辅助治疗的重要手段之一
(2)生活中:人们使用的护发素的主要功能也是调节头发的pH, 使 之达到适宜的酸碱度
(3)环保领域:酸性和碱性废水的处理常利用中和反应,处理过程 中可利用pH 自动测定仪进行检测和控制
(4)农业生产中:各种农作物生长都对土壤的pH 范围有一定的要求
(5)科学实验和工农业生产中:溶液pH的控制常常是影响实验结果 或产品质量、产量的一个关键因素。如在用于测定酸碱溶液浓度的 酸碱中和反应滴定中,溶液pH 的变化是判断滴定终点的依据
3、pH的应用
【练一练】
2、用 pH 试纸测定溶液pH 的正确操作是(D)
A. 将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准 比色卡对照
B.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测 液点在试纸中央,再与标准比色卡对照
C.将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色 卡对照
D. 将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸中央, 再与标准比色卡对照
先找出溶液中c(H+), 再计算PH
先找出溶液中c(OH-), 再利用Kw 求出c(H+), 最后求PH
二 、pH 的计算(25℃)
1、单一溶液的pH计算
酸性 溶液
碱性 溶液
解题 模板
例:计算25 ℃时1×10-3 mol/L H SO 溶液的pH
例:计算25℃时pH的溶液的物质的量浓度为多少
0.1mol/L
(1)求强酸溶液的pH :
已知c mol·L-1的H,A强酸溶液,则c(H+)=nc mol·L-1;
例:计算25℃时0.1 mol/L Ba(OH) 溶液的pH
例:计算25℃时pH些2的882) 溶液的物质的量浓度为多少
5×10-3mol/L
(2)求强碱溶液的pH :
已知c mol·L-1 B(OH),强碱溶液,则d(OH-)=nc mol·L-1;
解题思路:
利用电离度或者电离平衡常数K计算c(H+), 再 计 算PH
1、已知常温下浓度为0.01 mol/L 的CH COOH 溶液的电离度
为1%,求该溶液的pH 值 2、已知常温下浓度为0.1 m ol/L 的CH COOH 溶液的电离 常数为1.75x10-5, 求该溶液的pH 值
√ 1.75=1.32
PH=3-lg1.32
(3)求一元弱酸溶液的pH
解题思路:
利用电离度或者电离平衡常数K计算c(OH-), 再利用Kw 求 出c(H+), 最后求PH
1、已知常温下浓度为0.01 mol/L 的氨水溶液的电离度为1%,求 该溶液的pH 值 2、已知常温下浓度为0.1 mol/L 的氨水溶液的 电离常数为1.75x10-5, 求该溶液的pH值
(4)求一元弱碱溶液的pH
先找出混合溶液中c(H+), 再计算
PH
先找出混合溶液中c(OH-),再利用 Kw求出c(H+), 最后求PH
①中 性 :PH=7
②酸性:先找出混合溶液中c(H+), 再计算PH
③碱性:先找出混合溶液中c(OH-) 再利用Kw 求出c(H+), 最后求PH
酸溶液
混合
碱溶液 混合
酸碱溶 液混合
先判断混合 溶液酸碱性
2、酸碱溶液混合后pH 的计算
解题 模板
然后再用PH=-lgc(H+) 求pH
速算规律:两种强酸等体积混合,混合后的pH混=pH 示+0.3
(1)强酸与强酸混合(稀溶液体积变化忽略)
两强酸混合:先求混合后的c(H+)混
1、1L 0.2 mol/L HCl与2L 0.2 mol/L HCl混合,求该混合溶液 的pH 值 2 、 将pH=2 的H SO 溶液与pH=4 的H SO 溶液等体积 混合后,求溶液的pH值 PH=lg3-1
PH=2.3
(2)强碱与强碱混合(稀溶液体积变化忽略)
两强碱混合:先求混合后的d(OH-)混
再求c(H+)混
最后再用PH=-lgcd(H+)求pH
速算规律:两种强碱等体积混合,混合后的pH 混三pH 天-0.3
1、1L 0.1 mol/L NaOH与2L 0.2 mol/L Ba(OH) 混合,求该混 合溶液的pH 值2、将pH=11 和pH=13 的NaOH 溶液等体积混合, 求该混合溶液的pH值 PH=13-lg3
PH=12.7
(3)强酸与强碱混合(稀溶液体积变化忽略)
强酸与强碱溶液混合:根 据n(H±)与n(OH 二)的相对大小先判断酸、 碱的过量情况
①恰好完全反应,溶液呈中性,pH=7(25℃)
②若酸过量[ n(H+)>n(OH-)]: 先 求c(H+ )
最后再用PH=-lgd(H+) 求pH
③若碱过量[n(OH-)>n(H+)]: 先求c(OH-)
最后再用PH=-lgc(H+) 求pH
再求c(H+)
1、常温下pH=4 的HCl和pH=10 的NaOH 分别按体积比为1:1, 11:9,9:11混合,分别求三种情况下溶液的pH 值
PH=7,5,9
4、常温下,酸与碱pH 之和为14,等体积混合(1) 若为强酸与强碱,则混合后pH=7 (2)若为强酸与 弱碱,则混合后pH>7 (3)若为弱酸与强碱,则混 合后pH<7
谁弱偏向谁,都强显中性
酸(pH=a) 碱(pH=b) 弱酸 强酸 弱碱
强碱
稀释10n倍 a
pH=b-n
无限稀释 pH趋向于7,略小于7 pH趋向于7,略大于7
三、溶液的稀释与pH
1、酸碱溶液稀释时pH 的变化
pH
b
弱碱
7 强碱
稀释过程
(1)pH相等的酸或碱溶液稀释后溶液pH的变化示意图
2、酸碱溶液稀释时pH 的变化图像
稀释过程
ApH
弱酸
强酸
7
(2)c 相 等的酸或碱溶液稀释后溶液pH 的变化示意图
无论是c 相等还是pH 相 等 ,加水稀释相同倍数pH 变化大的都是强酸或强碱
稀释过程 稀释过程
【注意】
