化学能与电能 高一下学期化学人教版(2019)必修第二册(共46张PPT)
文档属性
| 名称 | 化学能与电能 高一下学期化学人教版(2019)必修第二册(共46张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-11 20:36:21 | ||
图片预览











文档简介
(共46张PPT)
人教版必修第二册
第六章
第一节 化学反应与能量变化
第二课时 化学反应与电能
默写答案
1. 陶瓷原料:黏土(含水的铝硅酸盐);水泥原料:石灰石、黏土、石膏
(调节水泥的硬化速率);玻璃原料:石灰石、纯碱、石英砂
2.Cl +2Fe +=2Fe ++2Cl- Cl +2I-=I +2Cl-
3. 强酸制弱酸:
②Ca(ClO) +CO +H O=2HClO+CaCO ↓
③CO +Ca(OH) =CaCO ↓+H O
④Na SiO +H O+CO ==Na CO +H SiO ↓
⑤Na CO +CO +H O==2NaHCO ↓
⑥CO +2AIO -+3H O=2Al(OH) ↓+CO 2-
铜片过量,稀硝酸少量,设有8 mol 稀硝酸
则在与铜反应时消耗8 mol H+和2 mol NO -,生成2 mol
NO
剩余6 mol NO -
此时加入稀硫酸,为剩余的6 mol NO -提供H+, 生成6 mol
NO
默写答案
4.3Cu+8H++2NO -=3Cu ++2NO 个+4H O
一 、原电池
1.定义:将化学能直接转变成电能的装置,称为原电池
如何选择化学反应
1. 常温下可以自发进行
2.有电子转移的反应 氧化还原反应
如何设计装置
将氧化反应和还原反应分别在不同的区域进行, 从而使电子转移产生的电流可以被利用。
[实验现象]:
铜片上有气泡产生,锌片不断溶解,电流
表的指针发生偏转。
[实验结论]: 导线中有电流通过
一、原电池原理
【实验6-3】
阴离子流向 阳离子流向
电势高低
e-—
e-
-阳离子
一阴离子
电流方向
正、负极 电子流向
电极反应式 总反应式
4.工作原理:
原电池能够运行,本质上是因为两个活泼性不同的电极之间存在电势差。
电极电势越低,还原剂的还原性越强,活泼性越强,越易失电子 电极电势越高,氧化剂的氧化性越强,活泼性越弱,越易得电子。
电子流向 电势低 → 电势高
电流流向 电势高→ 电势低
Zn-Cu-H SO 原电池,正负极电势高低
Cu( + ) 电势高
Zn(-)电势低
本质:氧化还原反应
十
2.电极:正 极 : 电子流进(或电流流出)的一极 负极: 电子流出(或电流流进)的一极
电源
原电池
1.定义:将化学能直接转变成电能的装置,称为原电池
从能量转变看:原电池是将 化学能转变为电 能的装置。
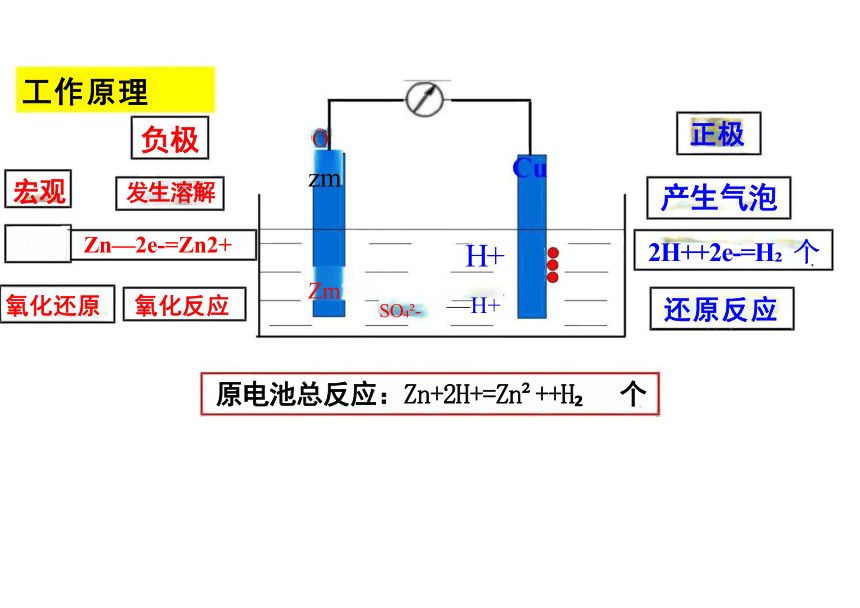
工作原理
负极
宏观 发生溶解
Zn—2e-=Zn2+
氧化还原 氧化反应
正极
产生气泡
2H++2e-=H 个
还原反应
O
zm
Zm2+
SO -
原电池总反应:Zn+2H+=Zn ++H 个
H+
—H+
工作原理
负极
宏观 发生溶解
Zn—2e-=Zn2+
氧化还原 氧化反应
正极
产生气泡
2H++2e-=H 个
还原反应
O
zm
Zm2+
SO -
原电池总反应:Zn+2H+=Zn ++H 个
H+
—H+
化学能转化为电能
负极
发生溶解
Zn—2e-=Zn2+
氧化反应
n
H+ Zn SO 2- —H+
—阴离子 阳离子—
2+
外 电子流向:负极 →沿导线 →正极
电
路‘电流方向:正极→沿导线→负极
正极
产生气泡
2H++2e-=H 个
还原反应
内电路
阳离子一 正极
阴离子一负极
原 电 池 总 反 应 :Zn+2H+=Zn ++H 个
电势正高负低
内电路
外电路
e -
【练习1】 Zn Cu
(1) 是负极, 是正极;
(2)外电路中电流由 流向 ; 电子由 流向
(3)Zn 片附近c(SO 2 一)变化 ;
( 4 ) 现 象 :Zn ,Cu CuSO 溶 液
判断:下列原电池谁做负极
①Al- Fe-CuSO 溶 液 ②Mg-Al-H S O 溶液 ③Fe-Cu- 稀H SO
Al为负极 Mg 为负极 Fe为负极
负极(Fe):Fe-2e-=Fe +.
正极(Ag):2H++2e-=H 个.
总反应式:Fe+2H+=Fe ++H T.
【课堂练习】
请在图上标出电子的流动方向和电流方向,并判断正负极,写出电 极反应式和总反应式。
H SO (aq)
一、原电池
1.定义:将化学能直接转变成电能的装置,称为原电池 2.正负极:
正极: 电子流进(或电流流出)的一极
负极: 电子流出(或电流流进)的一极
3.电极反应:
电极材料 原电池正负极 电极反应式
发生的反应
Zn片 负极 Zn-2e-=Zn +
氧化反应
Cu片 正极 2H++2e-=H 个
还原反应
电极总离子反应 Zn+2H+=Zn ++H 个(两个电极反应之和)
电源
4.工作原理:
铜
电极名称:负极
电极反应类型:还原反应
氧化反应
电极反应式:
2H++2e-=H 个
一、原电池
负极 正极 失去电子的一极 得到电子的一极 氧化反应 还原反应
活泼性强
活泼性弱
原电池总反应式:Zn+2H+==Zn ++H 1 ;
电极反应式:
Zn-2e-=Zn2+
电极名称:正 极
H+
SO2 -SO2- LI+
电极反应类型:
锌
H
A-
e-
Z
负极 正极
正极 I 负极 阳 离 子 → 正 极 阴离子 → 负极
4.工作原理:
外电路:
内电路:
这样整个电路构成了闭合回路,带电粒子的定向移动产生电流
图6-7 原电池原理示意图
一 、原电池
1. 电流方向
2. 正、负极
3.电子流向
4.电极反应式
5. 总反应式
6. 阴、阳离子流向
7.电势高低
理论上,自发的 氧化还原 反应均可构成原电池。
具体条件是:
①具有 活动性不同 的两个电极(金属与金属或金属与能导电的非金属);
②溶液:两电极均插入 电解质 溶液中(熔融电解质);
③导线:两极用导线相连,形成闭合回路。
一、原电池
5.构成条件
序号
① ② ③
能否构成 原电池
能 能 不能
构成原电 池的条件
2个电极:活动性不同的2种金属或金属+非金属
判断下列装置能否构成原电池
H SO H SO
H SO
序号
④ ⑤ ⑥
实验 装置
酒精
能否构成 原电池
能 能 不能
构成原电 池的条件
电极必须插在电解质溶液中
判断下列装置能否构成原电池
序号 ⑦ ⑧ ⑨ 实验 装置 Zn 盐桥 H SO H SO
Zn
H SO
能否构成 原电池 不能 能 能 构成原电 池的条件 两极相连形成闭合回路
判断下列装置能否构成原电池
Cu
2.下列装置能形成原电池的是
B.①②⑤⑥
D.①②③⑥⑦
稀硫酸 稀硫酸
④
CuSO 溶液
②
稀硫酸
①
稀硫酸
③
稀盐酸 ⑦
稀硫酸 ⑤
酒精 ⑥
1234
①电极材料:活泼金属为负极,不活泼金属为正极
②电子流向:电子流出的一极是负极,电子流入的一极是正极
③反应类 型 :发生氧化反应的一极是负极;发生还原反应的一极是正极
④离子流向:阴离子移向负极;阳离子移向正极
⑤实验 现 象:逐渐溶解/质量减轻的一极是负极;
有气泡冒出、有金属析出/质量增加的一极是正极
原电池正负两极的判断方法
指出下列原电池装置中的正负极材料,并写出正、负极电极
反应式以及总反应的离子方程式。
①Cu、C、AgNO 原电池 ②Mg、Al、稀盐酸原电池
③Fe、Cu、FeCl 原电池 ④Fe、C、海水原电池
(1)Zn 与足量的稀硫酸反应生成H 的图像。请画出加 少量CuSO 后的图像
(2)足量Zn 与稀硫酸反应生成H 如图,请画出加入
少量CuSO 溶液后的图像。
n(H )
t
(2)
n(H )
(1)
加快反应速率
t
负极 正极
电解质溶液
A Cu Zn
CuCl
B Zn Cu
H SO
C Zn C
CuSO
D Zn Al
CuCl
一个原电池的总反应的离子方程式是Zn+Cu +=Zn ++Cu, 该反应的的原电池的正确组成是 ( C )
设计原电池
例.将反应Fe+2Fe +=3Fe +, 设计成原电池装置。画图, 并指出正、负极材料,电解质溶液,写出正负极反应式
Fe 石墨C
Fe (SO ) 或FeCl 溶液
负极:Fe-2e-=Fe +
正极:2Fe ++2e-=2Fe +
设计原电池
金属的腐蚀速度:
原电池的负极>正常腐蚀>原电池的正极
【注 】当同为负极时,活动性相差越大,腐蚀越快
如要保护铁闸门,可用导线将其与锌块连接,使锌做 原电池负极,铁闸门做正极,从而使铁闸门受到保护。
用于保护金属
Fe Fe Sn Fe Zn Fe &u
海 水
(1)
例 . 下列装置中四块相同的Fe 片,放置 一 段时间后腐蚀速率
由快到慢的顺序是
421 3
海 水
(3)
海 水
(4)
海 水 (2
总 反 应 :2 Al+2H O+2NaOH=2NaAlO +3H 个
2Al+2H O+2OH-=2A1O -+3H 个 负极:Al-3e-+4OH-=A1O -+2H O
2Al-6e-+8OH-=2AlO -+4H O
正 极 :6 H O+6e-=3H 个+6OH-
NaOH溶液
浓硝酸
两个特殊的原电池
根据原电池原理,人们研制出很多结构和性能各异 的化学电池,满足不同的用电需要
1、锌锰干电池
负极:锌筒
正极:石墨棒 电解质溶液:氯化铵糊
负极(Zn):Zn-2e-=Zn +
正极(C):2MnO +2NH ++2e-=Mn O +2NH 个+H O
总反应式:Zn+2MnO +2NH Cl=ZnCl +Mn O +2NH 个+H O
化学电池
2、铅酸蓄电池
负极:铅 Pb
正极:二氧化铅PbO
电解质溶液:稀硫酸
负极(Pb): Pb+SO 2--2er=PbSO
正极(PbO ): PbO +4H++SO 2-+2er =PbSO +2H O
放电
总反应式:Pb+PbO +4H++2SO 放电2PbSO +2H O
3、锂离子电池
锂电池具有高效、安全环 保、体积小的优点,多用 于手机、笔记本、照相机 和摄像机等电器
4、燃料电池
燃料电池是一种将燃料( 如H 、
CH 、乙醇)和氧化剂( 如O ) 的化学 能直接转化为电能的电化学反应装置, 具有清洁、安全、高效等特点。燃料电 池的能量转化率可以达到80% 以上。
用电器
e
- O (空气)
H
正极
电解质
→H O
正极:通入氧气O
负极:通入燃 料
总反应式:2H +O =2H O
正极:O +4e=+4H+=2H O
负极:H -2e-=2H+
H O<
负极-
H
e
燃料电池:
①燃料(H 、CH 、乙醇)作负极,氧化剂(O 、Cl ) 作正极
②电极为惰性材料(石墨),不参与反应
③总反应一般为燃烧方程式
④含C酸性环境中→CO , 碱性环境中→CO 2-, 含N→N
化学电源的基本类型
(1)活泼金属作负极,被腐蚀或消耗,发生氧化反应,如锌锰干电池。
(2)两电极都参加反应,如铅蓄电池。
(3)两电极均为惰性电极,电极本身不发生反应,而是由引入到两极上 的物质发生反应,如燃料电池。
归纳总结
1、Mg、AI、NaOH溶液构成原电池, 是负极,电子 由 流向 ,Mg 周围c(Na+) ,总方程式 正、 负极电极反应式
2、H 、O 、H SO 溶液构成燃料电池,写出正、负极电极 方程式(标出正负)
3、CH 、O 、KOH 溶液构成燃料电池,写出正、负极电极 方程式(标出正负)
4、铜 片、锌片和300mL 稀硫酸组成的原电池中,当铜片上 放出3.36L气体(标准状况)时,硫酸恰好用完,产生这些 气体消耗锌的物质的量 有 个电子通过导线,原 硫酸的物质的量浓度为
原电池的相关计算:电子守恒法
等质量的Fe、Cu、硫酸铜组成的原电池,经过一 段时间后,两电极质量差为12g, 则消耗Fe g, 析 出Cu g, 导线上通过 mol 电子。
酸性条件下
负极:2H -4e-==4H+
正极:O +4H++4e-==2H O
总反应:2H +O =2H O
碱性条件下
负极:2H +4OH--4e-==4H O
正极:O +2H O+4e-==4OH-
总反应:2H +O =2H O
燃料电池---氢氧燃料电池
氢氧燃料电池示意图
H
负 极
正极 电解质
-O (空气)
→H O
H
酸性条件下 负极:CH -8e-+2H O ==CO +8H+
正极:2O +8e-+8H+==4H O
总反应:CH +2O ==CO +2H O
碱性条件下 负极:CH -8e-+10OH-==CO 2-+7H O
正极:2O +8e-+4H O==8OH-
总反应:CH +2O +2OH-==CO 2-+3H O
燃料电池---甲烷燃料电池
Pb+Pb0 +2H SO ===2PbSO +2H O
PbO ×
按要求回答下列问题: Pb
(1)负极材料是 Pb, 正极材料是 PbO ,电解质溶液是 H SO4。
(2)工作时,电解质溶液中的H+ 移向PbO 电(正)极。
(3)工作时,电解质溶液中硫酸的浓度减小 (填“增大” “减小”或“不 变”)。
(4)当铅蓄电池向外电路提供2mole一时,理论上负极板的质量增加96 g。
5.铅酸电池常用作汽车电瓶,其构造如图所示,
工作时该电池总的方程式为:
H SO
溶液
A B C
D
锂离子电池 太阳能集热器 燃气灶
硅太阳能电池
【课堂练习】
1.下列设备工作时,将化学能转化为电能的是
(A)
A.电子由铜通过导线流向锌
电流表
B.该装置是将电能转化为化学能的装置 C.锌电极发生氧化反应 D.电流由锌通过导线流向铜
【课堂练习】
2.如图为某兴趣小组制作的番茄电池,下列说法正确的是(C)
①原电池是把化学能转化成电能的一种装置
②原电池的正极发生氧化反应,负极发生还原反应
③能自发进行的氧化还原反应可设计成原电池
④碳棒不能用来作原电池的正极
⑤反应Cu+2Ag+= =Cu ++2Ag 可以自发进行
A.①③⑤ B.①④⑤ C.②③④ D.②⑤
4.下列叙述正确的是
【课堂练习】
【课堂练习】
5.如图所示的装置,M 为活动性顺序位于氢之前的金属,N为石墨棒,关于此装置的
下列叙述中,不正确的是(D)
A.N上有气体放出
B.M 为负极,N 为正极
C.稀硫酸中SO2-移向M 极
D.导线中有电流通过,电流方向是由M 到N
稀硫酸
6.下列几种化学电池中,不属于可充电电池的是
A.碱性锌锰电池 B. 手机用锂电池
C.汽车用铅蓄电池 D.玩具用镍氢电池
7.LED 产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED 发光的一种装置示
意图。下列有关叙述正确的是
A.a处通入氧气,b 处通入氢气
B.通入H 的电极发生反应:H -2e-=—2H+
C.通入O 的电极为电池的正极
D.该装置将化学能最终转化为电能
导线
e N- 型半导体
Pt
田 P- 型半导体
导线
【课堂练习】
氢氧燃料电池 LED发光二极管
KOH 溶 液
b—
田
田
e-
a—
e-
人教版必修第二册
第六章
第一节 化学反应与能量变化
第二课时 化学反应与电能
默写答案
1. 陶瓷原料:黏土(含水的铝硅酸盐);水泥原料:石灰石、黏土、石膏
(调节水泥的硬化速率);玻璃原料:石灰石、纯碱、石英砂
2.Cl +2Fe +=2Fe ++2Cl- Cl +2I-=I +2Cl-
3. 强酸制弱酸:
②Ca(ClO) +CO +H O=2HClO+CaCO ↓
③CO +Ca(OH) =CaCO ↓+H O
④Na SiO +H O+CO ==Na CO +H SiO ↓
⑤Na CO +CO +H O==2NaHCO ↓
⑥CO +2AIO -+3H O=2Al(OH) ↓+CO 2-
铜片过量,稀硝酸少量,设有8 mol 稀硝酸
则在与铜反应时消耗8 mol H+和2 mol NO -,生成2 mol
NO
剩余6 mol NO -
此时加入稀硫酸,为剩余的6 mol NO -提供H+, 生成6 mol
NO
默写答案
4.3Cu+8H++2NO -=3Cu ++2NO 个+4H O
一 、原电池
1.定义:将化学能直接转变成电能的装置,称为原电池
如何选择化学反应
1. 常温下可以自发进行
2.有电子转移的反应 氧化还原反应
如何设计装置
将氧化反应和还原反应分别在不同的区域进行, 从而使电子转移产生的电流可以被利用。
[实验现象]:
铜片上有气泡产生,锌片不断溶解,电流
表的指针发生偏转。
[实验结论]: 导线中有电流通过
一、原电池原理
【实验6-3】
阴离子流向 阳离子流向
电势高低
e-—
e-
-阳离子
一阴离子
电流方向
正、负极 电子流向
电极反应式 总反应式
4.工作原理:
原电池能够运行,本质上是因为两个活泼性不同的电极之间存在电势差。
电极电势越低,还原剂的还原性越强,活泼性越强,越易失电子 电极电势越高,氧化剂的氧化性越强,活泼性越弱,越易得电子。
电子流向 电势低 → 电势高
电流流向 电势高→ 电势低
Zn-Cu-H SO 原电池,正负极电势高低
Cu( + ) 电势高
Zn(-)电势低
本质:氧化还原反应
十
2.电极:正 极 : 电子流进(或电流流出)的一极 负极: 电子流出(或电流流进)的一极
电源
原电池
1.定义:将化学能直接转变成电能的装置,称为原电池
从能量转变看:原电池是将 化学能转变为电 能的装置。
工作原理
负极
宏观 发生溶解
Zn—2e-=Zn2+
氧化还原 氧化反应
正极
产生气泡
2H++2e-=H 个
还原反应
O
zm
Zm2+
SO -
原电池总反应:Zn+2H+=Zn ++H 个
H+
—H+
工作原理
负极
宏观 发生溶解
Zn—2e-=Zn2+
氧化还原 氧化反应
正极
产生气泡
2H++2e-=H 个
还原反应
O
zm
Zm2+
SO -
原电池总反应:Zn+2H+=Zn ++H 个
H+
—H+
化学能转化为电能
负极
发生溶解
Zn—2e-=Zn2+
氧化反应
n
H+ Zn SO 2- —H+
—阴离子 阳离子—
2+
外 电子流向:负极 →沿导线 →正极
电
路‘电流方向:正极→沿导线→负极
正极
产生气泡
2H++2e-=H 个
还原反应
内电路
阳离子一 正极
阴离子一负极
原 电 池 总 反 应 :Zn+2H+=Zn ++H 个
电势正高负低
内电路
外电路
e -
【练习1】 Zn Cu
(1) 是负极, 是正极;
(2)外电路中电流由 流向 ; 电子由 流向
(3)Zn 片附近c(SO 2 一)变化 ;
( 4 ) 现 象 :Zn ,Cu CuSO 溶 液
判断:下列原电池谁做负极
①Al- Fe-CuSO 溶 液 ②Mg-Al-H S O 溶液 ③Fe-Cu- 稀H SO
Al为负极 Mg 为负极 Fe为负极
负极(Fe):Fe-2e-=Fe +.
正极(Ag):2H++2e-=H 个.
总反应式:Fe+2H+=Fe ++H T.
【课堂练习】
请在图上标出电子的流动方向和电流方向,并判断正负极,写出电 极反应式和总反应式。
H SO (aq)
一、原电池
1.定义:将化学能直接转变成电能的装置,称为原电池 2.正负极:
正极: 电子流进(或电流流出)的一极
负极: 电子流出(或电流流进)的一极
3.电极反应:
电极材料 原电池正负极 电极反应式
发生的反应
Zn片 负极 Zn-2e-=Zn +
氧化反应
Cu片 正极 2H++2e-=H 个
还原反应
电极总离子反应 Zn+2H+=Zn ++H 个(两个电极反应之和)
电源
4.工作原理:
铜
电极名称:负极
电极反应类型:还原反应
氧化反应
电极反应式:
2H++2e-=H 个
一、原电池
负极 正极 失去电子的一极 得到电子的一极 氧化反应 还原反应
活泼性强
活泼性弱
原电池总反应式:Zn+2H+==Zn ++H 1 ;
电极反应式:
Zn-2e-=Zn2+
电极名称:正 极
H+
SO2 -SO2- LI+
电极反应类型:
锌
H
A-
e-
Z
负极 正极
正极 I 负极 阳 离 子 → 正 极 阴离子 → 负极
4.工作原理:
外电路:
内电路:
这样整个电路构成了闭合回路,带电粒子的定向移动产生电流
图6-7 原电池原理示意图
一 、原电池
1. 电流方向
2. 正、负极
3.电子流向
4.电极反应式
5. 总反应式
6. 阴、阳离子流向
7.电势高低
理论上,自发的 氧化还原 反应均可构成原电池。
具体条件是:
①具有 活动性不同 的两个电极(金属与金属或金属与能导电的非金属);
②溶液:两电极均插入 电解质 溶液中(熔融电解质);
③导线:两极用导线相连,形成闭合回路。
一、原电池
5.构成条件
序号
① ② ③
能否构成 原电池
能 能 不能
构成原电 池的条件
2个电极:活动性不同的2种金属或金属+非金属
判断下列装置能否构成原电池
H SO H SO
H SO
序号
④ ⑤ ⑥
实验 装置
酒精
能否构成 原电池
能 能 不能
构成原电 池的条件
电极必须插在电解质溶液中
判断下列装置能否构成原电池
序号 ⑦ ⑧ ⑨ 实验 装置 Zn 盐桥 H SO H SO
Zn
H SO
能否构成 原电池 不能 能 能 构成原电 池的条件 两极相连形成闭合回路
判断下列装置能否构成原电池
Cu
2.下列装置能形成原电池的是
B.①②⑤⑥
D.①②③⑥⑦
稀硫酸 稀硫酸
④
CuSO 溶液
②
稀硫酸
①
稀硫酸
③
稀盐酸 ⑦
稀硫酸 ⑤
酒精 ⑥
1234
①电极材料:活泼金属为负极,不活泼金属为正极
②电子流向:电子流出的一极是负极,电子流入的一极是正极
③反应类 型 :发生氧化反应的一极是负极;发生还原反应的一极是正极
④离子流向:阴离子移向负极;阳离子移向正极
⑤实验 现 象:逐渐溶解/质量减轻的一极是负极;
有气泡冒出、有金属析出/质量增加的一极是正极
原电池正负两极的判断方法
指出下列原电池装置中的正负极材料,并写出正、负极电极
反应式以及总反应的离子方程式。
①Cu、C、AgNO 原电池 ②Mg、Al、稀盐酸原电池
③Fe、Cu、FeCl 原电池 ④Fe、C、海水原电池
(1)Zn 与足量的稀硫酸反应生成H 的图像。请画出加 少量CuSO 后的图像
(2)足量Zn 与稀硫酸反应生成H 如图,请画出加入
少量CuSO 溶液后的图像。
n(H )
t
(2)
n(H )
(1)
加快反应速率
t
负极 正极
电解质溶液
A Cu Zn
CuCl
B Zn Cu
H SO
C Zn C
CuSO
D Zn Al
CuCl
一个原电池的总反应的离子方程式是Zn+Cu +=Zn ++Cu, 该反应的的原电池的正确组成是 ( C )
设计原电池
例.将反应Fe+2Fe +=3Fe +, 设计成原电池装置。画图, 并指出正、负极材料,电解质溶液,写出正负极反应式
Fe 石墨C
Fe (SO ) 或FeCl 溶液
负极:Fe-2e-=Fe +
正极:2Fe ++2e-=2Fe +
设计原电池
金属的腐蚀速度:
原电池的负极>正常腐蚀>原电池的正极
【注 】当同为负极时,活动性相差越大,腐蚀越快
如要保护铁闸门,可用导线将其与锌块连接,使锌做 原电池负极,铁闸门做正极,从而使铁闸门受到保护。
用于保护金属
Fe Fe Sn Fe Zn Fe &u
海 水
(1)
例 . 下列装置中四块相同的Fe 片,放置 一 段时间后腐蚀速率
由快到慢的顺序是
421 3
海 水
(3)
海 水
(4)
海 水 (2
总 反 应 :2 Al+2H O+2NaOH=2NaAlO +3H 个
2Al+2H O+2OH-=2A1O -+3H 个 负极:Al-3e-+4OH-=A1O -+2H O
2Al-6e-+8OH-=2AlO -+4H O
正 极 :6 H O+6e-=3H 个+6OH-
NaOH溶液
浓硝酸
两个特殊的原电池
根据原电池原理,人们研制出很多结构和性能各异 的化学电池,满足不同的用电需要
1、锌锰干电池
负极:锌筒
正极:石墨棒 电解质溶液:氯化铵糊
负极(Zn):Zn-2e-=Zn +
正极(C):2MnO +2NH ++2e-=Mn O +2NH 个+H O
总反应式:Zn+2MnO +2NH Cl=ZnCl +Mn O +2NH 个+H O
化学电池
2、铅酸蓄电池
负极:铅 Pb
正极:二氧化铅PbO
电解质溶液:稀硫酸
负极(Pb): Pb+SO 2--2er=PbSO
正极(PbO ): PbO +4H++SO 2-+2er =PbSO +2H O
放电
总反应式:Pb+PbO +4H++2SO 放电2PbSO +2H O
3、锂离子电池
锂电池具有高效、安全环 保、体积小的优点,多用 于手机、笔记本、照相机 和摄像机等电器
4、燃料电池
燃料电池是一种将燃料( 如H 、
CH 、乙醇)和氧化剂( 如O ) 的化学 能直接转化为电能的电化学反应装置, 具有清洁、安全、高效等特点。燃料电 池的能量转化率可以达到80% 以上。
用电器
e
- O (空气)
H
正极
电解质
→H O
正极:通入氧气O
负极:通入燃 料
总反应式:2H +O =2H O
正极:O +4e=+4H+=2H O
负极:H -2e-=2H+
H O<
负极-
H
e
燃料电池:
①燃料(H 、CH 、乙醇)作负极,氧化剂(O 、Cl ) 作正极
②电极为惰性材料(石墨),不参与反应
③总反应一般为燃烧方程式
④含C酸性环境中→CO , 碱性环境中→CO 2-, 含N→N
化学电源的基本类型
(1)活泼金属作负极,被腐蚀或消耗,发生氧化反应,如锌锰干电池。
(2)两电极都参加反应,如铅蓄电池。
(3)两电极均为惰性电极,电极本身不发生反应,而是由引入到两极上 的物质发生反应,如燃料电池。
归纳总结
1、Mg、AI、NaOH溶液构成原电池, 是负极,电子 由 流向 ,Mg 周围c(Na+) ,总方程式 正、 负极电极反应式
2、H 、O 、H SO 溶液构成燃料电池,写出正、负极电极 方程式(标出正负)
3、CH 、O 、KOH 溶液构成燃料电池,写出正、负极电极 方程式(标出正负)
4、铜 片、锌片和300mL 稀硫酸组成的原电池中,当铜片上 放出3.36L气体(标准状况)时,硫酸恰好用完,产生这些 气体消耗锌的物质的量 有 个电子通过导线,原 硫酸的物质的量浓度为
原电池的相关计算:电子守恒法
等质量的Fe、Cu、硫酸铜组成的原电池,经过一 段时间后,两电极质量差为12g, 则消耗Fe g, 析 出Cu g, 导线上通过 mol 电子。
酸性条件下
负极:2H -4e-==4H+
正极:O +4H++4e-==2H O
总反应:2H +O =2H O
碱性条件下
负极:2H +4OH--4e-==4H O
正极:O +2H O+4e-==4OH-
总反应:2H +O =2H O
燃料电池---氢氧燃料电池
氢氧燃料电池示意图
H
负 极
正极 电解质
-O (空气)
→H O
H
酸性条件下 负极:CH -8e-+2H O ==CO +8H+
正极:2O +8e-+8H+==4H O
总反应:CH +2O ==CO +2H O
碱性条件下 负极:CH -8e-+10OH-==CO 2-+7H O
正极:2O +8e-+4H O==8OH-
总反应:CH +2O +2OH-==CO 2-+3H O
燃料电池---甲烷燃料电池
Pb+Pb0 +2H SO ===2PbSO +2H O
PbO ×
按要求回答下列问题: Pb
(1)负极材料是 Pb, 正极材料是 PbO ,电解质溶液是 H SO4。
(2)工作时,电解质溶液中的H+ 移向PbO 电(正)极。
(3)工作时,电解质溶液中硫酸的浓度减小 (填“增大” “减小”或“不 变”)。
(4)当铅蓄电池向外电路提供2mole一时,理论上负极板的质量增加96 g。
5.铅酸电池常用作汽车电瓶,其构造如图所示,
工作时该电池总的方程式为:
H SO
溶液
A B C
D
锂离子电池 太阳能集热器 燃气灶
硅太阳能电池
【课堂练习】
1.下列设备工作时,将化学能转化为电能的是
(A)
A.电子由铜通过导线流向锌
电流表
B.该装置是将电能转化为化学能的装置 C.锌电极发生氧化反应 D.电流由锌通过导线流向铜
【课堂练习】
2.如图为某兴趣小组制作的番茄电池,下列说法正确的是(C)
①原电池是把化学能转化成电能的一种装置
②原电池的正极发生氧化反应,负极发生还原反应
③能自发进行的氧化还原反应可设计成原电池
④碳棒不能用来作原电池的正极
⑤反应Cu+2Ag+= =Cu ++2Ag 可以自发进行
A.①③⑤ B.①④⑤ C.②③④ D.②⑤
4.下列叙述正确的是
【课堂练习】
【课堂练习】
5.如图所示的装置,M 为活动性顺序位于氢之前的金属,N为石墨棒,关于此装置的
下列叙述中,不正确的是(D)
A.N上有气体放出
B.M 为负极,N 为正极
C.稀硫酸中SO2-移向M 极
D.导线中有电流通过,电流方向是由M 到N
稀硫酸
6.下列几种化学电池中,不属于可充电电池的是
A.碱性锌锰电池 B. 手机用锂电池
C.汽车用铅蓄电池 D.玩具用镍氢电池
7.LED 产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED 发光的一种装置示
意图。下列有关叙述正确的是
A.a处通入氧气,b 处通入氢气
B.通入H 的电极发生反应:H -2e-=—2H+
C.通入O 的电极为电池的正极
D.该装置将化学能最终转化为电能
导线
e N- 型半导体
Pt
田 P- 型半导体
导线
【课堂练习】
氢氧燃料电池 LED发光二极管
KOH 溶 液
b—
田
田
e-
a—
e-
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
