7.4糖类高一下学期化学人教版(2019)必修第二册(共37张PPT)
文档属性
| 名称 | 7.4糖类高一下学期化学人教版(2019)必修第二册(共37张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-11 20:40:46 | ||
图片预览









文档简介
(共37张PPT)
有机化合物
第四节
基本营养物质
第七章
必修第二册
学习目标
·1.通过阅读教材,并结合生活实例 认识糖类物质的基本性质与分类 特别是葡萄糖与果糖、蔗糖与麦 芽糖、淀粉与纤维素等。
·2.掌握葡萄糖、淀粉的特征反应。 ·3.掌握蔗糖、淀粉水解反应。
核心素养
·1.通过实验探究葡萄糖、淀 粉的特征反应,培养科学探究 与创新意识。
·2.通过认识葡萄糖、蔗糖、
淀粉、纤维素等糖类的用途 培养科学态度与社会责任。
情境导入
·糖尿病患者的糖代谢功能紊乱, ·其血液和尿液中的葡萄糖含量会 ·超出正常范围。测定患者血液
·或尿液中的葡萄糖含量有助于
·判断病情,可使用根据葡萄糖
·特征反应原理制备的试纸进行测试。
学生活动一
· 阅读课本P83-85, 糖类相关内容,思考下列问题: ·1.基本营养物质有哪些
·2.糖的元素组成、分类及其代表物
·3.葡萄糖的结构、物理性质、化学性质 5分钟
·4.淀粉的特征反应
·5.蔗糖、淀粉和纤维素的水解反应
· 基本营养物质:
食物中营 养物质
糖类
蛋白质
油脂
维生素
无机盐
水
人体基本 营养物质
情境导入
特别提醒
(1)不符合通式Cn(H O)m的也可能是糖类化合物, 如鼠李糖 C H O
(2)符合通式Cn(H O)m也可能不是糖,
如乙酸 C H O C (H O); 甲 醛 HCHO CH O
·糖类是由C 、H _、0 三种元素组成,可用通式Ca(H O)m表示,
也称为_碳水化合物
1.糖类的元素组成、分类及代表物
1. 糖类的元素组成、分类及代表物
·按是否水解及水解产物的不同,进行分类
物质 葡萄糖、果糖蔗糖、麦芽糖 淀粉
不能
水解 水解成
两分子单糖 水解成
多分子单糖
纤维素
(C H O )相对分子 质量在200万以上
(C H O )。相对分子
质量从几万到几十
万
C 2H O
C H 2O
组成
独立思考
·1.糖类化合物都有甜味吗 有甜味的都是糖
不是,例如淀粉没有甜味;
不是,阿斯巴甜有甜味但不属于糖类
维多阿斯巴甜
1产品名称:天门冬酰苯丙氩酸甲隆(同斯巴甜)
5.使用方法:按实际生产工艺添加
2. 贮存条件:常温干燥、密闭险存
3.净含量/报格:1kg
9产品批号及生产日期:见包装袋封口
10.使用范属、用量:执行GB2760 标准
可被正常生产柔要适蛋用于各类食品中
产品满足SC 25GFARCkSP最
苏 江苏X 1 -股21份7 0 0 8司
客电址::01阳0-市84民8 1 1济1并发区金牺路18号
地:中国 江苏 常州 陶址w
独立思考
·2.葡萄糖和果糖,均为单糖,分子式都一样。
·结合葡萄糖和果糖的分子结构,分析二者的关系
同分异构体
独立思考
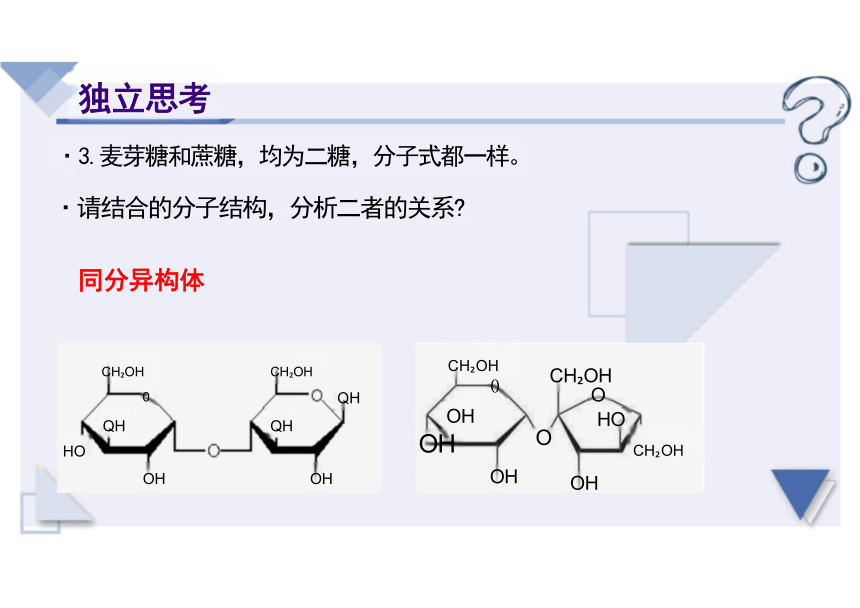
·3.麦芽糖和蔗糖,均为二糖,分子式都一样。 ·请结合的分子结构,分析二者的关系
同分异构体
CH OH
O
HO
CH OH
OH
CH OH 0
OH
OH
OH
CH OH
0
QH
HO
OH
CH OH
QH
QH
OH
O
淀粉和纤维素,均为多糖,
分子式看似一样,
但是因为n值不同,
分子式实际不同,
不能互称为同分异构体。
二者
都属于
天然
高分子
化合物
独立思考
·4.结合淀粉和纤维素的分子结构,分析二者的关系
2.葡萄糖的结构、物理性质、化学性质
·葡萄糖是一种有甜味的无色晶体,
·能溶于水,
·其分子式为C H O
2.葡萄糖的结构、物理性质、化学性质
·结构式:
多羟基醛
H H H H H H
H- C C=0
0—H 0—H O—H 0—H 0—H
醛基
羟基
· 结构简式: CH,CH CH CH CH CHO
I
OH OH OHOH OH
CH OH- CHOH-CHOH-CHOH-CHOH-CHO
2.葡萄糖的结构、物理性质、化学性质
CH OH(CHOH) CHO
2.葡萄糖的结构、物理性质、化学性质
·键线式: OH OH
HO
OH OH
实验式:CH O
①与钠发生置换反应
—OH-
②与乙酸等发生酯化反应
③与O 在Cu或Ag作催化剂是发生催化氧化
—CHO
有还原性 → —COOH
独立思考
·通过官能团预测葡萄糖的化学性质
2.葡萄糖的结构、物理性质、化学性质
· (1)在试管中先加入2mL( 过 量 )10%NaOH溶液,滴加5滴5 % CuSO ,
·溶液,得到新制的Cu(OH) 。再加入2mL10%葡萄糖溶液, ·加热,观察现象。
· (2)在洁净的试管中先加入1mL2% AgNO 溶液,然后一边振 ·荡试管,一边逐滴加入2%稀氨水,直到最初产生的沉淀恰好 ·溶解为止,得到银氨溶液。再加入1mL10%葡萄糖溶液,
·振荡,然后放在水浴中加热,观察现象。
5滴 5%CuSO 溶液 三10%NaOH 溶液 2mL 1 0 % 葡 萄糖 现象 产生砖红色沉淀
结论 葡萄糖具有还原性,将新 制Cu(OH) 还原为Cu O 醛基有较强还原性 注意 ①必须在碱性条件下进行,即NaOH过量 ②直接加热
(1)与弱氧化剂新制Cu(OH) 反应
2%稀氨水 l mL 10%葡 萄糖 现 象 产生光亮的银镜
结 论 葡萄糖具有还原性,在碱性条 件下将Ag+还原为Ag 醛基有较强还原性 1 mL2% AgNO 溶液 澄清溶液 热水 注意 ①配制银氨溶液:在AgNO 溶液中边振荡边逐滴加入稀 氨水至产生的沉淀恰好溶解 ②碱性条件 ③水浴加热
(2)与银氨溶液反应
独立思考
·根据实验7-7,回答以下问题:
1. 葡萄糖与新制Cu(OHD 反应的实验操作中,有哪些注意事项
(1)Cu(OH) 要现用现 配;
(2)配制Cu(OH) 时NaOH 溶液要过量。
2.如何配制银氨溶液
向硝酸银溶液中逐滴加入稀氨水,
直到最初产生的沉淀恰好溶解为止。
独立思考
·根据实验7-7,回答以下问题:
3.葡萄糖的两个实验中,它们的加热方式是否完全相同
实验(1 )加热煮沸;
实验(2)水浴加热
4.葡萄糖的两个实验中可分别观察到什么现象 体现了葡萄糖的什么性质
实 验 (1 )产生砖红色沉淀 Cu O, 氢氧化铜被还原成Cu O;
实 验 (2 )试管内壁形成光亮的银镜,Ag+→Ag;
-CHO 被氧化成-COOH, 葡萄糖表现还原性。
2.葡萄糖的结构、物理性质、化学性质
· (1)银镜反应
CH OH(CHOH) CHO +2[Ag(NH ) ]OH△
CH OH(CHOH) CHO+2Cu(OH) +NaOH△
CH OH(CHOH) COONa +Cu Ol+3H O
COONH +2Agl+3NH +H O
医学用于检验尿糖
CH OH(CHOH) · (2)与新制Cu(OH) 悬浊液反应
2.葡萄糖的结构、物理性质、化学性质
· (3)生理氧化
·葡萄糖易于被人体吸收,经酶的催化发生氧化反应放出热量,提供了维 持生命活动所需要的能量。低血糖的患者可利用静脉注射葡萄糖溶液的 方式来迅速补充营养。
C H O +60 酶 6CO +6H O
· 一判断题:
·1.葡萄糖可用于玻璃等材料表面化学覆银,因为葡萄糖具有还原性。
·2.向少量脱脂棉中加入几滴蒸馏水和几滴浓,搅拌成糊状。再加入几滴
溶液,加热,无明显现象。说明:脱脂棉水解产物无葡萄糖。()
·3.葡萄糖易溶于水,可用作制镜工业的原料。( × )
探究要点 · 典例合作细解基本能力 · 随堂评估自测能力课时培优练
典型例题
小结
· (1)在葡萄糖分子中含有两个决定葡萄糖化学性质的原子团,它们分别是 羟基(—OH) 和醛基(—CHO) 。
· (2)主要性质及应用
·①葡萄糖与新制的Cu(OH) 反应,生成砖红色的Cu O沉淀。此性质常用
于血液和尿液中葡萄糖的含量测定。
·②葡萄糖与银氨溶液反应生成Ag, 在试管内壁形成光亮的银镜。常用于
葡萄糖的检验和工业上的制镜。
·微点拨:葡萄糖与新制Cu(OH) 、 银氨溶液反应时均在碱性条件下加热 进行,同时后者应水浴加热。
3. 蔗糖和麦芽糖
· 蔗糖和麦芽糖分子式都为C 2H2 O11 ,两者互为同分异构体。
酸或酶
C1 H O1 十 H O 2C H O 。
麦芽糖 葡萄糖
蔗糖水解方程式: C H O 1+H O 蔗糖
C H 2O6+C H 2O 葡萄糖 果糖
催化剂
一
(1)稀硫酸做催化剂;
( 2) NFO 中和硫酸,并使溶液呈碱性。
(3)水浴加热,目的:有效控制温度,受热均匀。
独立思考
·如何检验蔗糖的水解产物
→产生红色沉淀」
新制Cu(OH)
悬浊液,△
特别提醒
稀NaOH
呈弱碱性
→ 中和液
→水解液
稀硫酸 水浴,△
蔗糖一
·二.判断题:
·1.取少量蔗糖水解液,加入新制的氢氧化铜悬浊液,加热至沸腾,未见
砖红色沉淀产生,说明:蔗糖在酸性条件下不能水解。( )
·2.向蔗糖溶液中加入稀硫酸并加热一段时间,然后滴加银氨溶液,无银
镜产生,说明:蔗糖未水解。( × )
·3.蔗糖和麦芽糖水解产物都只有一种,那就是葡萄糖。( x )
·4.蔗糖水解C H O (蔗糖)+H O 一定条件>2C H O。(葡萄糖) (×)
探究要点 · 典例合作细解基本能力 · 随堂评估自测能力课时培优练
典型例题
情境导入
·为什么馒头、米饭在嘴里会越嚼越甜
【实验7-8】
· (1)回忆生物课中学习的检验淀粉的方法。将碘溶液滴到一片馒头或土豆 上,观察现象。 催化剂,
加快淀粉水解
· (2)在试管中加入0.5g 淀粉和4 mL2 mol/LH SO 溶液,加热。待溶液
冷却后向其中加入NaOH 溶液,将溶液调至碱性,再加入少量新制的
Cu(OH) , 加热。观察解释实验现象。
中和硫酸;
保证溶液呈碱性,
· (1特征反应:淀粉遇碘显蓝色,该特征反应可用于淀粉和碘的相互检验。
· (2)水解反应:摄入人体内的淀粉在酶的催化作用下也可以发生逐步水解, 最终生成葡萄糖。葡萄糖经缓慢氧化转变为二氧化碳和水,同时放出能量。
食物中的淀粉— →糊精— → 麦芽糖一 → 葡萄糖 — 缓慢氧化 (C H O )n (C H O )m(m淀粉
体内氧化:C H O +60
发酵酿酒:C H O —酶
酶 6 CO +6H O
2 C H OH+2CO 个
思考与讨论
·如何设计实验判断淀粉的水解程度,是完全水解、部分水解还是尚未水 解 你所设计的实验方案包括:实验步骤、实验现象及结论。
新制氢氧化铜/银氨溶液
中和液 — → 现象B
△
现象B 结论
无银镜/无砖红色沉淀
有银镜/有砖红色沉淀 有银镜/有砖红色沉淀
NaOH
现象A
变蓝
变蓝
不变蓝
尚未水解
部分水解 完全水解
碘水
现象A
稀H SO 水解液
①
② ③
溶液
淀粉
△
银氨溶液、热水浴
1.淀粉+稀硫酸、加热
2.加入NaOH 溶液调至弱
碱性环境
如何探究淀粉水解的程度 是未水解、部分水解还是完全水解
①
淀粉+蒸馏水、加热
①
碘液
无明显现象
光亮银镜
碘液
变蓝
·下列结论中正确的是( ) 碘 水 溶液不变蓝
A. 淀粉尚有部分未水解 D
B. 淀粉已完全水解
C. 淀粉没有水 D. 淀粉已发生水解,但不知是否完全水解
硫酸、 过量NaOH
加热 溶液
→水解液— 至碱性 混合液
·三.某学生设计了如下实验方案用以检验淀粉的水解情况。
新制的 Cu(OH)
加热至沸腾
砖红色
沉淀
探究要点 · 典例合作细解基本能力 · 随堂评估自测能力课时培优练
典型例题
淀粉
溶液
食物中的淀粉
(C H Os)n
糊精
(C H O )m
(m麦芽糖
C H O
葡萄糖
C H O
缓慢氧化
C H O +60 =6CO +6H O
图7-26 淀粉在人体内的变化
C H O:酶>2C H OH+2CO 个 葡萄糖
纤维素:不能水解,但能刺激胃肠蠕动。
②工业生产:
淀粉、纤维素的用途
①人体内:
谢谢
有机化合物
第四节
基本营养物质
第七章
必修第二册
学习目标
·1.通过阅读教材,并结合生活实例 认识糖类物质的基本性质与分类 特别是葡萄糖与果糖、蔗糖与麦 芽糖、淀粉与纤维素等。
·2.掌握葡萄糖、淀粉的特征反应。 ·3.掌握蔗糖、淀粉水解反应。
核心素养
·1.通过实验探究葡萄糖、淀 粉的特征反应,培养科学探究 与创新意识。
·2.通过认识葡萄糖、蔗糖、
淀粉、纤维素等糖类的用途 培养科学态度与社会责任。
情境导入
·糖尿病患者的糖代谢功能紊乱, ·其血液和尿液中的葡萄糖含量会 ·超出正常范围。测定患者血液
·或尿液中的葡萄糖含量有助于
·判断病情,可使用根据葡萄糖
·特征反应原理制备的试纸进行测试。
学生活动一
· 阅读课本P83-85, 糖类相关内容,思考下列问题: ·1.基本营养物质有哪些
·2.糖的元素组成、分类及其代表物
·3.葡萄糖的结构、物理性质、化学性质 5分钟
·4.淀粉的特征反应
·5.蔗糖、淀粉和纤维素的水解反应
· 基本营养物质:
食物中营 养物质
糖类
蛋白质
油脂
维生素
无机盐
水
人体基本 营养物质
情境导入
特别提醒
(1)不符合通式Cn(H O)m的也可能是糖类化合物, 如鼠李糖 C H O
(2)符合通式Cn(H O)m也可能不是糖,
如乙酸 C H O C (H O); 甲 醛 HCHO CH O
·糖类是由C 、H _、0 三种元素组成,可用通式Ca(H O)m表示,
也称为_碳水化合物
1.糖类的元素组成、分类及代表物
1. 糖类的元素组成、分类及代表物
·按是否水解及水解产物的不同,进行分类
物质 葡萄糖、果糖蔗糖、麦芽糖 淀粉
不能
水解 水解成
两分子单糖 水解成
多分子单糖
纤维素
(C H O )相对分子 质量在200万以上
(C H O )。相对分子
质量从几万到几十
万
C 2H O
C H 2O
组成
独立思考
·1.糖类化合物都有甜味吗 有甜味的都是糖
不是,例如淀粉没有甜味;
不是,阿斯巴甜有甜味但不属于糖类
维多阿斯巴甜
1产品名称:天门冬酰苯丙氩酸甲隆(同斯巴甜)
5.使用方法:按实际生产工艺添加
2. 贮存条件:常温干燥、密闭险存
3.净含量/报格:1kg
9产品批号及生产日期:见包装袋封口
10.使用范属、用量:执行GB2760 标准
可被正常生产柔要适蛋用于各类食品中
产品满足SC 25GFARCkSP最
苏 江苏X 1 -股21份7 0 0 8司
客电址::01阳0-市84民8 1 1济1并发区金牺路18号
地:中国 江苏 常州 陶址w
独立思考
·2.葡萄糖和果糖,均为单糖,分子式都一样。
·结合葡萄糖和果糖的分子结构,分析二者的关系
同分异构体
独立思考
·3.麦芽糖和蔗糖,均为二糖,分子式都一样。 ·请结合的分子结构,分析二者的关系
同分异构体
CH OH
O
HO
CH OH
OH
CH OH 0
OH
OH
OH
CH OH
0
QH
HO
OH
CH OH
QH
QH
OH
O
淀粉和纤维素,均为多糖,
分子式看似一样,
但是因为n值不同,
分子式实际不同,
不能互称为同分异构体。
二者
都属于
天然
高分子
化合物
独立思考
·4.结合淀粉和纤维素的分子结构,分析二者的关系
2.葡萄糖的结构、物理性质、化学性质
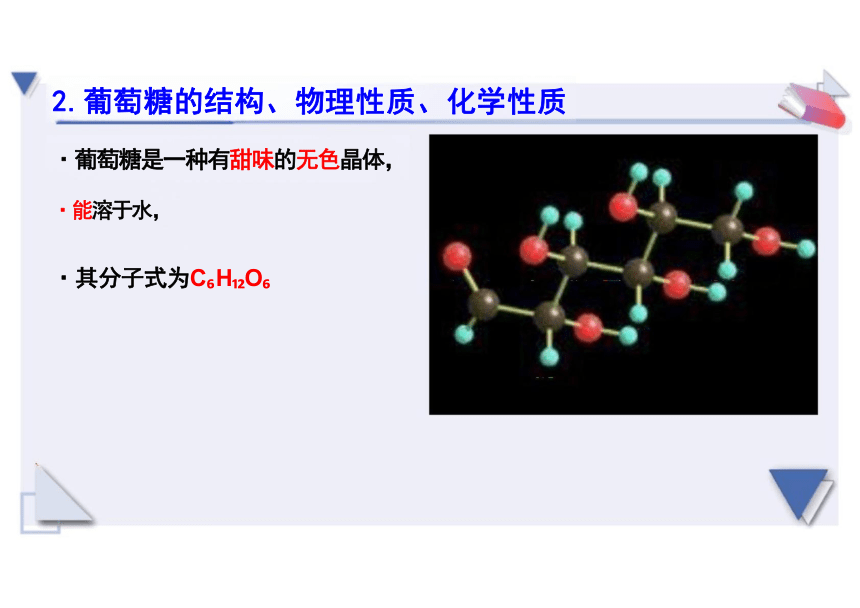
·葡萄糖是一种有甜味的无色晶体,
·能溶于水,
·其分子式为C H O
2.葡萄糖的结构、物理性质、化学性质
·结构式:
多羟基醛
H H H H H H
H- C C=0
0—H 0—H O—H 0—H 0—H
醛基
羟基
· 结构简式: CH,CH CH CH CH CHO
I
OH OH OHOH OH
CH OH- CHOH-CHOH-CHOH-CHOH-CHO
2.葡萄糖的结构、物理性质、化学性质
CH OH(CHOH) CHO
2.葡萄糖的结构、物理性质、化学性质
·键线式: OH OH
HO
OH OH
实验式:CH O
①与钠发生置换反应
—OH-
②与乙酸等发生酯化反应
③与O 在Cu或Ag作催化剂是发生催化氧化
—CHO
有还原性 → —COOH
独立思考
·通过官能团预测葡萄糖的化学性质
2.葡萄糖的结构、物理性质、化学性质
· (1)在试管中先加入2mL( 过 量 )10%NaOH溶液,滴加5滴5 % CuSO ,
·溶液,得到新制的Cu(OH) 。再加入2mL10%葡萄糖溶液, ·加热,观察现象。
· (2)在洁净的试管中先加入1mL2% AgNO 溶液,然后一边振 ·荡试管,一边逐滴加入2%稀氨水,直到最初产生的沉淀恰好 ·溶解为止,得到银氨溶液。再加入1mL10%葡萄糖溶液,
·振荡,然后放在水浴中加热,观察现象。
5滴 5%CuSO 溶液 三10%NaOH 溶液 2mL 1 0 % 葡 萄糖 现象 产生砖红色沉淀
结论 葡萄糖具有还原性,将新 制Cu(OH) 还原为Cu O 醛基有较强还原性 注意 ①必须在碱性条件下进行,即NaOH过量 ②直接加热
(1)与弱氧化剂新制Cu(OH) 反应
2%稀氨水 l mL 10%葡 萄糖 现 象 产生光亮的银镜
结 论 葡萄糖具有还原性,在碱性条 件下将Ag+还原为Ag 醛基有较强还原性 1 mL2% AgNO 溶液 澄清溶液 热水 注意 ①配制银氨溶液:在AgNO 溶液中边振荡边逐滴加入稀 氨水至产生的沉淀恰好溶解 ②碱性条件 ③水浴加热
(2)与银氨溶液反应
独立思考
·根据实验7-7,回答以下问题:
1. 葡萄糖与新制Cu(OHD 反应的实验操作中,有哪些注意事项
(1)Cu(OH) 要现用现 配;
(2)配制Cu(OH) 时NaOH 溶液要过量。
2.如何配制银氨溶液
向硝酸银溶液中逐滴加入稀氨水,
直到最初产生的沉淀恰好溶解为止。
独立思考
·根据实验7-7,回答以下问题:
3.葡萄糖的两个实验中,它们的加热方式是否完全相同
实验(1 )加热煮沸;
实验(2)水浴加热
4.葡萄糖的两个实验中可分别观察到什么现象 体现了葡萄糖的什么性质
实 验 (1 )产生砖红色沉淀 Cu O, 氢氧化铜被还原成Cu O;
实 验 (2 )试管内壁形成光亮的银镜,Ag+→Ag;
-CHO 被氧化成-COOH, 葡萄糖表现还原性。
2.葡萄糖的结构、物理性质、化学性质
· (1)银镜反应
CH OH(CHOH) CHO +2[Ag(NH ) ]OH△
CH OH(CHOH) CHO+2Cu(OH) +NaOH△
CH OH(CHOH) COONa +Cu Ol+3H O
COONH +2Agl+3NH +H O
医学用于检验尿糖
CH OH(CHOH) · (2)与新制Cu(OH) 悬浊液反应
2.葡萄糖的结构、物理性质、化学性质
· (3)生理氧化
·葡萄糖易于被人体吸收,经酶的催化发生氧化反应放出热量,提供了维 持生命活动所需要的能量。低血糖的患者可利用静脉注射葡萄糖溶液的 方式来迅速补充营养。
C H O +60 酶 6CO +6H O
· 一判断题:
·1.葡萄糖可用于玻璃等材料表面化学覆银,因为葡萄糖具有还原性。
·2.向少量脱脂棉中加入几滴蒸馏水和几滴浓,搅拌成糊状。再加入几滴
溶液,加热,无明显现象。说明:脱脂棉水解产物无葡萄糖。()
·3.葡萄糖易溶于水,可用作制镜工业的原料。( × )
探究要点 · 典例合作细解基本能力 · 随堂评估自测能力课时培优练
典型例题
小结
· (1)在葡萄糖分子中含有两个决定葡萄糖化学性质的原子团,它们分别是 羟基(—OH) 和醛基(—CHO) 。
· (2)主要性质及应用
·①葡萄糖与新制的Cu(OH) 反应,生成砖红色的Cu O沉淀。此性质常用
于血液和尿液中葡萄糖的含量测定。
·②葡萄糖与银氨溶液反应生成Ag, 在试管内壁形成光亮的银镜。常用于
葡萄糖的检验和工业上的制镜。
·微点拨:葡萄糖与新制Cu(OH) 、 银氨溶液反应时均在碱性条件下加热 进行,同时后者应水浴加热。
3. 蔗糖和麦芽糖
· 蔗糖和麦芽糖分子式都为C 2H2 O11 ,两者互为同分异构体。
酸或酶
C1 H O1 十 H O 2C H O 。
麦芽糖 葡萄糖
蔗糖水解方程式: C H O 1+H O 蔗糖
C H 2O6+C H 2O 葡萄糖 果糖
催化剂
一
(1)稀硫酸做催化剂;
( 2) NFO 中和硫酸,并使溶液呈碱性。
(3)水浴加热,目的:有效控制温度,受热均匀。
独立思考
·如何检验蔗糖的水解产物
→产生红色沉淀」
新制Cu(OH)
悬浊液,△
特别提醒
稀NaOH
呈弱碱性
→ 中和液
→水解液
稀硫酸 水浴,△
蔗糖一
·二.判断题:
·1.取少量蔗糖水解液,加入新制的氢氧化铜悬浊液,加热至沸腾,未见
砖红色沉淀产生,说明:蔗糖在酸性条件下不能水解。( )
·2.向蔗糖溶液中加入稀硫酸并加热一段时间,然后滴加银氨溶液,无银
镜产生,说明:蔗糖未水解。( × )
·3.蔗糖和麦芽糖水解产物都只有一种,那就是葡萄糖。( x )
·4.蔗糖水解C H O (蔗糖)+H O 一定条件>2C H O。(葡萄糖) (×)
探究要点 · 典例合作细解基本能力 · 随堂评估自测能力课时培优练
典型例题
情境导入
·为什么馒头、米饭在嘴里会越嚼越甜
【实验7-8】
· (1)回忆生物课中学习的检验淀粉的方法。将碘溶液滴到一片馒头或土豆 上,观察现象。 催化剂,
加快淀粉水解
· (2)在试管中加入0.5g 淀粉和4 mL2 mol/LH SO 溶液,加热。待溶液
冷却后向其中加入NaOH 溶液,将溶液调至碱性,再加入少量新制的
Cu(OH) , 加热。观察解释实验现象。
中和硫酸;
保证溶液呈碱性,
· (1特征反应:淀粉遇碘显蓝色,该特征反应可用于淀粉和碘的相互检验。
· (2)水解反应:摄入人体内的淀粉在酶的催化作用下也可以发生逐步水解, 最终生成葡萄糖。葡萄糖经缓慢氧化转变为二氧化碳和水,同时放出能量。
食物中的淀粉— →糊精— → 麦芽糖一 → 葡萄糖 — 缓慢氧化 (C H O )n (C H O )m(m
体内氧化:C H O +60
发酵酿酒:C H O —酶
酶 6 CO +6H O
2 C H OH+2CO 个
思考与讨论
·如何设计实验判断淀粉的水解程度,是完全水解、部分水解还是尚未水 解 你所设计的实验方案包括:实验步骤、实验现象及结论。
新制氢氧化铜/银氨溶液
中和液 — → 现象B
△
现象B 结论
无银镜/无砖红色沉淀
有银镜/有砖红色沉淀 有银镜/有砖红色沉淀
NaOH
现象A
变蓝
变蓝
不变蓝
尚未水解
部分水解 完全水解
碘水
现象A
稀H SO 水解液
①
② ③
溶液
淀粉
△
银氨溶液、热水浴
1.淀粉+稀硫酸、加热
2.加入NaOH 溶液调至弱
碱性环境
如何探究淀粉水解的程度 是未水解、部分水解还是完全水解
①
淀粉+蒸馏水、加热
①
碘液
无明显现象
光亮银镜
碘液
变蓝
·下列结论中正确的是( ) 碘 水 溶液不变蓝
A. 淀粉尚有部分未水解 D
B. 淀粉已完全水解
C. 淀粉没有水 D. 淀粉已发生水解,但不知是否完全水解
硫酸、 过量NaOH
加热 溶液
→水解液— 至碱性 混合液
·三.某学生设计了如下实验方案用以检验淀粉的水解情况。
新制的 Cu(OH)
加热至沸腾
砖红色
沉淀
探究要点 · 典例合作细解基本能力 · 随堂评估自测能力课时培优练
典型例题
淀粉
溶液
食物中的淀粉
(C H Os)n
糊精
(C H O )m
(m
C H O
葡萄糖
C H O
缓慢氧化
C H O +60 =6CO +6H O
图7-26 淀粉在人体内的变化
C H O:酶>2C H OH+2CO 个 葡萄糖
纤维素:不能水解,但能刺激胃肠蠕动。
②工业生产:
淀粉、纤维素的用途
①人体内:
谢谢
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
