2.2烯烃 高二下学期化学人教版(2019)选择性必修三(共45张PPT)
文档属性
| 名称 | 2.2烯烃 高二下学期化学人教版(2019)选择性必修三(共45张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-11 20:42:59 | ||
图片预览









文档简介
(共45张PPT)
第二章烃
第二节烯烃炔烃
2.2.1烯烃
学习目标
1、掌 握乙烯的结构特点,会书写乙烯的分子式、结构式、结构简 式、电子式
2、认识乙烯能够发生加成反应和氧化反应,熟 悉乙烯发生加成反 应时的断键和成键情况
3、掌握乙烯的制备方法及实验注意事项
4、认识烯烃的结构特征,掌握烯烃的物理性质的变化规律,熟 知 烯烃的化学性质
5、掌握烯烃的命名,学 会烯烃同分异构体的找法并认识烯烃的顺 反异构
是合成纤维、合成橡胶、合成塑料(聚乙烯及聚氯乙烯)、合成 乙醇(酒精)的基本化工原料,也用于制造氯乙烯、苯乙烯、环 氧乙烷、醋酸、乙醛和炸药等,也可用作水果和蔬菜的催熟剂
1、为什么乙烯的产量可以用来衡量一个国家的石油化工
思考
水平
分子式 电子式 结构式 结构简式 球棍模型
空间充 填模型
C H H H H:C::C:H H H H—C=C—H CH =CH
结构 特点 分子中碳原子采取 碳原子与碳原子间 分子中所有原子都 sp2杂 化 ,碳原子与氢原子间均形成单键(σ键), 以双键相连(1个σ键,1个π键),键角约为120°, 处于同一平面内
【 意】键长:0.5C-C键能:E(C—C)≤E(C=C)≤2E(G—C) (说明C=C 比C—C 活泼)
1、乙烯分子的组成与结构
乙烃的编构 乙烃的性质
一、乙烯
类型 结构式 结构特点
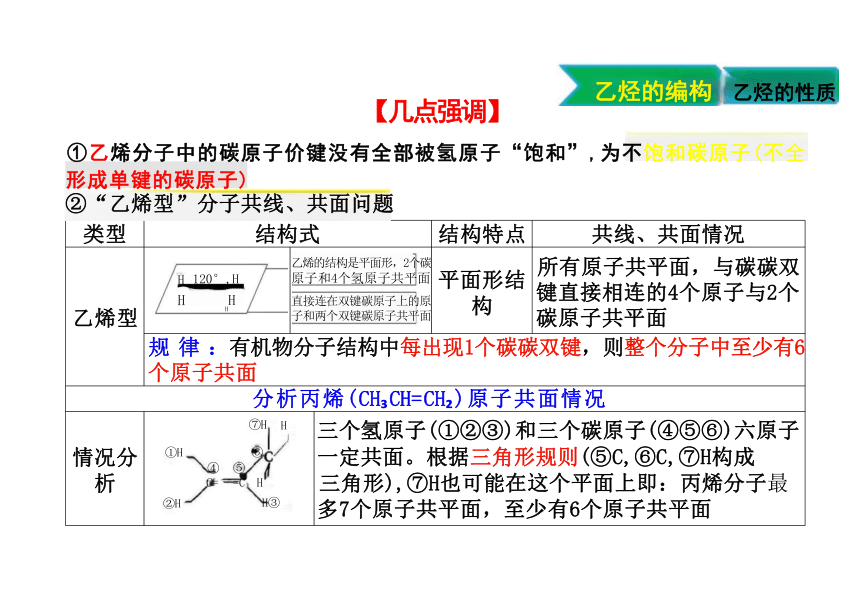
共线、共面情况
乙烯型 H 120°,H H HH 乙烯的结构是平面形,2个碳 原子和4个氢原子共平面 直接连在双键碳原子上的原 子和两个双键碳原子共平面 平面形结 构
所有原子共平面,与碳碳双 键直接相连的4个原子与2个 碳原子共平面
规 律 :有机物分子结构中每出现1个碳碳双键,则整个分子中至少有6 个原子共面 分析丙烯(CH CH=CH )原子共面情况 情况分 析 ⑦H H ①H ⑥ ④ ⑤ C= =C H ②H H③ 三个氢原子(①②③)和三个碳原子(④⑤⑥)六原子 一定共面。根据三角形规则(⑤C,⑥C,⑦H构成 三角形),⑦H也可能在这个平面上即:丙烯分子最 多7个原子共平面,至少有6个原子共平面
①乙烯分子中的碳原子价键没有全部被氢原子“饱和”,为不饱和碳原子(不全
形成单键的碳原子)
②“乙烯型”分子共线、共面问题
乙烃的编构 乙烃的性质
【几点强调】
①实验现象:火焰明亮且伴有黑烟(比甲烷要明亮),同时放出大量 的热
②原因: 产生黑烟是因为乙烯中碳的质量分数(85.7%)比较大,然 烧不完全产生的碳的小颗粒造成的;火焰明亮是由于碳微粒受灼热 成炽执状态而发光所致
③乙烯具有可燃性,点燃乙烯之前一定要检验乙烯纯度
①与氧气的燃烧反应:
化学方程式:C H +30
2、化学性质
乙圈的健质
(1)氧化反应
乙烯中的碳碳键、碳氢键全部破坏
乙烃的结构
2CO +2H O
点燃
(2)乙烯可使酸性高锰酸钾溶液褪色①反应方程式:5CH =CH + 12KMnO +18H SO -→ 10CO +12MnSO +6K SO +
28H O② 反应现象:酸性高锰酸钾溶液紫色褪去③反应机理:碳
碳双键易被酸性高锰酸钾溶液氧化,乙烯被氧化为CO , 高锰酸钾
溶液被还原为无色的Mn 用 高锰酸钾溶液可用于鉴别乙烷
和乙烯,但不能用于除去乙烷中的乙烯
乙烃的结构 乙屋的性质
为什么
实验过程
实验现象
将乙烯通入盛有溴的四氯化碳溶液 (或溴水)的试管中,观察现象
溴的四氯化碳溶液(或溴 水)褪色
乙橙的性质
(3)加成反应
Br—CH Br.
乙烃的结构
断键
Br Br
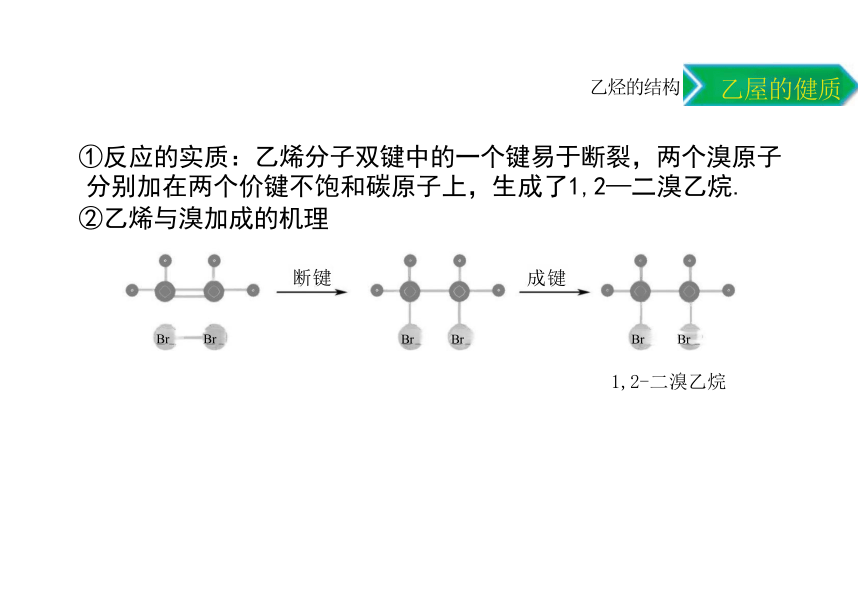
①反应的实质:乙烯分子双键中的一个键易于断裂,两个溴原子 分别加在两个价键不饱和碳原子上,生成了1,2—二溴乙烷.
②乙烯与溴加成的机理
乙屋的健质
1,2-二溴乙烷
乙烃的结构
成键
Br Br
Br
Br
③ 加成反应a .定义:有机物分子里不饱和的碳原子( 碳 碳 双键或碳碳 三 键 )跟其他原子或原子团直接结合生成新的化合物的反应,叫做加 成反应(有进无出)
b. 特点:断—(断双键中的一个键),加二(加两个原子或原子 团),只上不下。像“化合反应”
取代反应: 形式:有上有下,似置换
加成反应: 形式:只上不下,似化合
部位: C=C 或C三C或C=0
乙烃的结构 乙惨的健质
溴水
溴的CCl 溶液
反应现 象 褪色,褪色后溶液会分
褪色,褪色后溶液不分层
应用 鉴别乙烯和乙烷,除去乙烷中的乙烯气体,可以将 混合气体通过溴水的洗气瓶,但不能用溴的四氯化 碳溶液,因为乙烷能够溶于四氯化碳溶液中
乙烃的结构
④乙烯与溴水或溴的CCl 溶液反应现象的比较
乙耀的健质
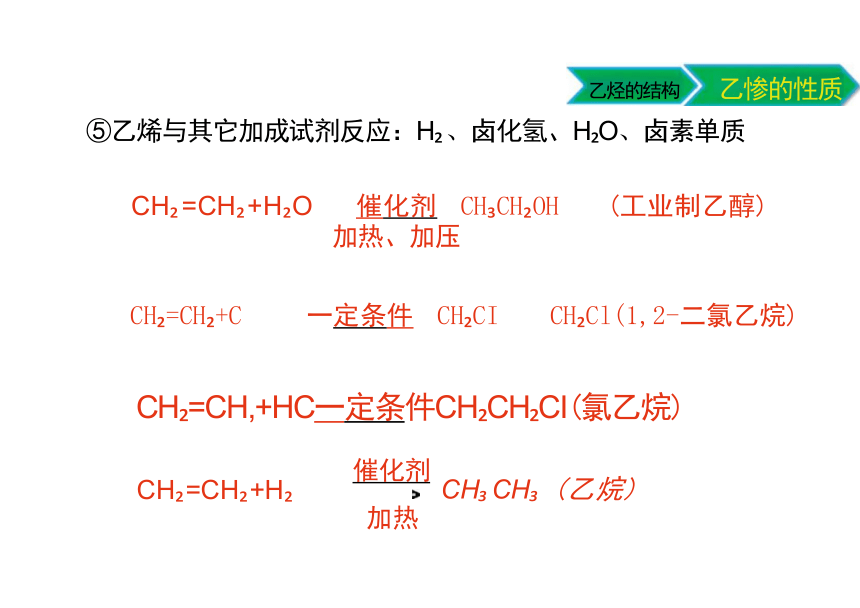
⑤乙烯与其它加成试剂反应:H 、卤化氢、H O、卤素单质
CH =CH +H O 催化剂 CH CH OH (工业制乙醇)
加热、加压
CH =CH +C 一定条件 CH CI CH Cl(1,2-二氯乙烷)
CH =CH,+HC一定条件CH CH CI(氯乙烷)
乙烃的结构 乙惨的性质
催化剂
加热
CH CH (乙烷)
CH =CH +H
用C H 和HCl反应制取更好。
乙烷和Cl 发生的是取代 成物中除CH CH Cl外,还 l 、 C H Cl 、C H Cl 、C HCl5 、C Cl 、HCl ,生成物不纯,产率低。C H 和HCl 发生的是加成反应,无副反应,生成物只有CH CH Cl。
2、乙烯和二氧化硫使溴水褪色的原理相同吗
不同。SO 使溴水褪色是因为SO 将溴单质还原生成了 无色的HBr, 乙烯使溴水褪色是因为乙烯与溴单质发生 了加成反应生成了无色的二溴乙烷
1、用乙烷(CH CH ) 和Cl 取代可以制取氯乙烷(CH CH Cl), 用乙烯(C H ) 和HCl 加成也能制氯乙烷,两种方法哪种更好
制取物质,要求纯净,不含杂质
乙烃的结构 乙圈的健质
思考
a.乙烯分子自身发生加成反应,生成聚乙烯
CH,=CH +CH =CH +CH,=CH + 催化剂CH —
CH —CH —CH —CH —CH — ...
n CH =CH 催化剂。ECH —CH 子。(聚乙烯)
①聚乙烯是一种重要的塑料,如用作食品保鲜膜、水管材料等 。生成聚乙烯的这种反应我们称为聚合反应。 由 于n 的值可能 不同,聚合物都是混合物
乙烃的结构 乙屋的性质
(4)加聚反应
②聚合反应:由相对分子质量小的化合物分子(单体)相互结合成相对 分子质量大的聚合物(高分子化合物)的反应叫聚合反应。
由不饱和的相对分子质量小的单体分子以加成反应的形式结合成相 对分子质量大的高分子化合物的反应叫做加成聚合反应,简称加聚
反应
③生活中用来包装食品的塑料袋是聚乙烯(无毒),如果将乙烯分子中
的一个氢原子用氯原子代替,聚合后成为聚氯乙烯,它就不能用来 包装食品了,因为有毒。塑料在高温或长期光照情况下,容易老化
,变脆。反应如下:
乙烃的结构 乙烃的性质
聚氯乙烯(有毒)
④聚合反应中的单体、链节和聚合度菖a.单体:能合成高分子的 小分子物质称为单体b. 链节:高分子化合物中化学组成相同、可 重复的最小单位称为链节c. 聚合度:链节的数目n叫做聚合度, 由于n 不同因此高聚物都是混合物
乙烃的结构 乙怪的性质
思考:聚乙烯、聚氯乙烯等高分子化合物能使溴水褪色吗 聚乙烯、聚氯乙烯中不含C=C,故不能使溴水褪色。
-[CH -CH }n 聚乙烯
f CH -CH}n
-[CH -CH}nCH
Cl
nCH =CHCH
nCH =CHCl
⑤常见聚合反应
nCH =CH
催化剂
催化剂
聚丙烯
聚氯乙烯
乙烃的结构 乙隆的作质
催化剂
乙烃的结构 乙圈的健质
3、物理性质
乙烯为无色、稍有气味的气体,密度比空气的略 小,难溶于水(排
水法收集),易溶于四氯化碳等有机溶剂
4、乙烯的实验室制法以及工业制法
详见导学案
含有碳碳双键(可以是若干个双键)的烃类化合物
(2)官能团:名称为碳碳双键,结构简式为
C=C
(3)分类① 单烯烃:分子中含有一个碳碳双键/② 多烯烃:分子中含 有两个及以上碳碳双键 ③ 二烯烃:分子中含有二个
碳碳双键。二烯烃又可分为累积二烯烃、孤立二烯烃和共轭二烯烃 ;累积二烯烃的结构特点是双键连在一起;共轭二烯烃的结构特点 是单、双键交替排列;孤立二烯烃的结构特点是在二个双键之间相 隔二个或二个以上的单键
烯控的结构烯烃的性质 二烯烃
二、烯烃的结构与性质
1、烯烃及其结构
(1)烯烃:
CH =CH CH =CHCH CH =CHCH CH CH =CHCH CH CH
乙烯 丙烯 1-丁烯 1-戊烯
图2-3几种简单烯烃的结构简式和分子结构模型
烯烃只含有一个碳碳双键(单烯烃)时,其通式一般表示为C,H n(n ≥2)
燃程的结构 烯烃的性质 二烯烃
(4)通式:
烯烃 丙烯 1-丁烯
1-戊烯
分子式 C H C H
C H 0
结构简式 (键线式)
碳原子杂化类型
共价键类型(σ键 π 键 ) σ键和π键 σ键和π键
σ键和π键
烯程的结构 烯烃的性质 二烯烃
(5)烯烃同系物的结构特点
(1)状态:一般情况下,2~4个碳原子烯烃(烃)为气态,5~16个碳 原子为液态,16个碳原子以上为固态(2)溶解性:烯烃不 溶于水,
易溶于有机溶剂 (3)熔沸点 :随着碳原子数增多(范德华力增大),熔 沸点增高;分子式相同的烯烃,支链越多,熔沸点越低(4)密 度:随 着碳原子数的递增,密度逐渐增加;烯烃的相对密度都小于水的密
度
烯烃的结构 烯屋的候质 二烯烃
2、物理性质
(类似于烷烃)
a.与氧气的然烧反应通式:
C,H n+(3n/2)O 点燃→ nCO +nH O
现象:火焰明亮,伴有黑烟(碳原子越多,燃烧越不充分)
b. 能 使酸性KMnO 溶液褪色:
将烯烃通入酸性高锰酸钾溶液中会使溶液的颜色变浅直至消
不一定生成二氧化碳)
烯烃的结构 烯屋的候质 二烯烃
3、化学性质
烯烃的官能团是碳碳双键: , 它决定了烯烃的主要化学
性 质,化学性质类似于乙烯
(1)氧化反应
烯烃被
氧化的
部分
氧化产
物
二氢成气 一氢成酸 无氢成酮
烯烃的结构 烯怪的使质 二烯烃
R
R
烯烃被酸性KMnO 溶液氧化产物规律
【几点强调】
—C—OH(羧酸)
(酮)
CH =
RCH=
②加成反应:(以丙烯为例)
a.与溴水加成:CH =CHCH +Br →CH BrCHBrCH (1,2 — 二溴丙烷)
与.与 加l加成成:C: C + I化 CH CH CH (丙烷)
CH CH CH Cl(次要)
c.与H O加成:CH =CHCH +H O一化剂→CH CH(OH)CH (主 要)/CH CH CH OH(次要)
加成的原则
马氏规则:凡是不对称结构的烯烃和酸(HX) 加成时,酸的负基(X一)
主要加到含氢原子较少的双键碳原子上,称为马尔科夫尼科夫规则 ,也就是马氏规则(氢加氢多,卤加氢少)
C
H
H
H
H
H
H
H
烯烃的结构 烯遏的使质 二烯烃
③加聚反应(C=C 变成C-C,某烯变成聚某烯):
烯烃的结构 烯澄的候质
b.2-丁烯加聚生成聚2-丁烯:
a.丙烯加聚生成聚丙烯:
二烯烃
a.CH = CH -CH = CH 中有两个双键,与足量溴水反应时,两 个双键全部被加成CH =CH-CH=CH 与溴水1:2加成:
CH =CH-CH=CH +2Br →CH BrCHBrCHBrCH Br
(1)概念:分子中含有两个碳碳双键的烯烃
(2)链状二烯烃的通式:CnH n-2(n≥3)
(3)常见的二烯烃:CH =CH-CH =CH (1,3—丁二烯)(共轭二烯烃)
(4)化学性质:由于含有双键,二烯烃跟烯烃性质相似,也能 发生加成反应、氧化反应和加聚反应
①1,3—丁二烯(CH =CHCH=CH ) 的 加成反应
烯烃的结构 烯烃的性质 二烯烃
4、二烯烃
b.CH =CH-CH=CH 中有两个双键,若CH =CH-CH=CH 与溴
水1:1反应时(溴水不足)
I.1, 2— 加成:若两个双键中的一个比较活泼的键断裂,溴 原子 连接在1、2两个碳原子上
烯烃的结构烯烃的性质 二烯屋
3,4-二溴-1-丁烯
烯烃的结构烯烃的性质 二烯烃
Ⅱ.1,4 — 加成:两个双键一起断裂,同时又生成一个新的双 键,溴原子连接在1、4两个碳原子上
Br Br
CH == CHCCH=CH CH —CH=CH—CH
1,4-二溴-2-丁烯
【 注 意 】
般的,在温度较高的条件下发生1,4-加成,在温度较低的条件 下发生1,2-加成),既1,2-加成和1,4-加成是竞争反应,哪种反 应占优势取决于反应条件。
烯烃的结构
Ⅲ.1,2-加成和1,4-加成机理
烯烃的性质 二烯烃
催化剂
n CH =CH—CH=CH 十 CH —CH=CH—CH 于n
(3)天然橡胶的合成(异戊二烯加聚成聚异戊二烯):
(2)1,3—丁二烯烃的加聚反应:
烯烃的结构>烯烃的性质 二烯烃
烯烃的结构 烯烃的性质
(4)乙烯与1,3-丁二烯发生的双烯烃加成反应
1,3-丁二烯 乙 烯 环已烯
二烯燈
练一练
1、由乙烯的结构和性质推测丙烯(CH =CH—CH ) 的结构或性质 正确的是(C)
A. 不能使酸性高锰酸钾溶液褪色 B. 不能发生加聚反应
C. 能使溴的四氯化碳溶液褪色 D. 与 HCl在一定条件下
能加成并只得到一种产物
2、柠檬烯具有良好的镇咳、祛痰、抑菌作用,其结构如图所示。
下列关于柠檬烯的说法正确的是(B )
A.1 mol柠檬烯只能与1 mol H 反应
B. 能发生取代反应和加成反应
C. 属于乙烯的同系物
D. 不能使酸性高锰酸钾溶液褪色
烯烃的命名与烷烃的命名相似,即遵循最长、最多、最近、最小 最简原则。但不同点是主链必须含有双键,编号时起始点必须离双 键最近
(1)选主链,称某烯:将含有双键的最长碳链作为主链,并按主 链中所含碳原子数称为“某烯”(下面虚线框内为主链)
三、烯烃的命名
1、命名方法
烯烃的命名 烯烃的同分异构体
2、命名步骤
(2)编号位,定支链:
从距离双键最近的一端给主链上的碳原子依次编号,使双键碳
原子的编号为最小,以确定双键、支链的位次
6 7
CH — CH
3 4 5
CH—CH—CH+CH
CH CH
CH
2
CH CH C
爆径的命名>烯烃的同分异构体
烯径的命名 烯烃的同分异构体
(3)按规则,写名称:
取代基位次—取代基名称—双键位次—某烯
①用阿拉伯数字标明双键的位置(只需标明双键碳原子编号较
小的数字)
5,5,6—三甲基—2—庚烯
烯烃的命名 烯烃的同分异构体
②若为多烯烃(炔烃),则用大写数字“二、三…”在烯的名 称前表示双键的个数
CH
CH —C=CH—CH=CH—CH 3
2—甲基—2,4—己二烯
6 7
CH CH — CH
2 3 4 5
CH —CH 十 C— CH一 CH—-CH十 CH
主链名称
双键位置
一取代基名称 取代基数目 取代基位置
CH
乙基-1- 庚烯
烯烃的命名 烯烃的同分异构体
烯烃的名称及名称中的各个部分的意义
CH
三 甲基
—
3,4,5
①给烯烃命名时,最长的碳链不一定是主链
② 烯烃命名时应从距离双键最近的一端开始编号,而不能以支链 为依据
燃烃的命名 烯烃的同分异构体
【几点强调】
练一练
3、某有机物的键线式为 ,它的名称是(A)
A.4- 甲基-2-己烯 B.4- 甲基-2-戊烯
C.3- 甲基-2-己烯 D.4- 甲基-3-己烯
4、某烯烃的结构简式如下,有甲、乙、丙、丁四位同学分别将其 命名为:2-甲基-4-乙基-1-戊烯;2-异丁基-1-丁烯;2,4-二甲基 -3-己烯;4-甲基-2-乙基-1-戊烯。下列对四位同学的命名判断正 确的是(D)
A. 甲的命名主链选择是错误的 B. 乙的命名编号是错误的
C. 丙的命名主链选择是正确的 D. 丁的命名是正确的
单烯烃与同碳数的环烷烃互为同分异构体。
(2)碳架异构与碳碳双键的位置异构:
书写烯烃的同分异构体时,先写碳架异构,再写碳碳双键的位置 异构。
四、烯烃同分异构体的找法
烯烃的命名 第烃的同分异构体
1、烯烃同分异构的分类
(1)官能团异构:
通式 C,H2n 同分异构体 烯烃(n≥2)
环烷烃(n≥3)
方法 单键变双键,要求相邻的两个 碳上必须各有一个氢原子(箭头 是指将单键变成双键)
减环法:先写出最大的碳环,侧链 先一个侧链,再两个侧链
以 “ C H o ” 为例 C一 C 中间碳原子没有氢原子)
烯烃的命名 第烃的同分异构体
(3)顺反异构现象由于碳碳双键连接的原子或原子团不能绕键轴旋转 ,会导致其空间排列方式不同,产生顺反异构 现象
①顺反异构形成的条件a.分子中具有碳碳双键结构b.组成双键的
每个碳原子必须连接不同的原子或原子团
有顺反异构 无顺反异构
烯烃的命名> 烃的同分异构体
6≥c-c
a
C=
a
a
C b
d
d
a
b
a
b
a
b
a
结构 H C CH C—C H H C H
H
C=C
CH
名称 顺-2-丁烯 反-2-丁烯 物理性质 熔点/℃ -139.3 -105.4 沸点/℃ 4 1 相对密度 0.621 0.604 化学性质 化学性质基本相同
②顺反异构的类别a顺式结构:两个相同的原子或原子团排列
在双键的同一侧b 反式结构:两个相同的原子或原子团分别排
列在双键的两侧
③性质:顺反异构体的化学性质基本相同,物理性质有一定的差异
烯烃的命名 径的同分异构体
练一练
5、分子式为C H 2, 分子中具有3个甲基的烯烃共有(D)
A.2 种 B.3 种 C.4 种 D.5 种
6、某烯烃与H 加成后的产物如下图,则该烯烃的结构式可能有(C
)
A.1 种 B.2 种 C.3 种 D.4 种
CH — CH—CH—C(CH )
CH CH
7、下列各组有机物中,能形成顺反异构的是(A)
A.1,2- 二氯丙烯 B.2- 氯丙烯
C.1,1- 二氯丙烯 D.1- 丁烯
第二章烃
第二节烯烃炔烃
2.2.1烯烃
学习目标
1、掌 握乙烯的结构特点,会书写乙烯的分子式、结构式、结构简 式、电子式
2、认识乙烯能够发生加成反应和氧化反应,熟 悉乙烯发生加成反 应时的断键和成键情况
3、掌握乙烯的制备方法及实验注意事项
4、认识烯烃的结构特征,掌握烯烃的物理性质的变化规律,熟 知 烯烃的化学性质
5、掌握烯烃的命名,学 会烯烃同分异构体的找法并认识烯烃的顺 反异构
是合成纤维、合成橡胶、合成塑料(聚乙烯及聚氯乙烯)、合成 乙醇(酒精)的基本化工原料,也用于制造氯乙烯、苯乙烯、环 氧乙烷、醋酸、乙醛和炸药等,也可用作水果和蔬菜的催熟剂
1、为什么乙烯的产量可以用来衡量一个国家的石油化工
思考
水平
分子式 电子式 结构式 结构简式 球棍模型
空间充 填模型
C H H H H:C::C:H H H H—C=C—H CH =CH
结构 特点 分子中碳原子采取 碳原子与碳原子间 分子中所有原子都 sp2杂 化 ,碳原子与氢原子间均形成单键(σ键), 以双键相连(1个σ键,1个π键),键角约为120°, 处于同一平面内
【 意】键长:0.5C-C
1、乙烯分子的组成与结构
乙烃的编构 乙烃的性质
一、乙烯
类型 结构式 结构特点
共线、共面情况
乙烯型 H 120°,H H HH 乙烯的结构是平面形,2个碳 原子和4个氢原子共平面 直接连在双键碳原子上的原 子和两个双键碳原子共平面 平面形结 构
所有原子共平面,与碳碳双 键直接相连的4个原子与2个 碳原子共平面
规 律 :有机物分子结构中每出现1个碳碳双键,则整个分子中至少有6 个原子共面 分析丙烯(CH CH=CH )原子共面情况 情况分 析 ⑦H H ①H ⑥ ④ ⑤ C= =C H ②H H③ 三个氢原子(①②③)和三个碳原子(④⑤⑥)六原子 一定共面。根据三角形规则(⑤C,⑥C,⑦H构成 三角形),⑦H也可能在这个平面上即:丙烯分子最 多7个原子共平面,至少有6个原子共平面
①乙烯分子中的碳原子价键没有全部被氢原子“饱和”,为不饱和碳原子(不全
形成单键的碳原子)
②“乙烯型”分子共线、共面问题
乙烃的编构 乙烃的性质
【几点强调】
①实验现象:火焰明亮且伴有黑烟(比甲烷要明亮),同时放出大量 的热
②原因: 产生黑烟是因为乙烯中碳的质量分数(85.7%)比较大,然 烧不完全产生的碳的小颗粒造成的;火焰明亮是由于碳微粒受灼热 成炽执状态而发光所致
③乙烯具有可燃性,点燃乙烯之前一定要检验乙烯纯度
①与氧气的燃烧反应:
化学方程式:C H +30
2、化学性质
乙圈的健质
(1)氧化反应
乙烯中的碳碳键、碳氢键全部破坏
乙烃的结构
2CO +2H O
点燃
(2)乙烯可使酸性高锰酸钾溶液褪色①反应方程式:5CH =CH + 12KMnO +18H SO -→ 10CO +12MnSO +6K SO +
28H O② 反应现象:酸性高锰酸钾溶液紫色褪去③反应机理:碳
碳双键易被酸性高锰酸钾溶液氧化,乙烯被氧化为CO , 高锰酸钾
溶液被还原为无色的Mn 用 高锰酸钾溶液可用于鉴别乙烷
和乙烯,但不能用于除去乙烷中的乙烯
乙烃的结构 乙屋的性质
为什么
实验过程
实验现象
将乙烯通入盛有溴的四氯化碳溶液 (或溴水)的试管中,观察现象
溴的四氯化碳溶液(或溴 水)褪色
乙橙的性质
(3)加成反应
Br—CH Br.
乙烃的结构
断键
Br Br
①反应的实质:乙烯分子双键中的一个键易于断裂,两个溴原子 分别加在两个价键不饱和碳原子上,生成了1,2—二溴乙烷.
②乙烯与溴加成的机理
乙屋的健质
1,2-二溴乙烷
乙烃的结构
成键
Br Br
Br
Br
③ 加成反应a .定义:有机物分子里不饱和的碳原子( 碳 碳 双键或碳碳 三 键 )跟其他原子或原子团直接结合生成新的化合物的反应,叫做加 成反应(有进无出)
b. 特点:断—(断双键中的一个键),加二(加两个原子或原子 团),只上不下。像“化合反应”
取代反应: 形式:有上有下,似置换
加成反应: 形式:只上不下,似化合
部位: C=C 或C三C或C=0
乙烃的结构 乙惨的健质
溴水
溴的CCl 溶液
反应现 象 褪色,褪色后溶液会分
褪色,褪色后溶液不分层
应用 鉴别乙烯和乙烷,除去乙烷中的乙烯气体,可以将 混合气体通过溴水的洗气瓶,但不能用溴的四氯化 碳溶液,因为乙烷能够溶于四氯化碳溶液中
乙烃的结构
④乙烯与溴水或溴的CCl 溶液反应现象的比较
乙耀的健质
⑤乙烯与其它加成试剂反应:H 、卤化氢、H O、卤素单质
CH =CH +H O 催化剂 CH CH OH (工业制乙醇)
加热、加压
CH =CH +C 一定条件 CH CI CH Cl(1,2-二氯乙烷)
CH =CH,+HC一定条件CH CH CI(氯乙烷)
乙烃的结构 乙惨的性质
催化剂
加热
CH CH (乙烷)
CH =CH +H
用C H 和HCl反应制取更好。
乙烷和Cl 发生的是取代 成物中除CH CH Cl外,还 l 、 C H Cl 、C H Cl 、C HCl5 、C Cl 、HCl ,生成物不纯,产率低。C H 和HCl 发生的是加成反应,无副反应,生成物只有CH CH Cl。
2、乙烯和二氧化硫使溴水褪色的原理相同吗
不同。SO 使溴水褪色是因为SO 将溴单质还原生成了 无色的HBr, 乙烯使溴水褪色是因为乙烯与溴单质发生 了加成反应生成了无色的二溴乙烷
1、用乙烷(CH CH ) 和Cl 取代可以制取氯乙烷(CH CH Cl), 用乙烯(C H ) 和HCl 加成也能制氯乙烷,两种方法哪种更好
制取物质,要求纯净,不含杂质
乙烃的结构 乙圈的健质
思考
a.乙烯分子自身发生加成反应,生成聚乙烯
CH,=CH +CH =CH +CH,=CH + 催化剂CH —
CH —CH —CH —CH —CH — ...
n CH =CH 催化剂。ECH —CH 子。(聚乙烯)
①聚乙烯是一种重要的塑料,如用作食品保鲜膜、水管材料等 。生成聚乙烯的这种反应我们称为聚合反应。 由 于n 的值可能 不同,聚合物都是混合物
乙烃的结构 乙屋的性质
(4)加聚反应
②聚合反应:由相对分子质量小的化合物分子(单体)相互结合成相对 分子质量大的聚合物(高分子化合物)的反应叫聚合反应。
由不饱和的相对分子质量小的单体分子以加成反应的形式结合成相 对分子质量大的高分子化合物的反应叫做加成聚合反应,简称加聚
反应
③生活中用来包装食品的塑料袋是聚乙烯(无毒),如果将乙烯分子中
的一个氢原子用氯原子代替,聚合后成为聚氯乙烯,它就不能用来 包装食品了,因为有毒。塑料在高温或长期光照情况下,容易老化
,变脆。反应如下:
乙烃的结构 乙烃的性质
聚氯乙烯(有毒)
④聚合反应中的单体、链节和聚合度菖a.单体:能合成高分子的 小分子物质称为单体b. 链节:高分子化合物中化学组成相同、可 重复的最小单位称为链节c. 聚合度:链节的数目n叫做聚合度, 由于n 不同因此高聚物都是混合物
乙烃的结构 乙怪的性质
思考:聚乙烯、聚氯乙烯等高分子化合物能使溴水褪色吗 聚乙烯、聚氯乙烯中不含C=C,故不能使溴水褪色。
-[CH -CH }n 聚乙烯
f CH -CH}n
-[CH -CH}nCH
Cl
nCH =CHCH
nCH =CHCl
⑤常见聚合反应
nCH =CH
催化剂
催化剂
聚丙烯
聚氯乙烯
乙烃的结构 乙隆的作质
催化剂
乙烃的结构 乙圈的健质
3、物理性质
乙烯为无色、稍有气味的气体,密度比空气的略 小,难溶于水(排
水法收集),易溶于四氯化碳等有机溶剂
4、乙烯的实验室制法以及工业制法
详见导学案
含有碳碳双键(可以是若干个双键)的烃类化合物
(2)官能团:名称为碳碳双键,结构简式为
C=C
(3)分类① 单烯烃:分子中含有一个碳碳双键/② 多烯烃:分子中含 有两个及以上碳碳双键 ③ 二烯烃:分子中含有二个
碳碳双键。二烯烃又可分为累积二烯烃、孤立二烯烃和共轭二烯烃 ;累积二烯烃的结构特点是双键连在一起;共轭二烯烃的结构特点 是单、双键交替排列;孤立二烯烃的结构特点是在二个双键之间相 隔二个或二个以上的单键
烯控的结构烯烃的性质 二烯烃
二、烯烃的结构与性质
1、烯烃及其结构
(1)烯烃:
CH =CH CH =CHCH CH =CHCH CH CH =CHCH CH CH
乙烯 丙烯 1-丁烯 1-戊烯
图2-3几种简单烯烃的结构简式和分子结构模型
烯烃只含有一个碳碳双键(单烯烃)时,其通式一般表示为C,H n(n ≥2)
燃程的结构 烯烃的性质 二烯烃
(4)通式:
烯烃 丙烯 1-丁烯
1-戊烯
分子式 C H C H
C H 0
结构简式 (键线式)
碳原子杂化类型
共价键类型(σ键 π 键 ) σ键和π键 σ键和π键
σ键和π键
烯程的结构 烯烃的性质 二烯烃
(5)烯烃同系物的结构特点
(1)状态:一般情况下,2~4个碳原子烯烃(烃)为气态,5~16个碳 原子为液态,16个碳原子以上为固态(2)溶解性:烯烃不 溶于水,
易溶于有机溶剂 (3)熔沸点 :随着碳原子数增多(范德华力增大),熔 沸点增高;分子式相同的烯烃,支链越多,熔沸点越低(4)密 度:随 着碳原子数的递增,密度逐渐增加;烯烃的相对密度都小于水的密
度
烯烃的结构 烯屋的候质 二烯烃
2、物理性质
(类似于烷烃)
a.与氧气的然烧反应通式:
C,H n+(3n/2)O 点燃→ nCO +nH O
现象:火焰明亮,伴有黑烟(碳原子越多,燃烧越不充分)
b. 能 使酸性KMnO 溶液褪色:
将烯烃通入酸性高锰酸钾溶液中会使溶液的颜色变浅直至消
不一定生成二氧化碳)
烯烃的结构 烯屋的候质 二烯烃
3、化学性质
烯烃的官能团是碳碳双键: , 它决定了烯烃的主要化学
性 质,化学性质类似于乙烯
(1)氧化反应
烯烃被
氧化的
部分
氧化产
物
二氢成气 一氢成酸 无氢成酮
烯烃的结构 烯怪的使质 二烯烃
R
R
烯烃被酸性KMnO 溶液氧化产物规律
【几点强调】
—C—OH(羧酸)
(酮)
CH =
RCH=
②加成反应:(以丙烯为例)
a.与溴水加成:CH =CHCH +Br →CH BrCHBrCH (1,2 — 二溴丙烷)
与.与 加l加成成:C: C + I化 CH CH CH (丙烷)
CH CH CH Cl(次要)
c.与H O加成:CH =CHCH +H O一化剂→CH CH(OH)CH (主 要)/CH CH CH OH(次要)
加成的原则
马氏规则:凡是不对称结构的烯烃和酸(HX) 加成时,酸的负基(X一)
主要加到含氢原子较少的双键碳原子上,称为马尔科夫尼科夫规则 ,也就是马氏规则(氢加氢多,卤加氢少)
C
H
H
H
H
H
H
H
烯烃的结构 烯遏的使质 二烯烃
③加聚反应(C=C 变成C-C,某烯变成聚某烯):
烯烃的结构 烯澄的候质
b.2-丁烯加聚生成聚2-丁烯:
a.丙烯加聚生成聚丙烯:
二烯烃
a.CH = CH -CH = CH 中有两个双键,与足量溴水反应时,两 个双键全部被加成CH =CH-CH=CH 与溴水1:2加成:
CH =CH-CH=CH +2Br →CH BrCHBrCHBrCH Br
(1)概念:分子中含有两个碳碳双键的烯烃
(2)链状二烯烃的通式:CnH n-2(n≥3)
(3)常见的二烯烃:CH =CH-CH =CH (1,3—丁二烯)(共轭二烯烃)
(4)化学性质:由于含有双键,二烯烃跟烯烃性质相似,也能 发生加成反应、氧化反应和加聚反应
①1,3—丁二烯(CH =CHCH=CH ) 的 加成反应
烯烃的结构 烯烃的性质 二烯烃
4、二烯烃
b.CH =CH-CH=CH 中有两个双键,若CH =CH-CH=CH 与溴
水1:1反应时(溴水不足)
I.1, 2— 加成:若两个双键中的一个比较活泼的键断裂,溴 原子 连接在1、2两个碳原子上
烯烃的结构烯烃的性质 二烯屋
3,4-二溴-1-丁烯
烯烃的结构烯烃的性质 二烯烃
Ⅱ.1,4 — 加成:两个双键一起断裂,同时又生成一个新的双 键,溴原子连接在1、4两个碳原子上
Br Br
CH == CHCCH=CH CH —CH=CH—CH
1,4-二溴-2-丁烯
【 注 意 】
般的,在温度较高的条件下发生1,4-加成,在温度较低的条件 下发生1,2-加成),既1,2-加成和1,4-加成是竞争反应,哪种反 应占优势取决于反应条件。
烯烃的结构
Ⅲ.1,2-加成和1,4-加成机理
烯烃的性质 二烯烃
催化剂
n CH =CH—CH=CH 十 CH —CH=CH—CH 于n
(3)天然橡胶的合成(异戊二烯加聚成聚异戊二烯):
(2)1,3—丁二烯烃的加聚反应:
烯烃的结构>烯烃的性质 二烯烃
烯烃的结构 烯烃的性质
(4)乙烯与1,3-丁二烯发生的双烯烃加成反应
1,3-丁二烯 乙 烯 环已烯
二烯燈
练一练
1、由乙烯的结构和性质推测丙烯(CH =CH—CH ) 的结构或性质 正确的是(C)
A. 不能使酸性高锰酸钾溶液褪色 B. 不能发生加聚反应
C. 能使溴的四氯化碳溶液褪色 D. 与 HCl在一定条件下
能加成并只得到一种产物
2、柠檬烯具有良好的镇咳、祛痰、抑菌作用,其结构如图所示。
下列关于柠檬烯的说法正确的是(B )
A.1 mol柠檬烯只能与1 mol H 反应
B. 能发生取代反应和加成反应
C. 属于乙烯的同系物
D. 不能使酸性高锰酸钾溶液褪色
烯烃的命名与烷烃的命名相似,即遵循最长、最多、最近、最小 最简原则。但不同点是主链必须含有双键,编号时起始点必须离双 键最近
(1)选主链,称某烯:将含有双键的最长碳链作为主链,并按主 链中所含碳原子数称为“某烯”(下面虚线框内为主链)
三、烯烃的命名
1、命名方法
烯烃的命名 烯烃的同分异构体
2、命名步骤
(2)编号位,定支链:
从距离双键最近的一端给主链上的碳原子依次编号,使双键碳
原子的编号为最小,以确定双键、支链的位次
6 7
CH — CH
3 4 5
CH—CH—CH+CH
CH CH
CH
2
CH CH C
爆径的命名>烯烃的同分异构体
烯径的命名 烯烃的同分异构体
(3)按规则,写名称:
取代基位次—取代基名称—双键位次—某烯
①用阿拉伯数字标明双键的位置(只需标明双键碳原子编号较
小的数字)
5,5,6—三甲基—2—庚烯
烯烃的命名 烯烃的同分异构体
②若为多烯烃(炔烃),则用大写数字“二、三…”在烯的名 称前表示双键的个数
CH
CH —C=CH—CH=CH—CH 3
2—甲基—2,4—己二烯
6 7
CH CH — CH
2 3 4 5
CH —CH 十 C— CH一 CH—-CH十 CH
主链名称
双键位置
一取代基名称 取代基数目 取代基位置
CH
乙基-1- 庚烯
烯烃的命名 烯烃的同分异构体
烯烃的名称及名称中的各个部分的意义
CH
三 甲基
—
3,4,5
①给烯烃命名时,最长的碳链不一定是主链
② 烯烃命名时应从距离双键最近的一端开始编号,而不能以支链 为依据
燃烃的命名 烯烃的同分异构体
【几点强调】
练一练
3、某有机物的键线式为 ,它的名称是(A)
A.4- 甲基-2-己烯 B.4- 甲基-2-戊烯
C.3- 甲基-2-己烯 D.4- 甲基-3-己烯
4、某烯烃的结构简式如下,有甲、乙、丙、丁四位同学分别将其 命名为:2-甲基-4-乙基-1-戊烯;2-异丁基-1-丁烯;2,4-二甲基 -3-己烯;4-甲基-2-乙基-1-戊烯。下列对四位同学的命名判断正 确的是(D)
A. 甲的命名主链选择是错误的 B. 乙的命名编号是错误的
C. 丙的命名主链选择是正确的 D. 丁的命名是正确的
单烯烃与同碳数的环烷烃互为同分异构体。
(2)碳架异构与碳碳双键的位置异构:
书写烯烃的同分异构体时,先写碳架异构,再写碳碳双键的位置 异构。
四、烯烃同分异构体的找法
烯烃的命名 第烃的同分异构体
1、烯烃同分异构的分类
(1)官能团异构:
通式 C,H2n 同分异构体 烯烃(n≥2)
环烷烃(n≥3)
方法 单键变双键,要求相邻的两个 碳上必须各有一个氢原子(箭头 是指将单键变成双键)
减环法:先写出最大的碳环,侧链 先一个侧链,再两个侧链
以 “ C H o ” 为例 C一 C 中间碳原子没有氢原子)
烯烃的命名 第烃的同分异构体
(3)顺反异构现象由于碳碳双键连接的原子或原子团不能绕键轴旋转 ,会导致其空间排列方式不同,产生顺反异构 现象
①顺反异构形成的条件a.分子中具有碳碳双键结构b.组成双键的
每个碳原子必须连接不同的原子或原子团
有顺反异构 无顺反异构
烯烃的命名> 烃的同分异构体
6≥c-c
a
C=
a
a
C b
d
d
a
b
a
b
a
b
a
结构 H C CH C—C H H C H
H
C=C
CH
名称 顺-2-丁烯 反-2-丁烯 物理性质 熔点/℃ -139.3 -105.4 沸点/℃ 4 1 相对密度 0.621 0.604 化学性质 化学性质基本相同
②顺反异构的类别a顺式结构:两个相同的原子或原子团排列
在双键的同一侧b 反式结构:两个相同的原子或原子团分别排
列在双键的两侧
③性质:顺反异构体的化学性质基本相同,物理性质有一定的差异
烯烃的命名 径的同分异构体
练一练
5、分子式为C H 2, 分子中具有3个甲基的烯烃共有(D)
A.2 种 B.3 种 C.4 种 D.5 种
6、某烯烃与H 加成后的产物如下图,则该烯烃的结构式可能有(C
)
A.1 种 B.2 种 C.3 种 D.4 种
CH — CH—CH—C(CH )
CH CH
7、下列各组有机物中,能形成顺反异构的是(A)
A.1,2- 二氯丙烯 B.2- 氯丙烯
C.1,1- 二氯丙烯 D.1- 丁烯
