2.1共价键+高二下化学人教版(2019)选择性必修2(共45张PPT)
文档属性
| 名称 | 2.1共价键+高二下化学人教版(2019)选择性必修2(共45张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-11 20:45:42 | ||
图片预览







文档简介
(共45张PPT)
第二章分子结构与性质
第一节共价键
2.1.1共价键
学习目标
1、熟 知共价键的概念与形成,知道共价键的特征——具有饱和 性和方向性
2、能够从不同的角度对共价键分类,会分析σ键和π键的形成及 特点,熟练判断分子中σ键和π键的存在及个数。
3、知 道键能、键长、键角等键参数的概念,能用键参数说明简单 分子的某些性质
1、诺贝尔物理学奖得主理查德 ·费曼曾说过,假如发生了 大灾难,人类全部的科学知识只能概括为一句话传诸后世, 那么这句话应该是“万物皆由原子构成”,那原子又是如 何给构成物质了
思考
理查德 ·费曼
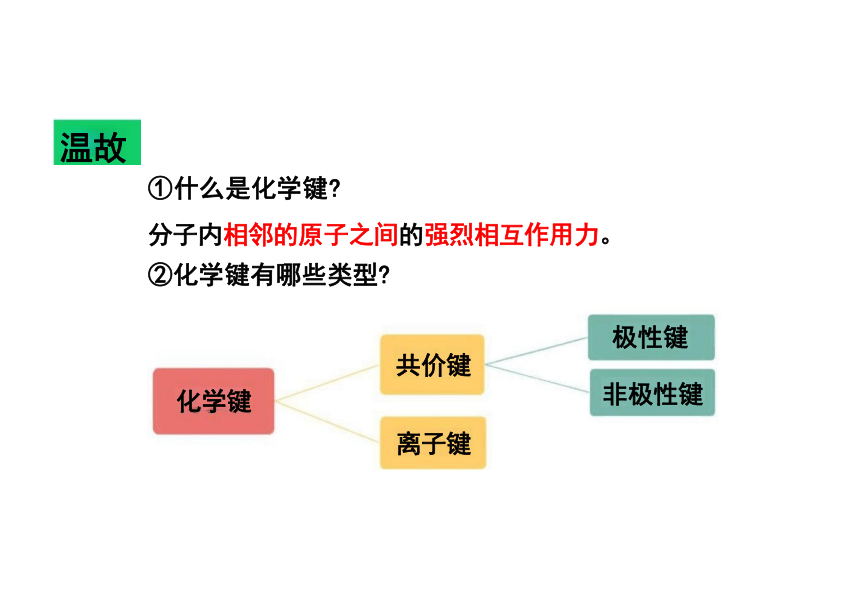
①什么是化学键
分子内相邻的原子之间的强烈相互作用力。
②化学键有哪些类型
极性键
共价键
非极性键
离子键
温故
化学键
比较 类型 离子键
共价键
概念 阴、阳离子间通过静电 作用所形成的化学键
原子间通过共用电子对 所形成的化学键。
成键微粒 阴、阳离子
原子
成键条件 得失电子
电子对共用
存在 (举例) 离子化合物 如NaCl、铵盐
非金属单质:H
共价化合物:HCl 某些离子化合物
分类
极性键和非极性键
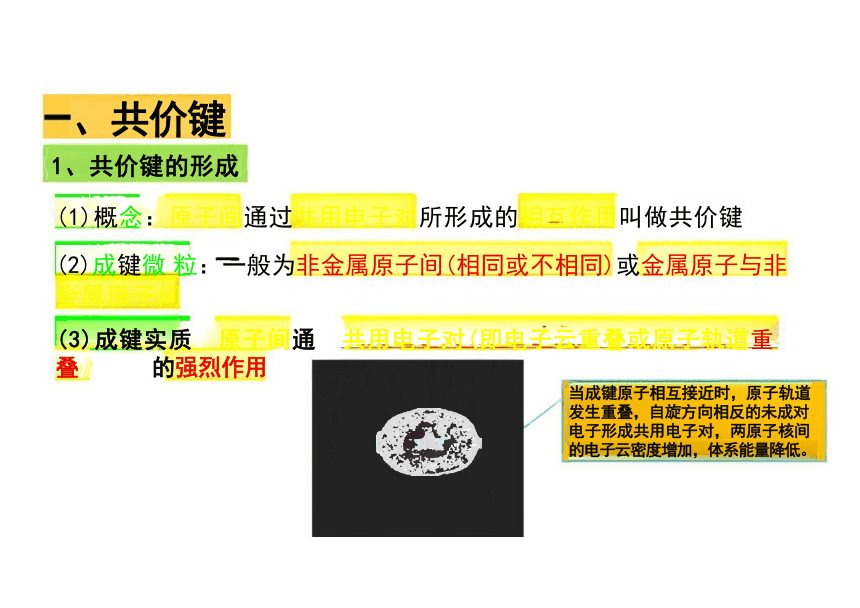
、共价键
1、共价键的形成
(1)概念:原子间通过共用电子对所形成的相互作用叫做共价键
(2)成键微 粒:一般为非金属原子间(相同或不相同)或金属原子与非 金属原子间
(3)成键实质:原子间通 共用电子对(即电子云重叠或原子轨道重 叠) 产 生的强烈作用
当成键原子相互接近时,原子轨道 发生重叠,自旋方向相反的未成对 电子形成共用电子对,两原子核间 的电子云密度增加,体系能量降低。
非金属元素的原子最外层未达到饱和状态( 即未达8电子稳定结 构),相互间通过共用电子对形成共价键。
①同种或不同种非金属元素的原子的结合②部分电负性之差小
于1.7的金属元素的原子和非金属原子结合(如 :AIC
BeCz)
(5)存在范围①非金属单质分子(稀有气体除外) , 如 :H 、O 、N Cl ②非金属形成的化合物中,如:CO 、H O、 H SO4 、NH 、CH ③ 部分离子化合物中,
如 :NaOH、Na,SO4、NH NO ④某些 金属和非金属形成的化合物中,如:AICl 、BeCl
(4)成键条件
共价键成键的原因是原子通过共用电子对,各原子最外层电子一 般都能达到饱和状态( 8个电子,仅H 是2个)两原子核都吸引共用 电子对,使之处于平衡状态,原子形成分子后,体系的总能量隆
低
(7)共价键表示方法①用电子式表示:用小黑点(或×)表示最外层
电子,如:H:H② 用结构式表示:用一根短线来表示一对共用 电子对,如:H-H
(6)成键的原因
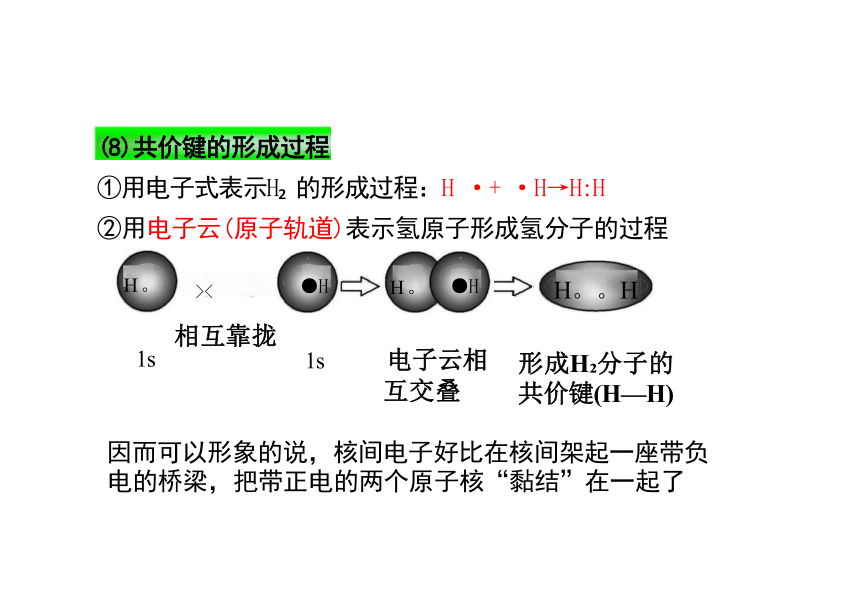
①用电子式表示H 的形成过程:H ·+ ·H→H:H
②用电子云(原子轨道)表示氢原子形成氢分子的过程
H 。 >< ●H H 。 ●H H。。H
因而可以形象的说,核间电子好比在核间架起一座带负 电的桥梁,把带正电的两个原子核“黏结”在一起了
形成H 分子的 共价键(H—H)
(8)共价键的形成过程
相互靠拢
1s
电子云相 互交叠
1s
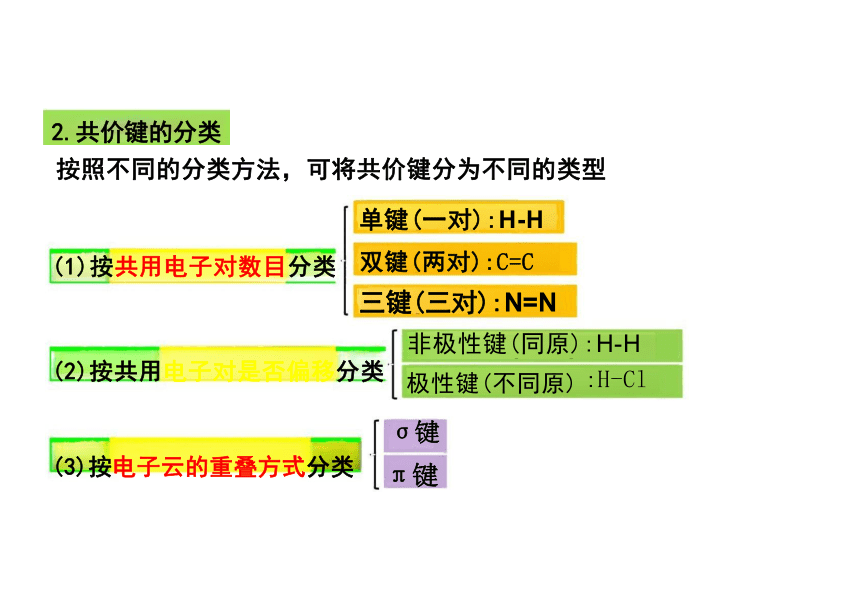
单键(一对):H-H
(1)按共用电子对数目分类 双键(两对):C=C
三键(三对):N=N
非极性键(同原):H-H
(2)按共用电子对是否偏移分类 极性键(不同原) :H-Cl
σ键
(3)按电子云的重叠方式分类 π键
按照不同的分类方法,可将共价键分为不同的类型
2.共价键的分类
练一练
1、下列说法正确的是( B )
A. 含有共价键的化合物一定是共价化合物
B. 由共价键形成的分子一定是共价化合物
C. 分子中只有共价键的化合物一定是共价化合物
D. 只有非金属原子间才能形成共价键
2、已 知 :X、Y、Z、W 四种元素原子的电负性数值。你认为上 述四种元素中,最容易形成共价键的是( B )
A.X 与Y B.X 与W C.Y 与Z D.Y 与W
元素 X Y Z
W
电负性 2.5 3.5 1.2
2.4
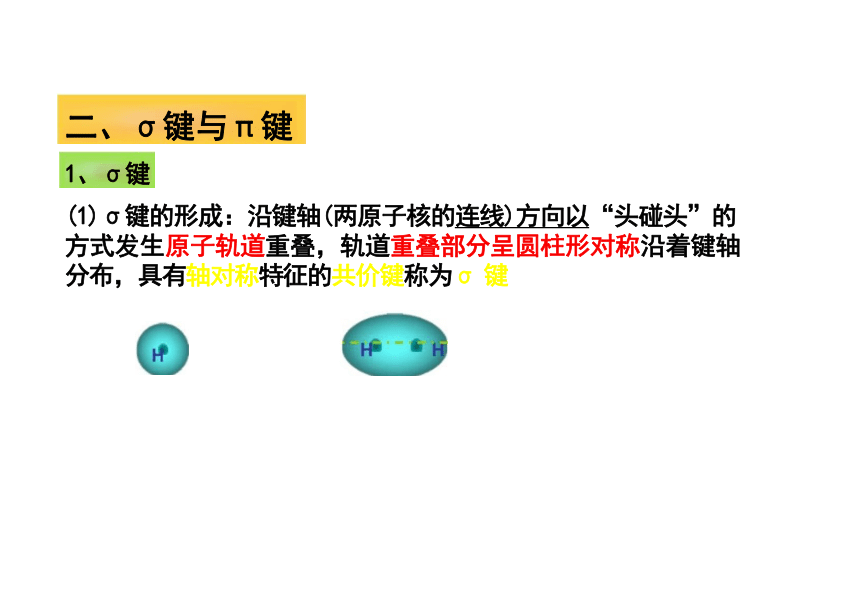
(1)σ键的形成:沿键轴(两原子核的连线)方向以“头碰头”的 方式发生原子轨道重叠,轨道重叠部分呈圆柱形对称沿着键轴 分布,具有轴对称特征的共价键称为σ 键
二、σ键与π键
1、σ键
根据成键电子原子轨道的不同,σ键可分为s-s σ键、s- p σ键、 p-p σ键
①s-s σ键:两个成键原子均提供s轨道形成的共价键。
口
H 中的共价键是由两个氢原子提供的未成对电子的1s原子轨道
H-H 的s-s σ键的形成
(2)σ键的类型
H
HCl 中的共价键是由氢原子提供的未成对电子的1s原子轨道和氯原子提供的 未成对电子的3p 原子轨道重叠形成的。
②s-p σ键:两个成键原子分别提供s轨道和p 轨道形成的共价键
- CB
H CI H CI
H-Cl 的s-pσ键的形成
H
HCI
Cl 中的共价键是由2个氯原子各提供1个未成对电子的3p原子轨道重叠形成的。
③p-p σ键 :两个成键原子均提供p轨道形成的共价键
CI Cl Cl Cl
Cl-Cl的p-pσ键的形成
未成对电子的原子轨道相互靠拢
原子轨道相互重叠
形成的共价单键
Cl
(3)σ键的特征①以形成化学键的两原子核的连线为轴作旋转操作 , 共价键电子云的图形不变,这种特征称为轴对称
② 形成σ键的原子轨道重叠程度较大,故σ键有较强的稳定性
③以形成σ键的两原子核的连线为轴,任何一个原子均可以旋转, 旋转时并不破坏o键的结构(化学单键可以旋转的原因)。
s σ 键
s-pσ 键
Px-P,σ 键
σ 键
(4)σ键的存在
共价单键为σ键;共价双键和共价三键中存在一个σ键
H·-> <一 ·H->H··H-> H··H
H—H的s-s σ键的形成
H—Cl的s-pσ 键的形成
Cl Cl Cl Cl Cl
Cl—Cl的p-pσ键的形成
分 子 式 乙烷
乙炔
球棍模型
比例模型
比例模型
2、观察乙烷、乙烯和乙炔的分子结构,它们的分子中 只有σ键
思考
氮分子的2个px 单电子沿着x-x 轴头碰头形成p-p σ键 后,由于py、 pz原子轨道垂直于px所在的平面,py 、pz 的单电子不可能再沿着 (y,z) 轴的方向以“头碰头”形成σ键,而只能是以“肩并肩 ”的 方式重叠,我们把这种以“肩并肩”的方式重叠的共价键叫π键
2、π键
两个原子的电子以”肩并肩“的方式发生原子轨道重叠,重叠
形成的电子云由两块形成,分别位于两原子核构成的平面两侧,
互为镜像而具有镜像对称特征的共价键称为π键
形成元键的电子称为π电子,p 轨道和p轨道形成π键的过程如 图所示:
(1)π键的形成
(2)π键的特征① 每个π键的电子云由两块组成,分别位于由两原子
核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它 们互为镜像,这种特征称为镜面对称②形成π键时原子轨道重叠程
度比形成σ键时小,元键没有σ键牢固(断键时先断键,后元断σ键)
③以形成π键的两个原子核的连线为轴,任意一个原子并不能单独 旋 转 ,元键不能旋转,若旋转则会破坏π键 (双键,三键不能转)
未成对电子的原子轨道相互靠拢
原子轨道相互重登
形成的π键
π键通常存在于双键或三键中
3、判断σ键、π键的一般规律
①共价单键为σ键;共价双键中有一个σ键,另一个是π键; 共价三键由一个σ键和两个元键构成
②s,p原子轨道均能形成σ键,分别为s-Sσ键,s-pσ键,p-pσ键
③只有p原子轨道能形成元键 ,p -pπ键
(3)π键的存在
乙烷 乙烯 乙炔
(1)观察乙烷、乙烯、乙炔的分子结构,它们的分子中的共价键分别由 几个δ键和几个π键构成
乙烷分子由7个σ键组成;乙烯分子由5个σ键和1个π键组成;乙炔分子 由3个σ键和2个π键组成
(2)乙烯和乙炔的化学性质为什么比乙烷活泼呢
乙烯的碳碳双键和乙炔的碳碳三键中分别含有1个和2个π键,π键原子 轨道重叠程度小,不稳定,容易断裂。而乙烷中没有π键,σ键稳定, 不易断裂
练一练
3、观察下图乙烷、乙烯和乙炔分子的结构回答
4 、 σ 键 与 π 键 的 比 较 键的类型比较项目 σ 键
π 键
概念 形成共价键的未成对电子的原子轨 道采取“头碰头 的方式重叠
形成共价键的未成对电子的原子轨道 采取“ 肩 并 肩 ”的方式重叠
原子轨道重叠方式 头碰头
肩并肩
原子轨道重叠部位 两原子核之间,在键轴处
键轴上方和下方,键轴处为零
原子轨道重叠程度 大
小
特征(电子云形状) 原子轨道重叠部分沿键轴呈轴对称
原子轨道重叠部分分别位于两原子核 构成平面的两侧,呈镜面对称
类型 s -S σ键、s-p- σ键、p =p σ键
p=p π键
键的性质 σ键可沿键轴自由旋转,不易断裂
π 键不能旋转,易断裂
键的强度 较大
较小
化学活泼性 不活泼
活泼
示意图 s-sc键00 s-po键-O00x P - p o 键 - O 0 0 OX
yy
p-pπ键
存在的情况 能单独存在,可存在于任何含共价 键的分子中
不能单独存在,必须与σ键共存,可 存在于双键和三键中(先σ后π)
【几点强调】
①s轨道与s轨道形成σ键时,电子并不是只在两核间运动,只是 电子在两核间出现的概率大②因s 轨道是球形的,故s 轨道与s 轨 道形成σ键时,无方向性。两 个s 轨道只能形成σ键,不能形成元
键
③两个原子间可以只形成σ键,但不能只形成元键④σ键和π键总 称价键轨道,但分子形成共价键时,先形成σ键后才形成π键
3、为什么只能有H 、HCl、Cl 等,不可能H 、H Cl和
思考
Cl 等
按照共价键的共用电子对理论,一个原子有几个未成对电子,便 可和几个自旋状态相反的电子配对成键,这就是共价键的“饱和 性”,如:H 原 子 、Cl 原子都只有一个未成对电子,因而只能形 成H 、HCl、Cl 分子,不能形成H 、H Cl、Cl 等分子,水的分 子式是H O 而不能是OH或H O 或HO 等
(1)用电子排布图表示HF分子中共用电子对的形成如下:
l s
三、共价键的特征
1、饱和性
H
2 p 个
原子轨道(电子云)重叠
l s 2 s
个
(2)氢、卤原子只有1个未成对电子,只形成1个共价键:-H、-
X(3)氧、硫原子有2个未成对电子,总是形成两个共价键:=0或- O-; 氮原子有3个未成对电子,与C、H等电负性比氮小的元素的 原子成键时总是形成三个共价键(共价键数=未成对电子数)
(4)共价键的饱和性决定了各种原子形成分子时相互结合的数量关 系(分子组成)
除s轨道是球形对称外,其他原子轨道在空间都具有一定的分布 特点。在形成共价键时,原子轨道重叠的愈多,电子在核间出现 的概率越大,所形成的共价键就越牢固,因此共价键将尽可能沿 着电子出现概率最大的方向形成,所以共价键具有方向性,如图
2、方向性
所示:
类型
方向性
s-S σ键
无
s-pσ键
有
p-p σ键
有
(1)共价键的方向性决定了分子的立体(空间)构型(2)并不是所 有共价键都具有方向性,如两个s电子形成共价键时就没有方
向性
练一练
4. σ键的常见类型有(1)s-s,(2)s-p,(3)p-p, 请指出下列分子σ 键所属类型:
A.HF S-p
B.NH s-p
C.F p-p
D.H
5. 下列关于共价键的说法不正确的是( D )
A .H S分子中两个共价键的键角接近90°的原因是共价键有方向性
B.N 分子中有1个σ键,两个π键
C. 两个原子形成共价键时至少有1个σ键
D. 在双键中,σ键的键能小于π键的键能
练一练
6.关于乙醇分子的说法正确的是( C )
A.分子中共含有8个极性键 B.分子中不含非极性键
C.分子中只含σ键 D.分子中含有1个π键
7.氰气的化学式为(CN)2, 结构式为NCCN, 性质与Cl 相似,下列
叙述不正确的是(BC)
A. 在一定条件下可发生加成反应
B. 分子中NC 键的键长大于C—C 键的键长
C. 分子只含有2个σ键和4个π键
D. 不 和NaOH 溶液反应
4、共价键的强弱用什么来衡量 我们如何用化学语言 来描述不同分子的空间结构和稳定性
CH CH CH OH C H CH COOH
思考
键能可通过实验测定,更多却是推算获得的,键能数据是平均值。
例如,断开CH 中的4个C—H, 所需能量并不相等,因此,CH 中的C—H 只能是平均值,而表2-1中的C—H键能是更多分子中 的C—H 键能的平均值。
气态分子中1_ mol 化学键解离(断键)成气态原子所吸收的能量。键 能通常是298.15 K、100 kPa条件下的标准值,单位是kJ ·mol-1
四、键参数—键能、键长与键角
1、键能
(1)概念
共价键的键能越大,共价键就越不容易断裂,成键原子间的结合
就越牢固。结构相似的分子,键能越大,分子越稳定
(3)共价键强弱的判断①由原子半径和共用电子对数判断:成键原 子的原子半径越小,共用电子对数越多,则共价键越牢固,含有该 共价键的分子越稳定②由键能判断:共价键的键能越大,共价键越 牢固,破坏共价键消耗的能量越大③由键长判断:共价键的键长越 短,共价键越牢固,破坏共价键消耗的能量越大④由电负性判断: 元素的电负性越大,该元素的原子对共用电子对的吸引力越大,形 成的共价键越稳定
(2)意义
(4)键能的应用①判断共价键的稳定性:键能越大,断开化学键时 需要的能量越多,化学键越稳定②判断分子的稳定性:结构相似 的分子中,共价键的键能越大,分子越稳定③判断化学反应的能
量变化:在化学反应中,旧化学键的断裂吸收能量,新化学键的 形成释放能量,因此反应焓变与键能的关系为△H= 反应物键能
△H<0 时,为放热反应;△H>0 时,为吸热反应
总和-生成物键能总和
键 键能(kJ ·mol-1) 键
键能(kJ ·mol-1)
H-H 436.0 N=N
418
F-F 157 N-0
176
Cl-Cl 242.7 N=0
607
Br-Br 193.7 O-0
142
I-I 152.7 O=0
497.3
C-C 347.7 C-H
413.4
C=C 615 O-H
462.8
C-O 351 N-H
390.8
C=0 745 H-F
568
N-N 193 H-Cl
431.8
①(同种元素)单键<双键<三键
②H-X 稳定性:H-I共价键的键长越短,往往键能越大,表明共价键越稳定
【注意】
键长通过晶体的X 射线衍射实验获得。
构成化学键的两个原子的核间距(不等于两原子半径之和), 因此 原子半径决定共价键的键长, 原子半径越小,共价键的键长越短
(2)键长与共价键的稳定性之间的关系
2、键长
(1)概念
(3)键长的应用①一般共价键的键长越短,键能越大,共价键越稳定, 分子越稳定,反之亦然
②键长的比较方法a .根据原子半径比较,同类型的共价键,成键 原子的原子半径越小,键长越短
如键长:H-I>H-Cl>H - F;Br -Br>Cl-Cl>F-F;Si-
Si>Si-C>C-Cb. 根据共用电子对数比较,相同的两个原子间形 成共价键时,单键键长>双键键长>三键键长
如键长:C-C>C=C>C=C
根据原子半径和共
用电子对数目判断
根据键能判断
根据键长判断
→共价键越牢固
共价键越牢固
原子半径越小
共用电子对数 越多
共价键越牢固
分子越稳定
共价键稳定
性强弱的判 断方法
键能越大
键长越短
由于C-H 和C-Cl 的键长不相等,CH 分子的空间结构为 正四面体形,而CH Cl 分子的空间结构是四面体形而不是 正四面体形。可见键长可以判断分子的空间结构
5、解 释CH 分子的空间结构为正四面体形,而CH Cl 分子的 空间结构是四面体形而不是正四面体形。
思考
在多原子分子中,两个相邻共价键之间的夹角
例如,三原子分子CO 的结构式为O=C=0, 它的键角为
180°,是一种直线型分子。 H O 分子中的H—0—H 键角是 105°,是一种V形(或称角形)分子。
105° 107°18'
H O: V形 NH : 三角锥形 (或称角形)
109°28′
CH : 正四面体形
3、键角
(1)概念:
180°
CO : 直线形
化学式 结构式 键角 空间结构
实例
CO O=C=0 180° 直线形
CS 、CH=CH
NH N HH 107° 三角锥形
NX
H O 0 H H 105° V形
H S
BF 120° 平面三角形
乙烯
CH 109°28' 正四面体形
CCl
在多原子分子中键角是 一 定的,这表明共价键具有方向性,因 此键角影响着共价分子的空间结构
常见分子的键角与分子空间结构
(2)应用
分子的稳定性
分子的性质
分子的空间构型一
【几点强调】
键参数对分子性质的影响
键能
键长 键角
决定
决定
决定
练一练
8. 原子间形成分子时,决定各原子相互结合的数量关系的是( B
)A. 共价键的方向性B. 共价键的饱和性C. 形成共价键原子的 大小D. 共价键的稳定性
9. 下列说法正确的是( )
A. 分子的结构是由键角决定的
B. 共价键的键能越大,共价键越牢固,由该键形成的分子越稳定 C.CF4、CCl4、CBr4、CI4 中C—X(X=F、Cl、Br、I) 的键长、 键角均相等
D.H20 分子中两个O—H的键角为180°
第二章分子结构与性质
第一节共价键
2.1.1共价键
学习目标
1、熟 知共价键的概念与形成,知道共价键的特征——具有饱和 性和方向性
2、能够从不同的角度对共价键分类,会分析σ键和π键的形成及 特点,熟练判断分子中σ键和π键的存在及个数。
3、知 道键能、键长、键角等键参数的概念,能用键参数说明简单 分子的某些性质
1、诺贝尔物理学奖得主理查德 ·费曼曾说过,假如发生了 大灾难,人类全部的科学知识只能概括为一句话传诸后世, 那么这句话应该是“万物皆由原子构成”,那原子又是如 何给构成物质了
思考
理查德 ·费曼
①什么是化学键
分子内相邻的原子之间的强烈相互作用力。
②化学键有哪些类型
极性键
共价键
非极性键
离子键
温故
化学键
比较 类型 离子键
共价键
概念 阴、阳离子间通过静电 作用所形成的化学键
原子间通过共用电子对 所形成的化学键。
成键微粒 阴、阳离子
原子
成键条件 得失电子
电子对共用
存在 (举例) 离子化合物 如NaCl、铵盐
非金属单质:H
共价化合物:HCl 某些离子化合物
分类
极性键和非极性键
、共价键
1、共价键的形成
(1)概念:原子间通过共用电子对所形成的相互作用叫做共价键
(2)成键微 粒:一般为非金属原子间(相同或不相同)或金属原子与非 金属原子间
(3)成键实质:原子间通 共用电子对(即电子云重叠或原子轨道重 叠) 产 生的强烈作用
当成键原子相互接近时,原子轨道 发生重叠,自旋方向相反的未成对 电子形成共用电子对,两原子核间 的电子云密度增加,体系能量降低。
非金属元素的原子最外层未达到饱和状态( 即未达8电子稳定结 构),相互间通过共用电子对形成共价键。
①同种或不同种非金属元素的原子的结合②部分电负性之差小
于1.7的金属元素的原子和非金属原子结合(如 :AIC
BeCz)
(5)存在范围①非金属单质分子(稀有气体除外) , 如 :H 、O 、N Cl ②非金属形成的化合物中,如:CO 、H O、 H SO4 、NH 、CH ③ 部分离子化合物中,
如 :NaOH、Na,SO4、NH NO ④某些 金属和非金属形成的化合物中,如:AICl 、BeCl
(4)成键条件
共价键成键的原因是原子通过共用电子对,各原子最外层电子一 般都能达到饱和状态( 8个电子,仅H 是2个)两原子核都吸引共用 电子对,使之处于平衡状态,原子形成分子后,体系的总能量隆
低
(7)共价键表示方法①用电子式表示:用小黑点(或×)表示最外层
电子,如:H:H② 用结构式表示:用一根短线来表示一对共用 电子对,如:H-H
(6)成键的原因
①用电子式表示H 的形成过程:H ·+ ·H→H:H
②用电子云(原子轨道)表示氢原子形成氢分子的过程
H 。 >< ●H H 。 ●H H。。H
因而可以形象的说,核间电子好比在核间架起一座带负 电的桥梁,把带正电的两个原子核“黏结”在一起了
形成H 分子的 共价键(H—H)
(8)共价键的形成过程
相互靠拢
1s
电子云相 互交叠
1s
单键(一对):H-H
(1)按共用电子对数目分类 双键(两对):C=C
三键(三对):N=N
非极性键(同原):H-H
(2)按共用电子对是否偏移分类 极性键(不同原) :H-Cl
σ键
(3)按电子云的重叠方式分类 π键
按照不同的分类方法,可将共价键分为不同的类型
2.共价键的分类
练一练
1、下列说法正确的是( B )
A. 含有共价键的化合物一定是共价化合物
B. 由共价键形成的分子一定是共价化合物
C. 分子中只有共价键的化合物一定是共价化合物
D. 只有非金属原子间才能形成共价键
2、已 知 :X、Y、Z、W 四种元素原子的电负性数值。你认为上 述四种元素中,最容易形成共价键的是( B )
A.X 与Y B.X 与W C.Y 与Z D.Y 与W
元素 X Y Z
W
电负性 2.5 3.5 1.2
2.4
(1)σ键的形成:沿键轴(两原子核的连线)方向以“头碰头”的 方式发生原子轨道重叠,轨道重叠部分呈圆柱形对称沿着键轴 分布,具有轴对称特征的共价键称为σ 键
二、σ键与π键
1、σ键
根据成键电子原子轨道的不同,σ键可分为s-s σ键、s- p σ键、 p-p σ键
①s-s σ键:两个成键原子均提供s轨道形成的共价键。
口
H 中的共价键是由两个氢原子提供的未成对电子的1s原子轨道
H-H 的s-s σ键的形成
(2)σ键的类型
H
HCl 中的共价键是由氢原子提供的未成对电子的1s原子轨道和氯原子提供的 未成对电子的3p 原子轨道重叠形成的。
②s-p σ键:两个成键原子分别提供s轨道和p 轨道形成的共价键
- CB
H CI H CI
H-Cl 的s-pσ键的形成
H
HCI
Cl 中的共价键是由2个氯原子各提供1个未成对电子的3p原子轨道重叠形成的。
③p-p σ键 :两个成键原子均提供p轨道形成的共价键
CI Cl Cl Cl
Cl-Cl的p-pσ键的形成
未成对电子的原子轨道相互靠拢
原子轨道相互重叠
形成的共价单键
Cl
(3)σ键的特征①以形成化学键的两原子核的连线为轴作旋转操作 , 共价键电子云的图形不变,这种特征称为轴对称
② 形成σ键的原子轨道重叠程度较大,故σ键有较强的稳定性
③以形成σ键的两原子核的连线为轴,任何一个原子均可以旋转, 旋转时并不破坏o键的结构(化学单键可以旋转的原因)。
s σ 键
s-pσ 键
Px-P,σ 键
σ 键
(4)σ键的存在
共价单键为σ键;共价双键和共价三键中存在一个σ键
H·-> <一 ·H->H··H-> H··H
H—H的s-s σ键的形成
H—Cl的s-pσ 键的形成
Cl Cl Cl Cl Cl
Cl—Cl的p-pσ键的形成
分 子 式 乙烷
乙炔
球棍模型
比例模型
比例模型
2、观察乙烷、乙烯和乙炔的分子结构,它们的分子中 只有σ键
思考
氮分子的2个px 单电子沿着x-x 轴头碰头形成p-p σ键 后,由于py、 pz原子轨道垂直于px所在的平面,py 、pz 的单电子不可能再沿着 (y,z) 轴的方向以“头碰头”形成σ键,而只能是以“肩并肩 ”的 方式重叠,我们把这种以“肩并肩”的方式重叠的共价键叫π键
2、π键
两个原子的电子以”肩并肩“的方式发生原子轨道重叠,重叠
形成的电子云由两块形成,分别位于两原子核构成的平面两侧,
互为镜像而具有镜像对称特征的共价键称为π键
形成元键的电子称为π电子,p 轨道和p轨道形成π键的过程如 图所示:
(1)π键的形成
(2)π键的特征① 每个π键的电子云由两块组成,分别位于由两原子
核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它 们互为镜像,这种特征称为镜面对称②形成π键时原子轨道重叠程
度比形成σ键时小,元键没有σ键牢固(断键时先断键,后元断σ键)
③以形成π键的两个原子核的连线为轴,任意一个原子并不能单独 旋 转 ,元键不能旋转,若旋转则会破坏π键 (双键,三键不能转)
未成对电子的原子轨道相互靠拢
原子轨道相互重登
形成的π键
π键通常存在于双键或三键中
3、判断σ键、π键的一般规律
①共价单键为σ键;共价双键中有一个σ键,另一个是π键; 共价三键由一个σ键和两个元键构成
②s,p原子轨道均能形成σ键,分别为s-Sσ键,s-pσ键,p-pσ键
③只有p原子轨道能形成元键 ,p -pπ键
(3)π键的存在
乙烷 乙烯 乙炔
(1)观察乙烷、乙烯、乙炔的分子结构,它们的分子中的共价键分别由 几个δ键和几个π键构成
乙烷分子由7个σ键组成;乙烯分子由5个σ键和1个π键组成;乙炔分子 由3个σ键和2个π键组成
(2)乙烯和乙炔的化学性质为什么比乙烷活泼呢
乙烯的碳碳双键和乙炔的碳碳三键中分别含有1个和2个π键,π键原子 轨道重叠程度小,不稳定,容易断裂。而乙烷中没有π键,σ键稳定, 不易断裂
练一练
3、观察下图乙烷、乙烯和乙炔分子的结构回答
4 、 σ 键 与 π 键 的 比 较 键的类型比较项目 σ 键
π 键
概念 形成共价键的未成对电子的原子轨 道采取“头碰头 的方式重叠
形成共价键的未成对电子的原子轨道 采取“ 肩 并 肩 ”的方式重叠
原子轨道重叠方式 头碰头
肩并肩
原子轨道重叠部位 两原子核之间,在键轴处
键轴上方和下方,键轴处为零
原子轨道重叠程度 大
小
特征(电子云形状) 原子轨道重叠部分沿键轴呈轴对称
原子轨道重叠部分分别位于两原子核 构成平面的两侧,呈镜面对称
类型 s -S σ键、s-p- σ键、p =p σ键
p=p π键
键的性质 σ键可沿键轴自由旋转,不易断裂
π 键不能旋转,易断裂
键的强度 较大
较小
化学活泼性 不活泼
活泼
示意图 s-sc键00 s-po键-O00x P - p o 键 - O 0 0 OX
yy
p-pπ键
存在的情况 能单独存在,可存在于任何含共价 键的分子中
不能单独存在,必须与σ键共存,可 存在于双键和三键中(先σ后π)
【几点强调】
①s轨道与s轨道形成σ键时,电子并不是只在两核间运动,只是 电子在两核间出现的概率大②因s 轨道是球形的,故s 轨道与s 轨 道形成σ键时,无方向性。两 个s 轨道只能形成σ键,不能形成元
键
③两个原子间可以只形成σ键,但不能只形成元键④σ键和π键总 称价键轨道,但分子形成共价键时,先形成σ键后才形成π键
3、为什么只能有H 、HCl、Cl 等,不可能H 、H Cl和
思考
Cl 等
按照共价键的共用电子对理论,一个原子有几个未成对电子,便 可和几个自旋状态相反的电子配对成键,这就是共价键的“饱和 性”,如:H 原 子 、Cl 原子都只有一个未成对电子,因而只能形 成H 、HCl、Cl 分子,不能形成H 、H Cl、Cl 等分子,水的分 子式是H O 而不能是OH或H O 或HO 等
(1)用电子排布图表示HF分子中共用电子对的形成如下:
l s
三、共价键的特征
1、饱和性
H
2 p 个
原子轨道(电子云)重叠
l s 2 s
个
(2)氢、卤原子只有1个未成对电子,只形成1个共价键:-H、-
X(3)氧、硫原子有2个未成对电子,总是形成两个共价键:=0或- O-; 氮原子有3个未成对电子,与C、H等电负性比氮小的元素的 原子成键时总是形成三个共价键(共价键数=未成对电子数)
(4)共价键的饱和性决定了各种原子形成分子时相互结合的数量关 系(分子组成)
除s轨道是球形对称外,其他原子轨道在空间都具有一定的分布 特点。在形成共价键时,原子轨道重叠的愈多,电子在核间出现 的概率越大,所形成的共价键就越牢固,因此共价键将尽可能沿 着电子出现概率最大的方向形成,所以共价键具有方向性,如图
2、方向性
所示:
类型
方向性
s-S σ键
无
s-pσ键
有
p-p σ键
有
(1)共价键的方向性决定了分子的立体(空间)构型(2)并不是所 有共价键都具有方向性,如两个s电子形成共价键时就没有方
向性
练一练
4. σ键的常见类型有(1)s-s,(2)s-p,(3)p-p, 请指出下列分子σ 键所属类型:
A.HF S-p
B.NH s-p
C.F p-p
D.H
5. 下列关于共价键的说法不正确的是( D )
A .H S分子中两个共价键的键角接近90°的原因是共价键有方向性
B.N 分子中有1个σ键,两个π键
C. 两个原子形成共价键时至少有1个σ键
D. 在双键中,σ键的键能小于π键的键能
练一练
6.关于乙醇分子的说法正确的是( C )
A.分子中共含有8个极性键 B.分子中不含非极性键
C.分子中只含σ键 D.分子中含有1个π键
7.氰气的化学式为(CN)2, 结构式为NCCN, 性质与Cl 相似,下列
叙述不正确的是(BC)
A. 在一定条件下可发生加成反应
B. 分子中NC 键的键长大于C—C 键的键长
C. 分子只含有2个σ键和4个π键
D. 不 和NaOH 溶液反应
4、共价键的强弱用什么来衡量 我们如何用化学语言 来描述不同分子的空间结构和稳定性
CH CH CH OH C H CH COOH
思考
键能可通过实验测定,更多却是推算获得的,键能数据是平均值。
例如,断开CH 中的4个C—H, 所需能量并不相等,因此,CH 中的C—H 只能是平均值,而表2-1中的C—H键能是更多分子中 的C—H 键能的平均值。
气态分子中1_ mol 化学键解离(断键)成气态原子所吸收的能量。键 能通常是298.15 K、100 kPa条件下的标准值,单位是kJ ·mol-1
四、键参数—键能、键长与键角
1、键能
(1)概念
共价键的键能越大,共价键就越不容易断裂,成键原子间的结合
就越牢固。结构相似的分子,键能越大,分子越稳定
(3)共价键强弱的判断①由原子半径和共用电子对数判断:成键原 子的原子半径越小,共用电子对数越多,则共价键越牢固,含有该 共价键的分子越稳定②由键能判断:共价键的键能越大,共价键越 牢固,破坏共价键消耗的能量越大③由键长判断:共价键的键长越 短,共价键越牢固,破坏共价键消耗的能量越大④由电负性判断: 元素的电负性越大,该元素的原子对共用电子对的吸引力越大,形 成的共价键越稳定
(2)意义
(4)键能的应用①判断共价键的稳定性:键能越大,断开化学键时 需要的能量越多,化学键越稳定②判断分子的稳定性:结构相似 的分子中,共价键的键能越大,分子越稳定③判断化学反应的能
量变化:在化学反应中,旧化学键的断裂吸收能量,新化学键的 形成释放能量,因此反应焓变与键能的关系为△H= 反应物键能
△H<0 时,为放热反应;△H>0 时,为吸热反应
总和-生成物键能总和
键 键能(kJ ·mol-1) 键
键能(kJ ·mol-1)
H-H 436.0 N=N
418
F-F 157 N-0
176
Cl-Cl 242.7 N=0
607
Br-Br 193.7 O-0
142
I-I 152.7 O=0
497.3
C-C 347.7 C-H
413.4
C=C 615 O-H
462.8
C-O 351 N-H
390.8
C=0 745 H-F
568
N-N 193 H-Cl
431.8
①(同种元素)单键<双键<三键
②H-X 稳定性:H-I
【注意】
键长通过晶体的X 射线衍射实验获得。
构成化学键的两个原子的核间距(不等于两原子半径之和), 因此 原子半径决定共价键的键长, 原子半径越小,共价键的键长越短
(2)键长与共价键的稳定性之间的关系
2、键长
(1)概念
(3)键长的应用①一般共价键的键长越短,键能越大,共价键越稳定, 分子越稳定,反之亦然
②键长的比较方法a .根据原子半径比较,同类型的共价键,成键 原子的原子半径越小,键长越短
如键长:H-I>H-Cl>H - F;Br -Br>Cl-Cl>F-F;Si-
Si>Si-C>C-Cb. 根据共用电子对数比较,相同的两个原子间形 成共价键时,单键键长>双键键长>三键键长
如键长:C-C>C=C>C=C
根据原子半径和共
用电子对数目判断
根据键能判断
根据键长判断
→共价键越牢固
共价键越牢固
原子半径越小
共用电子对数 越多
共价键越牢固
分子越稳定
共价键稳定
性强弱的判 断方法
键能越大
键长越短
由于C-H 和C-Cl 的键长不相等,CH 分子的空间结构为 正四面体形,而CH Cl 分子的空间结构是四面体形而不是 正四面体形。可见键长可以判断分子的空间结构
5、解 释CH 分子的空间结构为正四面体形,而CH Cl 分子的 空间结构是四面体形而不是正四面体形。
思考
在多原子分子中,两个相邻共价键之间的夹角
例如,三原子分子CO 的结构式为O=C=0, 它的键角为
180°,是一种直线型分子。 H O 分子中的H—0—H 键角是 105°,是一种V形(或称角形)分子。
105° 107°18'
H O: V形 NH : 三角锥形 (或称角形)
109°28′
CH : 正四面体形
3、键角
(1)概念:
180°
CO : 直线形
化学式 结构式 键角 空间结构
实例
CO O=C=0 180° 直线形
CS 、CH=CH
NH N HH 107° 三角锥形
NX
H O 0 H H 105° V形
H S
BF 120° 平面三角形
乙烯
CH 109°28' 正四面体形
CCl
在多原子分子中键角是 一 定的,这表明共价键具有方向性,因 此键角影响着共价分子的空间结构
常见分子的键角与分子空间结构
(2)应用
分子的稳定性
分子的性质
分子的空间构型一
【几点强调】
键参数对分子性质的影响
键能
键长 键角
决定
决定
决定
练一练
8. 原子间形成分子时,决定各原子相互结合的数量关系的是( B
)A. 共价键的方向性B. 共价键的饱和性C. 形成共价键原子的 大小D. 共价键的稳定性
9. 下列说法正确的是( )
A. 分子的结构是由键角决定的
B. 共价键的键能越大,共价键越牢固,由该键形成的分子越稳定 C.CF4、CCl4、CBr4、CI4 中C—X(X=F、Cl、Br、I) 的键长、 键角均相等
D.H20 分子中两个O—H的键角为180°
