1.2反应热的计算 高二上化学人教版(2019)选择性必修1(共35张PPT)
文档属性
| 名称 | 1.2反应热的计算 高二上化学人教版(2019)选择性必修1(共35张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-11 20:46:35 | ||
图片预览






文档简介
(共35张PPT)
第一章化学反应的热效应
第二节反应热的计算
1.2.1 盖斯定律及运用
学习目标
1 .知道盖斯定律的内容,能用盖斯定律进行有关反应热的简单计算
2. 学会有关反应热计算的方法技巧,进一步提高化学计算的能力
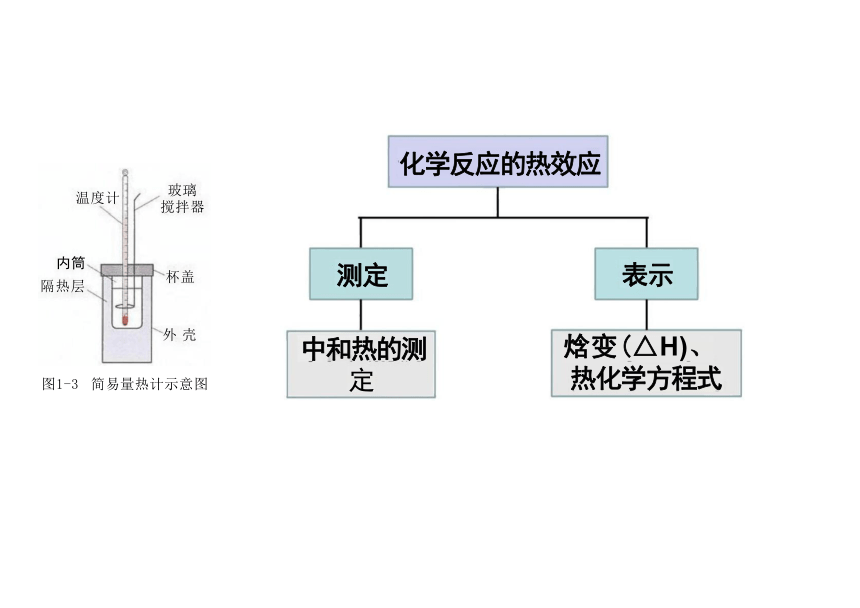
化学反应的热效应
表示
焓变(△H)、 热化学方程式
玻璃 搅拌器
内筒
隔热层
外 壳
测定
中和热的测
定
图1-3 简易量热计示意图
温度计
杯盖
否。
有些反应的产品不纯(有副反应发生),
如甲烷的不完全燃烧,大多数有机反应;
有些反应进行得很慢或太快,如煤炭,石油,钻石的形成或爆炸; 有些反应不容易直接发生,如石墨和氢气生成甲烷的反应。
1、利用热量计,我们可以测量中和反应热,说明中和反应 反应热是可以直接测量的,那么是否所有的反应热都可以直 接测量呢
思考
1840年俄国化学家盖斯为了解决这一问题依
据能量守恒定律,通过大量的实验证明了化
学反应的焓变与化学反应的过程没有关系, 只与反应物和生成物的始末状态有关,这 一
定律称之为盖斯定律。
2、能否利用一些已知的反应热来计算一些无法直 接测定的反应热呢
思考
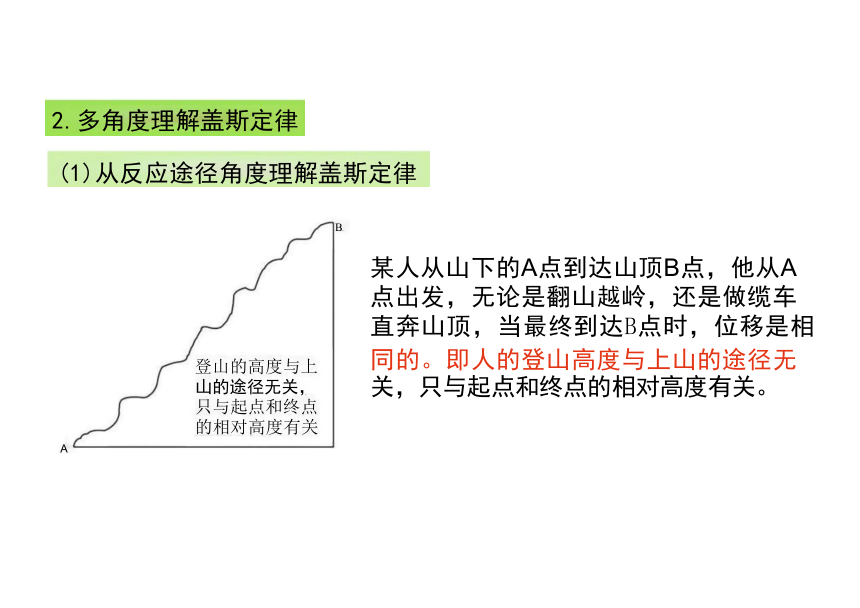
一个化学反应(在相同条件下),不管是一步完成还是分几步完成
的,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应 的途径无关
一.盖斯定律
1.内容
2.特点
某人从山下的A点到达山顶B点,他从A 点出发,无论是翻山越岭,还是做缆车 直奔山顶,当最终到达B点时,位移是相
同的。即人的登山高度与上山的途径无
关,只与起点和终点的相对高度有关。
(1)从反应途径角度理解盖斯定律
登山的高度与上 山的途径无关, 只与起点和终点 的相对高度有关
2.多角度理解盖斯定律
A
B
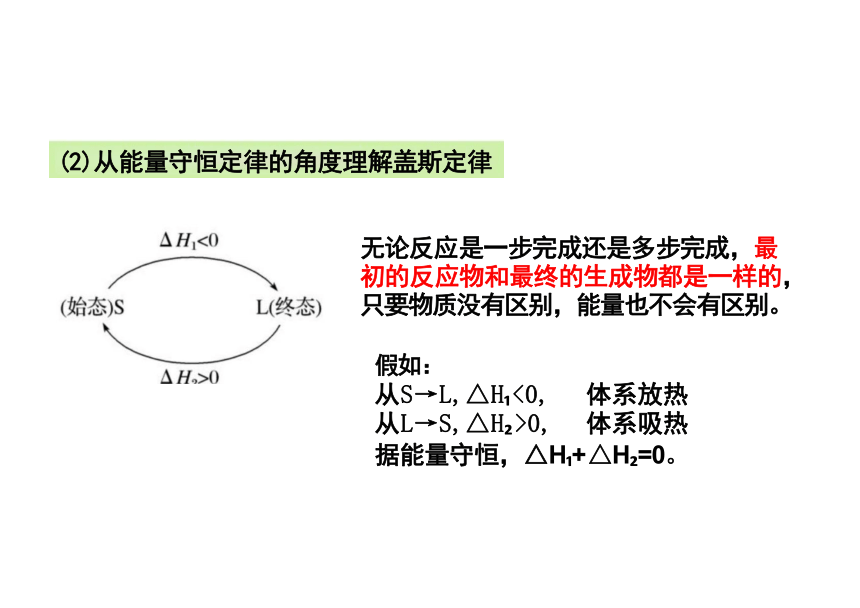
无论反应是一步完成还是多步完成,最 初的反应物和最终的生成物都是一样的, 只要物质没有区别,能量也不会有区别。
假如:
从S→L,△H <0, 体系放热
从L→S,△H >0, 体系吸热
据能量守恒,△H + △H =0。
(2)从能量守恒定律的角度理解盖斯定律
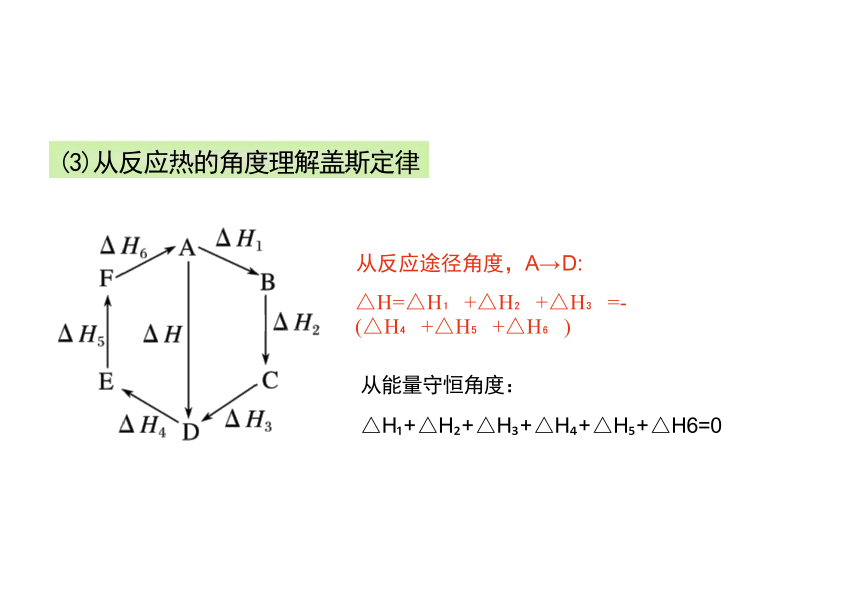
从反应途径角度,A→ D:
△H=△H +△H +△H =-(△H +△H +△H )
从能量守恒角度:
△H + △H + △H + △H + △H + △H6=0
(3)从反应热的角度理解盖斯定律
(1) “虚拟路径”法
若反应物A 变为生成物D, 可以有两个途径:①由A 直接变成D, 反应热 为△H;
②由A 经过B变成C, 再 由C 变成D, 每步的反应热分别为△H 、△H 、 △H
如图所示:
则△H=△H +△H +△H
有的反应进行得很慢,有些反应不直接发生,有些反应产品不 纯(有副反应发生),这给用实验测定反应热造成了困难,若应 用盖斯定律可间接地计算出它们的反应热
3.盖斯定律的意义
4.盖斯定律的应用
△H
△
D
A
B
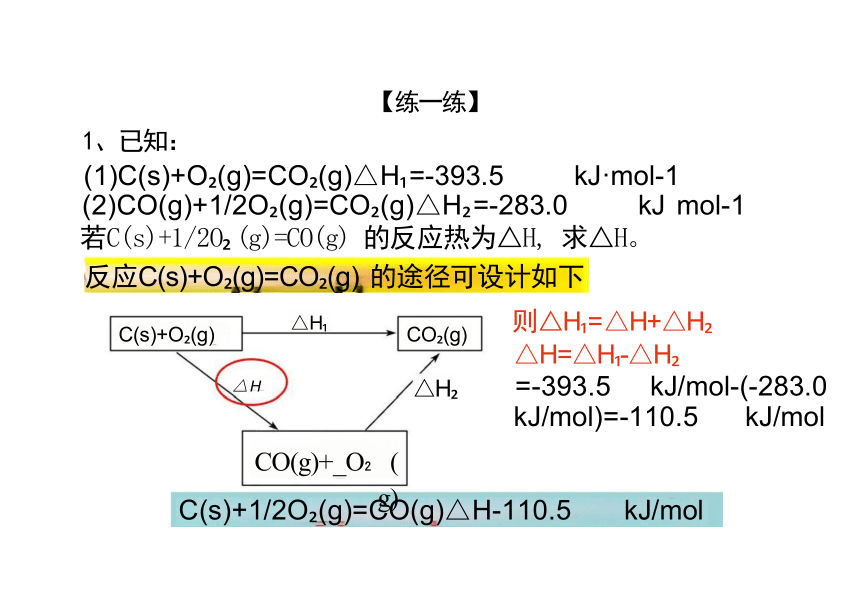
【练一练】
1、已知:
(1)C(s)+O (g)=CO (g)△H =-393.5 kJ·mol-1
若C(s)+1/2O (g)=CO(g) 的反应热为△H, 求△H。
△H
△H
则△H = △H+△H
△H=△H -△H
=-393.5 kJ/mol-(-283.0 kJ/mol)=-110.5 kJ/mol
(2)CO(g)+1/2O (g)=CO (g)△H =-283.0 kJ mol-1
C(s)+1/2O (g)=CO(g)△H-110.5 kJ/mol
反应C(s)+O (g)=CO (g) 的途径可设计如下
CO(g)+_O (g)
CO (g)
△H
C(s)+O (g)
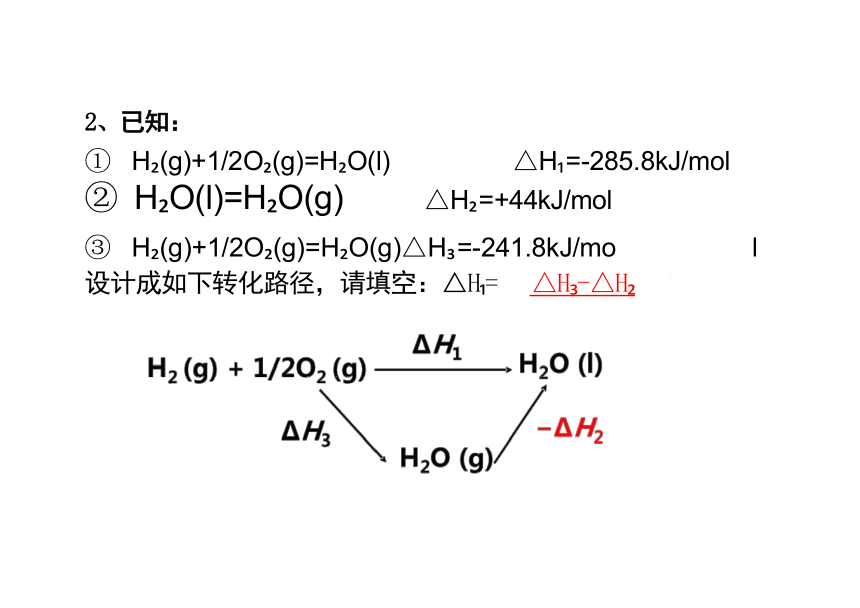
2、已知:
① H (g)+1/2O (g)=H O(l) △H =-285.8kJ/mol
② H O(l)=H O(g) △H =+44kJ/mol
③ H (g)+1/2O (g)=H O(g)△H =-241.8kJ/mo l 设计成如下转化路径,请填空:△H = △H -△H
已知:
I.C(s)+O (g)=CO (g) △H =-393.5 kJomol-1
Ⅱ.CO(g)+1/2O (g)=CO (g)△H =-283.0 kJ·mol-1 若C(s)+1/2O (g)=CO(g) 的反应热为△H, 求△H。
(2)加合法
①写出目标反应的热化学方程式,确定各物质在各反应中的位置 C(s)+1/2O (g)=CO(g)
② 将已知热化学方程式 Ⅱ变 形 ,得反应皿:CO (g)=CO( g )+
1/2O (g)△H =+283.0 kJomol-1
式(g相) H, △加H:, , ( 5 kJ/mol
10
s)+
-1
C
△
Ⅲ
则
+
I
H
也
△
H
O
程
(g
化
O
热
2
将
1/
③
热化学方程式
焓变之间的关系
aA=B A=1/aB △H △H
△H =1/a△H 或 △H =a△H
aA=B H B=aA H
△H =-△H
A △H △H B △H
△H=△H +△H
C
(3)常用关系式
(1)方法步骤——“三调一加”物质变化+能量变化
①一调:根据目标热化学方程式,调整已知热化学方程式中反 应物和生成物的左右位置 ,改写已知的热化学方程式
②二调:根据改写的热化学方程式调整相应△H 的符号
③三调:调整中间物质的化学计量数
④一加:将调整好的热化学方程式及其△H 相加
(2)注意事项
①热化学方程式乘以某一个数时 ,反应热的数值必须也乘上该数
②热化学方程式相加减时,物质之间相加减,反应热也必须相加减
③将一个热化学方程式颠倒时,△H 的“+”“ -”随之改变,但数 值不变
④每个热化学方程式只能调整一次
5.利用盖斯定律推测并书写热化学方程式
【练一练】
1、已知
①CO(g)+1/2 O (g)=CO (g) △H =-283.0 kJ/mol
计算:④2CO(g) + 4 H (g)= H O(1) + C H OH(1) 的△H
②|H (g)|+1/2 O (g)=|H O(I) △H =-285.8 kJ/mol
③C H OH(1) +3 O (g)=2CO (g)+3H O(1) △H =-1370 kJ/mol
2CO(g)+O (g)=2CO (g)2△H =-566.0 kJ/mol
4 H (g)+2O (g)=4H O(1)4△H =-1143.2kJ/mol
2CO (g)+3H O(1)=C H OH(l)+30 (g)-△H =+1370 kJ/mol
2CO(g)+4 H (g)=H O(l)+C H OH(l)△H =- 339.2 kJ/mol
得④=①×2+②×4-③
+)
【练一练】
2.已知:①2C(s)+O (g)=2CO(g)△H=-221.0 kJ·mol-1;②
的反应C(s)+H O(g)=CO(g)+H (g) 的△H 为(D)
kJ·mol-1
②Ca(s)+1/2O (g)=CaO(s)△H=-635.1 ③C(s, 石墨)+O (g)=CO (g)△H=-393.5 试求④CaCO (s)=CaO(s)+CO (g)的焓变。
kJ mol-1
·
·
kJ mol-1
3.已知下列各反应的焓变
①Ca(s)+C(s, 石墨)+3/2O (g)=CaCO (s)△H=-1206.8
2H (g)+O (g)=2H O(g)△H=-483.6 kJ mol-1。则制备水煤气
△H=+178.2 kJ·mol-1
B.-131.3
D.+131.3
A.+262.6
C.-352.3
kJ· mol-1
kJ mol-1
·
·
kJ mol-1
kJ mol-1
二.反应热的计算
1.根据盖斯定律计算反应热
将两个或两个以上的热化学方程式包括其△H 相加或相减,得 到一个新的热化学方程式及其△H。
(1)确定待求反应的热化学方程式(确定目标热化学方程式)。
(2)找出待求热化学方程式中只在已知化学方程式中出现一次的物质( 多次的不考虑),并依据该物质调整已知化学方程式的方向(同侧相加 ,异侧相减)和化学计量数。
(3)每个已知化学方程式只能调整一次。
(4)△H与化学方程式一对应调整和运算。
【练一练】
1、实验中不能直接测出由石墨和氢气生成甲烷反应的△H, 但可测出 CH 燃烧反应的△H, 根据盖斯定律求△H 。(1)CH (g)+
1/2O (g)=H O(l)△H=-285.8 kJ mol-1则 :C(石墨)+2H (g)=
CH (g);△H = 2、已知下列热化学时程术o(1)Fe O (s)+
CO还原成Fe和CO 的热化学方程式
3CO(g)=2Fe(s)+3CO (g)△H=-25kJ· mol-1(2)3Fe O (s)+
CO(g)=Fe O (s)+CO (g)△H=-47kJ mol-1(3)Fe O (s)+
2O (g)=CO (g)+2H O(I)△H=-890.3 · kJ mol-1 (2)C (石墨)
+O (g)=CO (g)△H=-393.5 kJ mol-1(3)H (g)+
CO(g)=3FeO(s)+CO (g)△H=+19 kJ mol-1 写出FeO(s)被
FeO(s)+CO(g)=Fe(s)+CO (g) △H=-11kJ·mol-1
物质 CO (C=O CH (C- H) P (P- P) SiO (Si-O) 石墨 金刚 石 S (S -S)
Si
键数 2 4 6 4 1.5 2 8
2
2、根据反应物和生成物的键能计算
△H= 反应物总键能=生成物总键能
常见物质中的化学键数目
【练一练】
2、化学反应过程可视为旧化学键断裂和新化学键形成的过程, H—H 键的键能为436 kJ·mol-1,Cl—Cl 键的键能为243
kJ·mol-1,H—Cl 键的键能为431 kJ·mol-1 。 已 知H (g)+
)A.-183 B.183 C.-862 D.862
Cl (g)=2HCl(g)△H=-QkJ mol-1, 则 Q 等于( B
热化学方程式中反应热数值与各物质的化学计量数成正比。例如,
aA(g)+bB(g)—cC(g)+dD(g)△H
a b C d |△H
n(A) n(B) n(C) n(D)Q
3、根据热化学方程式计算
则
【练一练】
3、依据叙述,写出下列反应的热化学方程式。(1)在25℃、101
kPa 下,1 g 甲醇燃烧生成CO 和液态水时放热22.68 kJ。则表示甲 醇燃烧热的热化学方程式为
C H OH(1)+3/20,(g)=CO,(g)+2H,0 @)若适 的 N 3 和O 完 全反no l-1
应,每生成23 g NO 需要吸收16.95 kJ热量。
其热化学方程式为 N (g)+2O (g)= 2NO (g)△H=+67.8 kJ·mol-1
可燃物完全燃烧放出的热量=n (可燃物)×△H (燃烧热的绝对值)
4、黄铁矿(主要成分为FeS )的燃烧是工业上制硫酸时得到SO
的途径之一,反应的化学方程式为:4FeS +110 ≥2Fe O +8SO
在25℃和101kPa 时,1mol FeS (s)完全燃烧生成Fe O (s) 和SO (g)
时放出853kJ的热量。
(1)请与出FeS 燃烧的热化学方程式。
( 2 ) 计 算 理 论 上 1kg 黄铁矿(FeS 的含量为90%)完全燃烧放出的 热 量。
4、根据物质的燃烧热数值计算
【解】
(1)根据题意,FeS 燃烧的热化学方程式为:
FeS +4O = Fe O +2SO (g)△H=-853 kJ/mol
1kg 黄铁矿含FeS 的质量为:1000g×90%=900g 900gFeS的物质的量为: 理论上1kg 黄铁矿完全燃烧放出的热量
为:7.5mol×853kJ/mol=6398kJ
答:(1)FeS 燃烧的热化学方程式:
(2)理论上1kg 黄铁矿完全燃烧放出的热量为6398kJ。
(2)FeS 的摩尔 质量为120g·mol-1。
能量/(kJ/mol)f
反应物的
总能量E
生成物的
总能量E
反应过程
能量/(kJ/mol)
生成物的
总能量E
反应物的
总能量E
△H=(E -E )kJ/mol =(a-b)kJ/mol =+ckJ/mol
△H=(E -E )kJ/mol
=-ckJ/mol
=(a-b)kJ/mol
5.根据图像计算
判断下列叙述中正确的是(B)
A.每生成2分子AB 吸收b kJ热量
B.该反应热△H=+(a-b)kJ ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A键和1 mol B—B键 , 放出a kJ能量
【练一练】
5、已知化学反应A (g)+B (g)=2AB(g) 的能量变化如图所示,
能量/(kJ·mol- )
a
2 mol AB(g)
I mol A (g)+1 mol B (g)
反应进程
0
根据△H= 生成物的总能量-反应物的总能量
根据键能计算
根据热化学方程式计算
根据燃烧热计算
根据盖斯定律计算
根据图像信息计算
反应热的计算方法
如 :
H (g)+1/2O (g)=H O(I)△H =-a· kJ·mol-1,2H (g)+
a△H 。放热反应,数值越大,△H越小
对于放热反应来说,△H=-Q kJ·mol-1, 虽然“-”仅表示放 热的意思,但在比较大小时要将其看成真正意义上的“负号 ” 即 :放热越多,△H 反而越小;放热越少,△H 反而越大
2.与“化学计量数”相关的反应热比较
O (g)=2H O(I) △H =-bkJ mol- 1
1.与“符号”相关的反应热比较
三.反应热的大小比较
A(g)+B(g)=C(g)△H <0, A(g)+B(g)=C(l)△H <0,
A(g)+B(g)=C(s)△H <0, 因 为C(g)=C(l)△H <0
C(I)=C(s)△H <0
则△H = △H -△H <0, 所以△H <△H
则△H = △H -△H <0 所以△H <△H
E
A(g)+B(g)
C(g)
C(l)
C(s)
同一反应,当反应物状态相同,生成物状态不同
①若是放热 反 应 ,则物质越稳定,反应热越小(数字 越大)
②若是吸热反应,则物质越不稳定,反应热越大(数
3、与“物质聚集状态”相关的反应热比较
(1)同一反应,生成物状态不同时
反应过程
字越大)
则△H =△H -△H
又△H <0, 所以△H < △H 同一反应,当生成物状态相同,反应物状态不同
①若是放热反应,则物质越不稳定,反应热越小(数
字越大)
②若是吸热反应,则物质越稳定,反应热越大(数字
越大)
E
S(g)+0 (g)
S(s)+O (g)
SO (g)
反应过程
S(g)+O (g)=SO (g)△H <0S(s) +O (g)=SO (g) △H <0
(2)同一反应,反应物状态不同时
△H +△H =△H
C( 石 墨 ,s)+O (g)=CO (g)△H C (金区 石 ,s)+O (g)=CO (g)△H 因为C(石墨 s)=C(金刚石,s)△H>0△H=△H1-△H2 所以△H=△H1-△H2
△H >△H
4、与“同素异形体”相关的反应热比较
E
C(金刚石,s)+O
C(石墨,s)+0
反应过程
CO (g)
1、试比较下列各组△H 的大小(1)同一反应,生成物状态不同时:A(g)+B(g)=C (g) △H <0 A(g)+B(g)=C(I) △H,<0, 则△H △H(2)同一反应,反应物状态
不同时 S(g)+O (g)=SO (g)△H <0 S(s)+O (g)=SO (g)△H ≥0, 则
△H △H (3)两个有联系的不同反应相比C(s)+O (g)=CO (g)△H < 0 C(s) +1/20,(g)=CO(g) △H,<0, 则△H △H 2、根据以下三个热化学方程式:
( =) ( H O△(l)H=-Q kJ · =-1- - O )+
)A.Q >Q >Q B.Q >Q >Q C.Q >Q >Q D.Q >Q >Q
A
s
+
2S
S(g
g
l
S
m
2H
Q kJ
mol
△H
O
(g)
H
O
2
S
s
g
2S
+30
O
2H
2H O(g) △H=-Q kJ mol-1 判断Q 、Q 、Q 三者关系正确的是(
3. 已知25℃、101 kPa 条件下:①4Al(s)+30 (g)=2Al O (s)△H= -2834.9 kJ·mol- ②4Al(s)+20 (g)=2Al O (s)△H=-3119.1 kJ·mol-1 由此得出的正确结论是(A)
A. 等质量的O 比O 能量低,由O 变O 为吸热反应
B. 反应①可确定铝的燃烧热是708.7 kJ
C.O 比O 稳定,由O 变O 为放热反应
D. 反应②可确定铝的燃烧热是779.78 kJ ·mol-1
4.已知1 mol 红磷转化为1 mol 白磷,吸收18.39 kJ热量。①4P(s, 红 )
+50 (g)=2P O (s)△H ②4P(s, 白 ) + 5O (g)=2P O (s)△H 则 △H 与△H 的关系正确的是(B)
A.△H =△H B.△H >△H C.△H <△H D.无法确定
第一章化学反应的热效应
第二节反应热的计算
1.2.1 盖斯定律及运用
学习目标
1 .知道盖斯定律的内容,能用盖斯定律进行有关反应热的简单计算
2. 学会有关反应热计算的方法技巧,进一步提高化学计算的能力
化学反应的热效应
表示
焓变(△H)、 热化学方程式
玻璃 搅拌器
内筒
隔热层
外 壳
测定
中和热的测
定
图1-3 简易量热计示意图
温度计
杯盖
否。
有些反应的产品不纯(有副反应发生),
如甲烷的不完全燃烧,大多数有机反应;
有些反应进行得很慢或太快,如煤炭,石油,钻石的形成或爆炸; 有些反应不容易直接发生,如石墨和氢气生成甲烷的反应。
1、利用热量计,我们可以测量中和反应热,说明中和反应 反应热是可以直接测量的,那么是否所有的反应热都可以直 接测量呢
思考
1840年俄国化学家盖斯为了解决这一问题依
据能量守恒定律,通过大量的实验证明了化
学反应的焓变与化学反应的过程没有关系, 只与反应物和生成物的始末状态有关,这 一
定律称之为盖斯定律。
2、能否利用一些已知的反应热来计算一些无法直 接测定的反应热呢
思考
一个化学反应(在相同条件下),不管是一步完成还是分几步完成
的,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应 的途径无关
一.盖斯定律
1.内容
2.特点
某人从山下的A点到达山顶B点,他从A 点出发,无论是翻山越岭,还是做缆车 直奔山顶,当最终到达B点时,位移是相
同的。即人的登山高度与上山的途径无
关,只与起点和终点的相对高度有关。
(1)从反应途径角度理解盖斯定律
登山的高度与上 山的途径无关, 只与起点和终点 的相对高度有关
2.多角度理解盖斯定律
A
B
无论反应是一步完成还是多步完成,最 初的反应物和最终的生成物都是一样的, 只要物质没有区别,能量也不会有区别。
假如:
从S→L,△H <0, 体系放热
从L→S,△H >0, 体系吸热
据能量守恒,△H + △H =0。
(2)从能量守恒定律的角度理解盖斯定律
从反应途径角度,A→ D:
△H=△H +△H +△H =-(△H +△H +△H )
从能量守恒角度:
△H + △H + △H + △H + △H + △H6=0
(3)从反应热的角度理解盖斯定律
(1) “虚拟路径”法
若反应物A 变为生成物D, 可以有两个途径:①由A 直接变成D, 反应热 为△H;
②由A 经过B变成C, 再 由C 变成D, 每步的反应热分别为△H 、△H 、 △H
如图所示:
则△H=△H +△H +△H
有的反应进行得很慢,有些反应不直接发生,有些反应产品不 纯(有副反应发生),这给用实验测定反应热造成了困难,若应 用盖斯定律可间接地计算出它们的反应热
3.盖斯定律的意义
4.盖斯定律的应用
△H
△
D
A
B
【练一练】
1、已知:
(1)C(s)+O (g)=CO (g)△H =-393.5 kJ·mol-1
若C(s)+1/2O (g)=CO(g) 的反应热为△H, 求△H。
△H
△H
则△H = △H+△H
△H=△H -△H
=-393.5 kJ/mol-(-283.0 kJ/mol)=-110.5 kJ/mol
(2)CO(g)+1/2O (g)=CO (g)△H =-283.0 kJ mol-1
C(s)+1/2O (g)=CO(g)△H-110.5 kJ/mol
反应C(s)+O (g)=CO (g) 的途径可设计如下
CO(g)+_O (g)
CO (g)
△H
C(s)+O (g)
2、已知:
① H (g)+1/2O (g)=H O(l) △H =-285.8kJ/mol
② H O(l)=H O(g) △H =+44kJ/mol
③ H (g)+1/2O (g)=H O(g)△H =-241.8kJ/mo l 设计成如下转化路径,请填空:△H = △H -△H
已知:
I.C(s)+O (g)=CO (g) △H =-393.5 kJomol-1
Ⅱ.CO(g)+1/2O (g)=CO (g)△H =-283.0 kJ·mol-1 若C(s)+1/2O (g)=CO(g) 的反应热为△H, 求△H。
(2)加合法
①写出目标反应的热化学方程式,确定各物质在各反应中的位置 C(s)+1/2O (g)=CO(g)
② 将已知热化学方程式 Ⅱ变 形 ,得反应皿:CO (g)=CO( g )+
1/2O (g)△H =+283.0 kJomol-1
式(g相) H, △加H:, , ( 5 kJ/mol
10
s)+
-1
C
△
Ⅲ
则
+
I
H
也
△
H
O
程
(g
化
O
热
2
将
1/
③
热化学方程式
焓变之间的关系
aA=B A=1/aB △H △H
△H =1/a△H 或 △H =a△H
aA=B H B=aA H
△H =-△H
A △H △H B △H
△H=△H +△H
C
(3)常用关系式
(1)方法步骤——“三调一加”物质变化+能量变化
①一调:根据目标热化学方程式,调整已知热化学方程式中反 应物和生成物的左右位置 ,改写已知的热化学方程式
②二调:根据改写的热化学方程式调整相应△H 的符号
③三调:调整中间物质的化学计量数
④一加:将调整好的热化学方程式及其△H 相加
(2)注意事项
①热化学方程式乘以某一个数时 ,反应热的数值必须也乘上该数
②热化学方程式相加减时,物质之间相加减,反应热也必须相加减
③将一个热化学方程式颠倒时,△H 的“+”“ -”随之改变,但数 值不变
④每个热化学方程式只能调整一次
5.利用盖斯定律推测并书写热化学方程式
【练一练】
1、已知
①CO(g)+1/2 O (g)=CO (g) △H =-283.0 kJ/mol
计算:④2CO(g) + 4 H (g)= H O(1) + C H OH(1) 的△H
②|H (g)|+1/2 O (g)=|H O(I) △H =-285.8 kJ/mol
③C H OH(1) +3 O (g)=2CO (g)+3H O(1) △H =-1370 kJ/mol
2CO(g)+O (g)=2CO (g)2△H =-566.0 kJ/mol
4 H (g)+2O (g)=4H O(1)4△H =-1143.2kJ/mol
2CO (g)+3H O(1)=C H OH(l)+30 (g)-△H =+1370 kJ/mol
2CO(g)+4 H (g)=H O(l)+C H OH(l)△H =- 339.2 kJ/mol
得④=①×2+②×4-③
+)
【练一练】
2.已知:①2C(s)+O (g)=2CO(g)△H=-221.0 kJ·mol-1;②
的反应C(s)+H O(g)=CO(g)+H (g) 的△H 为(D)
kJ·mol-1
②Ca(s)+1/2O (g)=CaO(s)△H=-635.1 ③C(s, 石墨)+O (g)=CO (g)△H=-393.5 试求④CaCO (s)=CaO(s)+CO (g)的焓变。
kJ mol-1
·
·
kJ mol-1
3.已知下列各反应的焓变
①Ca(s)+C(s, 石墨)+3/2O (g)=CaCO (s)△H=-1206.8
2H (g)+O (g)=2H O(g)△H=-483.6 kJ mol-1。则制备水煤气
△H=+178.2 kJ·mol-1
B.-131.3
D.+131.3
A.+262.6
C.-352.3
kJ· mol-1
kJ mol-1
·
·
kJ mol-1
kJ mol-1
二.反应热的计算
1.根据盖斯定律计算反应热
将两个或两个以上的热化学方程式包括其△H 相加或相减,得 到一个新的热化学方程式及其△H。
(1)确定待求反应的热化学方程式(确定目标热化学方程式)。
(2)找出待求热化学方程式中只在已知化学方程式中出现一次的物质( 多次的不考虑),并依据该物质调整已知化学方程式的方向(同侧相加 ,异侧相减)和化学计量数。
(3)每个已知化学方程式只能调整一次。
(4)△H与化学方程式一对应调整和运算。
【练一练】
1、实验中不能直接测出由石墨和氢气生成甲烷反应的△H, 但可测出 CH 燃烧反应的△H, 根据盖斯定律求△H 。(1)CH (g)+
1/2O (g)=H O(l)△H=-285.8 kJ mol-1则 :C(石墨)+2H (g)=
CH (g);△H = 2、已知下列热化学时程术o(1)Fe O (s)+
CO还原成Fe和CO 的热化学方程式
3CO(g)=2Fe(s)+3CO (g)△H=-25kJ· mol-1(2)3Fe O (s)+
CO(g)=Fe O (s)+CO (g)△H=-47kJ mol-1(3)Fe O (s)+
2O (g)=CO (g)+2H O(I)△H=-890.3 · kJ mol-1 (2)C (石墨)
+O (g)=CO (g)△H=-393.5 kJ mol-1(3)H (g)+
CO(g)=3FeO(s)+CO (g)△H=+19 kJ mol-1 写出FeO(s)被
FeO(s)+CO(g)=Fe(s)+CO (g) △H=-11kJ·mol-1
物质 CO (C=O CH (C- H) P (P- P) SiO (Si-O) 石墨 金刚 石 S (S -S)
Si
键数 2 4 6 4 1.5 2 8
2
2、根据反应物和生成物的键能计算
△H= 反应物总键能=生成物总键能
常见物质中的化学键数目
【练一练】
2、化学反应过程可视为旧化学键断裂和新化学键形成的过程, H—H 键的键能为436 kJ·mol-1,Cl—Cl 键的键能为243
kJ·mol-1,H—Cl 键的键能为431 kJ·mol-1 。 已 知H (g)+
)A.-183 B.183 C.-862 D.862
Cl (g)=2HCl(g)△H=-QkJ mol-1, 则 Q 等于( B
热化学方程式中反应热数值与各物质的化学计量数成正比。例如,
aA(g)+bB(g)—cC(g)+dD(g)△H
a b C d |△H
n(A) n(B) n(C) n(D)Q
3、根据热化学方程式计算
则
【练一练】
3、依据叙述,写出下列反应的热化学方程式。(1)在25℃、101
kPa 下,1 g 甲醇燃烧生成CO 和液态水时放热22.68 kJ。则表示甲 醇燃烧热的热化学方程式为
C H OH(1)+3/20,(g)=CO,(g)+2H,0 @)若适 的 N 3 和O 完 全反no l-1
应,每生成23 g NO 需要吸收16.95 kJ热量。
其热化学方程式为 N (g)+2O (g)= 2NO (g)△H=+67.8 kJ·mol-1
可燃物完全燃烧放出的热量=n (可燃物)×△H (燃烧热的绝对值)
4、黄铁矿(主要成分为FeS )的燃烧是工业上制硫酸时得到SO
的途径之一,反应的化学方程式为:4FeS +110 ≥2Fe O +8SO
在25℃和101kPa 时,1mol FeS (s)完全燃烧生成Fe O (s) 和SO (g)
时放出853kJ的热量。
(1)请与出FeS 燃烧的热化学方程式。
( 2 ) 计 算 理 论 上 1kg 黄铁矿(FeS 的含量为90%)完全燃烧放出的 热 量。
4、根据物质的燃烧热数值计算
【解】
(1)根据题意,FeS 燃烧的热化学方程式为:
FeS +4O = Fe O +2SO (g)△H=-853 kJ/mol
1kg 黄铁矿含FeS 的质量为:1000g×90%=900g 900gFeS的物质的量为: 理论上1kg 黄铁矿完全燃烧放出的热量
为:7.5mol×853kJ/mol=6398kJ
答:(1)FeS 燃烧的热化学方程式:
(2)理论上1kg 黄铁矿完全燃烧放出的热量为6398kJ。
(2)FeS 的摩尔 质量为120g·mol-1。
能量/(kJ/mol)f
反应物的
总能量E
生成物的
总能量E
反应过程
能量/(kJ/mol)
生成物的
总能量E
反应物的
总能量E
△H=(E -E )kJ/mol =(a-b)kJ/mol =+ckJ/mol
△H=(E -E )kJ/mol
=-ckJ/mol
=(a-b)kJ/mol
5.根据图像计算
判断下列叙述中正确的是(B)
A.每生成2分子AB 吸收b kJ热量
B.该反应热△H=+(a-b)kJ ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A键和1 mol B—B键 , 放出a kJ能量
【练一练】
5、已知化学反应A (g)+B (g)=2AB(g) 的能量变化如图所示,
能量/(kJ·mol- )
a
2 mol AB(g)
I mol A (g)+1 mol B (g)
反应进程
0
根据△H= 生成物的总能量-反应物的总能量
根据键能计算
根据热化学方程式计算
根据燃烧热计算
根据盖斯定律计算
根据图像信息计算
反应热的计算方法
如 :
H (g)+1/2O (g)=H O(I)△H =-a· kJ·mol-1,2H (g)+
a
对于放热反应来说,△H=-Q kJ·mol-1, 虽然“-”仅表示放 热的意思,但在比较大小时要将其看成真正意义上的“负号 ” 即 :放热越多,△H 反而越小;放热越少,△H 反而越大
2.与“化学计量数”相关的反应热比较
O (g)=2H O(I) △H =-bkJ mol- 1
1.与“符号”相关的反应热比较
三.反应热的大小比较
A(g)+B(g)=C(g)△H <0, A(g)+B(g)=C(l)△H <0,
A(g)+B(g)=C(s)△H <0, 因 为C(g)=C(l)△H <0
C(I)=C(s)△H <0
则△H = △H -△H <0, 所以△H <△H
则△H = △H -△H <0 所以△H <△H
E
A(g)+B(g)
C(g)
C(l)
C(s)
同一反应,当反应物状态相同,生成物状态不同
①若是放热 反 应 ,则物质越稳定,反应热越小(数字 越大)
②若是吸热反应,则物质越不稳定,反应热越大(数
3、与“物质聚集状态”相关的反应热比较
(1)同一反应,生成物状态不同时
反应过程
字越大)
则△H =△H -△H
又△H <0, 所以△H < △H 同一反应,当生成物状态相同,反应物状态不同
①若是放热反应,则物质越不稳定,反应热越小(数
字越大)
②若是吸热反应,则物质越稳定,反应热越大(数字
越大)
E
S(g)+0 (g)
S(s)+O (g)
SO (g)
反应过程
S(g)+O (g)=SO (g)△H <0S(s) +O (g)=SO (g) △H <0
(2)同一反应,反应物状态不同时
△H +△H =△H
C( 石 墨 ,s)+O (g)=CO (g)△H C (金区 石 ,s)+O (g)=CO (g)△H 因为C(石墨 s)=C(金刚石,s)△H>0△H=△H1-△H2 所以△H=△H1-△H2
△H >△H
4、与“同素异形体”相关的反应热比较
E
C(金刚石,s)+O
C(石墨,s)+0
反应过程
CO (g)
1、试比较下列各组△H 的大小(1)同一反应,生成物状态不同时:A(g)+B(g)=C (g) △H <0 A(g)+B(g)=C(I) △H,<0, 则△H △H(2)同一反应,反应物状态
不同时 S(g)+O (g)=SO (g)△H <0 S(s)+O (g)=SO (g)△H ≥0, 则
△H △H (3)两个有联系的不同反应相比C(s)+O (g)=CO (g)△H < 0 C(s) +1/20,(g)=CO(g) △H,<0, 则△H △H 2、根据以下三个热化学方程式:
( =) ( H O△(l)H=-Q kJ · =-1- - O )+
)A.Q >Q >Q B.Q >Q >Q C.Q >Q >Q D.Q >Q >Q
A
s
+
2S
S(g
g
l
S
m
2H
Q kJ
mol
△H
O
(g)
H
O
2
S
s
g
2S
+30
O
2H
2H O(g) △H=-Q kJ mol-1 判断Q 、Q 、Q 三者关系正确的是(
3. 已知25℃、101 kPa 条件下:①4Al(s)+30 (g)=2Al O (s)△H= -2834.9 kJ·mol- ②4Al(s)+20 (g)=2Al O (s)△H=-3119.1 kJ·mol-1 由此得出的正确结论是(A)
A. 等质量的O 比O 能量低,由O 变O 为吸热反应
B. 反应①可确定铝的燃烧热是708.7 kJ
C.O 比O 稳定,由O 变O 为放热反应
D. 反应②可确定铝的燃烧热是779.78 kJ ·mol-1
4.已知1 mol 红磷转化为1 mol 白磷,吸收18.39 kJ热量。①4P(s, 红 )
+50 (g)=2P O (s)△H ②4P(s, 白 ) + 5O (g)=2P O (s)△H 则 △H 与△H 的关系正确的是(B)
A.△H =△H B.△H >△H C.△H <△H D.无法确定
