3.2.3酸碱中和滴定高二上学期化学人教版(2019)选择性必修1(共38张PPT)
文档属性
| 名称 | 3.2.3酸碱中和滴定高二上学期化学人教版(2019)选择性必修1(共38张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-11 20:48:16 | ||
图片预览









文档简介
(共38张PPT)
第三章水溶液中的离子反应与平衡 第二节电离平衡
3.2.3酸碱中和滴定
学习目标
1.了解酸碱中和滴定的原理。
2.了解指示剂的选择方法,熟记酸碱中和滴定的主要仪器的名称及 用途。
3. 掌握酸碱中和滴定的实验操作、数据处理、误差分析,并迁移应用 于其他滴定。
①滴入CuSO 溶液,称取沉淀质量
②用已知物质的量浓度的酸来测定未知物质的量浓度的碱溶液。
1、如何测定一瓶未知浓度的氢氧化钠溶液物质的量浓度
思考
(1)概念:依据中和反应,用已知浓度的酸或碱(标准液) 来测定未知浓 度的碱或酸(待 测 液 )的方法
2)原理:在中和反应中,酸提供的H+与碱提供的OH- 之间的物质的 量相等 (H++OH-=H O)
即 :c(H+)·V 酸三c(OH-)·V 碱
一、酸碱中和滴定实验
1、概念和原理
【练一练】
1、用0 . 1000mol/L 的HCl 溶液滴定20.00mL 未知浓度的 NaOH 溶液,滴定完成时,用去HCl溶液28.00mL 。通 过 中和滴定测得NaOH 溶液的物质的量浓度是多少
0.1400mol/L
【变式】把上题中HCl改成H SO4, 则NaOH 的物质的量浓 度为多少
50 ml
20℃
… )
l
2
50
20
(B)
u
l
u
滴定
管夹
铷
碱式滴定管
酸式滴定管
50mL 20℃
(A)
50
l
2
50
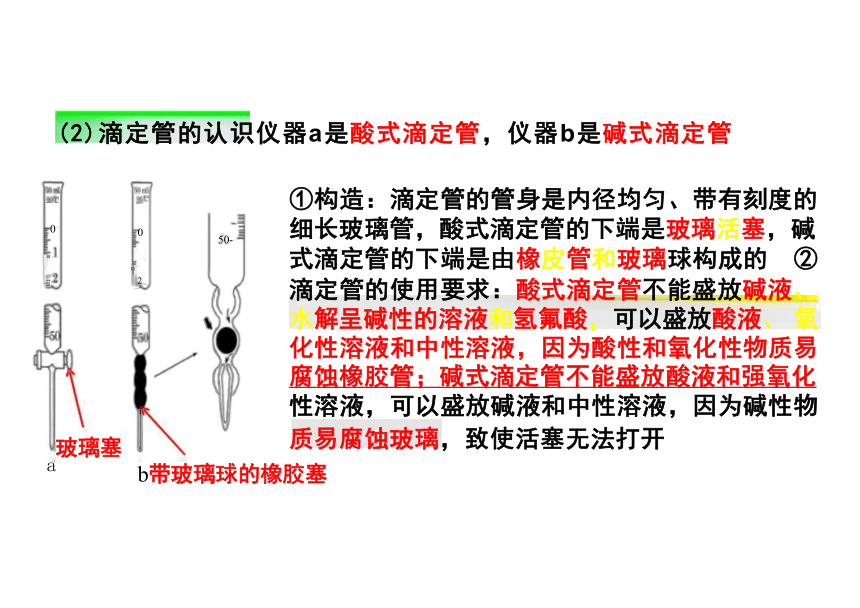
①构造:滴定管的管身是内径均匀、带有刻度的 细长玻璃管,酸式滴定管的下端是玻璃活塞,碱 式滴定管的下端是由橡皮管和玻璃球构成的 ②
滴定管的使用要求:酸式滴定管不能盛放碱液、 水解呈碱性的溶液和氢氟酸,可以盛放酸液、 氧 化性溶液和中性溶液,因为酸性和氧化性物质易 腐蚀橡胶管;碱式滴定管不能盛放酸液和强氧化
性溶液,可以盛放碱液和中性溶液,因为碱性物
质易腐蚀玻璃,致使活塞无法打开
(2)滴定管的认识仪器a是酸式滴定管,仪器b是碱式滴定管
b带玻璃球的橡胶塞
玻璃塞
0
1
2
l
m
山 m
a
50-
0
带玻璃球的橡胶塞
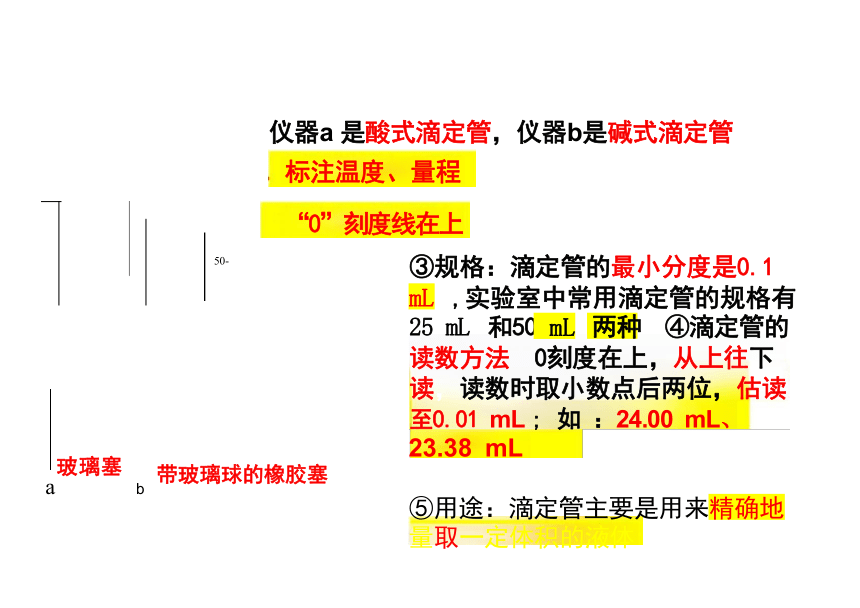
⑤用途:滴定管主要是用来精确地 量取一定体积的液体
25 mL 和50 两种 ④滴定管的
读数方法 0刻度在上,从上往下 读,读数时取小数点后两位,估读 至0.01 mL ; 如 :24.00 mL、
23.38 mL
③规格:滴定管的最小分度是0.1 mL ,实验室中常用滴定管的规格有
仪器a 是酸式滴定管,仪器b是碱式滴定管
“0”刻度线在上
标注温度、量程
a b
玻璃塞
mL
50-
【练一练】
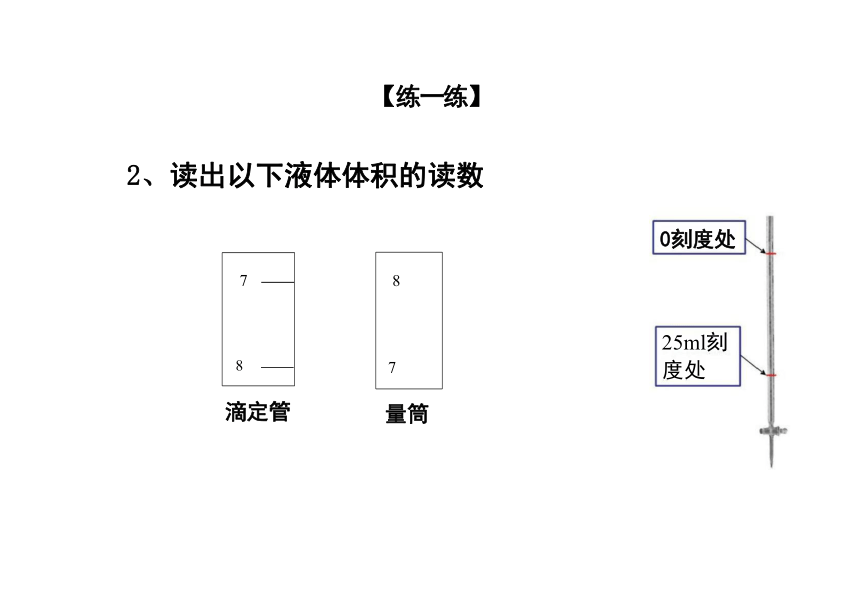
2、读出以下液体体积的读数
0刻度处
25ml刻
度处
7
8
8
7
滴定管 量筒
【练一练】
3、有一支50mL的滴定管,其中盛有溶液,液面恰 好在10mL刻度处,把滴定管中的液体全部流下排 除,承接在量筒中,量筒中的溶液的体积( A )
A.大于40.0mL B.等于40.0mL
C.小于40.0mL D.等于10.0mL
① 检查仪器:使用滴定管前,首先要检查活塞是否漏水 ( 查 漏 )检查滴
定管是否漏水的方法:向滴定管内加水(对酸式滴定管,要先关闭活塞) 至液面在“O”刻度线附近,用滴定管夹将滴定管固定在铁架台上,观察 滴定管是否漏水。若不漏水,对酸式滴定管将活塞旋转180°,对碱式滴 定管松动其阀门,放出少量液体,再次观察滴定管是否漏水,经两次检 查都不漏水的滴定管是检漏合格的滴定管。只有不漏水的滴定管才能使 用,若滴定管漏水,则不能使用
②润洗仪器:滴定管在加入酸、碱反应液之前,先用蒸馏水洗涤干净,
然后分别用待装液润洗2~3次 (润洗)润洗的方法:从滴定管上口加入 3~5 mL所要盛装的酸或碱,倾斜着转动滴定管,使液体润湿全部滴定 管内壁。然后,一手控制活塞(轻轻转动酸式滴定管的活塞;或者轻轻挤 压碱式滴定管中的玻璃球),将液体从滴定管下部放入预置的烧杯中
(3)滴定管的使用方法
③加入反应液:分别将酸、碱反应液加入酸式、碱式滴定管中,使 液面位于“0”刻度以上2~3 mL 处,并将滴定管垂直固定在滴定管 夹上( 装液 )
④赶气泡:在滴定管下放一烧杯,调节活塞或玻璃球,使滴定管尖
嘴部分充满反应液,如果滴定管内部有气泡,应快速放液以赶出气 泡(酸式滴定管→快速放液;碱式滴定管→橡皮管向上翘起)
⑤调液面记数据:然后调节滴定管夜面使其处于“ Q” 刻度或“0” 刻度以下的某一刻度,准确读取数值并记录
⑥放出反应液:根据实验需要从滴定管中逐滴放出一定量的反应液
排气泡的方法——快速放液的方法 酸式滴定 管 将酸式滴定管垂直夹持在滴定管夹上,旋转活塞,使溶液快速流出 的同时使气泡排出 碱式滴定 管 将碱式滴定管垂直夹持在滴定管夹上,使尖嘴 向上,并捏住小球后上部的橡皮管,使溶液快 速流出的同时使气泡排出
排碱式滴定
管胶管中气泡的方法
②滴定管洗涤:应先用自来水,再用蒸馏水,然后再用标准溶液( 或 待测溶液)润洗2~3次,以避免溶液被滴定管内壁上附着的蒸馏水稀 释而导致浓度变小(酸式滴定管用盐酸润洗,碱式滴定管用氢氧化钠 溶液润洗)
③洗涤的原则:少量多次
④洗涤的标准:管内壁不挂水珠
4、实验操作——以用盐酸标准液滴定NaOH 溶液为例
①锥形瓶:只能用蒸馏水洗涤,不能用待测溶液润洗
(1)查漏:使用前先检查滴定管活塞是否漏水(2)洗涤
(4)滴定:在锥形瓶下垫一张白纸,左手控制滴定管的活塞,向锥 形瓶中先快后慢地加入标准盐酸(后面逐滴加入,接近终点时,改 成滴加半滴酸),右手摇动锥形瓶,眼睛观察锥形瓶内溶液的颜色
变化
赶出气泡、调节液面至“ 0”刻度后,用碱式滴定管向锥形瓶中
滴入25.00 mL 待测溶液(待测液装在锥形瓶中 ) ,再向其中滴加 2滴酚酞溶液②向润洗过的酸式滴定管中加入标准盐酸,赶出气 泡、调节液面至“0”刻度后准确记录读数为V mL
(3)取液①向润洗过的碱式滴定管中加入待测浓度的NaOH 溶液,
左手
控制滴定管的活塞
右手
摇动锥形瓶
眼睛注视
锥形瓶内溶液的颜色变化
读数:当加入最后半滴标准盐酸,溶液由粉红色变为无色,且 半分钟内不变色,停止滴定。平视酸式滴定管中凹液面最低点, 读取溶液体积为V mL (盐酸的体积)
(6)计算:以(V =V )为消耗的标准盐酸的体积,取2~3次实 验结果的平均值,依据
计算待测NaOH 溶液的物质的量浓度
滴定次数 待测NaOH溶液的体 积/mL 0.1032mol ·L-1盐酸的体积/mL 滴定前刻 度 滴定后刻 文
溶液体积 /mL
第一次 25.00 0.00 26.11
26.11
第二次 25.00 1.56 30.30
第三次 25.00 0.22 26.31
26.09
例,某学生用0.1032 mol ·L-1盐酸溶液滴定未知浓度的
NaOH 溶液,依据表中数据计算该NaOH 溶液的物质的量浓 度 0.1077mol·L-1
【几点强调】
① 滴速:先快后慢,当 接近终点时,应一滴一摇,甚至半滴一摇,利用 锥形瓶内壁承接尖嘴处悬挂的半滴溶液
②终点的判断:滴入最后一滴标准液,指示剂变色,且在半分钟内不变 回原色,视为滴定终点③滴定终点的判断答题模板:当滴入最后一滴
×××××标准溶液后,溶液由××色变成××色,且半分钟内不恢复原来 的颜色
解答此类题目的三个关键点:
a.最后一滴:必须说明是滴入“最后一滴”溶液。
b. 颜色变化:必须说明滴入“最后一滴”溶液后,溶液“颜色的变化”。 c.半分钟:必须说明溶液颜色变化后“半分钟内不褪色”。④滴定操作 要点:左手控制活塞或玻璃小球,右手摇动锥形瓶,两眼注视锥形瓶内 溶液颜色的变化⑤在滴定过程中锥形瓶瓶口不能碰滴定管下端尖嘴
中和滴定记忆口决
先查漏液再润洗,装液排气调液面; 左手活塞右手瓶,瓶不润洗要记清; 眼看颜色手不停,三十秒钟要记清。
2、为什么要用酸碱指示剂
加入指示剂是为了确定化学反应的终点
3、如何选择合适的指示剂
5、指示剂的选择
思考
用0.1000 mol ·L-1NaOH溶液滴定20.00 mL 0.100 0 mol ·L- HCl溶液过程中的pH变化曲线 加入的 VNaOH(mL 余 VHci(mL 过量 VNaOH( mL) pH
中和滴定曲线
0.00 20.00 1.0
18.00 2.00 2.3 19.80 0.20 3.3 19.98 0.02 4.3 20.00 0.00 7.0 20.02 0.02 9.7 20.20 0.20 10.7 22.00 2.00 11.7 40.00 20.00 12.5
(1)中和滴定曲线:以滴加酸(或碱)的量为横坐标,以溶液的pH 为纵 坐标绘出一条溶液的pH 随酸(或碱)的滴加量而变化的曲线
pH
酚酞
20 30 40
V[NaOH(aq)]/mL
反应终点
突变范围
甲基橙
12
10
8
4
2
0
6
10
(2)指示剂选择的依据:由曲线可以看出,在酸、碱中和滴定过程中, 溶液的pH 在接近滴定终点时有一个突变过程,在此范围内,滴加
很少的酸(或碱), 溶液的pH就有很大的变化,能使指示剂的颜色 发生明显变化,有利于确定滴定终点,所以即使酚酞、甲基橙的变 色不在恰好中和的pH=7 的点上,但体积差距很小,可以忽略不计
①变色要灵敏、变色范围要小(一般不选择石蕊)
② 使变色范围尽量与滴定终点溶液的酸碱性一致
指示剂 变色范围(颜色与pH的关系) 石蕊 <5.0红色 5.0~8.0紫色
>8.0蓝色
酚酞 <8.2无色 8.2~10.0浅红色
>10.0红色
甲基橙 <3.1红色 3.1~4.4橙色
>4.4黄色
8 .210
5 8 3. 4.4
结合滴定终点选择指示剂:
终点时,溶液显碱性选酚酞;显酸性选甲基橙;显中性酚酞或甲基橙均可。 一般不选石蕊,变色现象不明显。
酚酞:
石蕊: 甲基橙:
围
(3)常见酸碱指示剂的变色范
(5)滴定终点的判断——以盐酸滴定未知浓度的NaOH 溶液为例 ① 若用酚酞作指示 剂,当滴入最后一滴盐酸时 ,溶液的颜色由粉红 色突变为无色,且半分钟内不变色,说明达到滴定终点②若用里 基橙作指示剂,当滴入最后一滴盐酸时,溶液的颜色由黄色变为 红色,且半分钟内不变色,说明达到滴定终点
滴定种类
指示剂
强酸—强碱(中性)
酚酞或甲基橙
强酸—弱碱(酸性)
甲基橙
强碱—弱酸(碱性)
酚酞
(4)中和滴定指示剂的选择
【几点强调】
①若滴定终点为碱性时,选择酚酞;酸性时,选择甲基橙;中性时,酚 酞、甲基橙都行
②在酸碱中和滴定的实验中,不用石蕊作指示剂,主要原因是:石蕊的 “红色→紫色”、“紫色→蓝色”的颜色变化不够明显,不利于及时、
准确地作出酸碱是否恰好完全中和的判断
③并不是所有的滴定都须使用指示剂,如:用标准的Na,SO 溶液滴定 KMnO 溶液时,KMnO 颜色褪去时即为滴定终点(氧化还原滴定)
④用HCl滴定0.1mol/L Na CO 溶液,第一步生成NaHCO 时,可选 用 酚酞为指示剂,由红色→浅红→无色。化学方程式为:Na CO +
HCl=NaHCO +NaCl; 第二步生成碳酸(CO T+H O), 可选用甲基橙 为指示剂,由黄色→橙色,化学方程式为:NaHCO +HCl=NaCl+
H O+CO 个(了解)
【几点强调】
⑤ 指示剂的用量一般是2~3滴。当指示剂刚好变色,并在半分钟内 不褪色,即认为已达到滴定终点。酸碱中和滴定是通过指示剂颜色 的变化来确定滴定终点(指示剂过多会影响测定结果)
⑥酸和碱的中和能力是指一定物质的量的酸(或碱)完全中和所消耗 的碱(或酸)的能力,而不是指酸碱中和后溶液的pH=7
【练一练】
4、以甲基橙为指示剂,用标准的盐酸来滴定未知浓度的氢
氧化钠溶液,滴定达终点时,溶液颜色变化是( C ) A、由黄色到红色 B、由橙色到红色
C、由黄色到橙色 D、由红色到橙色
c(待测)= V (待测) ,因为c(标准)与V(待测)已确定,所以只要
分析出不正确操作引起V (标准)的变化,即分析出结果。 即C待测的大小取决于V 标准的大小。
中和滴定实验中,产生误差的途径主要有操作不当、读数不 准等,分 析误差要根据计算式分析,c (标准) ·V(标准)=c (待测) ·V(待测),所以
C ( 标 准 ) ( 标 准 )
二、酸碱中和滴定误差分析
1、误差分析依据
图 I 图 Ⅱ
(1)如图I, 开始仰视读数,滴定完毕俯视读数,V(标准)偏小,滴定结果会偏小。
(2)如图Ⅱ,开始俯视读数,滴定完毕仰视读数,V (标准)偏大,滴定结果会偏大。
滴定管 正确的读数方法是视线、刻度线、凹液面最低点在同一水平线上。 试分析下列图示读数对滴定结果的影响:
2.滴定管读数误差分析
读数引起的误差:
1. 滴定时起始读数正确,达到终点后仰视刻度线
读数仰视时
偏高
2.滴定时起始读数正确,达到终点后俯视刻度线
偏低
读数俯视时
正确读数
先偏大 后偏小
实际读数
先仰后俯
V=V (后)-V(前),读数偏小
3.滴定前仰视刻度线,滴定后俯视刻度线
偏低
门 门 门 门 门 门 1
正确读数
先偏小 后偏大
上E 的 目 而 自
实际读数
先俯后仰
V=V (后)-V(前),读数偏大
4.滴定前俯视刻度线,滴定后仰视刻度线
偏高
0[F
步骤 操作 V标准
c(NaOH
)
洗涤 酸式滴定管未用标准溶液润洗 偏大
偏高
碱式滴定管未用待测液润洗 偏小
偏低
锥形瓶用待测液润洗 偏大
偏高
锥形瓶洗净后还留有蒸馏水 不变
无影响
取液 放出碱液的滴定管开始有气泡,放出液体后气泡消失 偏小
偏低
滴定 酸式滴定管滴定前有气泡,滴定终点时气泡消失 偏大
偏高
滴定过程中振荡锥形瓶时部分液体溅出 偏小
偏低
滴定时,部分酸液滴出锥形瓶外 偏大
偏高
滴定时有几滴标准溶液滴在锥形瓶的内壁上而未用蒸馏水冲入瓶内 偏大
偏高
溶液颜色较浅时滴入盐酸过快,停止滴定后反加一滴NaOH溶液无变 化 偏大
偏高
滴定完毕后立即读数,半分钟后颜色又褪去 偏小
偏低
读数 滴定前仰视读数或滴定后俯视读数 偏小
偏低
滴定前俯视读数或滴定后仰视读数 偏大
偏高
3.常见的误差分析—以用标准盐酸滴定待测氢氧化钠溶液为例
若把位置放反,则出现的误差相反。
②分析酸碱中和滴定实验误差时,可把影响因素归结到标准液用
量的多少上来判断。
若标准液用量偏多,则测定结果偏高;
若标准液用量偏少,则测定结果偏低;
若不影响标准液用量,则对测定结果无影响。
【几点强调】
①中和滴定误差分析时,标准液是放在滴定管中,待测液放在锥 形瓶中。
【练一练】
5、用标准盐酸滴定未知浓度的氢氧化钠溶液(氢氧化钠放于 锥形瓶中)下列操作对氢氧化钠溶液浓度有什么影响
a. 关于酸式滴定管
1.未用标准液(HCl)润洗酸式滴定管( 偏高)
2.滴定管尖嘴处有气泡,滴定后气泡消失( 偏高 ) 3.滴定操作时,有少量盐酸滴于锥形瓶外( 偏高) 4.滴定前仰视刻度,滴定后俯视刻度( 偏低 )
b.关于锥形瓶
5.锥形瓶内用蒸馏水洗涤后,再用待测氢氧化钠润洗2-3次,将润
洗液倒掉,再装NaOH 溶液( 偏高 )
6.锥形瓶用蒸馏水洗后未倒尽即装NaOH 溶液( 无影响 )
7.滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部( 偏低 )
c.关于碱式滴定管
8.碱式滴定管用水洗后,未用待测液润洗( 偏低 )
9.取待测液时,未将盛待测液的碱式滴定管尖嘴的气泡排除。取液
后滴定管尖嘴充满溶液(偏低 )
第三章水溶液中的离子反应与平衡 第二节电离平衡
3.2.3酸碱中和滴定
学习目标
1.了解酸碱中和滴定的原理。
2.了解指示剂的选择方法,熟记酸碱中和滴定的主要仪器的名称及 用途。
3. 掌握酸碱中和滴定的实验操作、数据处理、误差分析,并迁移应用 于其他滴定。
①滴入CuSO 溶液,称取沉淀质量
②用已知物质的量浓度的酸来测定未知物质的量浓度的碱溶液。
1、如何测定一瓶未知浓度的氢氧化钠溶液物质的量浓度
思考
(1)概念:依据中和反应,用已知浓度的酸或碱(标准液) 来测定未知浓 度的碱或酸(待 测 液 )的方法
2)原理:在中和反应中,酸提供的H+与碱提供的OH- 之间的物质的 量相等 (H++OH-=H O)
即 :c(H+)·V 酸三c(OH-)·V 碱
一、酸碱中和滴定实验
1、概念和原理
【练一练】
1、用0 . 1000mol/L 的HCl 溶液滴定20.00mL 未知浓度的 NaOH 溶液,滴定完成时,用去HCl溶液28.00mL 。通 过 中和滴定测得NaOH 溶液的物质的量浓度是多少
0.1400mol/L
【变式】把上题中HCl改成H SO4, 则NaOH 的物质的量浓 度为多少
50 ml
20℃
… )
l
2
50
20
(B)
u
l
u
滴定
管夹
铷
碱式滴定管
酸式滴定管
50mL 20℃
(A)
50
l
2
50
①构造:滴定管的管身是内径均匀、带有刻度的 细长玻璃管,酸式滴定管的下端是玻璃活塞,碱 式滴定管的下端是由橡皮管和玻璃球构成的 ②
滴定管的使用要求:酸式滴定管不能盛放碱液、 水解呈碱性的溶液和氢氟酸,可以盛放酸液、 氧 化性溶液和中性溶液,因为酸性和氧化性物质易 腐蚀橡胶管;碱式滴定管不能盛放酸液和强氧化
性溶液,可以盛放碱液和中性溶液,因为碱性物
质易腐蚀玻璃,致使活塞无法打开
(2)滴定管的认识仪器a是酸式滴定管,仪器b是碱式滴定管
b带玻璃球的橡胶塞
玻璃塞
0
1
2
l
m
山 m
a
50-
0
带玻璃球的橡胶塞
⑤用途:滴定管主要是用来精确地 量取一定体积的液体
25 mL 和50 两种 ④滴定管的
读数方法 0刻度在上,从上往下 读,读数时取小数点后两位,估读 至0.01 mL ; 如 :24.00 mL、
23.38 mL
③规格:滴定管的最小分度是0.1 mL ,实验室中常用滴定管的规格有
仪器a 是酸式滴定管,仪器b是碱式滴定管
“0”刻度线在上
标注温度、量程
a b
玻璃塞
mL
50-
【练一练】
2、读出以下液体体积的读数
0刻度处
25ml刻
度处
7
8
8
7
滴定管 量筒
【练一练】
3、有一支50mL的滴定管,其中盛有溶液,液面恰 好在10mL刻度处,把滴定管中的液体全部流下排 除,承接在量筒中,量筒中的溶液的体积( A )
A.大于40.0mL B.等于40.0mL
C.小于40.0mL D.等于10.0mL
① 检查仪器:使用滴定管前,首先要检查活塞是否漏水 ( 查 漏 )检查滴
定管是否漏水的方法:向滴定管内加水(对酸式滴定管,要先关闭活塞) 至液面在“O”刻度线附近,用滴定管夹将滴定管固定在铁架台上,观察 滴定管是否漏水。若不漏水,对酸式滴定管将活塞旋转180°,对碱式滴 定管松动其阀门,放出少量液体,再次观察滴定管是否漏水,经两次检 查都不漏水的滴定管是检漏合格的滴定管。只有不漏水的滴定管才能使 用,若滴定管漏水,则不能使用
②润洗仪器:滴定管在加入酸、碱反应液之前,先用蒸馏水洗涤干净,
然后分别用待装液润洗2~3次 (润洗)润洗的方法:从滴定管上口加入 3~5 mL所要盛装的酸或碱,倾斜着转动滴定管,使液体润湿全部滴定 管内壁。然后,一手控制活塞(轻轻转动酸式滴定管的活塞;或者轻轻挤 压碱式滴定管中的玻璃球),将液体从滴定管下部放入预置的烧杯中
(3)滴定管的使用方法
③加入反应液:分别将酸、碱反应液加入酸式、碱式滴定管中,使 液面位于“0”刻度以上2~3 mL 处,并将滴定管垂直固定在滴定管 夹上( 装液 )
④赶气泡:在滴定管下放一烧杯,调节活塞或玻璃球,使滴定管尖
嘴部分充满反应液,如果滴定管内部有气泡,应快速放液以赶出气 泡(酸式滴定管→快速放液;碱式滴定管→橡皮管向上翘起)
⑤调液面记数据:然后调节滴定管夜面使其处于“ Q” 刻度或“0” 刻度以下的某一刻度,准确读取数值并记录
⑥放出反应液:根据实验需要从滴定管中逐滴放出一定量的反应液
排气泡的方法——快速放液的方法 酸式滴定 管 将酸式滴定管垂直夹持在滴定管夹上,旋转活塞,使溶液快速流出 的同时使气泡排出 碱式滴定 管 将碱式滴定管垂直夹持在滴定管夹上,使尖嘴 向上,并捏住小球后上部的橡皮管,使溶液快 速流出的同时使气泡排出
排碱式滴定
管胶管中气泡的方法
②滴定管洗涤:应先用自来水,再用蒸馏水,然后再用标准溶液( 或 待测溶液)润洗2~3次,以避免溶液被滴定管内壁上附着的蒸馏水稀 释而导致浓度变小(酸式滴定管用盐酸润洗,碱式滴定管用氢氧化钠 溶液润洗)
③洗涤的原则:少量多次
④洗涤的标准:管内壁不挂水珠
4、实验操作——以用盐酸标准液滴定NaOH 溶液为例
①锥形瓶:只能用蒸馏水洗涤,不能用待测溶液润洗
(1)查漏:使用前先检查滴定管活塞是否漏水(2)洗涤
(4)滴定:在锥形瓶下垫一张白纸,左手控制滴定管的活塞,向锥 形瓶中先快后慢地加入标准盐酸(后面逐滴加入,接近终点时,改 成滴加半滴酸),右手摇动锥形瓶,眼睛观察锥形瓶内溶液的颜色
变化
赶出气泡、调节液面至“ 0”刻度后,用碱式滴定管向锥形瓶中
滴入25.00 mL 待测溶液(待测液装在锥形瓶中 ) ,再向其中滴加 2滴酚酞溶液②向润洗过的酸式滴定管中加入标准盐酸,赶出气 泡、调节液面至“0”刻度后准确记录读数为V mL
(3)取液①向润洗过的碱式滴定管中加入待测浓度的NaOH 溶液,
左手
控制滴定管的活塞
右手
摇动锥形瓶
眼睛注视
锥形瓶内溶液的颜色变化
读数:当加入最后半滴标准盐酸,溶液由粉红色变为无色,且 半分钟内不变色,停止滴定。平视酸式滴定管中凹液面最低点, 读取溶液体积为V mL (盐酸的体积)
(6)计算:以(V =V )为消耗的标准盐酸的体积,取2~3次实 验结果的平均值,依据
计算待测NaOH 溶液的物质的量浓度
滴定次数 待测NaOH溶液的体 积/mL 0.1032mol ·L-1盐酸的体积/mL 滴定前刻 度 滴定后刻 文
溶液体积 /mL
第一次 25.00 0.00 26.11
26.11
第二次 25.00 1.56 30.30
第三次 25.00 0.22 26.31
26.09
例,某学生用0.1032 mol ·L-1盐酸溶液滴定未知浓度的
NaOH 溶液,依据表中数据计算该NaOH 溶液的物质的量浓 度 0.1077mol·L-1
【几点强调】
① 滴速:先快后慢,当 接近终点时,应一滴一摇,甚至半滴一摇,利用 锥形瓶内壁承接尖嘴处悬挂的半滴溶液
②终点的判断:滴入最后一滴标准液,指示剂变色,且在半分钟内不变 回原色,视为滴定终点③滴定终点的判断答题模板:当滴入最后一滴
×××××标准溶液后,溶液由××色变成××色,且半分钟内不恢复原来 的颜色
解答此类题目的三个关键点:
a.最后一滴:必须说明是滴入“最后一滴”溶液。
b. 颜色变化:必须说明滴入“最后一滴”溶液后,溶液“颜色的变化”。 c.半分钟:必须说明溶液颜色变化后“半分钟内不褪色”。④滴定操作 要点:左手控制活塞或玻璃小球,右手摇动锥形瓶,两眼注视锥形瓶内 溶液颜色的变化⑤在滴定过程中锥形瓶瓶口不能碰滴定管下端尖嘴
中和滴定记忆口决
先查漏液再润洗,装液排气调液面; 左手活塞右手瓶,瓶不润洗要记清; 眼看颜色手不停,三十秒钟要记清。
2、为什么要用酸碱指示剂
加入指示剂是为了确定化学反应的终点
3、如何选择合适的指示剂
5、指示剂的选择
思考
用0.1000 mol ·L-1NaOH溶液滴定20.00 mL 0.100 0 mol ·L- HCl溶液过程中的pH变化曲线 加入的 VNaOH(mL 余 VHci(mL 过量 VNaOH( mL) pH
中和滴定曲线
0.00 20.00 1.0
18.00 2.00 2.3 19.80 0.20 3.3 19.98 0.02 4.3 20.00 0.00 7.0 20.02 0.02 9.7 20.20 0.20 10.7 22.00 2.00 11.7 40.00 20.00 12.5
(1)中和滴定曲线:以滴加酸(或碱)的量为横坐标,以溶液的pH 为纵 坐标绘出一条溶液的pH 随酸(或碱)的滴加量而变化的曲线
pH
酚酞
20 30 40
V[NaOH(aq)]/mL
反应终点
突变范围
甲基橙
12
10
8
4
2
0
6
10
(2)指示剂选择的依据:由曲线可以看出,在酸、碱中和滴定过程中, 溶液的pH 在接近滴定终点时有一个突变过程,在此范围内,滴加
很少的酸(或碱), 溶液的pH就有很大的变化,能使指示剂的颜色 发生明显变化,有利于确定滴定终点,所以即使酚酞、甲基橙的变 色不在恰好中和的pH=7 的点上,但体积差距很小,可以忽略不计
①变色要灵敏、变色范围要小(一般不选择石蕊)
② 使变色范围尽量与滴定终点溶液的酸碱性一致
指示剂 变色范围(颜色与pH的关系) 石蕊 <5.0红色 5.0~8.0紫色
>8.0蓝色
酚酞 <8.2无色 8.2~10.0浅红色
>10.0红色
甲基橙 <3.1红色 3.1~4.4橙色
>4.4黄色
8 .210
5 8 3. 4.4
结合滴定终点选择指示剂:
终点时,溶液显碱性选酚酞;显酸性选甲基橙;显中性酚酞或甲基橙均可。 一般不选石蕊,变色现象不明显。
酚酞:
石蕊: 甲基橙:
围
(3)常见酸碱指示剂的变色范
(5)滴定终点的判断——以盐酸滴定未知浓度的NaOH 溶液为例 ① 若用酚酞作指示 剂,当滴入最后一滴盐酸时 ,溶液的颜色由粉红 色突变为无色,且半分钟内不变色,说明达到滴定终点②若用里 基橙作指示剂,当滴入最后一滴盐酸时,溶液的颜色由黄色变为 红色,且半分钟内不变色,说明达到滴定终点
滴定种类
指示剂
强酸—强碱(中性)
酚酞或甲基橙
强酸—弱碱(酸性)
甲基橙
强碱—弱酸(碱性)
酚酞
(4)中和滴定指示剂的选择
【几点强调】
①若滴定终点为碱性时,选择酚酞;酸性时,选择甲基橙;中性时,酚 酞、甲基橙都行
②在酸碱中和滴定的实验中,不用石蕊作指示剂,主要原因是:石蕊的 “红色→紫色”、“紫色→蓝色”的颜色变化不够明显,不利于及时、
准确地作出酸碱是否恰好完全中和的判断
③并不是所有的滴定都须使用指示剂,如:用标准的Na,SO 溶液滴定 KMnO 溶液时,KMnO 颜色褪去时即为滴定终点(氧化还原滴定)
④用HCl滴定0.1mol/L Na CO 溶液,第一步生成NaHCO 时,可选 用 酚酞为指示剂,由红色→浅红→无色。化学方程式为:Na CO +
HCl=NaHCO +NaCl; 第二步生成碳酸(CO T+H O), 可选用甲基橙 为指示剂,由黄色→橙色,化学方程式为:NaHCO +HCl=NaCl+
H O+CO 个(了解)
【几点强调】
⑤ 指示剂的用量一般是2~3滴。当指示剂刚好变色,并在半分钟内 不褪色,即认为已达到滴定终点。酸碱中和滴定是通过指示剂颜色 的变化来确定滴定终点(指示剂过多会影响测定结果)
⑥酸和碱的中和能力是指一定物质的量的酸(或碱)完全中和所消耗 的碱(或酸)的能力,而不是指酸碱中和后溶液的pH=7
【练一练】
4、以甲基橙为指示剂,用标准的盐酸来滴定未知浓度的氢
氧化钠溶液,滴定达终点时,溶液颜色变化是( C ) A、由黄色到红色 B、由橙色到红色
C、由黄色到橙色 D、由红色到橙色
c(待测)= V (待测) ,因为c(标准)与V(待测)已确定,所以只要
分析出不正确操作引起V (标准)的变化,即分析出结果。 即C待测的大小取决于V 标准的大小。
中和滴定实验中,产生误差的途径主要有操作不当、读数不 准等,分 析误差要根据计算式分析,c (标准) ·V(标准)=c (待测) ·V(待测),所以
C ( 标 准 ) ( 标 准 )
二、酸碱中和滴定误差分析
1、误差分析依据
图 I 图 Ⅱ
(1)如图I, 开始仰视读数,滴定完毕俯视读数,V(标准)偏小,滴定结果会偏小。
(2)如图Ⅱ,开始俯视读数,滴定完毕仰视读数,V (标准)偏大,滴定结果会偏大。
滴定管 正确的读数方法是视线、刻度线、凹液面最低点在同一水平线上。 试分析下列图示读数对滴定结果的影响:
2.滴定管读数误差分析
读数引起的误差:
1. 滴定时起始读数正确,达到终点后仰视刻度线
读数仰视时
偏高
2.滴定时起始读数正确,达到终点后俯视刻度线
偏低
读数俯视时
正确读数
先偏大 后偏小
实际读数
先仰后俯
V=V (后)-V(前),读数偏小
3.滴定前仰视刻度线,滴定后俯视刻度线
偏低
门 门 门 门 门 门 1
正确读数
先偏小 后偏大
上E 的 目 而 自
实际读数
先俯后仰
V=V (后)-V(前),读数偏大
4.滴定前俯视刻度线,滴定后仰视刻度线
偏高
0[F
步骤 操作 V标准
c(NaOH
)
洗涤 酸式滴定管未用标准溶液润洗 偏大
偏高
碱式滴定管未用待测液润洗 偏小
偏低
锥形瓶用待测液润洗 偏大
偏高
锥形瓶洗净后还留有蒸馏水 不变
无影响
取液 放出碱液的滴定管开始有气泡,放出液体后气泡消失 偏小
偏低
滴定 酸式滴定管滴定前有气泡,滴定终点时气泡消失 偏大
偏高
滴定过程中振荡锥形瓶时部分液体溅出 偏小
偏低
滴定时,部分酸液滴出锥形瓶外 偏大
偏高
滴定时有几滴标准溶液滴在锥形瓶的内壁上而未用蒸馏水冲入瓶内 偏大
偏高
溶液颜色较浅时滴入盐酸过快,停止滴定后反加一滴NaOH溶液无变 化 偏大
偏高
滴定完毕后立即读数,半分钟后颜色又褪去 偏小
偏低
读数 滴定前仰视读数或滴定后俯视读数 偏小
偏低
滴定前俯视读数或滴定后仰视读数 偏大
偏高
3.常见的误差分析—以用标准盐酸滴定待测氢氧化钠溶液为例
若把位置放反,则出现的误差相反。
②分析酸碱中和滴定实验误差时,可把影响因素归结到标准液用
量的多少上来判断。
若标准液用量偏多,则测定结果偏高;
若标准液用量偏少,则测定结果偏低;
若不影响标准液用量,则对测定结果无影响。
【几点强调】
①中和滴定误差分析时,标准液是放在滴定管中,待测液放在锥 形瓶中。
【练一练】
5、用标准盐酸滴定未知浓度的氢氧化钠溶液(氢氧化钠放于 锥形瓶中)下列操作对氢氧化钠溶液浓度有什么影响
a. 关于酸式滴定管
1.未用标准液(HCl)润洗酸式滴定管( 偏高)
2.滴定管尖嘴处有气泡,滴定后气泡消失( 偏高 ) 3.滴定操作时,有少量盐酸滴于锥形瓶外( 偏高) 4.滴定前仰视刻度,滴定后俯视刻度( 偏低 )
b.关于锥形瓶
5.锥形瓶内用蒸馏水洗涤后,再用待测氢氧化钠润洗2-3次,将润
洗液倒掉,再装NaOH 溶液( 偏高 )
6.锥形瓶用蒸馏水洗后未倒尽即装NaOH 溶液( 无影响 )
7.滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部( 偏低 )
c.关于碱式滴定管
8.碱式滴定管用水洗后,未用待测液润洗( 偏低 )
9.取待测液时,未将盛待测液的碱式滴定管尖嘴的气泡排除。取液
后滴定管尖嘴充满溶液(偏低 )
