3.4配合物与超分子 高二化学人教版(2019)选择性必修2(共17张PPT)
文档属性
| 名称 | 3.4配合物与超分子 高二化学人教版(2019)选择性必修2(共17张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-14 00:00:00 | ||
图片预览





文档简介
(共17张PPT)
第三章晶体结构与性质
第四节配合物与超分子
课时1配合物与超分子
课堂学习
H O
十 Cu + → H O:Cu +:OH
刚才的视频中我们发现铜盐固体的颜色不同,但在溶于水后 都变成了蓝色,右图中的晶体又是如何结合的呢
H O
孤电子对 具有空轨道 配位键
配位键与配合物
O
H H
CuSO,5H O 晶体 CuCl, ·2H,O晶体
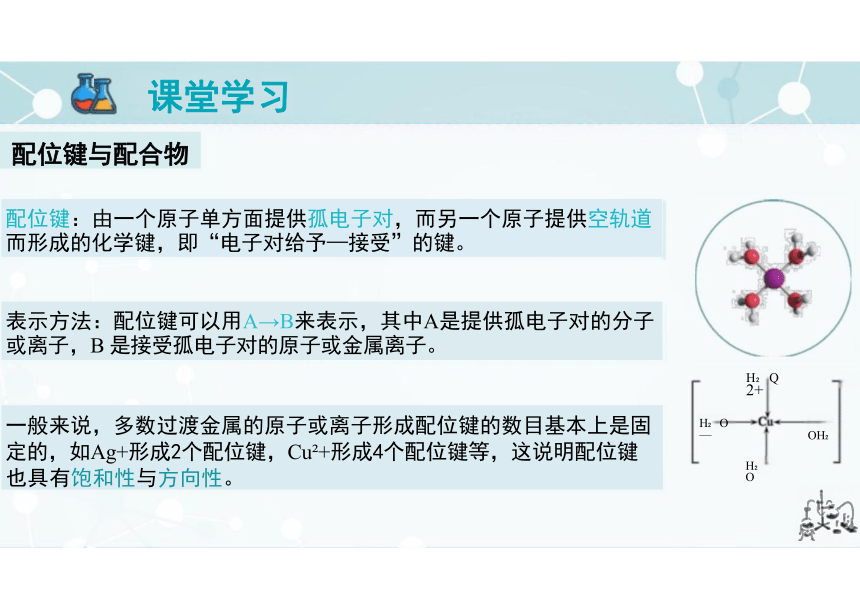
一般来说,多数过渡金属的原子或离子形成配位键的数目基本上是固 定的,如Ag+形成2个配位键,Cu +形成4个配位键等,这说明配位键 也具有饱和性与方向性。
课堂学习
表示方法:配位键可以用A→B来表示,其中A是提供孤电子对的分子 或离子,B 是接受孤电子对的原子或金属离子。
配位键:由一个原子单方面提供孤电子对,而另一个原子提供空轨道 而形成的化学键,即“电子对给予—接受”的键。
配位键与配合物
H Q 2+
OH
H O—
H O
配合物(配位化合物):金属离子或原子(称为中心 离子或原子)与某些分子或离子(称为配体或配位 体)以配位键结合形成的化合物。
相关概念:
①中心原子(离子):提供空轨道,接受孤电子对, 通常是过渡元素的原子或离子,如Fe、Ni、Fe +、 Cu +、Zn +、Ag+、Co +、Cr +等。
②配位体:提供孤电子对的离子或分子,如分子 CO、NH 、H O 等,阴离子F、CN-、Cl-等,配 位原子必须有孤电子对。
③配位数:直接同中心原子(离子)配位的分子或 离子的数目。
课堂学习
[Cu(NH ) JSO
中 心 离 子 配 体 配 位 数 离 子 ( 外 界 )
配离子(内界)
相关概念:
①内界:配离子称为内界。
②外界:组成中的其余离子。
③配合物不一定存在外界,如Ni(CO)4。
配位键与配合物
实验现象:滴加氨水后,试管中首先出现蓝色沉淀,氨 水过量后沉淀逐渐溶解,得到深蓝色的透明溶液,滴加 乙醇后析出深蓝色晶体。
实验原理:
Cu ++2NH ·H O=Cu(OH) ↓+2NH +
Cu(OH) +4NH =[Cu(NH ) ] ++2OH-
[Cu(NH ) ] ++SO -+H O=[Cu(NH ) ]SO ·H OJ
实验现象:滴加AgNO 溶液后,试管中出现白色沉淀, 继续滴加氨水沉淀溶解,溶液呈无色。
实验原理:
AgCl+2NH =[Ag(NH ) ] ++Cl-
课堂学习
l mol·L-1 氨水 4 mL 0.1 mol·L- CuSO 溶液
8 mL 0.1 mol·L- 95%AgNO 溶液 乙醇
l mol·L-
0
0 氨水
0 0
0 0
配位键与配合物
0.1 mol·L-1 FeCl 溶液
0.1 mol·L-1
KSCN溶液
0.1 mol·L-1 NaCl溶液
0
0
0
配合物的形成对性质的影响:
(1)颜色改变,如Fe(SCN) 的形成;
(2)溶解度改变,如[Ag(NH ) ]+的形成;
(3)稳定性增强,配合物具有一定的稳定性,配合物中 的配位键越强,配合物越稳定。当作为中心离子的金 属离子相同时,配合物的稳定性与配体的性质有关。
配位键的稳定性比较:
①电子对给予体形成配位键的能力:NH >H O;
②接受体形成配位键的能力:H+> 过渡金属>主族金 属;
③配位键越强,配合物越稳定,如稳定性:Cu +—OH-驱 课堂学习
配位键与配合物
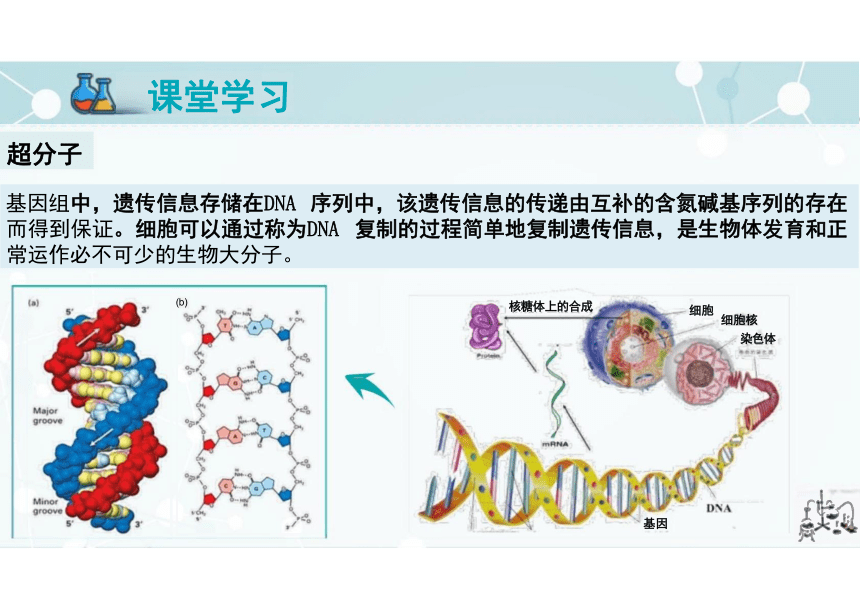
基因组中,遗传信息存储在DNA 序列中,该遗传信息的传递由互补的含氮碱基序列的存在 而得到保证。细胞可以通过称为DNA 复制的过程简单地复制遗传信息,是生物体发育和正 常运作必不可少的生物大分子。
课堂学习
超分子
细胞核
染色体
核糖体上的合成
基因
细胞
(b)
7π 课堂学习
分子间相互作用:通过非共价键结合,包括氢键、静 电作用、疏水作用以及一些分子与金属离子形成的弱 配位键等。
超分子:由两种或两种以上的分子(或离子)通过分子间 相互作用形成的分子聚集体。
A 与T通过2个氢键配对,G 与C 通过3个氢键配对,DNA 的双螺旋结构碱基对是通过氢键相互识别并结合的。
DNA双螺旋的两条分子链是通过什么作用力结合的
超分子
(1)超分子定义中的分子是广义的,包括离子; (2)超分子这种分子聚集体,有的是有限的,
有的是无限伸展的。
60
十
甲苯过滤
氯仿
超分子:由两种或两种以上的分子(或离子)通 过分子间相互作用形成的分子聚集体。
超分子的两个重要特征是分子识别和自组装。
60 70
超分子
C
70
溶于 甲苯
课堂学习
π
超分子不溶
于甲苯
超分子
“杯酚”
不溶于氯仿
溶于
氯仿
循环 使用
C
60
冠醚是皇冠状的分子,有不同大小的空穴,能与正 离子,尤其是碱金属离子络合,并随环的大小不同 而与不同的金属离子络合,利用此性质可以识别碱 金属离子。
课堂学习
12-冠-4
C 原子:8 O 原子:4
15-冠-5
C 原子:10 O 原子:5
C 原子:12
O原子:6
超分子
18-冠-6
冠醚,是分子中含有多个-氧-亚甲基- 结构单元的大环多醚。冠醚的空穴结 构对离子有选择作用,不同冠醚的空 腔尺寸不同,与不同的阳离子相匹配 (配位作用),从而实现选择性结合(识 别不同大小的碱金属离子),在有机 反应中可作催化剂。
冠醚冠醚空腔直径/pm合适的粒子(直径/pm)
12-冠-4 120~150 Li+(152)
15-冠-5 170~220 Nat(204)
18-冠-6 260~320 K+(276)Rb+(304)
21-冠-7 340~430 Cs+(334)
冠醚中,C 原子是环的骨架,稳定了整个冠醚,O 原子吸引阳离 子,冠醚与碱金属离子之间的配位键属于共价键,冠醚与碱金 属离子形成配合物得到的晶体里存在着阴离子,这类晶体属于 离子晶体。
π 课堂学习
超分子
高锰酸钾溶液可以氧化甲苯,从而褪色,但是 高锰酸钾溶解在水中,难溶于甲苯,难以和甲 苯充分接触,实验时需要不断振荡,二者才能 充分反应,溶液从而褪色。若在该实验中加入 冠醚,可以起到催化作用。
甲苯中冠醚的浓度
褪色时间
30 g/L
5 min不褪色
60 g/L
5 min明显褪色
120 g/L
4.5 min明显褪色
课堂学习
表面活性剂在水中会形成亲水基团向外、疏水 基团向内的胶束,油渍等污垢是疏水的,会被 包裹在胶束内腔,这就是肥皂和洗涤剂的去污 原理。
超分子组装的过程称为分子自组装,自组装过 程是使超分子产生高度有序的过程。
超分子
纯水 洗洁精 胶束
丁达尔效应
这些分子之所以被称为表面活性剂,是由于它们会分散在水的液体表面形成一层疏 水基团朝向空气的单分子层,又称单分子膜,从而大大降低水的表面张力。高浓度 时,剩余的表面活性剂在溶液中形成胶束。
具 π 课堂学习
表面活性剂从分子结构上说,也叫两亲分子——亲水性和亲脂性,分子的一端有极 性,称为亲水基团,另一端没有或几乎没有极性,称为疏水基团。
亲水基团 疏水基团
表面活性剂单体
超分子
空氢
单分子层
课堂巩固
正误判断
1.配位键是一种很特殊的共价键。 √
2.有配位键的化合物一定是配位化合物。 X
3.配合物与人类的生产生活和科学技术联系密切。 √
4.细胞和细胞器的双分子膜、DNA 分子都属于超分子。 √
中未成对电子数等于5。下列说法正确的是
A.X 与Z形成的化合物不可能含非极性共价键 B.Y、Z、W、L 的原子半径排序:L>W>Z>Y
C.M + 的配位数为6
D. 简单气态氢化物键角:WX >ZX
课堂巩固
一种新型补血药剂的结构如下图所示:其中X 、Y 、Z 、W 、L是原子序 数依次增大的短周期主族元素,Y、Z、W 相 邻 ,X 与L同主族,基态M +
( C )
驱 课堂小结
第四节
配合物与超分子
第1课时
概念
表示方法
形成条件
概念
组成
成键特征
配合物的形成对性质的影响
概念
特征
应用
配位键
配合物
超分子
谢谢观看
T H A
第三章晶体结构与性质
第四节配合物与超分子
课时1配合物与超分子
课堂学习
H O
十 Cu + → H O:Cu +:OH
刚才的视频中我们发现铜盐固体的颜色不同,但在溶于水后 都变成了蓝色,右图中的晶体又是如何结合的呢
H O
孤电子对 具有空轨道 配位键
配位键与配合物
O
H H
CuSO,5H O 晶体 CuCl, ·2H,O晶体
一般来说,多数过渡金属的原子或离子形成配位键的数目基本上是固 定的,如Ag+形成2个配位键,Cu +形成4个配位键等,这说明配位键 也具有饱和性与方向性。
课堂学习
表示方法:配位键可以用A→B来表示,其中A是提供孤电子对的分子 或离子,B 是接受孤电子对的原子或金属离子。
配位键:由一个原子单方面提供孤电子对,而另一个原子提供空轨道 而形成的化学键,即“电子对给予—接受”的键。
配位键与配合物
H Q 2+
OH
H O—
H O
配合物(配位化合物):金属离子或原子(称为中心 离子或原子)与某些分子或离子(称为配体或配位 体)以配位键结合形成的化合物。
相关概念:
①中心原子(离子):提供空轨道,接受孤电子对, 通常是过渡元素的原子或离子,如Fe、Ni、Fe +、 Cu +、Zn +、Ag+、Co +、Cr +等。
②配位体:提供孤电子对的离子或分子,如分子 CO、NH 、H O 等,阴离子F、CN-、Cl-等,配 位原子必须有孤电子对。
③配位数:直接同中心原子(离子)配位的分子或 离子的数目。
课堂学习
[Cu(NH ) JSO
中 心 离 子 配 体 配 位 数 离 子 ( 外 界 )
配离子(内界)
相关概念:
①内界:配离子称为内界。
②外界:组成中的其余离子。
③配合物不一定存在外界,如Ni(CO)4。
配位键与配合物
实验现象:滴加氨水后,试管中首先出现蓝色沉淀,氨 水过量后沉淀逐渐溶解,得到深蓝色的透明溶液,滴加 乙醇后析出深蓝色晶体。
实验原理:
Cu ++2NH ·H O=Cu(OH) ↓+2NH +
Cu(OH) +4NH =[Cu(NH ) ] ++2OH-
[Cu(NH ) ] ++SO -+H O=[Cu(NH ) ]SO ·H OJ
实验现象:滴加AgNO 溶液后,试管中出现白色沉淀, 继续滴加氨水沉淀溶解,溶液呈无色。
实验原理:
AgCl+2NH =[Ag(NH ) ] ++Cl-
课堂学习
l mol·L-1 氨水 4 mL 0.1 mol·L- CuSO 溶液
8 mL 0.1 mol·L- 95%AgNO 溶液 乙醇
l mol·L-
0
0 氨水
0 0
0 0
配位键与配合物
0.1 mol·L-1 FeCl 溶液
0.1 mol·L-1
KSCN溶液
0.1 mol·L-1 NaCl溶液
0
0
0
配合物的形成对性质的影响:
(1)颜色改变,如Fe(SCN) 的形成;
(2)溶解度改变,如[Ag(NH ) ]+的形成;
(3)稳定性增强,配合物具有一定的稳定性,配合物中 的配位键越强,配合物越稳定。当作为中心离子的金 属离子相同时,配合物的稳定性与配体的性质有关。
配位键的稳定性比较:
①电子对给予体形成配位键的能力:NH >H O;
②接受体形成配位键的能力:H+> 过渡金属>主族金 属;
③配位键越强,配合物越稳定,如稳定性:Cu +—OH-
配位键与配合物
基因组中,遗传信息存储在DNA 序列中,该遗传信息的传递由互补的含氮碱基序列的存在 而得到保证。细胞可以通过称为DNA 复制的过程简单地复制遗传信息,是生物体发育和正 常运作必不可少的生物大分子。
课堂学习
超分子
细胞核
染色体
核糖体上的合成
基因
细胞
(b)
7π 课堂学习
分子间相互作用:通过非共价键结合,包括氢键、静 电作用、疏水作用以及一些分子与金属离子形成的弱 配位键等。
超分子:由两种或两种以上的分子(或离子)通过分子间 相互作用形成的分子聚集体。
A 与T通过2个氢键配对,G 与C 通过3个氢键配对,DNA 的双螺旋结构碱基对是通过氢键相互识别并结合的。
DNA双螺旋的两条分子链是通过什么作用力结合的
超分子
(1)超分子定义中的分子是广义的,包括离子; (2)超分子这种分子聚集体,有的是有限的,
有的是无限伸展的。
60
十
甲苯过滤
氯仿
超分子:由两种或两种以上的分子(或离子)通 过分子间相互作用形成的分子聚集体。
超分子的两个重要特征是分子识别和自组装。
60 70
超分子
C
70
溶于 甲苯
课堂学习
π
超分子不溶
于甲苯
超分子
“杯酚”
不溶于氯仿
溶于
氯仿
循环 使用
C
60
冠醚是皇冠状的分子,有不同大小的空穴,能与正 离子,尤其是碱金属离子络合,并随环的大小不同 而与不同的金属离子络合,利用此性质可以识别碱 金属离子。
课堂学习
12-冠-4
C 原子:8 O 原子:4
15-冠-5
C 原子:10 O 原子:5
C 原子:12
O原子:6
超分子
18-冠-6
冠醚,是分子中含有多个-氧-亚甲基- 结构单元的大环多醚。冠醚的空穴结 构对离子有选择作用,不同冠醚的空 腔尺寸不同,与不同的阳离子相匹配 (配位作用),从而实现选择性结合(识 别不同大小的碱金属离子),在有机 反应中可作催化剂。
冠醚冠醚空腔直径/pm合适的粒子(直径/pm)
12-冠-4 120~150 Li+(152)
15-冠-5 170~220 Nat(204)
18-冠-6 260~320 K+(276)Rb+(304)
21-冠-7 340~430 Cs+(334)
冠醚中,C 原子是环的骨架,稳定了整个冠醚,O 原子吸引阳离 子,冠醚与碱金属离子之间的配位键属于共价键,冠醚与碱金 属离子形成配合物得到的晶体里存在着阴离子,这类晶体属于 离子晶体。
π 课堂学习
超分子
高锰酸钾溶液可以氧化甲苯,从而褪色,但是 高锰酸钾溶解在水中,难溶于甲苯,难以和甲 苯充分接触,实验时需要不断振荡,二者才能 充分反应,溶液从而褪色。若在该实验中加入 冠醚,可以起到催化作用。
甲苯中冠醚的浓度
褪色时间
30 g/L
5 min不褪色
60 g/L
5 min明显褪色
120 g/L
4.5 min明显褪色
课堂学习
表面活性剂在水中会形成亲水基团向外、疏水 基团向内的胶束,油渍等污垢是疏水的,会被 包裹在胶束内腔,这就是肥皂和洗涤剂的去污 原理。
超分子组装的过程称为分子自组装,自组装过 程是使超分子产生高度有序的过程。
超分子
纯水 洗洁精 胶束
丁达尔效应
这些分子之所以被称为表面活性剂,是由于它们会分散在水的液体表面形成一层疏 水基团朝向空气的单分子层,又称单分子膜,从而大大降低水的表面张力。高浓度 时,剩余的表面活性剂在溶液中形成胶束。
具 π 课堂学习
表面活性剂从分子结构上说,也叫两亲分子——亲水性和亲脂性,分子的一端有极 性,称为亲水基团,另一端没有或几乎没有极性,称为疏水基团。
亲水基团 疏水基团
表面活性剂单体
超分子
空氢
单分子层
课堂巩固
正误判断
1.配位键是一种很特殊的共价键。 √
2.有配位键的化合物一定是配位化合物。 X
3.配合物与人类的生产生活和科学技术联系密切。 √
4.细胞和细胞器的双分子膜、DNA 分子都属于超分子。 √
中未成对电子数等于5。下列说法正确的是
A.X 与Z形成的化合物不可能含非极性共价键 B.Y、Z、W、L 的原子半径排序:L>W>Z>Y
C.M + 的配位数为6
D. 简单气态氢化物键角:WX >ZX
课堂巩固
一种新型补血药剂的结构如下图所示:其中X 、Y 、Z 、W 、L是原子序 数依次增大的短周期主族元素,Y、Z、W 相 邻 ,X 与L同主族,基态M +
( C )
驱 课堂小结
第四节
配合物与超分子
第1课时
概念
表示方法
形成条件
概念
组成
成键特征
配合物的形成对性质的影响
概念
特征
应用
配位键
配合物
超分子
谢谢观看
T H A
