2.3物质的量高一化学人教版(2019)必修第一册(共47张PPT)
文档属性
| 名称 | 2.3物质的量高一化学人教版(2019)必修第一册(共47张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 8.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-14 19:22:31 | ||
图片预览











文档简介
(共47张PPT)
物质的量的课件
通过自主学习,了解影响物质体积的因素
了解气体摩尔体积的概念,并会进行简 单的计算
掌握阿伏加德罗定律及其推论
学习目标
2
固体 气体
膨胀、体积变大
是什么呢
思考与讨论 课本P52 1L=1000cm
在一定条件下,Imol 不同物质的体积如下表所示。观察并分析表中的数据,你 能得出哪些结论 与同学讨论。
气体
H
O
0℃、101 kPa时的体积/L
液体
20℃时的体积/cm
固体
22.4
H O
18.0
Fe
22.4
H SO
53.6
Al
20℃时的体积/cm
7.12
10.0
只相同。
半
二、摩尔质量
定 义 :单位物质的量的物质所具有的质量
符号:M 摩尔质量与相对分子质量或相对原子质量的
单位:g/mol 数值相等,单位不等 【提醒一】摩尔质量≠相对分子质量或相对原子质量。
例:O 的相对原子质量是16,则氧气的摩尔质量是32g/mol
SO 的相对质量为96,则SO 的摩尔质量为96g/mol
【提醒二】对于离子来说,电子的质量很小,可忽略不计
【提醒三】摩尔质量的值是一个定值,不随物质的物质的量的改变而改变
关 系 (摩尔质量以g/mol 为单位):
●Mg
●Al ●P ●S ●CI ●K ●Ca
24
27
31
32
35.5 39
40
●H
●C ●N ●0 ●Na
常见的相对原子质量
1
12
14
16
23
342g 蔗糖
63.5g Cu
44g 干冰
18g H O
1mol不同物质的质量
24 g Mg
65 g Zn
32 g S
物质的量 (n)、质 量(m) 与摩尔质量(M) 之间的关系:
m=n×M
【解】Na CO 的相对分子质量为106,摩尔质量为106 g/mol。
n(Na CO )= (m(Na2CO3))/(M(Na2CO3))
=(26.5 g)/(106 g/mol)
=0.25 mol
答:26.5 gNa CO 的物质的量是0.25 mol。
例126.5 g Na CO 的物质的量是多少
26.5g Na CO 的物质的量是多少 溶于水后能电离出Na 的数目是多少
(已知:Na CO 的相对分子质量为106)
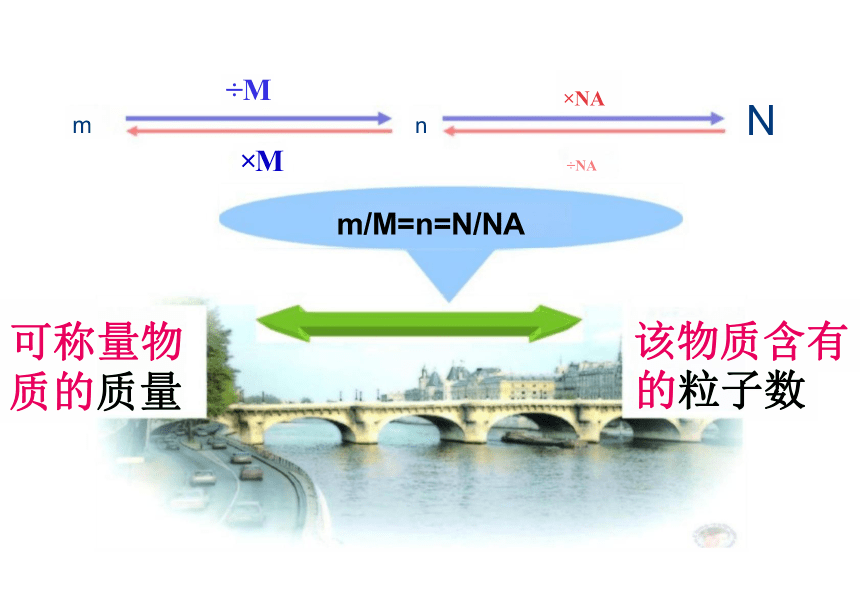
该物质含有 的粒子数
可称量物 质的质量
÷M
×M
m/M=n=N/NA
×NA
÷NA
N
m
n
物质的量 该物质含有
的粒子数
n × N
物质的量 ÷NA
m/M=n= N/NA
可称量物
质的质量
N
粒子数
M=
÷M
×M
质量
【牛刀小试】
1、CO 的摩尔质量是 ,Cl 原子的摩尔质量是 。 2、3mol H O的质量是 ,58.5g NaCl的物质的量是 。 3、17g某气体含有6.02×10 个分子,则该物质的相对分子质量 为:
4、54g AI 含有__ 个铝离子,_____mol电 子 , _mol电荷。
【课后练习】
1、3.01×10 个H S分子含有H原子约______mol。
2 、0.6mol Na SO 含约 个Na。
3 、24gCH 中含有______mol C原子,约 个H原子。
4 、48g SO 含_____ mol 0原子, _mol 质子, ___mol 电子。
5、9.03×10 个H 0分子的质量是 _ _ _ _ 。
6、下列物质中,质量最大的是_______,分子数最多的是_______。
A.64g SO B.3.01×10 个N
C.0.75mol H SO D.4g NaOH
单位 ·
数学表达式 va=Y
标准状况温度0℃ ,压强101 kPa ,气体摩尔体积
约为22.4 L·mol-1 , 该状况可简写为STP
影响因素气体所处的 温度和压强
单位物质的量的气体所占的体 积
Vm
二、气体摩尔体积
定义
符号
气 体 摩 尔 体 积
L mol-1
【思考 ·讨论】
(1)气体摩尔体积适用范围是气体,是否必须为纯净气体
提示:气体摩尔体积的适用范围是气体,可以是单一气
体 ,也可为混合气体,如标准状况下0.2 mol H 和0.8 mol O
的混合气体约为22.4 L, 但要特别注意以混合气体中气体之间
不发生化学反应为前提。
(2)气体在非标准状况下的气体摩尔体积,一定不是22.4 L/mol吗
提 示 :不一定。气体在标准状况下的气体摩尔体积是
22.4 L·mol-1,升高温度,体积增大,增大压强,体积减小。 所以,在温度和压强适当的情况下,气体摩尔体积也可能为 22.4 L·mol-1。
【重点剖析】
一 、物质的量浓度及有关计算
1.有关物质的量浓度的计算
(1)计算的基本公式
(2)计算的基本类型和方法:
①已知溶质的质量。
②已知溶液中某种粒子的数目。
③标准状况下,气体溶质的物质的量浓度的计算。
浴 质 的 物
溶液的体
2.物质的量浓度与溶质的质量分数的换算
(1)换算公式
M: 溶质B 的摩尔质量;p:溶液密度(g ·mL-1)。
(2)推导方法:
设溶液体积为1 L,则
3.溶液稀释和混合的计算
(1)溶液稀释的有关计算:稀 释前后溶质的物质的量和 质量都保持不变。
c(浓) ·V(浓)=c(稀) ·V(稀), m(浓) ·w(浓)=m(稀) ·w(稀)。
【注意】无特别指明时,(混≠Y +v,;V(混=(漏,
但溶液的质量守恒:m (混)=m +m 。
(2)溶液混合的计算:混合前后
溶质的物质的量或质量不变。
c ·V +c ·V =c(混) ·V(混),
m ·w +m ·W =m(混) ·w(混)。
【思考 ·讨论】
(1)10.6 g Na CO 溶于水配成1L溶液,其物质的量浓度是多少
提
(2)将22.4 LHC1 气体溶于水配成1 L溶液,得到的盐酸的浓度
为1mol-L-1,对吗 为什么
提示:不对。因为没有给出22.4 LHCI 所处的条件是否为标 准状况下。
(3)将3 mol-L-1的NaCl溶液稀释到原来的3倍,稀释后的溶液
的浓度是多少
提示:1 mol-L-1。稀释过程溶质的物质的量不变,溶液体积扩 大3倍,浓度变为原来的三分之一。
质量 物质的量
H 和O 物质的量之比
H 0.2g 0.1mol
2:1
0 1.6g 0.05mol
(1)H 和O 体积之比:2:1
电解
(2)2H O 二二二二 2H 个+0 个
36 4 32
1.8g 0.2g 1.6g
电解水产生的气体体积比是多少 假设电解了1.8g
水,计算生成O 、H 的质量和物质的量。填写表格。
【想一想】
由表格内容,你能否得出气体物质的量相等时体 积也相等的结论
H 和O 物质的量之比:2:1
H 和O 体积之比:2:1
相同温度和压强下,1mol H 和1mol 0 的体积是 相等的。
物质 1 mol物质的质量(g) 密度(g/L)
体积(L)
H 2.016g 0.0899
22.42
0 32g 1.429
22.39
【思考与交流】
计算出在标准状况下,1 molH 和1 mol0 的体积(保 留小数点后2位)。你能得出什么结论
计算得出的数据可知它们的体积几乎相等哦!
物质 状态 1 mol物 质所含微 粒数 1 mol物 质质量(g) 密度 (g/cm )
体积
(cm )
Fe 固体 6.02×1023 56 7.86
7.12
Al 固体 27 2.70
10.00
H O 液体 18 0.998
18.04
H SO 液体 98 1.83
53.55
【思考与交流】
在相同的条件下1 mol 固体或液体的体积是否也 相等
半
物质 状态 密度
体积
Fe 固体 7.8g/mL
7.2mL
Al 固体 2.7g/mL
10mL
H O 液体 1g/mL
18mL
H SO 液体 1.83g/mL
53.6mL
H 气体 0.0893g/L
22.4L
0 气体 1.429g/L
22.39L
CO 气体 1.965g/L
22.39L
K
【思考与交流】
1 mol 固体或液体的体积不相等。下表是1mol物
质标准状况下的体积,你有哪些启示
由上表的体积数据结合物质状态,可以得出如下结
论:
1.在同温同压(0℃、1.01×105 Pa)下,1摩尔固体
和液体的体积各不相同。
2.在同温同压(0℃、1.01×105 Pa)下,1摩尔任何
气体的体积基本相同。
3.标准状况(0℃、1.01×105 Pa)下,1摩尔任何气 体的体积约为22.4L。
【想一想】
物质的体积由哪些因素决定
结论:
(1)在相同条件下粒子数相同的不同固态或液态物质的体积不相同。
(2)在同温同压条件下,粒子数相同的任何气体的体积都相同。
微点拨:①决定气体分子间距离的因素是温度和压强,温度越高,压强越 小,分子间距离越大。
②气体分子间间距远大于分子大小,而固、液体分子间间距很小,但大小 差别较大。
宏观 物质的量 (质量) 微观 (微粒数)
宏观量(如质量, 看得见,可称量) 微观粒子的集合体
微观粒子(分子、原子、离 子等肉眼看不见,难以计量)
18 g H O 1 mol H O
6.02×1023个H O
2 g H 2 mol H
2×6.02×1023个H
16 g O 1 mol O
6.02×1023个0
***
【规律方法】(1)物质的量的桥梁作用
科学上采用“物质的量”这个物理量把一定数目的原子、分子 或离子等微观粒子与可称量的物质联系起来。
(2)使用物质的量、摩尔质量时易犯的错误
①用物质的量描述宏观物质。
②描述的对象不明确。如1 mol 氮的表示方法错误,应指明对象, 如1 mol N 表示1 mol 氮分子,1 mol N表示1 mol氮原子。
③换算错误。如1 mol CH 中含有4 mol H,而不是1 mol H。
④将摩尔质量与质量的单位混淆。
⑤误认为摩尔质量与相对原子质量或相对分子质量完全等同。
K
【 重点剖析】 物质的量、物质的质量、粒子数目之间的关系
1.基本关系式
(n表示物质的量,N 表示粒子数)。
关系式中N 的单位是mol-1。
乙 (M 为摩尔质量,m为物质的质量)。
在M 、n 和m中,已知任意两项求第三项;
若M的单位是g·mol-1时,则m 的单位是g。
2.恒等关系式
由 和 可得恒等关系式:
在N 、NA 、m 、M中,已知任意三项可求第四项。
一般情况下,NA、M是已知的,则N与m可互求。
3.摩尔质量的计算方法
(1)已知任意状态物质的质量时: (定义式)。
(2)已知一个分子的质量时:M=m (分子)×NA。
(3)已知一个分子的质量和一个12C 原子的质量时:
【思考 ·讨论】
(1)0.5 mol CO 中含CO 分子数与原子总数各为多少
提示:分子数:0.5 mol×6.02×1023 mol-1=3.01×1023; 原子总数:3.01×1023×3=9.03×1023。
(2)9.03×1023个CO 分子的物质的量、物质的质量分别是多少
提示
m=n·M=1.5 mol×44 g·mol- =66 g。
(3)1 mol K Cr O 被还原为Cr +转移的电子数为多少N
提示:由K Cr O, 得6e>2Cr + 知1 mol K Cr O,被还原 为Cr +转移的电子数为6NA。
1.下列关于决定物质体积的因素的说法不正确的是( C )
A. 物质的体积取决于粒子数目、粒子大小和粒子间距
B.相同条件下,粒子数相同的任何气体都具有相同体积 C.同温同压下,1 mol任何物质所占有的体积均相同
D. 等质量的H , 压强越小、温度越高,气体所占体积越大
2.下列说法正确的是 ( C )
A.22.4 L任何气体的物质的量均为1 mol
B.0.2 mol H 和0.8 mol CO 组成的混合气体在标准状况下的体积 约为22.4 L
C. 标准状况下,1 mol任何物质的体积必定是22.4 L
D.22.4 LCO 和18 g H O所含的分子数相等
3.标准状况下,2.24L 某气体的质量为2.8 g, 则此气体的相对分
子质量为( D )
A.28 g·mol-1 B.28 mol
C.28 g D.28
4.下列关于CO 和CO 说法正确的是( B )
A. 质量相等时,分子数之比为7:11 B. 同温同压下,密度之比为7:11
C. 物质的量相同时,体积之比为1:1
D. 原子数相同时,物质的量之比为2:3
5.(1)标准状况下,0.5 mol H 占有的体积约为11.2 L。
(2)标准状况下,44.8 LH 的质量约为 4 g。
(3)标准状况下,3.01×1023个氧气分子所占的体积约为11.2 L。
(4)标准状况下,33.6L 氧气所含的氧分子数约为9.03×1023 个。
(5)标准状况下,16 g氧气和42 g N 的混合气体的体积约为44.8 L。
质量分数M溶质-m溶覆 ×100%
物质的量浓度 换算/关系
【课堂回眸】
物质的 量浓度
→洗涤 →定容摇匀 →分装
误差分析依据
配制一定 物质的量
浓度的溶液
溶解或 移液
计 算→称量或
量取
稀释
物质的量的课件
通过自主学习,了解影响物质体积的因素
了解气体摩尔体积的概念,并会进行简 单的计算
掌握阿伏加德罗定律及其推论
学习目标
2
固体 气体
膨胀、体积变大
是什么呢
思考与讨论 课本P52 1L=1000cm
在一定条件下,Imol 不同物质的体积如下表所示。观察并分析表中的数据,你 能得出哪些结论 与同学讨论。
气体
H
O
0℃、101 kPa时的体积/L
液体
20℃时的体积/cm
固体
22.4
H O
18.0
Fe
22.4
H SO
53.6
Al
20℃时的体积/cm
7.12
10.0
只相同。
半
二、摩尔质量
定 义 :单位物质的量的物质所具有的质量
符号:M 摩尔质量与相对分子质量或相对原子质量的
单位:g/mol 数值相等,单位不等 【提醒一】摩尔质量≠相对分子质量或相对原子质量。
例:O 的相对原子质量是16,则氧气的摩尔质量是32g/mol
SO 的相对质量为96,则SO 的摩尔质量为96g/mol
【提醒二】对于离子来说,电子的质量很小,可忽略不计
【提醒三】摩尔质量的值是一个定值,不随物质的物质的量的改变而改变
关 系 (摩尔质量以g/mol 为单位):
●Mg
●Al ●P ●S ●CI ●K ●Ca
24
27
31
32
35.5 39
40
●H
●C ●N ●0 ●Na
常见的相对原子质量
1
12
14
16
23
342g 蔗糖
63.5g Cu
44g 干冰
18g H O
1mol不同物质的质量
24 g Mg
65 g Zn
32 g S
物质的量 (n)、质 量(m) 与摩尔质量(M) 之间的关系:
m=n×M
【解】Na CO 的相对分子质量为106,摩尔质量为106 g/mol。
n(Na CO )= (m(Na2CO3))/(M(Na2CO3))
=(26.5 g)/(106 g/mol)
=0.25 mol
答:26.5 gNa CO 的物质的量是0.25 mol。
例126.5 g Na CO 的物质的量是多少
26.5g Na CO 的物质的量是多少 溶于水后能电离出Na 的数目是多少
(已知:Na CO 的相对分子质量为106)
该物质含有 的粒子数
可称量物 质的质量
÷M
×M
m/M=n=N/NA
×NA
÷NA
N
m
n
物质的量 该物质含有
的粒子数
n × N
物质的量 ÷NA
m/M=n= N/NA
可称量物
质的质量
N
粒子数
M=
÷M
×M
质量
【牛刀小试】
1、CO 的摩尔质量是 ,Cl 原子的摩尔质量是 。 2、3mol H O的质量是 ,58.5g NaCl的物质的量是 。 3、17g某气体含有6.02×10 个分子,则该物质的相对分子质量 为:
4、54g AI 含有__ 个铝离子,_____mol电 子 , _mol电荷。
【课后练习】
1、3.01×10 个H S分子含有H原子约______mol。
2 、0.6mol Na SO 含约 个Na。
3 、24gCH 中含有______mol C原子,约 个H原子。
4 、48g SO 含_____ mol 0原子, _mol 质子, ___mol 电子。
5、9.03×10 个H 0分子的质量是 _ _ _ _ 。
6、下列物质中,质量最大的是_______,分子数最多的是_______。
A.64g SO B.3.01×10 个N
C.0.75mol H SO D.4g NaOH
单位 ·
数学表达式 va=Y
标准状况温度0℃ ,压强101 kPa ,气体摩尔体积
约为22.4 L·mol-1 , 该状况可简写为STP
影响因素气体所处的 温度和压强
单位物质的量的气体所占的体 积
Vm
二、气体摩尔体积
定义
符号
气 体 摩 尔 体 积
L mol-1
【思考 ·讨论】
(1)气体摩尔体积适用范围是气体,是否必须为纯净气体
提示:气体摩尔体积的适用范围是气体,可以是单一气
体 ,也可为混合气体,如标准状况下0.2 mol H 和0.8 mol O
的混合气体约为22.4 L, 但要特别注意以混合气体中气体之间
不发生化学反应为前提。
(2)气体在非标准状况下的气体摩尔体积,一定不是22.4 L/mol吗
提 示 :不一定。气体在标准状况下的气体摩尔体积是
22.4 L·mol-1,升高温度,体积增大,增大压强,体积减小。 所以,在温度和压强适当的情况下,气体摩尔体积也可能为 22.4 L·mol-1。
【重点剖析】
一 、物质的量浓度及有关计算
1.有关物质的量浓度的计算
(1)计算的基本公式
(2)计算的基本类型和方法:
①已知溶质的质量。
②已知溶液中某种粒子的数目。
③标准状况下,气体溶质的物质的量浓度的计算。
浴 质 的 物
溶液的体
2.物质的量浓度与溶质的质量分数的换算
(1)换算公式
M: 溶质B 的摩尔质量;p:溶液密度(g ·mL-1)。
(2)推导方法:
设溶液体积为1 L,则
3.溶液稀释和混合的计算
(1)溶液稀释的有关计算:稀 释前后溶质的物质的量和 质量都保持不变。
c(浓) ·V(浓)=c(稀) ·V(稀), m(浓) ·w(浓)=m(稀) ·w(稀)。
【注意】无特别指明时,(混≠Y +v,;V(混=(漏,
但溶液的质量守恒:m (混)=m +m 。
(2)溶液混合的计算:混合前后
溶质的物质的量或质量不变。
c ·V +c ·V =c(混) ·V(混),
m ·w +m ·W =m(混) ·w(混)。
【思考 ·讨论】
(1)10.6 g Na CO 溶于水配成1L溶液,其物质的量浓度是多少
提
(2)将22.4 LHC1 气体溶于水配成1 L溶液,得到的盐酸的浓度
为1mol-L-1,对吗 为什么
提示:不对。因为没有给出22.4 LHCI 所处的条件是否为标 准状况下。
(3)将3 mol-L-1的NaCl溶液稀释到原来的3倍,稀释后的溶液
的浓度是多少
提示:1 mol-L-1。稀释过程溶质的物质的量不变,溶液体积扩 大3倍,浓度变为原来的三分之一。
质量 物质的量
H 和O 物质的量之比
H 0.2g 0.1mol
2:1
0 1.6g 0.05mol
(1)H 和O 体积之比:2:1
电解
(2)2H O 二二二二 2H 个+0 个
36 4 32
1.8g 0.2g 1.6g
电解水产生的气体体积比是多少 假设电解了1.8g
水,计算生成O 、H 的质量和物质的量。填写表格。
【想一想】
由表格内容,你能否得出气体物质的量相等时体 积也相等的结论
H 和O 物质的量之比:2:1
H 和O 体积之比:2:1
相同温度和压强下,1mol H 和1mol 0 的体积是 相等的。
物质 1 mol物质的质量(g) 密度(g/L)
体积(L)
H 2.016g 0.0899
22.42
0 32g 1.429
22.39
【思考与交流】
计算出在标准状况下,1 molH 和1 mol0 的体积(保 留小数点后2位)。你能得出什么结论
计算得出的数据可知它们的体积几乎相等哦!
物质 状态 1 mol物 质所含微 粒数 1 mol物 质质量(g) 密度 (g/cm )
体积
(cm )
Fe 固体 6.02×1023 56 7.86
7.12
Al 固体 27 2.70
10.00
H O 液体 18 0.998
18.04
H SO 液体 98 1.83
53.55
【思考与交流】
在相同的条件下1 mol 固体或液体的体积是否也 相等
半
物质 状态 密度
体积
Fe 固体 7.8g/mL
7.2mL
Al 固体 2.7g/mL
10mL
H O 液体 1g/mL
18mL
H SO 液体 1.83g/mL
53.6mL
H 气体 0.0893g/L
22.4L
0 气体 1.429g/L
22.39L
CO 气体 1.965g/L
22.39L
K
【思考与交流】
1 mol 固体或液体的体积不相等。下表是1mol物
质标准状况下的体积,你有哪些启示
由上表的体积数据结合物质状态,可以得出如下结
论:
1.在同温同压(0℃、1.01×105 Pa)下,1摩尔固体
和液体的体积各不相同。
2.在同温同压(0℃、1.01×105 Pa)下,1摩尔任何
气体的体积基本相同。
3.标准状况(0℃、1.01×105 Pa)下,1摩尔任何气 体的体积约为22.4L。
【想一想】
物质的体积由哪些因素决定
结论:
(1)在相同条件下粒子数相同的不同固态或液态物质的体积不相同。
(2)在同温同压条件下,粒子数相同的任何气体的体积都相同。
微点拨:①决定气体分子间距离的因素是温度和压强,温度越高,压强越 小,分子间距离越大。
②气体分子间间距远大于分子大小,而固、液体分子间间距很小,但大小 差别较大。
宏观 物质的量 (质量) 微观 (微粒数)
宏观量(如质量, 看得见,可称量) 微观粒子的集合体
微观粒子(分子、原子、离 子等肉眼看不见,难以计量)
18 g H O 1 mol H O
6.02×1023个H O
2 g H 2 mol H
2×6.02×1023个H
16 g O 1 mol O
6.02×1023个0
***
【规律方法】(1)物质的量的桥梁作用
科学上采用“物质的量”这个物理量把一定数目的原子、分子 或离子等微观粒子与可称量的物质联系起来。
(2)使用物质的量、摩尔质量时易犯的错误
①用物质的量描述宏观物质。
②描述的对象不明确。如1 mol 氮的表示方法错误,应指明对象, 如1 mol N 表示1 mol 氮分子,1 mol N表示1 mol氮原子。
③换算错误。如1 mol CH 中含有4 mol H,而不是1 mol H。
④将摩尔质量与质量的单位混淆。
⑤误认为摩尔质量与相对原子质量或相对分子质量完全等同。
K
【 重点剖析】 物质的量、物质的质量、粒子数目之间的关系
1.基本关系式
(n表示物质的量,N 表示粒子数)。
关系式中N 的单位是mol-1。
乙 (M 为摩尔质量,m为物质的质量)。
在M 、n 和m中,已知任意两项求第三项;
若M的单位是g·mol-1时,则m 的单位是g。
2.恒等关系式
由 和 可得恒等关系式:
在N 、NA 、m 、M中,已知任意三项可求第四项。
一般情况下,NA、M是已知的,则N与m可互求。
3.摩尔质量的计算方法
(1)已知任意状态物质的质量时: (定义式)。
(2)已知一个分子的质量时:M=m (分子)×NA。
(3)已知一个分子的质量和一个12C 原子的质量时:
【思考 ·讨论】
(1)0.5 mol CO 中含CO 分子数与原子总数各为多少
提示:分子数:0.5 mol×6.02×1023 mol-1=3.01×1023; 原子总数:3.01×1023×3=9.03×1023。
(2)9.03×1023个CO 分子的物质的量、物质的质量分别是多少
提示
m=n·M=1.5 mol×44 g·mol- =66 g。
(3)1 mol K Cr O 被还原为Cr +转移的电子数为多少N
提示:由K Cr O, 得6e>2Cr + 知1 mol K Cr O,被还原 为Cr +转移的电子数为6NA。
1.下列关于决定物质体积的因素的说法不正确的是( C )
A. 物质的体积取决于粒子数目、粒子大小和粒子间距
B.相同条件下,粒子数相同的任何气体都具有相同体积 C.同温同压下,1 mol任何物质所占有的体积均相同
D. 等质量的H , 压强越小、温度越高,气体所占体积越大
2.下列说法正确的是 ( C )
A.22.4 L任何气体的物质的量均为1 mol
B.0.2 mol H 和0.8 mol CO 组成的混合气体在标准状况下的体积 约为22.4 L
C. 标准状况下,1 mol任何物质的体积必定是22.4 L
D.22.4 LCO 和18 g H O所含的分子数相等
3.标准状况下,2.24L 某气体的质量为2.8 g, 则此气体的相对分
子质量为( D )
A.28 g·mol-1 B.28 mol
C.28 g D.28
4.下列关于CO 和CO 说法正确的是( B )
A. 质量相等时,分子数之比为7:11 B. 同温同压下,密度之比为7:11
C. 物质的量相同时,体积之比为1:1
D. 原子数相同时,物质的量之比为2:3
5.(1)标准状况下,0.5 mol H 占有的体积约为11.2 L。
(2)标准状况下,44.8 LH 的质量约为 4 g。
(3)标准状况下,3.01×1023个氧气分子所占的体积约为11.2 L。
(4)标准状况下,33.6L 氧气所含的氧分子数约为9.03×1023 个。
(5)标准状况下,16 g氧气和42 g N 的混合气体的体积约为44.8 L。
质量分数M溶质-m溶覆 ×100%
物质的量浓度 换算/关系
【课堂回眸】
物质的 量浓度
→洗涤 →定容摇匀 →分装
误差分析依据
配制一定 物质的量
浓度的溶液
溶解或 移液
计 算→称量或
量取
稀释
