2.2烯烃高二下学期化学人教版(2019)选择性必修3(共41张PPT)
文档属性
| 名称 | 2.2烯烃高二下学期化学人教版(2019)选择性必修3(共41张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 12.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-14 19:25:59 | ||
图片预览









文档简介
(共41张PPT)
第 二 章 烃
第 二 节 烯 烃 炔 烃
第 一课时
番茄红素
这种“气”究竟是什么呢 人们一
直不明白。到20世纪60年代,气
相层析技术的应用使人们终于弄
清楚,是成熟果实释放出的乙烯
促进了其他果实的成熟
乙烯的产量是
衡量国家石油化工水平的重要标 志。
①C采取 sp 杂化,共有_5 个 σ 键,1 π键,键角约为 120° 。
② 平面_形 分 子 ,6 个原子共平面。
【思考】丙烯(CH =CHCH ) 分子中至少有6 个原子共面, 最多有7 个原子共面。
120°
π键
C
12 键
133 pm
0°
σ
乙烯——衡量一个国家石油化学工业的发展水平
H
o 键
σ键
H
H
120°
H
个
烯烃和炔烃的命名
1、与烷烃相似。
2、不同点是主链必须含有双键或叁键(官能团优先)
命名步骤:
(1) 选主链,含 双键(叁键)
(2) 定 编号,近双键(叁键)【在无法根据官能团的位号来确定方向时, 应让取代基的位号尽可能小】
(3)写名称,标 双 键 ( 叁键)【用较小的数字表示双键或三键的位号】
2,3-二甲基-1-丁烯 4,4-二甲基-2-戊炔 2-甲基-2,4-己二烯
代表官能团的数目
烯烃和炔烃的命名
(1)取含双键最多的最长碳链作为主链,称为某几烯,这是该化合物的母 称。主链碳原子的编号,从离双键较近的一端开始,双键的位号由小到 大排列,母体名称前,并用一短线相连。
(2)取代基的位号由与它相连的主链上的碳原子的位号确定,写在取代 基称前,用一短线与取代基的名称相连。
(3)写名称时,取代基在前,母体在后。
CHc-H-c=c
3-甲基-1,4-戊二炔
H C=CH-CH=CH
1,3-丁二烯
2-甲基-1,3-丁二烯
单烯烃 乙烯 丙烯 1--丁烯
1--戊烯
分子式 C H C H C H
C H10
结构简式 CH =CH CH =CHCH CH =CHCH CH
CH =CHCH CH CH
碳原子杂化类型 sp
共价键类型(σ键或π键) σ键和π键 σ键和π键 σ键和π键
σ键和π键
CH =CH C H =CHCH CH =CHCH CH CH =CHCH CH CH
几种简单烯烃的结构简式和分子结构模型
乙烯
烯烃的结构特点
1.概念:分子中含有碳碳双键的烃,属于不饱和烃。
2.烯烃的官能团为:碳碳双键 C=C
3 .烯烃只含有一个碳碳双键时,其通式一般表示为 CHa(n≥2)
4.结构特点:碳碳双键碳原子均采取sp 杂化,以碳碳双键为中心的6个原
子一定在同一平面
5、分类:
单烯烃:只有一个碳碳双键的烯烃。
累积二烯烃 C-C=C=C-C
二烯烃:含有二个碳碳双键的烯烃。 孤立二烯烃 C=C-C=C-C
多烯烃:含有多个碳碳双键的烯烃。 共轭二烯烃 C=C-C-C=C
度逐渐增加
名称 结构简式 沸点
相对密度
乙烯 CH =CH -103.7 沸 点 逐 渐 增 加
0.566
丙烯 CH =CHCH -47.4
0.5193
1-丁烯 CH =CHCH CH -6.3
0.5951
1-戊烯 CH =CH(CH ) CH 30
0.6405
1-己烯 CH =CH(CH ) CH 63.3
0.6731
1-庚烯 CH =CH(CH ) CH 93.6 0.6970
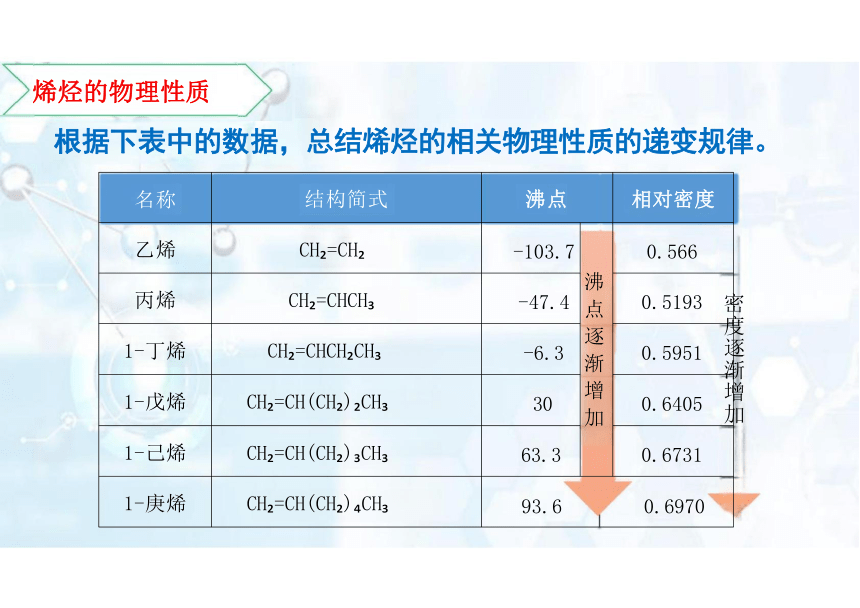
烯烃的物理性质
根据下表中的数据,总结烯烃的相关物理性质的递变规律。
密
物理性质
递变规律
状态
当碳原子数小于或等于4 时,烯烃在常温下呈气态,其他的 烯烃常温下呈液态或固态
溶解性
难溶于水,易溶于有机溶剂
沸点
随碳原子数的递增,沸点逐渐_升高_ ;碳原子数相同的烯烃,
支链越多,沸点越低
密度
随碳原子数的递增,相对密度逐渐_增大;烯烃的密度 小于
水的密度
烯烃的物理性质
CH =CH
结构式 结构简式
烯烃的化学性质——代表物:乙烯
C H
分子式
空间填充模型
球棍模型
乙烯分子结构示意图
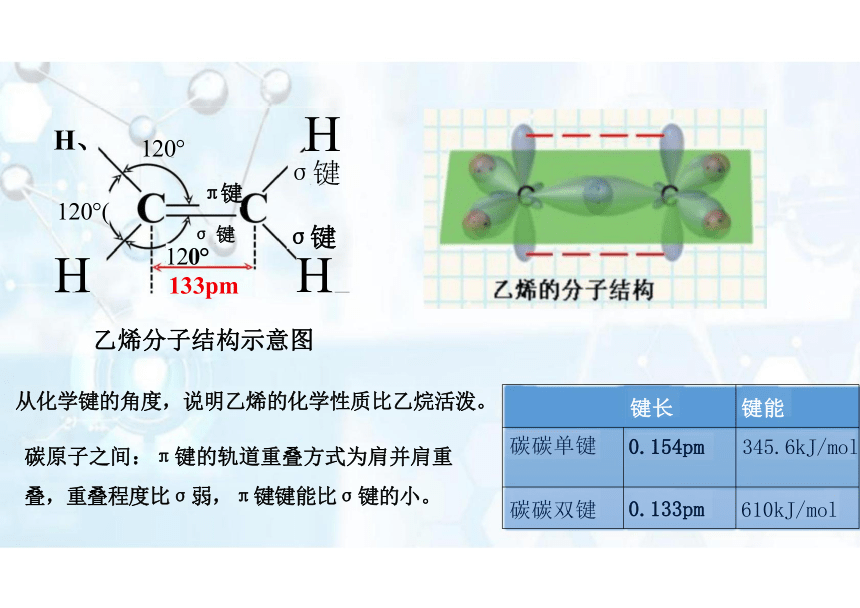
从化学键的角度,说明乙烯的化学性质比乙烷活泼。
碳原子之间:π键的轨道重叠方式为肩并肩重
叠,重叠程度比σ弱,π键键能比σ键的小。
键长
键能
碳碳单键 0.154pm
345.6kJ/mol
碳碳双键 0.133pm
610kJ/mol
120°
π键
σ 键
120°
133pm
H σ键
σ键
H
H、
120°(
H
甲烷的燃烧 乙烯的燃烧
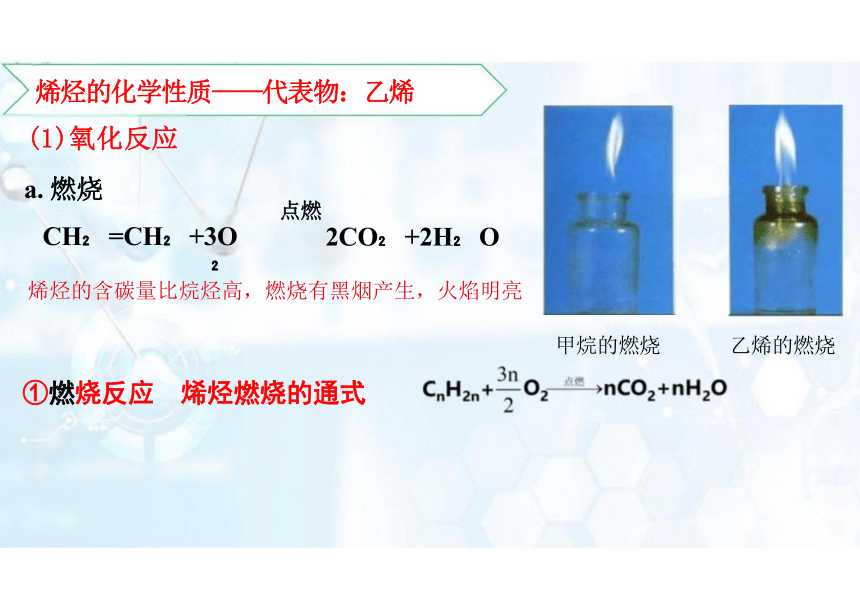
①燃烧反应 烯烃燃烧的通式
(1)氧化反应
a. 燃烧
CH =CH +3O
烯烃的含碳量比烷烃高,燃烧有黑烟产生,火焰明亮
点燃
2CO +2H O
烯烃的化学性质——代表物:乙烯
10CO ] +12MnSO +6K SO +28H O
说 明 :a 、 乙烯被高锰酸钾氧化后的产物是
CO
b 、此性质可用于鉴别烷烃 和烯烃,
但不能用来除杂
酸性溶液
(1)氧化反应
b.被酸性高锰酸钾氧化
现 象 :KMnO (H+) 溶液褪色
5CH =CH +12KMnO +18H SO —→
H* OH
进一步氧化
CO +H O
H
[拓展]烯烃被酸性高锰酸钾溶液氧化的产物规律
H O,OH
KMnO /H
CO H
OH KMnO4
总反应
总反应
KMnO H+
KMnO4
COOH
CO +
双键被氧 化部分 CH = (不饱和C上有2个H) RCH= (不饱和C上有1个H)
(不饱和C上没有H)
氧化 产物 CO R-C-OH
R
C=O
R
二氢成气
一氢成酸 酸性高锰酸钾溶液可鉴别烯烃和烷烃,但不能除杂!
无氢成酮
[拓展]烯烃被酸性高锰酸钾溶液氧化的产物规律
对点演练
例2.有机物A 的结构如图所示,写出A 与足量酸性
高锰酸钾溶液反应后生成的所有有机物的结构简式:
Hc-c-coon Hooc-CH-CH -cooH
思考:分子式为C 0H 0 的某烯烃被酸性高锰酸钾溶液氧化后,生成正丁酸
和3-己酮。请据此推测该烯烃的结构简式。
(CH CH CH COOH) (CH CH COCH CH CH )
正丁酸 3-己酮
烯烃的化学性质——代表物:乙烯
(2)加成反应
有机物分子中的不饱和键(双键或三键)两端的碳原子与其他原子或原
子团直接结合成新化合物的反应叫加成反应。
烯烃可使B 的 CCL溶液或 溴水溶液褪色,可用于烯烃 与烷烃鉴别和除杂。
无色液体,
1,2-二溴乙烷 密度比水大, 难溶于水。
当分子结构不对称的烯烃与分子结构不对称的试剂发生加成时,加成方
向应如何决定 如丙烯与溴化氢反应后,会生成什么产物呢
主要产物
次要产物
类比推理
写出乙烯与H 、
Cl 、HCI 、H O加成的化学方程
催化剂
△CH CH
CH CICH CI
CH =CH +H
CH =CH +Cl —
试剂 乙 烯 丙 烯 溴 CH =CH +Br →CH BrCH Br CH CH=CH +Br →CH CHBrCH Br 氯化氢 (HX) 催化剂 CH =CH + HCl →CH CH Cl 催化剂 CH CH=CH +HC I → CH CH CH C1(次) 催化剂 CH CH=CH +HCl → CH CHC ICH (主) 水 催化剂 CH =CH +H O →CH CH OH 马氏规则(马尔科夫尼科夫):当不对 称烯烃与卤化氢发生加成反应时,通 常氢加到含氢多的不饱和碳原子一侧。 HCN 催化剂 CH =CH +HCN →CH CH CN H 催化剂 CH =CH +H →CH CH 加热加压 氢上加氢
【思考与讨论】
聚合反应:由相对分子质量小的化合物分子互相结合成相对分子质量大的聚合物的反应。 加聚反应:由不饱和的相对分子质量小的化合物分子结合成相对分子质量大的聚合物, 既是加成又是聚合的反应。
注意:n的值不固定,
所得的聚乙烯是混合物。
单体:合成高分子的小分子 链节:高分子中重复的结构单元 聚合度
思考:聚乙烧配使溴水腿色四
烯烃的化学性质——代表物:乙烯
③加聚反应
n CH =CH 催化剂 CH CH n (聚乙烯PE)
原理:双键中的元键打开,双键碳原 子在主链,其余C成为支链。
本质:多个乙烯分子自身加成。
随堂练习
分别写出丙烯、2-丁烯和苯乙烯的加聚反应方程式。
n IC=CH
书写技巧:
先写出不
饱和键两
端的碳、
氢,将其
他的原子
或者原子
团写成支
链的形式,
双键变单
键,两头
伸出半键,
再加上
“[]”和“n”
聚丙烯
聚2- 丁烯
聚苯乙烯
n
R
R
R
3.加聚反应
①共轭二烯烃的加聚反应
共轭二烯烃发生加聚反应与单烯烃有所不同,如1,3-丁二烯 的加聚反应:
②多种单体共聚
②由高分子写单体
例6.写出形成以下高分子的单体:
CH =CH——COOCH
②使酸性KMnO 溶液褪色,生成CO
CH =CH +Br —→CH BrCH Br
CH =CH +HX 化剂→CH CH X
CH =CH +H 化剂→CH CH
CH =CH +H O 化 CH CH OH
归纳总结
1. 乙烯的性质
烯烃化学性质 与乙烯类似
纯净的乙烯为无 色、稍有气味的气 体, 难溶于水,密度比空气略小。
燃
①可燃性 C H +30 —→2CO +2H O
加聚反应 nCH -CH 催化剂+CH -CH
反 应 加成反应
物理性质
化 学 性 质
氧 化
知识拓展——二烯烃
1、定义:二烯烃是分子含有两个碳碳双键的烯烃。
2、链状二烯烃的通式:C H n-2(n≥4)
3 、 分 类 :依据两个双键在碳链中的不同位置:
②共轭二烯烃 C = C-C =C-C
③孤立二烯烃 C=C-C-C=C
①累积二烯烃 C -C = C = C-C
[性质同单烯烃]
不稳定
稳定
知识拓展:共轭二烯烃的化学性质
与烯烃相似: 氧化、加成、加聚
(1)加成反应: 1,3-丁二烯与氯气发生加成反应时,
CH ==CH—CH==CH +Cl —
温度较低时,发生1,2加成
① ② ③ ④
CH ==CH—CH==CH +Cl →
温度较低时,发生1,4加成
CH —CH—CH—CH
Cl Cl
CH —CH—CH—CH
Cl Cl
③完全加成 CH ==CH—CH==CH +2Cl →CH Cl—CHCl—CHCI—CH Cl
①1,2-加成
②1,4-加成
① ② ③ ④
Diels-Alder反应,也称双烯合成
二烯烃的加成反应
含活泼双键或叁键的化合物(亲双烯体)与含共轭双键的化合物 (双烯体)之间发生1 ,4 - 加成生成六元环状化合物的反应,称为 Diels-Alder 反应,也称双烯合成
90M
17h
当双烯体连有供电子基团,而亲双烯体连有吸电子基团(如: —CHO、 —COR、—CN、 一NO 等)时,将有利于反应的进行。
CHO
十
十
CHO
0
0
苯
△
苯
(只考虑位置异构)理论上最多有( C )
A、2 种
B、3种
C、4种
D、6 种
例 1、β -月桂烯的结构如右图所示, 一分子该物质与两分子溴发生加成反应的产物
练习:已知 十 一定条件 如果要合成
所用的原始原料可以是 ( A、D )
A.2一甲基一1,3一丁二烯和2一丁炔
B.1,3 一戊二烯和2一丁炔
C.2,3— 二甲基一1,3一戊二烯和乙炔
D.2,3— 二甲基一I,3 一丁二烯和丙炔
天然橡胶简介:
俗称:异戊二烯 学名:2-甲基-1,3-丁二烯
聚异戊二烯 (天然橡胶)
(2)加聚反应
课堂练习:某烃的结构用键线式可表示为 《则该烃与Br 加
成时(物质的量之比为1:1)所得产物有 ( C )
A.3种 B.4种 C.5种 D.6种
课堂练习:工业上常用苯乙烯、1,3-丁二烯和丙烯腈来合成ABS 塑料, 书写化学方程式。
2、顺反异构体
相同的原子或原子团位于双键同 一侧的称为顺 式结构,相同的原子或原
子团位于双键两侧的称为反式结构,例如顺--2--丁烯和反--2--丁烯的结
1 . 顺 反 异 构 现 象
1. 概 念 :通过碳碳双键连接的原子或原子团不能绕键轴旋转会导致其空间排列方式不同,产 生顺反异构现象。
烯烃的立体异构
二者的结构一样吗
CH
c=c
H
构简式分别
H
CH
和
4.性质顺反异构体的化学性质基本相同,物 理 性 质有 一定的差异。
顺-2-丁烯 反-2-丁烯
(bp 3.7℃) (bp 0.88℃)
碳碳双键的每个碳原子必须连接两个不同的原子或原子团。
R R R R
R R R R
同一个双键碳上不能连有相同的基团
3、顺反异构的条件
有顺反异构的类型
无顺反异构的类型
练、下列哪种物质存在顺反异构( A、D )
B
C H
H
CH
C H
C=
D、
相同的原子或原子团位于双键同一侧为顺式结构
相同的原子或原子团位于双键两侧为反式结构
若双键碳所连的原子或原子团均不相同,则“较优基团”在
双键同侧的为顺式结构;为双键两侧为反式结构
①存在
②顺式结构
③顺反异构的判断 方法:
该物质是否存在顺反异构 若存在该物质是顺式结构 还是反式结构 如何判断
思考:
①官能团(或基团)的 优先顺序:-CO OH ( 羧 基 ) > -COO R ( 酯 基)>
-CONH (酰氨基)>-CHO(醛基)>-OH(醇羟基)>-OH (酚羟基)>- NH (氨基)>叁键>双键> -Ph(苯基)> 烷基>-X>-NO
②对于烷基而言:相对分子质量的大的优先级较高。如:乙基优先 级高于甲基。
当相对分子质量相同时,支链较多的优先级高一些。如:异丙基的 优先级高于正丙基
较优基团的判断
烯烃的制备
一、工业制法 1 . 石油裂解
二、实验室制法
1.醇脱水
2.卤代烃脱卤化氢
2 . 由醇脱水
结构:含碳碳双键,C 采取sp 杂化
物理性质:同烷烃
氧化反应
化学性质 加成反应
加聚反应
立体异构——顺反异构
共轭二烯烃的化学性质 注意1,4—加成
课 堂 小 结
烯 烃
1、异戊二烯( CH =C-CH=CH )是合成橡胶的重要原料,关于
CH
异戊二烯的说法正确的是( A )
A.与1,3-丁二烯互为同系物
B.与液溴1:1加成的产物有2种
C.形成的聚合物中没有双键
D.难溶于乙醇、乙醚等多数有机溶剂
CH —C=CH—CH
2. 已知
CH
线式
,某有机化合物的键
B.2-- 甲基庚烯
D.5-- 甲基--2--庚烯
乙基--2--己烯
甲基--5--庚烯
的键线式可写作
其正确名称是 (D)
A.5-
C.3--
第 二 章 烃
第 二 节 烯 烃 炔 烃
第 一课时
番茄红素
这种“气”究竟是什么呢 人们一
直不明白。到20世纪60年代,气
相层析技术的应用使人们终于弄
清楚,是成熟果实释放出的乙烯
促进了其他果实的成熟
乙烯的产量是
衡量国家石油化工水平的重要标 志。
①C采取 sp 杂化,共有_5 个 σ 键,1 π键,键角约为 120° 。
② 平面_形 分 子 ,6 个原子共平面。
【思考】丙烯(CH =CHCH ) 分子中至少有6 个原子共面, 最多有7 个原子共面。
120°
π键
C
12 键
133 pm
0°
σ
乙烯——衡量一个国家石油化学工业的发展水平
H
o 键
σ键
H
H
120°
H
个
烯烃和炔烃的命名
1、与烷烃相似。
2、不同点是主链必须含有双键或叁键(官能团优先)
命名步骤:
(1) 选主链,含 双键(叁键)
(2) 定 编号,近双键(叁键)【在无法根据官能团的位号来确定方向时, 应让取代基的位号尽可能小】
(3)写名称,标 双 键 ( 叁键)【用较小的数字表示双键或三键的位号】
2,3-二甲基-1-丁烯 4,4-二甲基-2-戊炔 2-甲基-2,4-己二烯
代表官能团的数目
烯烃和炔烃的命名
(1)取含双键最多的最长碳链作为主链,称为某几烯,这是该化合物的母 称。主链碳原子的编号,从离双键较近的一端开始,双键的位号由小到 大排列,母体名称前,并用一短线相连。
(2)取代基的位号由与它相连的主链上的碳原子的位号确定,写在取代 基称前,用一短线与取代基的名称相连。
(3)写名称时,取代基在前,母体在后。
CHc-H-c=c
3-甲基-1,4-戊二炔
H C=CH-CH=CH
1,3-丁二烯
2-甲基-1,3-丁二烯
单烯烃 乙烯 丙烯 1--丁烯
1--戊烯
分子式 C H C H C H
C H10
结构简式 CH =CH CH =CHCH CH =CHCH CH
CH =CHCH CH CH
碳原子杂化类型 sp
共价键类型(σ键或π键) σ键和π键 σ键和π键 σ键和π键
σ键和π键
CH =CH C H =CHCH CH =CHCH CH CH =CHCH CH CH
几种简单烯烃的结构简式和分子结构模型
乙烯
烯烃的结构特点
1.概念:分子中含有碳碳双键的烃,属于不饱和烃。
2.烯烃的官能团为:碳碳双键 C=C
3 .烯烃只含有一个碳碳双键时,其通式一般表示为 CHa(n≥2)
4.结构特点:碳碳双键碳原子均采取sp 杂化,以碳碳双键为中心的6个原
子一定在同一平面
5、分类:
单烯烃:只有一个碳碳双键的烯烃。
累积二烯烃 C-C=C=C-C
二烯烃:含有二个碳碳双键的烯烃。 孤立二烯烃 C=C-C=C-C
多烯烃:含有多个碳碳双键的烯烃。 共轭二烯烃 C=C-C-C=C
度逐渐增加
名称 结构简式 沸点
相对密度
乙烯 CH =CH -103.7 沸 点 逐 渐 增 加
0.566
丙烯 CH =CHCH -47.4
0.5193
1-丁烯 CH =CHCH CH -6.3
0.5951
1-戊烯 CH =CH(CH ) CH 30
0.6405
1-己烯 CH =CH(CH ) CH 63.3
0.6731
1-庚烯 CH =CH(CH ) CH 93.6 0.6970
烯烃的物理性质
根据下表中的数据,总结烯烃的相关物理性质的递变规律。
密
物理性质
递变规律
状态
当碳原子数小于或等于4 时,烯烃在常温下呈气态,其他的 烯烃常温下呈液态或固态
溶解性
难溶于水,易溶于有机溶剂
沸点
随碳原子数的递增,沸点逐渐_升高_ ;碳原子数相同的烯烃,
支链越多,沸点越低
密度
随碳原子数的递增,相对密度逐渐_增大;烯烃的密度 小于
水的密度
烯烃的物理性质
CH =CH
结构式 结构简式
烯烃的化学性质——代表物:乙烯
C H
分子式
空间填充模型
球棍模型
乙烯分子结构示意图
从化学键的角度,说明乙烯的化学性质比乙烷活泼。
碳原子之间:π键的轨道重叠方式为肩并肩重
叠,重叠程度比σ弱,π键键能比σ键的小。
键长
键能
碳碳单键 0.154pm
345.6kJ/mol
碳碳双键 0.133pm
610kJ/mol
120°
π键
σ 键
120°
133pm
H σ键
σ键
H
H、
120°(
H
甲烷的燃烧 乙烯的燃烧
①燃烧反应 烯烃燃烧的通式
(1)氧化反应
a. 燃烧
CH =CH +3O
烯烃的含碳量比烷烃高,燃烧有黑烟产生,火焰明亮
点燃
2CO +2H O
烯烃的化学性质——代表物:乙烯
10CO ] +12MnSO +6K SO +28H O
说 明 :a 、 乙烯被高锰酸钾氧化后的产物是
CO
b 、此性质可用于鉴别烷烃 和烯烃,
但不能用来除杂
酸性溶液
(1)氧化反应
b.被酸性高锰酸钾氧化
现 象 :KMnO (H+) 溶液褪色
5CH =CH +12KMnO +18H SO —→
H* OH
进一步氧化
CO +H O
H
[拓展]烯烃被酸性高锰酸钾溶液氧化的产物规律
H O,OH
KMnO /H
CO H
OH KMnO4
总反应
总反应
KMnO H+
KMnO4
COOH
CO +
双键被氧 化部分 CH = (不饱和C上有2个H) RCH= (不饱和C上有1个H)
(不饱和C上没有H)
氧化 产物 CO R-C-OH
R
C=O
R
二氢成气
一氢成酸 酸性高锰酸钾溶液可鉴别烯烃和烷烃,但不能除杂!
无氢成酮
[拓展]烯烃被酸性高锰酸钾溶液氧化的产物规律
对点演练
例2.有机物A 的结构如图所示,写出A 与足量酸性
高锰酸钾溶液反应后生成的所有有机物的结构简式:
Hc-c-coon Hooc-CH-CH -cooH
思考:分子式为C 0H 0 的某烯烃被酸性高锰酸钾溶液氧化后,生成正丁酸
和3-己酮。请据此推测该烯烃的结构简式。
(CH CH CH COOH) (CH CH COCH CH CH )
正丁酸 3-己酮
烯烃的化学性质——代表物:乙烯
(2)加成反应
有机物分子中的不饱和键(双键或三键)两端的碳原子与其他原子或原
子团直接结合成新化合物的反应叫加成反应。
烯烃可使B 的 CCL溶液或 溴水溶液褪色,可用于烯烃 与烷烃鉴别和除杂。
无色液体,
1,2-二溴乙烷 密度比水大, 难溶于水。
当分子结构不对称的烯烃与分子结构不对称的试剂发生加成时,加成方
向应如何决定 如丙烯与溴化氢反应后,会生成什么产物呢
主要产物
次要产物
类比推理
写出乙烯与H 、
Cl 、HCI 、H O加成的化学方程
催化剂
△CH CH
CH CICH CI
CH =CH +H
CH =CH +Cl —
试剂 乙 烯 丙 烯 溴 CH =CH +Br →CH BrCH Br CH CH=CH +Br →CH CHBrCH Br 氯化氢 (HX) 催化剂 CH =CH + HCl →CH CH Cl 催化剂 CH CH=CH +HC I → CH CH CH C1(次) 催化剂 CH CH=CH +HCl → CH CHC ICH (主) 水 催化剂 CH =CH +H O →CH CH OH 马氏规则(马尔科夫尼科夫):当不对 称烯烃与卤化氢发生加成反应时,通 常氢加到含氢多的不饱和碳原子一侧。 HCN 催化剂 CH =CH +HCN →CH CH CN H 催化剂 CH =CH +H →CH CH 加热加压 氢上加氢
【思考与讨论】
聚合反应:由相对分子质量小的化合物分子互相结合成相对分子质量大的聚合物的反应。 加聚反应:由不饱和的相对分子质量小的化合物分子结合成相对分子质量大的聚合物, 既是加成又是聚合的反应。
注意:n的值不固定,
所得的聚乙烯是混合物。
单体:合成高分子的小分子 链节:高分子中重复的结构单元 聚合度
思考:聚乙烧配使溴水腿色四
烯烃的化学性质——代表物:乙烯
③加聚反应
n CH =CH 催化剂 CH CH n (聚乙烯PE)
原理:双键中的元键打开,双键碳原 子在主链,其余C成为支链。
本质:多个乙烯分子自身加成。
随堂练习
分别写出丙烯、2-丁烯和苯乙烯的加聚反应方程式。
n IC=CH
书写技巧:
先写出不
饱和键两
端的碳、
氢,将其
他的原子
或者原子
团写成支
链的形式,
双键变单
键,两头
伸出半键,
再加上
“[]”和“n”
聚丙烯
聚2- 丁烯
聚苯乙烯
n
R
R
R
3.加聚反应
①共轭二烯烃的加聚反应
共轭二烯烃发生加聚反应与单烯烃有所不同,如1,3-丁二烯 的加聚反应:
②多种单体共聚
②由高分子写单体
例6.写出形成以下高分子的单体:
CH =CH——COOCH
②使酸性KMnO 溶液褪色,生成CO
CH =CH +Br —→CH BrCH Br
CH =CH +HX 化剂→CH CH X
CH =CH +H 化剂→CH CH
CH =CH +H O 化 CH CH OH
归纳总结
1. 乙烯的性质
烯烃化学性质 与乙烯类似
纯净的乙烯为无 色、稍有气味的气 体, 难溶于水,密度比空气略小。
燃
①可燃性 C H +30 —→2CO +2H O
加聚反应 nCH -CH 催化剂+CH -CH
反 应 加成反应
物理性质
化 学 性 质
氧 化
知识拓展——二烯烃
1、定义:二烯烃是分子含有两个碳碳双键的烯烃。
2、链状二烯烃的通式:C H n-2(n≥4)
3 、 分 类 :依据两个双键在碳链中的不同位置:
②共轭二烯烃 C = C-C =C-C
③孤立二烯烃 C=C-C-C=C
①累积二烯烃 C -C = C = C-C
[性质同单烯烃]
不稳定
稳定
知识拓展:共轭二烯烃的化学性质
与烯烃相似: 氧化、加成、加聚
(1)加成反应: 1,3-丁二烯与氯气发生加成反应时,
CH ==CH—CH==CH +Cl —
温度较低时,发生1,2加成
① ② ③ ④
CH ==CH—CH==CH +Cl →
温度较低时,发生1,4加成
CH —CH—CH—CH
Cl Cl
CH —CH—CH—CH
Cl Cl
③完全加成 CH ==CH—CH==CH +2Cl →CH Cl—CHCl—CHCI—CH Cl
①1,2-加成
②1,4-加成
① ② ③ ④
Diels-Alder反应,也称双烯合成
二烯烃的加成反应
含活泼双键或叁键的化合物(亲双烯体)与含共轭双键的化合物 (双烯体)之间发生1 ,4 - 加成生成六元环状化合物的反应,称为 Diels-Alder 反应,也称双烯合成
90M
17h
当双烯体连有供电子基团,而亲双烯体连有吸电子基团(如: —CHO、 —COR、—CN、 一NO 等)时,将有利于反应的进行。
CHO
十
十
CHO
0
0
苯
△
苯
(只考虑位置异构)理论上最多有( C )
A、2 种
B、3种
C、4种
D、6 种
例 1、β -月桂烯的结构如右图所示, 一分子该物质与两分子溴发生加成反应的产物
练习:已知 十 一定条件 如果要合成
所用的原始原料可以是 ( A、D )
A.2一甲基一1,3一丁二烯和2一丁炔
B.1,3 一戊二烯和2一丁炔
C.2,3— 二甲基一1,3一戊二烯和乙炔
D.2,3— 二甲基一I,3 一丁二烯和丙炔
天然橡胶简介:
俗称:异戊二烯 学名:2-甲基-1,3-丁二烯
聚异戊二烯 (天然橡胶)
(2)加聚反应
课堂练习:某烃的结构用键线式可表示为 《则该烃与Br 加
成时(物质的量之比为1:1)所得产物有 ( C )
A.3种 B.4种 C.5种 D.6种
课堂练习:工业上常用苯乙烯、1,3-丁二烯和丙烯腈来合成ABS 塑料, 书写化学方程式。
2、顺反异构体
相同的原子或原子团位于双键同 一侧的称为顺 式结构,相同的原子或原
子团位于双键两侧的称为反式结构,例如顺--2--丁烯和反--2--丁烯的结
1 . 顺 反 异 构 现 象
1. 概 念 :通过碳碳双键连接的原子或原子团不能绕键轴旋转会导致其空间排列方式不同,产 生顺反异构现象。
烯烃的立体异构
二者的结构一样吗
CH
c=c
H
构简式分别
H
CH
和
4.性质顺反异构体的化学性质基本相同,物 理 性 质有 一定的差异。
顺-2-丁烯 反-2-丁烯
(bp 3.7℃) (bp 0.88℃)
碳碳双键的每个碳原子必须连接两个不同的原子或原子团。
R R R R
R R R R
同一个双键碳上不能连有相同的基团
3、顺反异构的条件
有顺反异构的类型
无顺反异构的类型
练、下列哪种物质存在顺反异构( A、D )
B
C H
H
CH
C H
C=
D、
相同的原子或原子团位于双键同一侧为顺式结构
相同的原子或原子团位于双键两侧为反式结构
若双键碳所连的原子或原子团均不相同,则“较优基团”在
双键同侧的为顺式结构;为双键两侧为反式结构
①存在
②顺式结构
③顺反异构的判断 方法:
该物质是否存在顺反异构 若存在该物质是顺式结构 还是反式结构 如何判断
思考:
①官能团(或基团)的 优先顺序:-CO OH ( 羧 基 ) > -COO R ( 酯 基)>
-CONH (酰氨基)>-CHO(醛基)>-OH(醇羟基)>-OH (酚羟基)>- NH (氨基)>叁键>双键> -Ph(苯基)> 烷基>-X>-NO
②对于烷基而言:相对分子质量的大的优先级较高。如:乙基优先 级高于甲基。
当相对分子质量相同时,支链较多的优先级高一些。如:异丙基的 优先级高于正丙基
较优基团的判断
烯烃的制备
一、工业制法 1 . 石油裂解
二、实验室制法
1.醇脱水
2.卤代烃脱卤化氢
2 . 由醇脱水
结构:含碳碳双键,C 采取sp 杂化
物理性质:同烷烃
氧化反应
化学性质 加成反应
加聚反应
立体异构——顺反异构
共轭二烯烃的化学性质 注意1,4—加成
课 堂 小 结
烯 烃
1、异戊二烯( CH =C-CH=CH )是合成橡胶的重要原料,关于
CH
异戊二烯的说法正确的是( A )
A.与1,3-丁二烯互为同系物
B.与液溴1:1加成的产物有2种
C.形成的聚合物中没有双键
D.难溶于乙醇、乙醚等多数有机溶剂
CH —C=CH—CH
2. 已知
CH
线式
,某有机化合物的键
B.2-- 甲基庚烯
D.5-- 甲基--2--庚烯
乙基--2--己烯
甲基--5--庚烯
的键线式可写作
其正确名称是 (D)
A.5-
C.3--
