7.3乙醇 高一下学期化学人教版(2019)必修2(共25张PPT)
文档属性
| 名称 | 7.3乙醇 高一下学期化学人教版(2019)必修2(共25张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-14 00:00:00 | ||
图片预览




文档简介
(共25张PPT)
第七章有机化合物
· 第三节乙醇和乙酸 第一课时乙醇
1.认识乙醇的物理性质和结构
2.知道官能团和烃的衍生物等有机重要概念 3.掌握乙醇的化学性质
4.知道乙醇和钠反应的原理
5.熟练应用乙醇的氧化原理,在不同条件下的氧化产物能够区分
学习目标
欢时-----李白说:人生得意须尽欢,莫使金樽空对月。
喜时-----杜甫说:白日放歌须纵酒,青春作伴好还乡。 离时-----王维说:劝君更尽一杯酒,西出阳关无故人。
愁时-----李白说:抽刀断水水更流,举杯消愁愁更愁。
酒文化:
酒的历史悠久,早在几干年前,人类就掌握了发酵法酿酒的技术。 你能想起哪些含有酒的诗句
啤酒含酒精 3%~5%
葡萄酒含酒精 6%~20% 黄酒含酒精 8%~15%
白酒含酒精 50%~70% (均为体积分数)
医用酒精含乙醇75%
工业酒精约含乙醇96%
无水酒精含乙醇99.5% 以上
你知道吗
啤酒 葡萄酒
绍兴黄酒
白酒
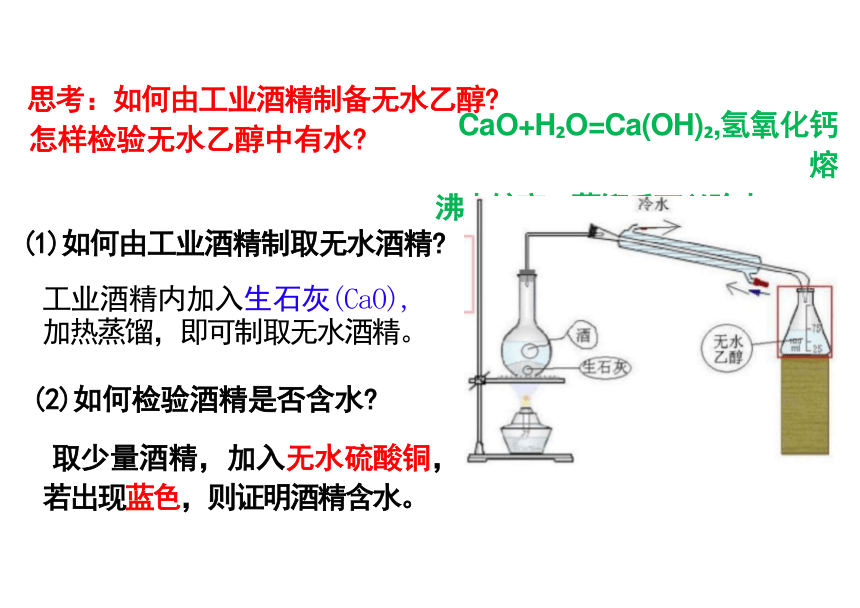
思考:如何由工业酒精制备无水乙醇
怎样检验无水乙醇中有水 CaO+H O=Ca(OH) ,氢氧化钙熔
沸点较高,蒸馏后可以除去。
(1)如何由工业酒精制取无水酒精
工业酒精内加入生石灰(CaO),
加热蒸馏,即可制取无水酒精。
(2)如何检验酒精是否含水
取少量酒精,加入无水硫酸铜,
若出现蓝色,则证明酒精含水。
【思考】以下说法或事实体现了乙醇哪些物理性质
1.病人发烧通常用酒精擦拭全身,用此法降温。易挥发,吸热
2.酒香不怕巷子深 易挥发、有特殊香味
3.白酒的主要成分是乙醇和水 易溶于水
4.衣服上沾上少许汽油用酒精可以去除。
俗称 颜色 气味 沸点 状态 溶 解 性
密度
酒 精 无色 特殊 香味 78.5℃ 易挥发 液体 与水以任意比互溶,能 溶解多种有机物和无机物
比水小 、
0.789
一、乙醇的物理性质
良好的有机溶剂、能溶解汽油
g/cm
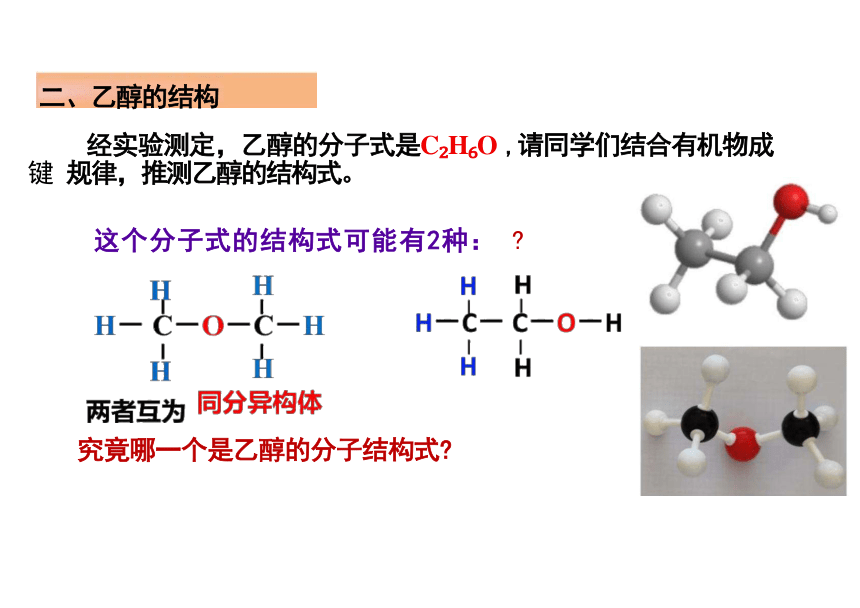
这个分子式的结构式可能有2种:
究竟哪一个是乙醇的分子结构式
经实验测定,乙醇的分子式是C H O ,请同学们结合有机物成键 规律,推测乙醇的结构式。
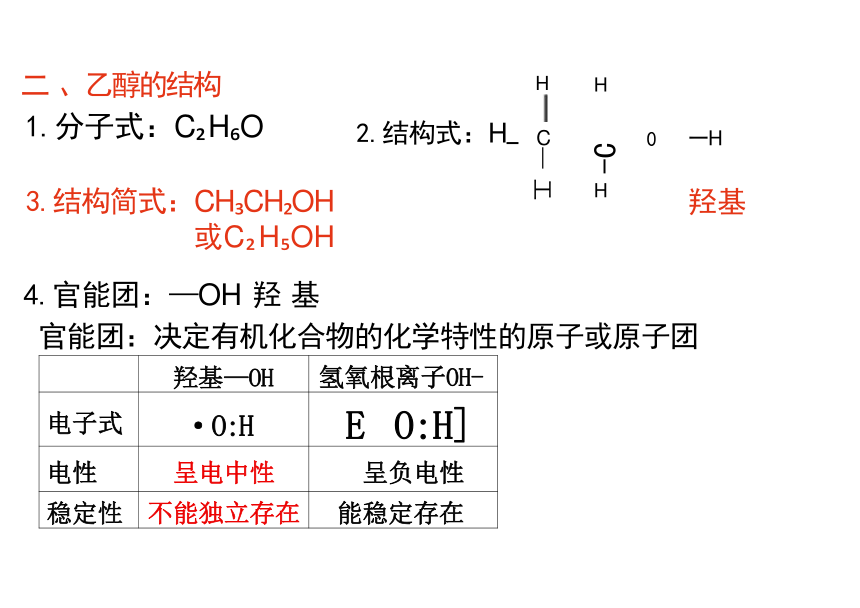
二、乙醇的结构
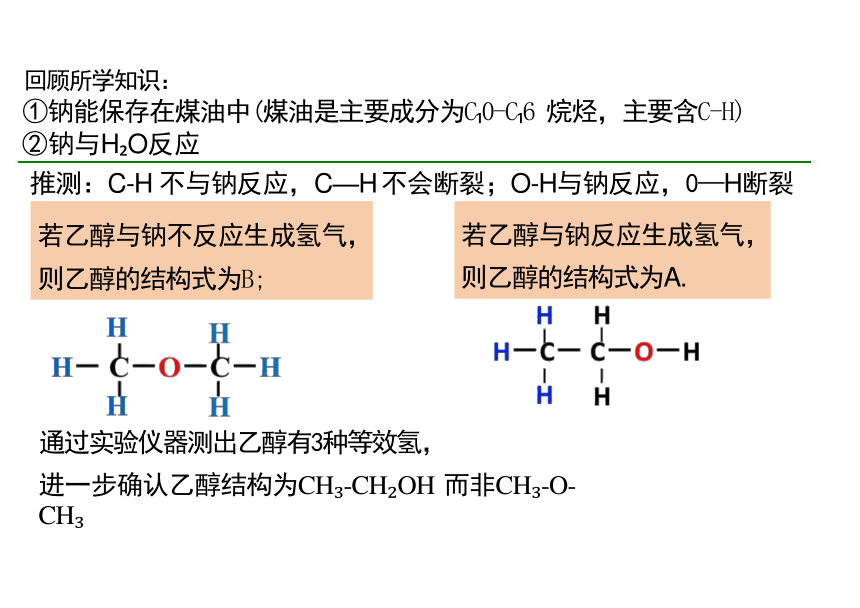
回顾所学知识:
①钠能保存在煤油中(煤油是主要成分为C 0-C 6 烷烃,主要含C-H)
②钠与H O反应
推测:C-H 不与钠反应,C—H 不会断裂;O-H与钠反应,0—H断裂
通过实验仪器测出乙醇有3种等效氢,
进一步确认乙醇结构为CH -CH OH 而非CH -O-CH
若乙醇与钠不反应生成氢气, 则乙醇的结构式为B;
若乙醇与钠反应生成氢气, 则乙醇的结构式为A.
二 、乙醇的结构
1.分子式:C H O 2.结构式:H
3.结构简式:CH CH OH
或C H OH
羟基—OH
氢氧根离子OH-
电子式 ·O:H
E O:H]
电性 呈电中性
呈负电性
稳定性 不能独立存在
能稳定存在
4.官能团:—OH 羟 基
官能团:决定有机化合物的化学特性的原子或原子团
一H
羟基
H
H
— 工
H
C
-C
0
乙醇分子可看作是乙烷分子里的一个H 被羟基所取代的产物。
烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代 而生成的一系列化合物称为烃的衍生物。
除了C、H元素外,还有其他元素 如 CH Cl、CH COOH等
H| H
H-C|- -Q-H
H H
羟基(-OH)
乙基+羟基 → 乙醇
官 能 团 定 义 :决定有机化合物的化学特性的原子或原子团
碳碳双键
碳碳三键
碳氯键
I
A.CH CH Br B.CH CH OH
D.CH =CH
2.下列物质含有两种官能团的是 (C)
CH OH Br
A. B. C.CH =CHCH OH D.CH CH Br
1.下列有机物中,不属于烃的衍生物的是( )
记住:烷烃有几种等效氢,就有几种一元醇或一氯代物
3、写出分子式为C H O 属于醇类的同分异构体
① CH -CH CH CH OH ②
a.钠开始沉于试管底部,有_无色无味气泡产生,(钠被气体带着上浮, 慢慢变小直至消失);
b.点燃,火焰呈淡蓝色;
d. 向试管中加入澄清石灰水,澄清石灰水_不变浑浊
结论:1.密度:水 > 钠 > 乙 醇
2.剧烈程度:钠 与 水 反 应 比 与 乙 醇 反 应 更 剧 烈
3.乙醇与钠反应生成 H 。
三 、乙醇的化学性质
1 . 乙醇和金属钠的反应
c.试管内壁有 液滴产生;
验纯后 迅速倒转
钠 一无水乙醇
澄清 石灰水
现象:
三、乙醇的化学性质
1、乙醇与钠反应 → 置换反应
2 CH CH OH +2Na→2CH CH ONa+H 个
乙醇钠
2Na+2HOH=2NaOH+H
[练习]其它活泼金属如钾、镁和铝等也可与乙醇反应,均可产生H ,
请写出镁与乙醇反应的化学方程式。
2CH CH OH +Mg — →(CH CH O) Mg +H 个
乙醇镁
钠与乙醇反应缓和,原因乙醇羟基中的氢原子不如水中的氢原子活泼
(氢原子活泼性:酸>H O>羟基>乙基)
规律:2-OH——H
①处O—H 键断开
针对训练:已知分子中含有羟基的物质都能与钠反应产生氢气。 CH —OH
乙醇、乙二醇 丙三醇( CH—OH )分别与足
CH —OH
量金属钠作用,产生等量的氢气。则这三种醇的物质的量之比
为(A)。
A.6:3:2 B.1:2:3 C.3:2:1 D.4:3:2
上 述 物 质 互 为 同 系 物 吗
规律:2-OH——H
金属钠的变化 气体燃烧现象
检验产物
水 浮熔游响 气体在空气中 燃烧,发出 淡蓝色火焰
溶液加酚酞后变红, 生成了碱
乙醇 钠先沉于试管底部,后浮 上 水 面 ,不熔成光亮的小 球,表面有气泡产生
干燥烧杯内壁有水 珠,加入澄清石灰 水无明显现象。
结论:1.密度:水>钠>乙醇
2.剧烈程度:钠与水反应比与乙醇反应更剧烈
比较钠分别与水、乙醇反应的实验现象:
2、乙醇的氧化反应
① 燃烧 现象:发出淡蓝色火焰,并放出大量热
C H OH +30 点 燃2CO +3H O
红色铜丝→变黑—→ 又变红,产生刺激性气味
实验结论: C H OH+Cuo一CH CHO+H O+Cu
铜丝
乙醇一
实验现象:
(2)催化氧化
向试管中加入少量乙醇,将铜丝在酒精灯上灼烧后插入乙醇,反复几次。
插入乙醇
催化剂 2Cu+O △2CuO
中间产物2CuO+2CH CH OH一2Cu+2 CH CHO+2H O
乙醛 H H
2CH CH OH+O Cu→2CH CHO+2H O Hπ C C
乙 醛 一
思考:反应中乙醇断什么键 ⑤ 工 ④ H
Cu或Ag
断①③键
2H—c—C—H)+ 2H 0
H H H 乙醛
H 0+ H
2H—C—C— Hf O
③
H
② ①
催化剂
H 0
工匠焊接银器、铜器时,表面会生成发黑的氧化膜,这时可以先把铜、银 在火上烧热,马上蘸一下酒精,铜银会光亮如初。你知道为什么吗
Ag O+CH CH OH△2Ag+CH CHO+H O
4Ag +O ≌2Ag O
2Cu+O ≌2CuO
CuO+CH CH OH 一 C u+CH CHO+H O
③R-{—→不 能 化
乙醇的催化氧化中断裂的键:
总结:
R -CH -OH →R CHO
小结:
醇能催化氧化的条件:连有-OH的碳原子上必须有H
能被催化氧化成醛的条件:连有-OH的碳原子上至少连有两个H 不能被催化氧化的醇:连有-OH的碳原子没有H
④ CH -CH-CH ⑤ CH OH
OH OH OH
思考:判断下列物质是否能发生羟基的催化氧化
OH
① CH -CH-CH
CH
CH -CH-CH -OH
②
③被酸性KMnO 、K Cr O 溶液氧化为乙酸
加 入 乙醇
重铬酸钾 酸性溶液
K Cr O Cr (SO )
重铬酸钾(橙色) 硫酸铬(绿色)
酸性高锰酸钾溶液
CH COOH
酸性重铬酸钾溶液
小结:能使高锰酸钾溶液褪色有机物:烯烃、炔烃、醇、醛
KMnO
(紫色)
CH CH OH
MnSO
(无色)
绿色
(1)上述反应中,氧化剂是 K Cr O ; 氧化产物是 CH COOH ; 反应中铬元素的化合价由_ +6 价变为 +3 价
(2)若反应中生成1.0 mol Cr +,则反应中转移的电子总数是
3NA
下列反应可以用来检验司机是否酒后驾车.
2K Cr O +3CH CH OH+8H SO —→
橙色
与Na 反应,断 ① 键
催化氧化,断①③ 键
燃烧,断 ①②③④⑤键
溶液 Cu或Ag
或酸性K Cr O 溶液 △
Na 燃烧
CO +H O
乙醇 还原性
酸性KMnO
H.CH01 .0
G13Cn0+1120
CH CH ONa+H
CH C00H
第七章有机化合物
· 第三节乙醇和乙酸 第一课时乙醇
1.认识乙醇的物理性质和结构
2.知道官能团和烃的衍生物等有机重要概念 3.掌握乙醇的化学性质
4.知道乙醇和钠反应的原理
5.熟练应用乙醇的氧化原理,在不同条件下的氧化产物能够区分
学习目标
欢时-----李白说:人生得意须尽欢,莫使金樽空对月。
喜时-----杜甫说:白日放歌须纵酒,青春作伴好还乡。 离时-----王维说:劝君更尽一杯酒,西出阳关无故人。
愁时-----李白说:抽刀断水水更流,举杯消愁愁更愁。
酒文化:
酒的历史悠久,早在几干年前,人类就掌握了发酵法酿酒的技术。 你能想起哪些含有酒的诗句
啤酒含酒精 3%~5%
葡萄酒含酒精 6%~20% 黄酒含酒精 8%~15%
白酒含酒精 50%~70% (均为体积分数)
医用酒精含乙醇75%
工业酒精约含乙醇96%
无水酒精含乙醇99.5% 以上
你知道吗
啤酒 葡萄酒
绍兴黄酒
白酒
思考:如何由工业酒精制备无水乙醇
怎样检验无水乙醇中有水 CaO+H O=Ca(OH) ,氢氧化钙熔
沸点较高,蒸馏后可以除去。
(1)如何由工业酒精制取无水酒精
工业酒精内加入生石灰(CaO),
加热蒸馏,即可制取无水酒精。
(2)如何检验酒精是否含水
取少量酒精,加入无水硫酸铜,
若出现蓝色,则证明酒精含水。
【思考】以下说法或事实体现了乙醇哪些物理性质
1.病人发烧通常用酒精擦拭全身,用此法降温。易挥发,吸热
2.酒香不怕巷子深 易挥发、有特殊香味
3.白酒的主要成分是乙醇和水 易溶于水
4.衣服上沾上少许汽油用酒精可以去除。
俗称 颜色 气味 沸点 状态 溶 解 性
密度
酒 精 无色 特殊 香味 78.5℃ 易挥发 液体 与水以任意比互溶,能 溶解多种有机物和无机物
比水小 、
0.789
一、乙醇的物理性质
良好的有机溶剂、能溶解汽油
g/cm
这个分子式的结构式可能有2种:
究竟哪一个是乙醇的分子结构式
经实验测定,乙醇的分子式是C H O ,请同学们结合有机物成键 规律,推测乙醇的结构式。
二、乙醇的结构
回顾所学知识:
①钠能保存在煤油中(煤油是主要成分为C 0-C 6 烷烃,主要含C-H)
②钠与H O反应
推测:C-H 不与钠反应,C—H 不会断裂;O-H与钠反应,0—H断裂
通过实验仪器测出乙醇有3种等效氢,
进一步确认乙醇结构为CH -CH OH 而非CH -O-CH
若乙醇与钠不反应生成氢气, 则乙醇的结构式为B;
若乙醇与钠反应生成氢气, 则乙醇的结构式为A.
二 、乙醇的结构
1.分子式:C H O 2.结构式:H
3.结构简式:CH CH OH
或C H OH
羟基—OH
氢氧根离子OH-
电子式 ·O:H
E O:H]
电性 呈电中性
呈负电性
稳定性 不能独立存在
能稳定存在
4.官能团:—OH 羟 基
官能团:决定有机化合物的化学特性的原子或原子团
一H
羟基
H
H
— 工
H
C
-C
0
乙醇分子可看作是乙烷分子里的一个H 被羟基所取代的产物。
烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代 而生成的一系列化合物称为烃的衍生物。
除了C、H元素外,还有其他元素 如 CH Cl、CH COOH等
H| H
H-C|- -Q-H
H H
羟基(-OH)
乙基+羟基 → 乙醇
官 能 团 定 义 :决定有机化合物的化学特性的原子或原子团
碳碳双键
碳碳三键
碳氯键
I
A.CH CH Br B.CH CH OH
D.CH =CH
2.下列物质含有两种官能团的是 (C)
CH OH Br
A. B. C.CH =CHCH OH D.CH CH Br
1.下列有机物中,不属于烃的衍生物的是( )
记住:烷烃有几种等效氢,就有几种一元醇或一氯代物
3、写出分子式为C H O 属于醇类的同分异构体
① CH -CH CH CH OH ②
a.钠开始沉于试管底部,有_无色无味气泡产生,(钠被气体带着上浮, 慢慢变小直至消失);
b.点燃,火焰呈淡蓝色;
d. 向试管中加入澄清石灰水,澄清石灰水_不变浑浊
结论:1.密度:水 > 钠 > 乙 醇
2.剧烈程度:钠 与 水 反 应 比 与 乙 醇 反 应 更 剧 烈
3.乙醇与钠反应生成 H 。
三 、乙醇的化学性质
1 . 乙醇和金属钠的反应
c.试管内壁有 液滴产生;
验纯后 迅速倒转
钠 一无水乙醇
澄清 石灰水
现象:
三、乙醇的化学性质
1、乙醇与钠反应 → 置换反应
2 CH CH OH +2Na→2CH CH ONa+H 个
乙醇钠
2Na+2HOH=2NaOH+H
[练习]其它活泼金属如钾、镁和铝等也可与乙醇反应,均可产生H ,
请写出镁与乙醇反应的化学方程式。
2CH CH OH +Mg — →(CH CH O) Mg +H 个
乙醇镁
钠与乙醇反应缓和,原因乙醇羟基中的氢原子不如水中的氢原子活泼
(氢原子活泼性:酸>H O>羟基>乙基)
规律:2-OH——H
①处O—H 键断开
针对训练:已知分子中含有羟基的物质都能与钠反应产生氢气。 CH —OH
乙醇、乙二醇 丙三醇( CH—OH )分别与足
CH —OH
量金属钠作用,产生等量的氢气。则这三种醇的物质的量之比
为(A)。
A.6:3:2 B.1:2:3 C.3:2:1 D.4:3:2
上 述 物 质 互 为 同 系 物 吗
规律:2-OH——H
金属钠的变化 气体燃烧现象
检验产物
水 浮熔游响 气体在空气中 燃烧,发出 淡蓝色火焰
溶液加酚酞后变红, 生成了碱
乙醇 钠先沉于试管底部,后浮 上 水 面 ,不熔成光亮的小 球,表面有气泡产生
干燥烧杯内壁有水 珠,加入澄清石灰 水无明显现象。
结论:1.密度:水>钠>乙醇
2.剧烈程度:钠与水反应比与乙醇反应更剧烈
比较钠分别与水、乙醇反应的实验现象:
2、乙醇的氧化反应
① 燃烧 现象:发出淡蓝色火焰,并放出大量热
C H OH +30 点 燃2CO +3H O
红色铜丝→变黑—→ 又变红,产生刺激性气味
实验结论: C H OH+Cuo一CH CHO+H O+Cu
铜丝
乙醇一
实验现象:
(2)催化氧化
向试管中加入少量乙醇,将铜丝在酒精灯上灼烧后插入乙醇,反复几次。
插入乙醇
催化剂 2Cu+O △2CuO
中间产物2CuO+2CH CH OH一2Cu+2 CH CHO+2H O
乙醛 H H
2CH CH OH+O Cu→2CH CHO+2H O Hπ C C
乙 醛 一
思考:反应中乙醇断什么键 ⑤ 工 ④ H
Cu或Ag
断①③键
2H—c—C—H)+ 2H 0
H H H 乙醛
H 0+ H
2H—C—C— Hf O
③
H
② ①
催化剂
H 0
工匠焊接银器、铜器时,表面会生成发黑的氧化膜,这时可以先把铜、银 在火上烧热,马上蘸一下酒精,铜银会光亮如初。你知道为什么吗
Ag O+CH CH OH△2Ag+CH CHO+H O
4Ag +O ≌2Ag O
2Cu+O ≌2CuO
CuO+CH CH OH 一 C u+CH CHO+H O
③R-{—→不 能 化
乙醇的催化氧化中断裂的键:
总结:
R -CH -OH →R CHO
小结:
醇能催化氧化的条件:连有-OH的碳原子上必须有H
能被催化氧化成醛的条件:连有-OH的碳原子上至少连有两个H 不能被催化氧化的醇:连有-OH的碳原子没有H
④ CH -CH-CH ⑤ CH OH
OH OH OH
思考:判断下列物质是否能发生羟基的催化氧化
OH
① CH -CH-CH
CH
CH -CH-CH -OH
②
③被酸性KMnO 、K Cr O 溶液氧化为乙酸
加 入 乙醇
重铬酸钾 酸性溶液
K Cr O Cr (SO )
重铬酸钾(橙色) 硫酸铬(绿色)
酸性高锰酸钾溶液
CH COOH
酸性重铬酸钾溶液
小结:能使高锰酸钾溶液褪色有机物:烯烃、炔烃、醇、醛
KMnO
(紫色)
CH CH OH
MnSO
(无色)
绿色
(1)上述反应中,氧化剂是 K Cr O ; 氧化产物是 CH COOH ; 反应中铬元素的化合价由_ +6 价变为 +3 价
(2)若反应中生成1.0 mol Cr +,则反应中转移的电子总数是
3NA
下列反应可以用来检验司机是否酒后驾车.
2K Cr O +3CH CH OH+8H SO —→
橙色
与Na 反应,断 ① 键
催化氧化,断①③ 键
燃烧,断 ①②③④⑤键
溶液 Cu或Ag
或酸性K Cr O 溶液 △
Na 燃烧
CO +H O
乙醇 还原性
酸性KMnO
H.CH01 .0
G13Cn0+1120
CH CH ONa+H
CH C00H
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
