7。3乙醇高一下学期化学人教版(2019)必修2(共40张PPT)
文档属性
| 名称 | 7。3乙醇高一下学期化学人教版(2019)必修2(共40张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-14 19:30:53 | ||
图片预览







文档简介
(共40张PPT)
第七章有机化合物
1.理解烃的衍生物、官 能 团的概念 2.认识乙醇的结构
3.掌握乙醇的化学性质——乙醇 与钠反应、氧化反应
学习目标
身边的“酒” 新课导入
含酒精:38%-65%
酒类产品标签中的
酒精度是指乙醇的
体积分数P 9
含酒精:95%
含酒精:75%(医用酒精)
含酒精:8%-15%
含酒精:6%-20%
联系生活归纳乙醇的物理性质
含酒精:3%-5%
颜色状态:无色透明的液体
气 味:特殊的香味
密 度 :比水小,20C 时的密度是0.789g/cm 挥发性:沸点78.5℃,易挥发
溶解性:和水可以以任意比互溶,
能够溶解多种有机物和无机物
汽油,苯 I 等
医用酒精:75%乙醇(体积分数)
工业酒精:95%乙醇(体积分数)
乙醇的物理性质
教师点拨25min
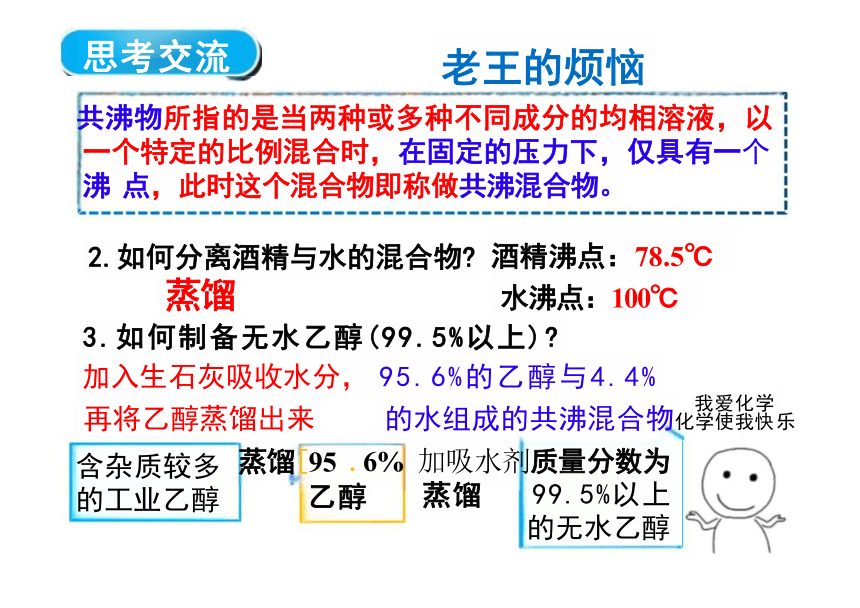
共沸物所指的是当两种或多种不同成分的均相溶液,以 一个特定的比例混合时,在固定的压力下,仅具有一个 沸 点,此时这个混合物即称做共沸混合物。
2.如何分离酒精与水的混合物 酒精沸点:78.5℃
蒸馏 水沸点:100℃
3.如何制备无水乙醇(99.5%以上)
加入生石灰吸收水分, 95.6%的乙醇与4.4%
再将乙醇蒸馏出来 的水组成的共沸混合物化 乐
学使我快
我爱化学
蒸馏[95 .6% 加吸水剂质量分数为 乙醇 蒸馏 99.5%以上 的无水乙醇
思考交流
含杂质较多 的工业乙醇
老王的烦恼
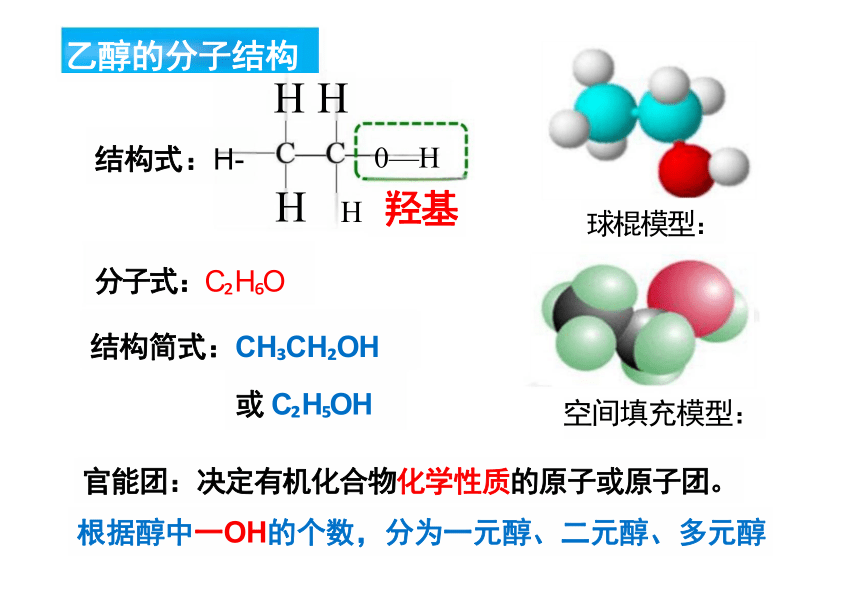
分子式:C H O
结构简式:CH CH OH
或 C H OH 空间填充模型:
官能团:决定有机化合物化学性质的原子或原子团。
根据醇中一OH的个数,分为一元醇、二元醇、多元醇
H H
结构式:H- 0—H
H H 羟基
乙醇的分子结构
球棍模型:
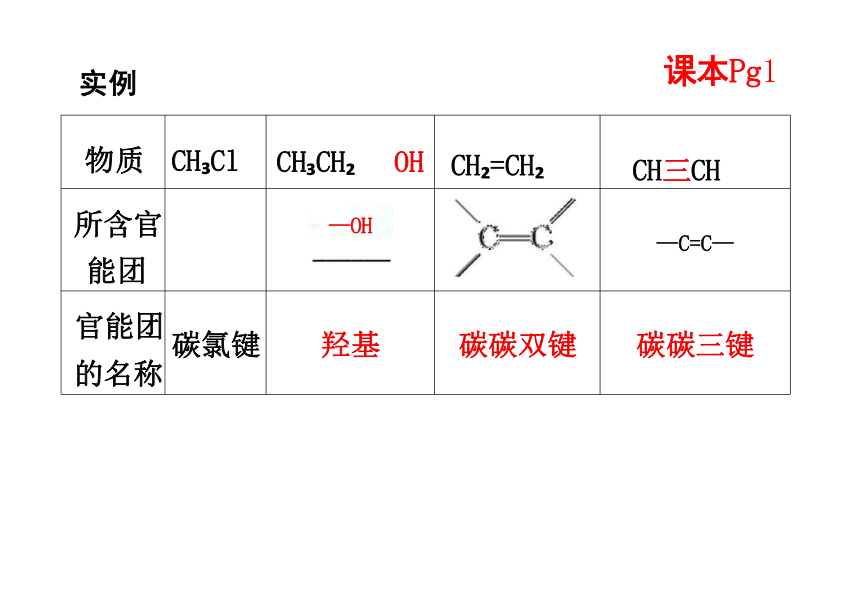
物质 CH Cl CH CH OH CH =CH
CH三CH
所含官 能团 —OH
—C=C—
官能团 的名称 碳氯键 羟基 碳碳双键
碳碳三键
课本Pg1
实例
我们把—OH 原子团叫做羟基。乙醇可以
看成是乙烷分子中的一个氢原子被羟基取代 后的产物。我们把烃类物质饱和碳原子上的 氢原子被羟基取代而成的化合物,叫做醇。
像这样,烃分子中的氢原子被其他原子或 原子团所取代而生成的一系列化合物成为烃的 衍生物。比如前面学习的CH BrCH Br CH Cl、 CH Cl 都属于烃的衍生物。
烃的衍生物和烃具有不同的性质
烃(只有C、H)
判断
烃的衍生物(不只含C、H)
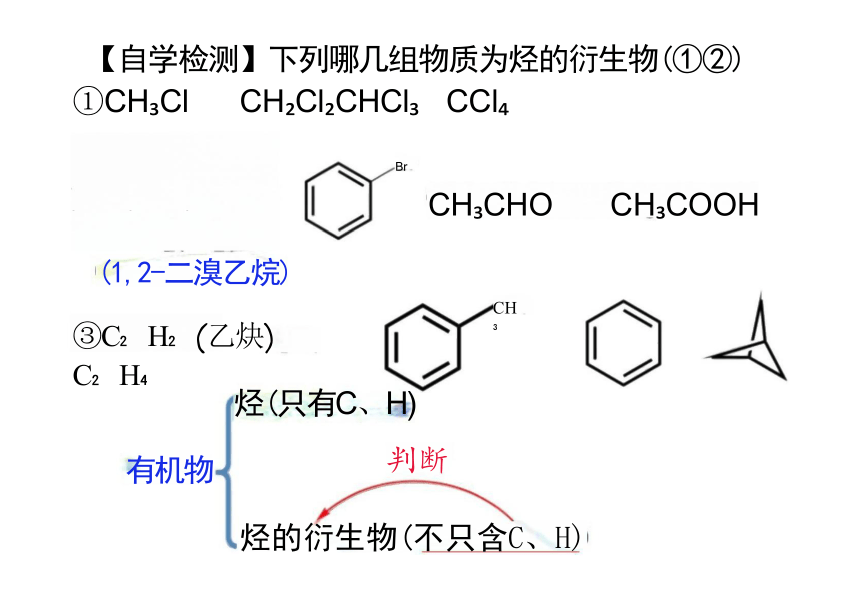
【自学检测】下列哪几组物质为烃的衍生物(①②)
①CH Cl CH Cl CHCl CCl
(1,2-二溴乙烷)
③C H (乙炔) C H
Br
CH CHO CH COOH
有机物
---
CH
催化剂
CH = CH 十 H O
加热、加压
CH = CH2十HCl
△
CH2 = CH2 十Cl —→CH CICH Cl
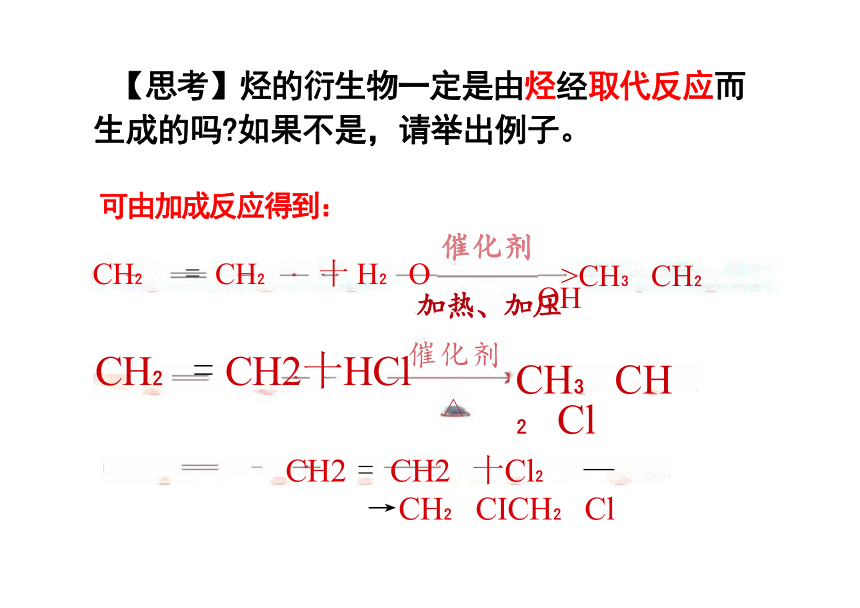
【思考】烃的衍生物一定是由烃经取代反应而
生成的吗 如果不是,请举出例子。
可由加成反应得到:
>CH CH OH
CH CH Cl
催化剂
羟基(=OH)
氢氧根(OH-)
电性 电中性
带负电
电子式 0:H
。
稳定性 不稳定 不能独立存在,必须和 其他基团或原子结合
稳定
离子稳定存在溶液中
乙醇为非电解质,乙醇的水溶液为中性,乙醇中不含OH-
①1mol-OH 羟基含 9 mol 质子, 9 mol e-
②1mol OH含 9 mol质 子 , 10 mol e-
判一判(● 判断正误(正确的打“ √ ”,错误的打“×”)
(1)乙醇易溶于水,难溶于有机溶剂。 ( X ) 乙醇易溶于水,易溶于有机溶剂。
(2)乙醇可以溶解多种有机物和无机物。 (
(3)乙醇可以看成由乙基和羟基组成的有机物。
H- - o—H 1 ( √ )
o: H
(4)—OH 的电子式为:0 H
I
-
C
H
实战演练
H H
_ _
【实战演练】某有机物(含C、H、O)分子结构如图所示,
有关该有机物说法正确的是 ②③⑥
①该有机物含有取代基团OH- =OH
该有机物分子中碳和氢原子个数比为1:3
该有机物的同分异构体结构简式为CH —O—CH ④ 该有机物溶于水呈酸性 水溶液为中性
⑤该有机物分子中三种类型的氢原子,都能电离出H+
工 业上获取无水该有机物的方法,常加入新制的生石
灰,再进行蒸馏
CH CH OH
下列物质中含有2种官能团的是(A)
A. 乳酸( CH —CH-icO0H ) OH
CH ) 甲苯中没有官能团
烷基、苯环等不属于官能团
B. 苯乙烯(
C. 丙三醇
D. 甲苯(
CH= CH
2I
在盛有少量无水乙醇的试管中,加入一小块新切的用
滤纸吸干表面煤油的钠 ,在试管口迅速塞上带尖嘴导 管的橡胶塞。用小试管收集气体并检验其纯度,然 后 点燃(如图7- 19),再将干燥的小烧杯罩在火焰上, 待烧杯壁上出现液滴后,迅速倒转烧杯,向其中加入 少量澄清石灰水,观察现象,并与前面做过的水与钠 反应的实验现象进行比较。
1.乙醇与钠反应
【实验7-4】
乙醇的化学性质
① 钠开始沉于试管底部,最终慢慢消失,产生 气泡 P 水> P 钠 _> P 乙醇
② 烧杯内壁有水珠产生;
③向烧杯中加入澄清石灰水不变浑浊
乙醇与钠反应生成氢气,
方程式2CH CH OH+2Na→2CH CH ONa+H ↑
乙醇的化学性质 1 . 乙醇与钠反应
实验
结论
实验
现象
单位时间内放出的热量不能使钠块熔化
钠与乙醇、Na 与水反应的对比
Na与水反应
Na与乙醇反应
现象 浮、熔、游、响、
沉、不熔、不响
反应式 2Na +2 H O=2NaO 2CH CH OH+2Na
H+H 个
→ 2CH CH ONa +H 个
剧烈程度 Na与水反应更剧烈 H的活性:酸中的H>水中的H>羟基H(—OH)
反应实质 Na置换水电离出的H+
Na置换羟基中的H, 生 成 H
2CH CH OH +2Na→2CH CH ONa + H 个 【思考】如何用实验证明乙醇的结构简式是
CH CH OH 而不是CH OCH
乙醇与金属钠反应的断键
①处O -H键断开
H—c—c—0—H H—C— -C—H
H H H H
乙醇中有3种H 甲醚中有1 种H
可利用乙醇与金属钠反应产生氢气进行定量实验,经 实验测得1 mol 乙醇与足量金属钠反应可产生
0.5molH , 则可证明乙醇分子中的6个氢原子中只
有1个氢原子与另外5个氢原子不同,可推知乙醇的
结构简式为CH CH OH
【思考】如何用实验证明乙醇的结构简式是 CH CH OH而不是CH OCH
H H
H
H
2.乙醇的氧化反应
(1)乙醇在空气中燃烧:
C H OH+3O 点燃2CO +3H O 现象:产生淡蓝色火焰,同时放出大量热。
酒精燃料飞机 酒精火锅
乙醇的化学性质
高温焊接银器或 铜器时,表面会生成黑色 的氧化物师傅说:把铜、银器具趁热蘸一下 酒精,铜、银会光亮如初!真的这么神奇吗
乙醇的化学性质
2.乙醇的氧化反应
(2)乙醇的催化氧化
【实验7-5】向试管中加入少量乙醇,取一根 铜丝,下端绕成螺旋状,在酒精灯上灼烧后插 入乙醇,反复几次,注意观察反应现象,小心 地闻试管中液体产生的气味。
[结论]
2Cu+O A2CuO
C H OH+CuO△CH CHO+H O+Cu
铜丝灼烧时 变黑,插入乙醇后变 红,反复几次可闻到
刺激性气味
2Cu+O A=2CuO ①
△
C H OH+CuO —→CH CHO+H O+Cu ②
②×2+①
总反应 2 CH CH OH+O (乙醇具有还原性)
0
→CH C—HJ+H O
乙醛
H
CH C O—H
H
CH CHO 结构中的
—CHO 基团叫醛基
乙醛易溶于水、 具有刺激性气味
催化剂
Cu
O
CuO
Cu
△→ 2CH CHO+2H O
醇催化氧化的条件:
与羟基直接相连的碳原子上必须有氢
【巧记方法】
碳氧去氢双键连 碳上俩氢变成醛
断键
机理:
H
[思考]在焊接铜漆包线的线头时,常先把线头放在 火上烧一下,以除去漆层,并立即在酒精中蘸一下,
再焊接。 用火烧法去掉漆层后,铜表面被氧化成了
反应原理为Cuo,在酒精中蘸一下,CuO又被还原成 了单质Cu
乙醇的化学性质
2.乙醇的氧化反应
(3)乙醇被氧化为乙酸
被氧化为乙醛:
2CH CH OH+0 2CH CHO+2H O
乙醛接着可以被氧化为乙酸:
2 CH CHO +0 催化剂2CH COOH
乙醇的化学性质
酸性高锰酸钾溶液
CH CH OH 酸性重铬酸钾溶液 CH COOH
MnSO K Cr O Cr (SO )
(无色) 重铬酸钾(橙黄色)硫酸铬(绿色)
交警常用此原理检测司机是否酒后驾车
酸性高锰酸钾溶液 酸性重铬酸钾溶液(K Cr O )
也能被强氧化剂直接氧化为乙酸
KMnO ( 紫色)
KMnO (H+)/K Cr O (H+)
氧化反应:在有机反应中失去氢原子或加入氧原 子的反应称为氧化反应
有机物氧化反应:有机物做还原剂,
被氧化剂氧化, 从组成上看:有机物去氢/加氧
CH CH OH 乙醇 O Cu/Ag 加热
CH CHO 乙醛
乙醇的氧化反应
乙醇去氢
有机物氧化反应的特点:
O (点燃)
乙醛加氧
CH COOH 乙酸
CO +H O
O
可以做溶剂,提取多 种有机物、无机物
消毒剂(75%的乙 醇溶液)体积分数
可以做燃料, 提供能量
乙醇的用途
重要的化工原料和溶剂
酒精10%+汽油90%
医 药
饮料
知识脉络
物理性质:色、态、味,溶解性及密度
官能团:羟基(—OH)
组成结构:C H O,CH CH OH
与活泼金属反应(如Na)
燃烧反应
催化氧化为乙醛
强氧化剂氧化为乙酸
化学性质
应用
氧化反应
烃 的 衍生物
乙醇
(正确的打“ √”,错误的打“×”)
(1)乙醇可以看做是乙基(—CH CH ) 与羟基(—OH) 相互结 合形成的,故它的官能团是羟基或乙基。羧 基
(2)乙醇分子中含有六个氢原子,故1 mol乙醇与足量的钠
反应可以生成3 mol 的氢气。与钠反应
(3)乙醇在Cu 的催化作用下,与 足 量O 反应可以生成乙酸。
被O 氧化为乙醛
(4)乙醇、乙烯均使酸性KMnO 溶液褪色,二者均发生氧
化反应。
实战演练
只有羟基中的氢
A. 和金属钠反应时断裂①
B. 在铜或银催化共热下与O 反应时断裂①和③ C. 在铜或银催化共热下与O 反应时断裂①和⑤ D. 在空气中完全燃烧时断裂①②③④⑤
1. 乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中
断裂键的说明不正确的是(C)
2.乙醇的催化氧化过程如图所示,下列说法错误的 是(C )
A. 过程①中的现象是红色固体变成黑色BCu 和程 醇化
CH CHO C H OH
学方程式是CuO+CH CH OH-→CH CH 迎色固体变
H OC.由图可知,催化剂不参与化学反应感角.将
Cu换成Ag, 也能实现乙醇催化氧化生成乙醛
醇的催化氧化反应规律
醇在有催化剂(铜或银)存在的条件下,可以发生 催化氧化反应生成醛,但并不是所有的醇都能被 氧化生成醛。 2 H
(1)凡是含有R—CH OH(R 代表烃基)结构的醇,
在一定条件下都能被氧化成醛)-CHO
2CH OH+O 哭 2 HCHO+2H O
醇催化氧化的条件:
与羟基直接相连的碳原子上必须有氢
(3)凡是含有R+ c )-QH 结构的醇通常情况下不能被催
OH
(2)凡是含有 1H
R—( CH) R'
α碳
被氧化,但生成物不是醛,而是酮(
结构的醇,在一定条件下也能
化氧化。
1.下列有机物中,不属于烃的衍生物的是(D)
A. B.CH CH NO
C.CH ===CHBr D.CH ===CH 烃
2. 下列关于乙醇的说法中,不正确的是( A )A. 乙
醇与Na 反应比水与Na 反应更剧烈B. 乙 酥肆的氢随活泼 溶剂,故可以用乙醇来提取某些中药中的有效成分
C. 乙醇能与水以任意比例互溶,故可以勾兑出不同 酒精度的酒D. 因为羟基的存在,所以乙醇能与钠反
应
C.1 mol乙醇与足量的Na 作用得0.5 mol H
D.1 mol乙醇可生成1 mol乙醛
乙醇氧化成乙醛时,0—H 及C—H 均参与反应
C项:乙醇与足量钠反应,参与反应的氢原子数占乙醇 分子中氢原子总数的六分之一,说明其中一个氢原子
与另外五个不同
其他氢原子不同的是(C)
A.1 mol乙醇完全燃烧生成3 B. 乙醇可以制饮料
乙醇燃烧时,所有的氢原 子均参与反应生成H O
mol水
3.下列方法中可以证明乙醇分子中有一个氢原子与
①CH CH CHCH
OH
③CH CHCH
A.① 和 ②
C.③ 和 ④
4.下列四种有机物的分子式都是C H 0O, 其中不
能被氧化为同碳原子数醛的是(D) 2H
②CH CH CH CH
看α碳上H 的个数 α碳
OH
B.② 和③
D.① 和④
第七章有机化合物
1.理解烃的衍生物、官 能 团的概念 2.认识乙醇的结构
3.掌握乙醇的化学性质——乙醇 与钠反应、氧化反应
学习目标
身边的“酒” 新课导入
含酒精:38%-65%
酒类产品标签中的
酒精度是指乙醇的
体积分数P 9
含酒精:95%
含酒精:75%(医用酒精)
含酒精:8%-15%
含酒精:6%-20%
联系生活归纳乙醇的物理性质
含酒精:3%-5%
颜色状态:无色透明的液体
气 味:特殊的香味
密 度 :比水小,20C 时的密度是0.789g/cm 挥发性:沸点78.5℃,易挥发
溶解性:和水可以以任意比互溶,
能够溶解多种有机物和无机物
汽油,苯 I 等
医用酒精:75%乙醇(体积分数)
工业酒精:95%乙醇(体积分数)
乙醇的物理性质
教师点拨25min
共沸物所指的是当两种或多种不同成分的均相溶液,以 一个特定的比例混合时,在固定的压力下,仅具有一个 沸 点,此时这个混合物即称做共沸混合物。
2.如何分离酒精与水的混合物 酒精沸点:78.5℃
蒸馏 水沸点:100℃
3.如何制备无水乙醇(99.5%以上)
加入生石灰吸收水分, 95.6%的乙醇与4.4%
再将乙醇蒸馏出来 的水组成的共沸混合物化 乐
学使我快
我爱化学
蒸馏[95 .6% 加吸水剂质量分数为 乙醇 蒸馏 99.5%以上 的无水乙醇
思考交流
含杂质较多 的工业乙醇
老王的烦恼
分子式:C H O
结构简式:CH CH OH
或 C H OH 空间填充模型:
官能团:决定有机化合物化学性质的原子或原子团。
根据醇中一OH的个数,分为一元醇、二元醇、多元醇
H H
结构式:H- 0—H
H H 羟基
乙醇的分子结构
球棍模型:
物质 CH Cl CH CH OH CH =CH
CH三CH
所含官 能团 —OH
—C=C—
官能团 的名称 碳氯键 羟基 碳碳双键
碳碳三键
课本Pg1
实例
我们把—OH 原子团叫做羟基。乙醇可以
看成是乙烷分子中的一个氢原子被羟基取代 后的产物。我们把烃类物质饱和碳原子上的 氢原子被羟基取代而成的化合物,叫做醇。
像这样,烃分子中的氢原子被其他原子或 原子团所取代而生成的一系列化合物成为烃的 衍生物。比如前面学习的CH BrCH Br CH Cl、 CH Cl 都属于烃的衍生物。
烃的衍生物和烃具有不同的性质
烃(只有C、H)
判断
烃的衍生物(不只含C、H)
【自学检测】下列哪几组物质为烃的衍生物(①②)
①CH Cl CH Cl CHCl CCl
(1,2-二溴乙烷)
③C H (乙炔) C H
Br
CH CHO CH COOH
有机物
---
CH
催化剂
CH = CH 十 H O
加热、加压
CH = CH2十HCl
△
CH2 = CH2 十Cl —→CH CICH Cl
【思考】烃的衍生物一定是由烃经取代反应而
生成的吗 如果不是,请举出例子。
可由加成反应得到:
>CH CH OH
CH CH Cl
催化剂
羟基(=OH)
氢氧根(OH-)
电性 电中性
带负电
电子式 0:H
。
稳定性 不稳定 不能独立存在,必须和 其他基团或原子结合
稳定
离子稳定存在溶液中
乙醇为非电解质,乙醇的水溶液为中性,乙醇中不含OH-
①1mol-OH 羟基含 9 mol 质子, 9 mol e-
②1mol OH含 9 mol质 子 , 10 mol e-
判一判(● 判断正误(正确的打“ √ ”,错误的打“×”)
(1)乙醇易溶于水,难溶于有机溶剂。 ( X ) 乙醇易溶于水,易溶于有机溶剂。
(2)乙醇可以溶解多种有机物和无机物。 (
(3)乙醇可以看成由乙基和羟基组成的有机物。
H- - o—H 1 ( √ )
o: H
(4)—OH 的电子式为:0 H
I
-
C
H
实战演练
H H
_ _
【实战演练】某有机物(含C、H、O)分子结构如图所示,
有关该有机物说法正确的是 ②③⑥
①该有机物含有取代基团OH- =OH
该有机物分子中碳和氢原子个数比为1:3
该有机物的同分异构体结构简式为CH —O—CH ④ 该有机物溶于水呈酸性 水溶液为中性
⑤该有机物分子中三种类型的氢原子,都能电离出H+
工 业上获取无水该有机物的方法,常加入新制的生石
灰,再进行蒸馏
CH CH OH
下列物质中含有2种官能团的是(A)
A. 乳酸( CH —CH-icO0H ) OH
CH ) 甲苯中没有官能团
烷基、苯环等不属于官能团
B. 苯乙烯(
C. 丙三醇
D. 甲苯(
CH= CH
2I
在盛有少量无水乙醇的试管中,加入一小块新切的用
滤纸吸干表面煤油的钠 ,在试管口迅速塞上带尖嘴导 管的橡胶塞。用小试管收集气体并检验其纯度,然 后 点燃(如图7- 19),再将干燥的小烧杯罩在火焰上, 待烧杯壁上出现液滴后,迅速倒转烧杯,向其中加入 少量澄清石灰水,观察现象,并与前面做过的水与钠 反应的实验现象进行比较。
1.乙醇与钠反应
【实验7-4】
乙醇的化学性质
① 钠开始沉于试管底部,最终慢慢消失,产生 气泡 P 水> P 钠 _> P 乙醇
② 烧杯内壁有水珠产生;
③向烧杯中加入澄清石灰水不变浑浊
乙醇与钠反应生成氢气,
方程式2CH CH OH+2Na→2CH CH ONa+H ↑
乙醇的化学性质 1 . 乙醇与钠反应
实验
结论
实验
现象
单位时间内放出的热量不能使钠块熔化
钠与乙醇、Na 与水反应的对比
Na与水反应
Na与乙醇反应
现象 浮、熔、游、响、
沉、不熔、不响
反应式 2Na +2 H O=2NaO 2CH CH OH+2Na
H+H 个
→ 2CH CH ONa +H 个
剧烈程度 Na与水反应更剧烈 H的活性:酸中的H>水中的H>羟基H(—OH)
反应实质 Na置换水电离出的H+
Na置换羟基中的H, 生 成 H
2CH CH OH +2Na→2CH CH ONa + H 个 【思考】如何用实验证明乙醇的结构简式是
CH CH OH 而不是CH OCH
乙醇与金属钠反应的断键
①处O -H键断开
H—c—c—0—H H—C— -C—H
H H H H
乙醇中有3种H 甲醚中有1 种H
可利用乙醇与金属钠反应产生氢气进行定量实验,经 实验测得1 mol 乙醇与足量金属钠反应可产生
0.5molH , 则可证明乙醇分子中的6个氢原子中只
有1个氢原子与另外5个氢原子不同,可推知乙醇的
结构简式为CH CH OH
【思考】如何用实验证明乙醇的结构简式是 CH CH OH而不是CH OCH
H H
H
H
2.乙醇的氧化反应
(1)乙醇在空气中燃烧:
C H OH+3O 点燃2CO +3H O 现象:产生淡蓝色火焰,同时放出大量热。
酒精燃料飞机 酒精火锅
乙醇的化学性质
高温焊接银器或 铜器时,表面会生成黑色 的氧化物师傅说:把铜、银器具趁热蘸一下 酒精,铜、银会光亮如初!真的这么神奇吗
乙醇的化学性质
2.乙醇的氧化反应
(2)乙醇的催化氧化
【实验7-5】向试管中加入少量乙醇,取一根 铜丝,下端绕成螺旋状,在酒精灯上灼烧后插 入乙醇,反复几次,注意观察反应现象,小心 地闻试管中液体产生的气味。
[结论]
2Cu+O A2CuO
C H OH+CuO△CH CHO+H O+Cu
铜丝灼烧时 变黑,插入乙醇后变 红,反复几次可闻到
刺激性气味
2Cu+O A=2CuO ①
△
C H OH+CuO —→CH CHO+H O+Cu ②
②×2+①
总反应 2 CH CH OH+O (乙醇具有还原性)
0
→CH C—HJ+H O
乙醛
H
CH C O—H
H
CH CHO 结构中的
—CHO 基团叫醛基
乙醛易溶于水、 具有刺激性气味
催化剂
Cu
O
CuO
Cu
△→ 2CH CHO+2H O
醇催化氧化的条件:
与羟基直接相连的碳原子上必须有氢
【巧记方法】
碳氧去氢双键连 碳上俩氢变成醛
断键
机理:
H
[思考]在焊接铜漆包线的线头时,常先把线头放在 火上烧一下,以除去漆层,并立即在酒精中蘸一下,
再焊接。 用火烧法去掉漆层后,铜表面被氧化成了
反应原理为Cuo,在酒精中蘸一下,CuO又被还原成 了单质Cu
乙醇的化学性质
2.乙醇的氧化反应
(3)乙醇被氧化为乙酸
被氧化为乙醛:
2CH CH OH+0 2CH CHO+2H O
乙醛接着可以被氧化为乙酸:
2 CH CHO +0 催化剂2CH COOH
乙醇的化学性质
酸性高锰酸钾溶液
CH CH OH 酸性重铬酸钾溶液 CH COOH
MnSO K Cr O Cr (SO )
(无色) 重铬酸钾(橙黄色)硫酸铬(绿色)
交警常用此原理检测司机是否酒后驾车
酸性高锰酸钾溶液 酸性重铬酸钾溶液(K Cr O )
也能被强氧化剂直接氧化为乙酸
KMnO ( 紫色)
KMnO (H+)/K Cr O (H+)
氧化反应:在有机反应中失去氢原子或加入氧原 子的反应称为氧化反应
有机物氧化反应:有机物做还原剂,
被氧化剂氧化, 从组成上看:有机物去氢/加氧
CH CH OH 乙醇 O Cu/Ag 加热
CH CHO 乙醛
乙醇的氧化反应
乙醇去氢
有机物氧化反应的特点:
O (点燃)
乙醛加氧
CH COOH 乙酸
CO +H O
O
可以做溶剂,提取多 种有机物、无机物
消毒剂(75%的乙 醇溶液)体积分数
可以做燃料, 提供能量
乙醇的用途
重要的化工原料和溶剂
酒精10%+汽油90%
医 药
饮料
知识脉络
物理性质:色、态、味,溶解性及密度
官能团:羟基(—OH)
组成结构:C H O,CH CH OH
与活泼金属反应(如Na)
燃烧反应
催化氧化为乙醛
强氧化剂氧化为乙酸
化学性质
应用
氧化反应
烃 的 衍生物
乙醇
(正确的打“ √”,错误的打“×”)
(1)乙醇可以看做是乙基(—CH CH ) 与羟基(—OH) 相互结 合形成的,故它的官能团是羟基或乙基。羧 基
(2)乙醇分子中含有六个氢原子,故1 mol乙醇与足量的钠
反应可以生成3 mol 的氢气。与钠反应
(3)乙醇在Cu 的催化作用下,与 足 量O 反应可以生成乙酸。
被O 氧化为乙醛
(4)乙醇、乙烯均使酸性KMnO 溶液褪色,二者均发生氧
化反应。
实战演练
只有羟基中的氢
A. 和金属钠反应时断裂①
B. 在铜或银催化共热下与O 反应时断裂①和③ C. 在铜或银催化共热下与O 反应时断裂①和⑤ D. 在空气中完全燃烧时断裂①②③④⑤
1. 乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中
断裂键的说明不正确的是(C)
2.乙醇的催化氧化过程如图所示,下列说法错误的 是(C )
A. 过程①中的现象是红色固体变成黑色BCu 和程 醇化
CH CHO C H OH
学方程式是CuO+CH CH OH-→CH CH 迎色固体变
H OC.由图可知,催化剂不参与化学反应感角.将
Cu换成Ag, 也能实现乙醇催化氧化生成乙醛
醇的催化氧化反应规律
醇在有催化剂(铜或银)存在的条件下,可以发生 催化氧化反应生成醛,但并不是所有的醇都能被 氧化生成醛。 2 H
(1)凡是含有R—CH OH(R 代表烃基)结构的醇,
在一定条件下都能被氧化成醛)-CHO
2CH OH+O 哭 2 HCHO+2H O
醇催化氧化的条件:
与羟基直接相连的碳原子上必须有氢
(3)凡是含有R+ c )-QH 结构的醇通常情况下不能被催
OH
(2)凡是含有 1H
R—( CH) R'
α碳
被氧化,但生成物不是醛,而是酮(
结构的醇,在一定条件下也能
化氧化。
1.下列有机物中,不属于烃的衍生物的是(D)
A. B.CH CH NO
C.CH ===CHBr D.CH ===CH 烃
2. 下列关于乙醇的说法中,不正确的是( A )A. 乙
醇与Na 反应比水与Na 反应更剧烈B. 乙 酥肆的氢随活泼 溶剂,故可以用乙醇来提取某些中药中的有效成分
C. 乙醇能与水以任意比例互溶,故可以勾兑出不同 酒精度的酒D. 因为羟基的存在,所以乙醇能与钠反
应
C.1 mol乙醇与足量的Na 作用得0.5 mol H
D.1 mol乙醇可生成1 mol乙醛
乙醇氧化成乙醛时,0—H 及C—H 均参与反应
C项:乙醇与足量钠反应,参与反应的氢原子数占乙醇 分子中氢原子总数的六分之一,说明其中一个氢原子
与另外五个不同
其他氢原子不同的是(C)
A.1 mol乙醇完全燃烧生成3 B. 乙醇可以制饮料
乙醇燃烧时,所有的氢原 子均参与反应生成H O
mol水
3.下列方法中可以证明乙醇分子中有一个氢原子与
①CH CH CHCH
OH
③CH CHCH
A.① 和 ②
C.③ 和 ④
4.下列四种有机物的分子式都是C H 0O, 其中不
能被氧化为同碳原子数醛的是(D) 2H
②CH CH CH CH
看α碳上H 的个数 α碳
OH
B.② 和③
D.① 和④
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
