7.3 乙酸 高一下学期化学人教版(2019)必修2(共22张PPT)
文档属性
| 名称 | 7.3 乙酸 高一下学期化学人教版(2019)必修2(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-14 19:36:34 | ||
图片预览






文档简介
(共22张PPT)
第七章有机化合物
第三节乙醇与乙酸
第二课时乙酸
1.联系日常生活,认识乙酸的用途和物理性质;
2.比较乙醇、乙酸、乙酸乙酯的分子结构与性质,认识有机物中官能团对其 性质的决定性作用,发展宏观辨识与微观探析化学学科核心素养。
3.通过实验探究,认识酯化反应,并构建其模型,发展证据推理与模型认知 化学学科核心素养。
核心素养
情境导学
食醋是中国古代劳动人民发明传统调味品,食醋中含有3%~5%的
乙 酸,故乙酸又被称为醋酸。
资料:传说古代山西省有个酿酒高手叫杜康。他儿子黑塔
也学会了酿酒技术。后来,从山西迁到镇江。黑塔觉得酿
酒后把酒糟扔掉可惜,把酒糟浸泡在水缸里。到了第二十
一 日的酉时, 一开缸, 一股浓郁的香气扑鼻而来。黑塔忍
不住尝了 一 口,酸酸的,味道很美。烧菜时放了 一些,味
道特别鲜美便贮藏着作为“调味酱”。
颜色 状态 气味 溶解性 挥发性 熔点
沸点
无色 液体 有强烈刺激 性气味 易溶于水 和乙醇 易挥发 16.6℃
118℃
当温度低于16.6℃时,乙酸可凝结成类似冰的晶体,故纯净的乙酸又
称为“冰 醋 酸 ”。
任务一:乙酸的物理性质
1、乙酸的物理性质: 俗名:醋酸
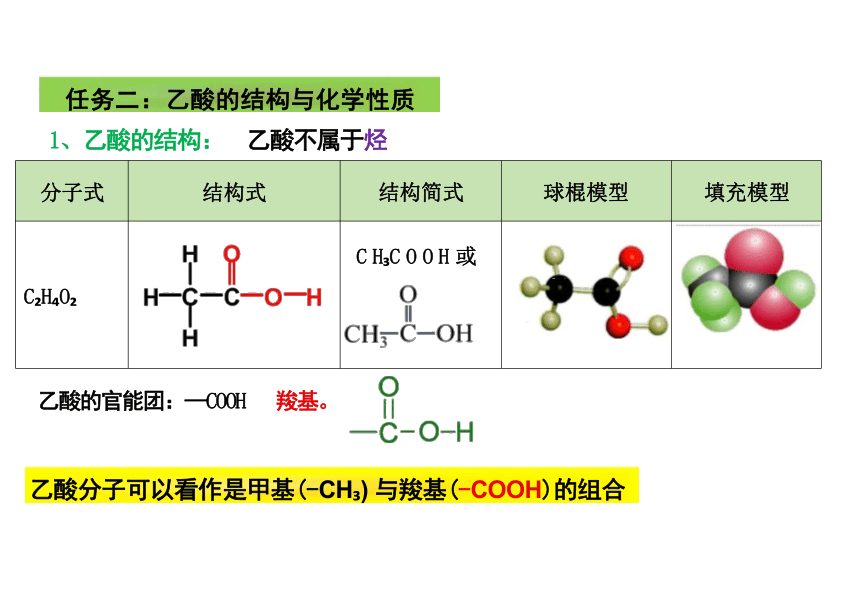
分子式 结构式 结构简式 球棍模型
填充模型
C H O C H C O O H 或
乙酸分子可以看作是甲基(-CH ) 与羧基(-COOH)的组合
任务二:乙酸的结构与化学性质
1、乙酸的结构: 乙酸不属于烃
乙酸的官能团:—COOH 羧基。
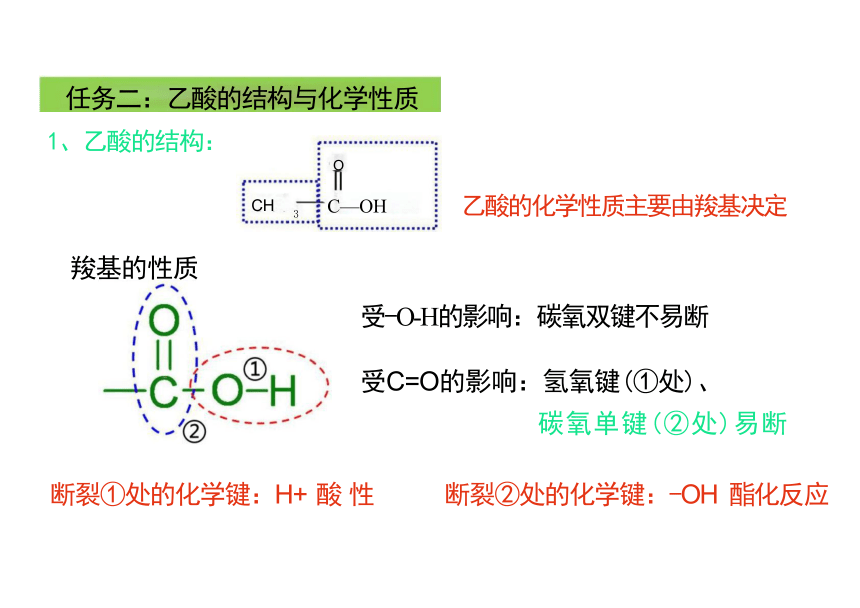
羧基的性质
受-O-H的影响:碳氧双键不易断
受C=O的影响:氢氧键(①处)、
碳氧单键(②处)易断
断裂①处的化学键:H+ 酸 性 断裂②处的化学键:-OH 酯化反应
任务二:乙酸的结构与化学性质
乙酸的化学性质主要由羧基决定
1、乙酸的结构:
O
C—OH
CH
3
思考1:醋酸是几元酸
一元弱酸,具有酸的通性
CH COOH— CH CO0-+H+
2、乙酸的化学性质:
(1)酸性: O
11
CH —C—O÷H
任务二:乙酸的结构和化学性质
2、乙酸的化学性质: ( 1 ) 酸 性 :
思考2:根据下列提供的药品,设计实验证明乙酸的酸性。
镁带、Na O 粉末、Na CO 粉末、NaOH 溶液、乙酸溶液、酚酞、石蕊。 方案一:往乙酸溶液中加石蕊 紫色石蕊溶液变红
方案二:将镁条插入乙酸溶液 2 CH COOH+Mg =(CH COO) Mg+H 个
方案三:往Na O粉未中加入乙酸溶液
2CH COOH+Na O=2CH COONa+H O
方案四:往Na CO 粉未中加入乙酸溶液
2 CH COOH+Na CO =2 CH COONa+H O+CO 个
方案五:向滴有酚酞的NaOH 溶液中滴加乙酸
CH COOH+NaOH = CH COONa +H O
任务二:乙酸的结构和化学性质
2、乙酸的化学性质: ( 1 ) 酸 性 :
思考3: 食醋除水垢(主要成分CaCO 和Mg(OH) ) 的原理是什么
2CH COOH+CaCO =(CH CO0) Ca
任务二:乙酸的结构和化学性质
2CH COOH+Mg(OH) =(CH CO0) Mg +2H O
+H O+CO 个
1.向锥形瓶中加入 碳酸钠粉末
2.向分液漏斗中加入乙酸溶液 0
3.装置B中所盛放的试剂 饱和碳酸氢钠溶液 作用是 除去CO 中混有的乙酸 。
4.装置C中所盛放的试剂硅酸钠溶液
现象是 由白色胶状沉淀物生成 。
思考4:如何设计实验比较酸性强弱:CH COOH、H CO 、H SiO
任务二:乙酸的结构和化学性质
2、乙酸的化学性质: (1)酸性:
酸性强弱:CH C00H>H CO >H SiO
优化设计63页例题
A B C
C
1.下列物质都能与金属钠反应放出H , 产 生H 的速率排序正确的( )
①C H OH ②水③醋酸溶液
A.①>②>③ B.②>①>③ C.③>②>① D.③>①>②
乙醇+乙酸+浓硫酸
饱和Na CO 溶液
实验现象:饱和碳酸钠溶液出现分层,上层为无色透明油状液体, 且能闻到果香味。
2、乙酸的化学性质:
(2)酯化反应: 实验探究7-6
任务二:乙酸的结构和化学性质
乙 酸 乙 酯
酯化反应有什么特点
反应特点:反应可逆,且反应速率小
2、乙酸的化学性质:
(2)酯化反应: 酯化反应属于取代反应
酯化反应的实质:酸脱羟基、醇脱氩。
任务二:乙酸的结构和化学性质
酯化反应:酸与醇反应生成酯和水的反应。
2、乙酸的化学性质: (2)酯化反应:
思考5:根据该实验思考以下为题:
(1)浓硫酸的作用是 (1)催化剂、吸水剂
(2)试剂加入的顺序是
(3)得到的反应产物是否纯净 主要杂质有哪些
(4)导管末端为什么不伸入液面以下 (4)防止倒吸。 饱和Na CO 溶液有什么作用
(5)如何分离碳酸钠和乙酸乙酯
(2)先加入乙醇,然后沿器壁慢慢加入浓硫酸,冷却后再加入乙酸。
(3)反应产物不纯净,杂质:乙酸、乙醇。提纯方法:蒸馏
饱和Na CO 作用:溶解乙醇,反应乙酸,降低酯在水中的溶解度。
任务二:乙酸的结构和化学性质
(5)分离碳酸钠和乙酸乙酯的方法:分液
乙酸甲酯
HCOOCH CH +H O
甲酸乙酯
(某酸+某醇→某酸某酯+水)
1.完成下列反应的化学方程式。
①表现酸性时断裂化学键 ①;
②发生酯化反应时断裂化学键②。 乙醇断裂化学键③。
(2)酯化反应属于 取代 反应。
2.乙酸发生反应时的断键情况:
③
)
A.苹果酸中能发生酯化反应的官能团有2种
B.1 mol苹果酸可与3 mol NaOH发生中和反应 C.1 mol苹果酸与足量Na反应生成1 mol H
D.1 mol苹果酸与足量Na CO 反应生成1 mol CO
3.苹果酸有特殊的酸味,主要用于食品和医药行业。
,下列说法正确的是(AD)
苹果酸的结构简式为
羧酸分子羧基中的—OH 被 —OR '取代后的产物称为酯。
酯是有芳香气味的液体,存在于各种水果和花草中。
任务三:认识酯
乙酸异戊酯 戊酸戊酯
官能团:酯基
乙酸乙酯
高级脂肪酸甘油酯
3、酯:
或-COOR
类别 代表物 官能团
烃 饱和烃 烷烃 CH
环烷烃
不饱和烃 烯烃 CH =CH
碳碳双键
炔烃 CH=CH —C=C—
碳碳三键
芳香烃
注意:烷基、苯环均不属于官能团。
任务三:官能团与有机物的分类
类别 代表物 官能团
名称 结构简式
烃 的 衍 生 物 卤代烃 一氯甲烷 CH Cl —X
卤素原子
醇 乙醇 C H OH —OH
羟基
醛 乙醛 CH CHO —CHO
醛基
酸 乙酸 CH COOH —COOH
羧基
酯 乙酸乙酯 CH COOC H —COOR
酯基
醚 甲醚 CH OCH C—O—C
醚基
酮 丙酮 O CH -C-CH
羰基
酚 苯酚 OH —OH
酚羟基
4.写化合物官能团
(1)CH =CH
(2)CH -Cl
(3)CH CH OH
(4)CH COOH
(5)CH CHO
>C=C
—Cl
—OH
—COOH
—CHO
—COOR
乙酸乙酯
GC疑烃 ⑥CH H、
卤代烃 卤 代 烃 醇
炔烃
C=C
⑦CH —Cl、⑧CH CH Br、⑨CH OH、⑩CH CH OH、 1DCH C-OH (12)CH CH OCH CH 醇
友 酸 醚
芳香烃
(13) (14)
芳香烃 CH
(15)
环烷烃
5.按官能团对这些化合物进行分类
③CH =CH 、
烯烃
①CH 、
烷烃
环烷烃
(16)
第七章有机化合物
第三节乙醇与乙酸
第二课时乙酸
1.联系日常生活,认识乙酸的用途和物理性质;
2.比较乙醇、乙酸、乙酸乙酯的分子结构与性质,认识有机物中官能团对其 性质的决定性作用,发展宏观辨识与微观探析化学学科核心素养。
3.通过实验探究,认识酯化反应,并构建其模型,发展证据推理与模型认知 化学学科核心素养。
核心素养
情境导学
食醋是中国古代劳动人民发明传统调味品,食醋中含有3%~5%的
乙 酸,故乙酸又被称为醋酸。
资料:传说古代山西省有个酿酒高手叫杜康。他儿子黑塔
也学会了酿酒技术。后来,从山西迁到镇江。黑塔觉得酿
酒后把酒糟扔掉可惜,把酒糟浸泡在水缸里。到了第二十
一 日的酉时, 一开缸, 一股浓郁的香气扑鼻而来。黑塔忍
不住尝了 一 口,酸酸的,味道很美。烧菜时放了 一些,味
道特别鲜美便贮藏着作为“调味酱”。
颜色 状态 气味 溶解性 挥发性 熔点
沸点
无色 液体 有强烈刺激 性气味 易溶于水 和乙醇 易挥发 16.6℃
118℃
当温度低于16.6℃时,乙酸可凝结成类似冰的晶体,故纯净的乙酸又
称为“冰 醋 酸 ”。
任务一:乙酸的物理性质
1、乙酸的物理性质: 俗名:醋酸
分子式 结构式 结构简式 球棍模型
填充模型
C H O C H C O O H 或
乙酸分子可以看作是甲基(-CH ) 与羧基(-COOH)的组合
任务二:乙酸的结构与化学性质
1、乙酸的结构: 乙酸不属于烃
乙酸的官能团:—COOH 羧基。
羧基的性质
受-O-H的影响:碳氧双键不易断
受C=O的影响:氢氧键(①处)、
碳氧单键(②处)易断
断裂①处的化学键:H+ 酸 性 断裂②处的化学键:-OH 酯化反应
任务二:乙酸的结构与化学性质
乙酸的化学性质主要由羧基决定
1、乙酸的结构:
O
C—OH
CH
3
思考1:醋酸是几元酸
一元弱酸,具有酸的通性
CH COOH— CH CO0-+H+
2、乙酸的化学性质:
(1)酸性: O
11
CH —C—O÷H
任务二:乙酸的结构和化学性质
2、乙酸的化学性质: ( 1 ) 酸 性 :
思考2:根据下列提供的药品,设计实验证明乙酸的酸性。
镁带、Na O 粉末、Na CO 粉末、NaOH 溶液、乙酸溶液、酚酞、石蕊。 方案一:往乙酸溶液中加石蕊 紫色石蕊溶液变红
方案二:将镁条插入乙酸溶液 2 CH COOH+Mg =(CH COO) Mg+H 个
方案三:往Na O粉未中加入乙酸溶液
2CH COOH+Na O=2CH COONa+H O
方案四:往Na CO 粉未中加入乙酸溶液
2 CH COOH+Na CO =2 CH COONa+H O+CO 个
方案五:向滴有酚酞的NaOH 溶液中滴加乙酸
CH COOH+NaOH = CH COONa +H O
任务二:乙酸的结构和化学性质
2、乙酸的化学性质: ( 1 ) 酸 性 :
思考3: 食醋除水垢(主要成分CaCO 和Mg(OH) ) 的原理是什么
2CH COOH+CaCO =(CH CO0) Ca
任务二:乙酸的结构和化学性质
2CH COOH+Mg(OH) =(CH CO0) Mg +2H O
+H O+CO 个
1.向锥形瓶中加入 碳酸钠粉末
2.向分液漏斗中加入乙酸溶液 0
3.装置B中所盛放的试剂 饱和碳酸氢钠溶液 作用是 除去CO 中混有的乙酸 。
4.装置C中所盛放的试剂硅酸钠溶液
现象是 由白色胶状沉淀物生成 。
思考4:如何设计实验比较酸性强弱:CH COOH、H CO 、H SiO
任务二:乙酸的结构和化学性质
2、乙酸的化学性质: (1)酸性:
酸性强弱:CH C00H>H CO >H SiO
优化设计63页例题
A B C
C
1.下列物质都能与金属钠反应放出H , 产 生H 的速率排序正确的( )
①C H OH ②水③醋酸溶液
A.①>②>③ B.②>①>③ C.③>②>① D.③>①>②
乙醇+乙酸+浓硫酸
饱和Na CO 溶液
实验现象:饱和碳酸钠溶液出现分层,上层为无色透明油状液体, 且能闻到果香味。
2、乙酸的化学性质:
(2)酯化反应: 实验探究7-6
任务二:乙酸的结构和化学性质
乙 酸 乙 酯
酯化反应有什么特点
反应特点:反应可逆,且反应速率小
2、乙酸的化学性质:
(2)酯化反应: 酯化反应属于取代反应
酯化反应的实质:酸脱羟基、醇脱氩。
任务二:乙酸的结构和化学性质
酯化反应:酸与醇反应生成酯和水的反应。
2、乙酸的化学性质: (2)酯化反应:
思考5:根据该实验思考以下为题:
(1)浓硫酸的作用是 (1)催化剂、吸水剂
(2)试剂加入的顺序是
(3)得到的反应产物是否纯净 主要杂质有哪些
(4)导管末端为什么不伸入液面以下 (4)防止倒吸。 饱和Na CO 溶液有什么作用
(5)如何分离碳酸钠和乙酸乙酯
(2)先加入乙醇,然后沿器壁慢慢加入浓硫酸,冷却后再加入乙酸。
(3)反应产物不纯净,杂质:乙酸、乙醇。提纯方法:蒸馏
饱和Na CO 作用:溶解乙醇,反应乙酸,降低酯在水中的溶解度。
任务二:乙酸的结构和化学性质
(5)分离碳酸钠和乙酸乙酯的方法:分液
乙酸甲酯
HCOOCH CH +H O
甲酸乙酯
(某酸+某醇→某酸某酯+水)
1.完成下列反应的化学方程式。
①表现酸性时断裂化学键 ①;
②发生酯化反应时断裂化学键②。 乙醇断裂化学键③。
(2)酯化反应属于 取代 反应。
2.乙酸发生反应时的断键情况:
③
)
A.苹果酸中能发生酯化反应的官能团有2种
B.1 mol苹果酸可与3 mol NaOH发生中和反应 C.1 mol苹果酸与足量Na反应生成1 mol H
D.1 mol苹果酸与足量Na CO 反应生成1 mol CO
3.苹果酸有特殊的酸味,主要用于食品和医药行业。
,下列说法正确的是(AD)
苹果酸的结构简式为
羧酸分子羧基中的—OH 被 —OR '取代后的产物称为酯。
酯是有芳香气味的液体,存在于各种水果和花草中。
任务三:认识酯
乙酸异戊酯 戊酸戊酯
官能团:酯基
乙酸乙酯
高级脂肪酸甘油酯
3、酯:
或-COOR
类别 代表物 官能团
烃 饱和烃 烷烃 CH
环烷烃
不饱和烃 烯烃 CH =CH
碳碳双键
炔烃 CH=CH —C=C—
碳碳三键
芳香烃
注意:烷基、苯环均不属于官能团。
任务三:官能团与有机物的分类
类别 代表物 官能团
名称 结构简式
烃 的 衍 生 物 卤代烃 一氯甲烷 CH Cl —X
卤素原子
醇 乙醇 C H OH —OH
羟基
醛 乙醛 CH CHO —CHO
醛基
酸 乙酸 CH COOH —COOH
羧基
酯 乙酸乙酯 CH COOC H —COOR
酯基
醚 甲醚 CH OCH C—O—C
醚基
酮 丙酮 O CH -C-CH
羰基
酚 苯酚 OH —OH
酚羟基
4.写化合物官能团
(1)CH =CH
(2)CH -Cl
(3)CH CH OH
(4)CH COOH
(5)CH CHO
>C=C
—Cl
—OH
—COOH
—CHO
—COOR
乙酸乙酯
GC疑烃 ⑥CH H、
卤代烃 卤 代 烃 醇
炔烃
C=C
⑦CH —Cl、⑧CH CH Br、⑨CH OH、⑩CH CH OH、 1DCH C-OH (12)CH CH OCH CH 醇
友 酸 醚
芳香烃
(13) (14)
芳香烃 CH
(15)
环烷烃
5.按官能团对这些化合物进行分类
③CH =CH 、
烯烃
①CH 、
烷烃
环烷烃
(16)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
