影响化学反应速率的因素 高二上学期化学人教版(2019)选择性必修1(共38张PPT)
文档属性
| 名称 | 影响化学反应速率的因素 高二上学期化学人教版(2019)选择性必修1(共38张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-14 00:00:00 | ||
图片预览










文档简介
(共38张PPT)
第二章
化学反应速率和化学平衡
第一节第三课时
影响化学反应速率的因素
合理
取向的
碰撞 有效
碰撞
能量
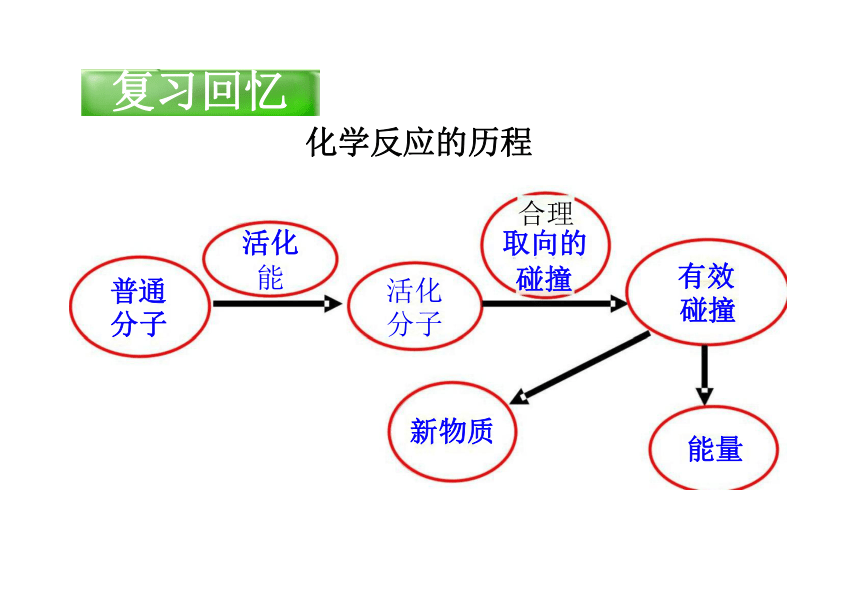
复习回忆
化学反应的历程
活化
能
活化 分子
普通 分子
新物质
复习 回忆
有效碰撞:能够发生化学反应的碰撞。
活化分子:有可能发生有效碰撞的分子。
活化能:活化分子所多出普通分子的那部分能量E 。
※在温度不变时,对某一个反应来说,活化分子在反 应物中所占的百分数是恒定的,且与温度呈正比。
思考
用碰撞模型解释化学反应速率的快慢
单位 时间 内有 效碰 撞次 数的 多少
单位 体积 内活 化分 子的
多少
化学 反应 速率 的快 慢
反应 物本 身的 性质
活化 能的 大小
外 因
内Y 因
决定
决定
决定
决定
思考与复习
化学反应速率的决定因素是什么
影响因素(外界条件)是什么
※决定因素(内因):
反应物本身的性质
※影响因素(外因):
(1)浓度; (2)温度;(3)压强
(4)催化剂;(5)其他因素
Na S O +H SO =Na SO +SO 个+SJ+H O
实验2-2结论:加入浓度大的H SO 溶液先出现浑浊
结论:其它条件相同时,增 加反应物的浓度,反应
速率加快;反之,降低反应物的浓度,反应速率减慢。
加入试剂 0.1mol/LH SO
0.5mol/LH SO
实验快慢 慢
快
探究实验2-2
一 、浓度对化学反应速率的影响
影响 外因 单 位 体 积 内 有效碰撞几率
化学反 应速率
分子总数 活化分子数
增大浓度 增加 增加 增加
加快
碰 撞 理 论 解 释
(1)浓度对反应速率的影响 ●-活化分子
注意
对于纯固体或纯液体,其
浓度可视为常数,因而其物质 的量改变时不影响化学反应速 率。
应 用 1 :
一定条件下,在CaCO (块状)+2HCl=CaCl +H O+CO 个反应 中,为了加快反应的速率,下列哪些方法可行: A.D
A、增加HCl的浓度 B、加水
C、增加同浓度盐酸的量 D、改加CaCO 粉末
应 用 2 :
若将物质的量相等的HI气体分别放在等容积的两个针桶中, 一 个保持体积不变,另一个压缩为原来的1/2。其它条件不变,则
一应用3: 如反应:3KSCN+FeCl =Fe(SCN) +3KCI
若在上述反应体系中加入KCl晶体,会不会影响化学反应速率
不会
HI的分解反应速率谁快
体积压缩为原来的1/2的
二 、压强对化学反应速率的影响
对于有气体参加的反应,当其他条件不变时, 增大压强,气体的体积减小,浓度增大,反应 速率加快。
1、由于压强对固体、液体的浓度几乎无影响,因此,对
无气体参加的反应,压强对反应速率的影响可忽略不计。 2、对于有气体参加的可逆反应,增大压强,正、逆反应 速率都增大;减小压强,正、逆反应速率都减小。
说明
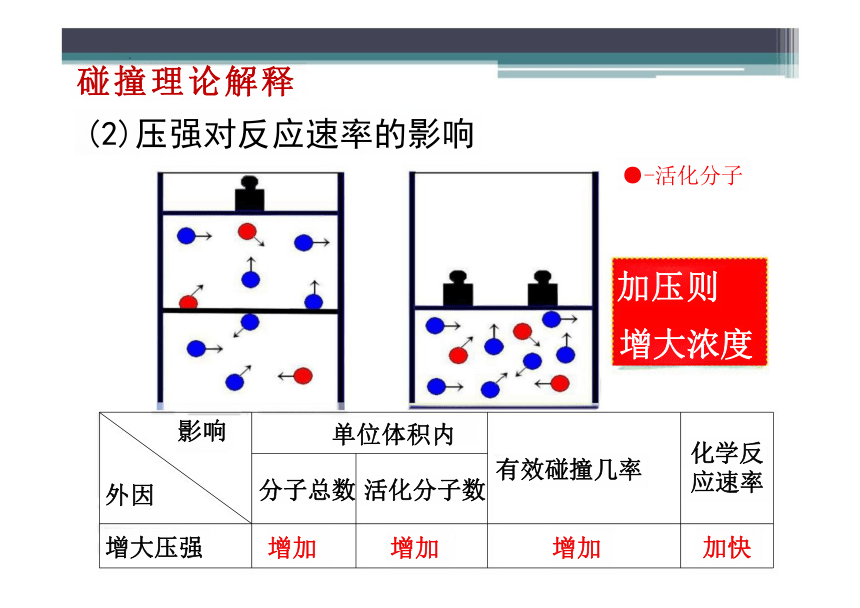
碰撞理论解释
(2)压强对反应速率的影响
●-活化分子
加压则
增大浓度
影响 外因 单位体积内 有效碰撞几率
化学反 应速率
分子总数 活化分子数
增大压强 增加 增加 增加
加快
压强的“真变”与“假变”
例2、在N +3H ==2NH 中,当其他外界条件不变时:
A、减小体系压强,该反应的速率怎么变
· 反应速率减慢
B、在反应中保持体系容积不变,充入N , 反应的速率
怎么变
· 反应速率加快
C、在反应中保持体系容积不变,充入He, 反应的速率
怎么变
· 反应速率不变
D、在反应中保持体系压强不变,充入He, 反应的速率
怎么变
· 反应速率减慢
规律:
1、恒 温时,增加压强,体积缩 小,浓度增 大,
反应速率 加快;
2、恒温恒容密闭容器:
(1)充入气体反应物,压强 增大,
气体反应物浓度增 大,反应速率 加 快 ;
(2)充入不参与反应的气体,总压强 增大, 各物质浓度_不变,反应速率不 变;
3、恒温恒压时,充入不参与反应的气体,体积增大, 气体反应物浓度缩小,反应速率_ 减小
编 号 0.1mol/L Na S O 0.1mol/L H SO 反应温度
反应快慢
1 2mL 2mL 室温
2 2mL 2mL 热水
实验2-3结论:温度高的溶液先出现浑浊
结论:其它条件相同时,升高温度,反应速率加快; 反之,降低温度,反应速率减慢。
探究实验2-3 三、温度对反应速率的影响
Na S O +H SO =Na SO +SO 个+ J+H O
影响 外因 单 位 体 积 内 有效碰撞几率
化学反 应速率
分子总数 活化分子数
升高温度 不变 增加 增加
加快
碰 撞 理 论 解 释
(3)温度对反应速率的影响 -活化分子
注意事项:
(1)温度对反应速率影响的规律,对吸热反应、放 热反应都适用,且不受反应物状态的影响。
(2)反应若是可逆反应,升高温度,正、逆反应速 率都加快,降低温度,正、逆反应速率都减小。
(3)温度每升高10℃,速率增加2-4倍。
=(2~4)
t
V为速率,
t为温度
2-t1
10
1、在 10℃时某化学反应速率为0.1molL-1.S-1, 若
温度每升高10℃,反应速率增加到原来的2倍,
为了把该反应速率提高到1.6mol-L-1.S-1则该反应 需在什么温度下进行(C )
A 30℃ B 40℃ C 50℃ D 60℃
2、把除去氧化膜的Mg 条,投入到盛有稀
盐酸的试管中,发现H 的产生速率 (v)
与时间 (t) 的变化情况如右图所示,
·t ~t 速率变化的主要原因是:
·t ~t 速率变化的主要原因是:
四 、催化剂对反应速率的影响
实验2-4结论:加入催化剂可以加快反应的速率
四、催化剂对反应速率的影响
催化剂能改变化学反应速率而自身的化学组成
和质量在反应前后保持不变
注:不说明指正催化剂
负催化剂 减慢化学反应速率
·使用催化剂,能够降低反应所需的能量,这 样会使更多的反应物分子成为活化分子,大 大增加单位体积内反应物分子中活化分子所 占的百分数。因而使反应速率加快。
正催化剂 加快化学反应速率
催 化 剂
碰撞理论解释(4)催化剂对反应速率的影响
活化能 没加催化剂
活化分子
E
影响 外因 单位体积内 有效碰撞几率
化学反 应速率
分子总数 活化分子数
正催化剂 不变 增加 增加
加快
反应物
加了催化剂
反应过程
生成物
能量
注意事项
1)同一催化剂能同等程度地改变正、逆反应的速率。
2 )催化剂只能改变反应速率,不能将不反应变成反应。
3)催化剂有一定的选择性和活化温度:
4) 催化剂中毒:催化剂的活性往往因接触少量杂质而 明显下降,甚至遭到破坏,这种现象叫催化剂中毒。 催化剂中毒会严重影响反应的顺利进行。工业上为了 防止催化剂中毒,要把原料进行净化除去毒物。
巩 固 练 习
下列条件的变化,是因为降低反应所需的能量而 增加单位体积内的反应物活化分子百分数致使反 应速率加快的是( D )
A、增大浓度 B 、增大压强
C、升高温度 D 、使用催化剂
五、其他如光照、反应物固体的颗粒大小、 电磁波、超声波、溶剂的性质等,也会对化 学反应的速率产生影响。
总结:
各条件对速率的影响大小是:
催化剂>>温度>浓度=压强(体积变 化引起的)。
各种影响都有其局限性,要针对具 体反应具体分析。
本节课小结
决定因素:参加化学反应的物质的性质
影响因素:当其它条件不变时
1.浓度的影响:增加反应物的浓度可以加快化学反应速率;
降低反应物的浓度,可以减慢化学反应速率。
2.压强的影响: (仅适用于有气体参加的反应)增加体系 的压强,可以加快化学反应速率;降低体系的压强,可以 减慢化学反应速率
3.温度的影响:升高体系的温度可以加快化学反应速率; 降低体系的温度,可以减慢化学反应速率。
4.催化剂:使用催化剂同等程度的增大(减慢)正逆反应 速率,从而改变反应到达平衡所需时间。
>没特别指明一般指正催化剂
影响 外因 单位体积内 有效碰撞频率
化学反应
速率
分子 总数 活化分 子数 活化分 百分数
增大反应物浓度 增加 增加 不变 增加
加快
增大压强 增加 增加 不变 增加
加快
升高温度 不变 增加 增大 增加
加快
正催化剂 不变 增加 增大 增加
加快
小结:影响化学反应速率的因素
巩固练习
1、一定量的盐酸跟过量的铁粉反应时,为了 减慢反应速率,而不影响生成H 的总量,可向 其中加入适量的 C
A、Na CO 晶体 B、NaOH 晶体
C、水 D、CuSO 晶体
2、设NO+CO — NO +CO (正反应吸热)反应
速率为v ;N +3H — 2NH (正反应放热)反
应速率为v 。对于前述反应,当温度升高时,v 和v 变化情况为( A )
A、 同时增大 B、 同时减小
C、v 减 少 ,v 增大
D、v 增大,v 减小
3 、用3克块状大理石与30毫升3mol/L 盐酸反应制
取CO 气体,若要增大反应速率,可采取的措施是
①再加入30毫升3mol/L盐酸
②改用30毫升6mol/L盐酸
③改用3克粉末状大理石
④适当升高温度 ( B )
A.①②④ B.②③④
C.①③④ D.①②③
编号 改变的条件
生成SO 的速率
① 升高温度
增大
② 降低温度
减小
③ 增大氧气的浓度
增大
④ 使用V O 作催化剂
增大
⑤ 压缩体积
增大
⑥ 保持压强不变,充入N
减小
⑦ 保持气体总体积不变,充入N
不变
例 :反应2SO +O — 2SO 的△H<0, 当其他条件不变,只
改变一个反应条件时,将生成SO 的反应速率的变化填入空格 里(填“增大”“减小”或“不变”)
·
·
·
·
·
·
·
(1)实验时放出气体总体积是(1)60 mL。
(2)放出一半气体所需的时间约为(2)1 min。
(3)A 、B 、C 、D 各点反应速率快慢的顺序是(3)D>C>B>A
(4)过氧化氢溶液的初始物质的量浓度为(4)0.11 mol/L
把0.1 MnO 粉末加入50 mL过氧化氢的溶液里(p=
·
mol
1.1g L-1),在标准状况下,
放出气体的体积y 和时间t的 关系曲线如图所示。
在C(固)+CO (气)=2CO(气)的反应中。
现采取下列措施:
(1)增大压强;(2)增加碳的量
(3)通入CO ; (4)恒容下充入N ;
(5)恒压下充入N
哪些措施能够使反应速率增大 为什么
答案:(1)(3)
例:室温下,同种规格的铝片分别与下列物质混
合生成氢气的化学反应速率最大的是( C )
A.0.1mol/L 的盐酸15mL
B.0.2mol/L 的盐酸12mL
C.0.15mol/L 的硫酸10mL
D.18mol/L 的硫酸15mL
·把下列四种X溶液分别加入四个盛有10mL 2mol/L盐酸的烧杯中,均匀加水稀释到50 mL。此时X和盐酸缓缓地进行反应。其中 反应速率最大的是( A )
·A.20 mL3 mol/L的X 溶液
·B.20 mL 2mol/L的X 溶液
·C.10 mL 4mol/L的X溶液
·D.10mL 2mol/L的X溶液
变式探究
【例】把下列四种X溶液,分别加入四个盛有 10mL 2mol/L盐酸的烧杯中,并加水稀释到
50ml。此时X和盐酸缓慢进行反应,其中反应
速率最快的是 ( B )
A、10℃ 20ml 3mol/L
B 、20℃30ml 2mol/L
C、10℃10ml 4mol/L
D 、10℃10ml 2mol/L
组 号 反应 温度 (℃) Na S O 3 H SO
H O
(mL) (mol ·L -1) (mL) (mol ·L -1)
(mL)
A 10 5 0.1 10 0.1
5
B 10 5 0.1 5 0.1
10
C 30 5 0.1 5 0.1
10
D 30 5 0.1 5 0.2
10
E 0 10 0.1 10 0.1
5
·下列各组实验中溶液最先浑浊的是( D )
课堂练习
要使在容积恒定的密闭容器中进行的可逆反应
2A ( 气 ) +B ( 固 ) = = 2C ( 气 ) +Q(Q>0 ) 的正反应速率显著加快,可采用的措施是
(不考虑固、气态间的接触面积) ( D
A. 降温 B. 加入B
C.增大体积使压强减小 D. 加入A
(2010 ·黄冈高二检测)在可逆反应中,改变
下列条件一定能加快反应速率的是( )
A.增大反应物的量 B.升高温度
C.增大压强 D.使用催化剂
【解析】选B。
第二章
化学反应速率和化学平衡
第一节第三课时
影响化学反应速率的因素
合理
取向的
碰撞 有效
碰撞
能量
复习回忆
化学反应的历程
活化
能
活化 分子
普通 分子
新物质
复习 回忆
有效碰撞:能够发生化学反应的碰撞。
活化分子:有可能发生有效碰撞的分子。
活化能:活化分子所多出普通分子的那部分能量E 。
※在温度不变时,对某一个反应来说,活化分子在反 应物中所占的百分数是恒定的,且与温度呈正比。
思考
用碰撞模型解释化学反应速率的快慢
单位 时间 内有 效碰 撞次 数的 多少
单位 体积 内活 化分 子的
多少
化学 反应 速率 的快 慢
反应 物本 身的 性质
活化 能的 大小
外 因
内Y 因
决定
决定
决定
决定
思考与复习
化学反应速率的决定因素是什么
影响因素(外界条件)是什么
※决定因素(内因):
反应物本身的性质
※影响因素(外因):
(1)浓度; (2)温度;(3)压强
(4)催化剂;(5)其他因素
Na S O +H SO =Na SO +SO 个+SJ+H O
实验2-2结论:加入浓度大的H SO 溶液先出现浑浊
结论:其它条件相同时,增 加反应物的浓度,反应
速率加快;反之,降低反应物的浓度,反应速率减慢。
加入试剂 0.1mol/LH SO
0.5mol/LH SO
实验快慢 慢
快
探究实验2-2
一 、浓度对化学反应速率的影响
影响 外因 单 位 体 积 内 有效碰撞几率
化学反 应速率
分子总数 活化分子数
增大浓度 增加 增加 增加
加快
碰 撞 理 论 解 释
(1)浓度对反应速率的影响 ●-活化分子
注意
对于纯固体或纯液体,其
浓度可视为常数,因而其物质 的量改变时不影响化学反应速 率。
应 用 1 :
一定条件下,在CaCO (块状)+2HCl=CaCl +H O+CO 个反应 中,为了加快反应的速率,下列哪些方法可行: A.D
A、增加HCl的浓度 B、加水
C、增加同浓度盐酸的量 D、改加CaCO 粉末
应 用 2 :
若将物质的量相等的HI气体分别放在等容积的两个针桶中, 一 个保持体积不变,另一个压缩为原来的1/2。其它条件不变,则
一应用3: 如反应:3KSCN+FeCl =Fe(SCN) +3KCI
若在上述反应体系中加入KCl晶体,会不会影响化学反应速率
不会
HI的分解反应速率谁快
体积压缩为原来的1/2的
二 、压强对化学反应速率的影响
对于有气体参加的反应,当其他条件不变时, 增大压强,气体的体积减小,浓度增大,反应 速率加快。
1、由于压强对固体、液体的浓度几乎无影响,因此,对
无气体参加的反应,压强对反应速率的影响可忽略不计。 2、对于有气体参加的可逆反应,增大压强,正、逆反应 速率都增大;减小压强,正、逆反应速率都减小。
说明
碰撞理论解释
(2)压强对反应速率的影响
●-活化分子
加压则
增大浓度
影响 外因 单位体积内 有效碰撞几率
化学反 应速率
分子总数 活化分子数
增大压强 增加 增加 增加
加快
压强的“真变”与“假变”
例2、在N +3H ==2NH 中,当其他外界条件不变时:
A、减小体系压强,该反应的速率怎么变
· 反应速率减慢
B、在反应中保持体系容积不变,充入N , 反应的速率
怎么变
· 反应速率加快
C、在反应中保持体系容积不变,充入He, 反应的速率
怎么变
· 反应速率不变
D、在反应中保持体系压强不变,充入He, 反应的速率
怎么变
· 反应速率减慢
规律:
1、恒 温时,增加压强,体积缩 小,浓度增 大,
反应速率 加快;
2、恒温恒容密闭容器:
(1)充入气体反应物,压强 增大,
气体反应物浓度增 大,反应速率 加 快 ;
(2)充入不参与反应的气体,总压强 增大, 各物质浓度_不变,反应速率不 变;
3、恒温恒压时,充入不参与反应的气体,体积增大, 气体反应物浓度缩小,反应速率_ 减小
编 号 0.1mol/L Na S O 0.1mol/L H SO 反应温度
反应快慢
1 2mL 2mL 室温
2 2mL 2mL 热水
实验2-3结论:温度高的溶液先出现浑浊
结论:其它条件相同时,升高温度,反应速率加快; 反之,降低温度,反应速率减慢。
探究实验2-3 三、温度对反应速率的影响
Na S O +H SO =Na SO +SO 个+ J+H O
影响 外因 单 位 体 积 内 有效碰撞几率
化学反 应速率
分子总数 活化分子数
升高温度 不变 增加 增加
加快
碰 撞 理 论 解 释
(3)温度对反应速率的影响 -活化分子
注意事项:
(1)温度对反应速率影响的规律,对吸热反应、放 热反应都适用,且不受反应物状态的影响。
(2)反应若是可逆反应,升高温度,正、逆反应速 率都加快,降低温度,正、逆反应速率都减小。
(3)温度每升高10℃,速率增加2-4倍。
=(2~4)
t
V为速率,
t为温度
2-t1
10
1、在 10℃时某化学反应速率为0.1molL-1.S-1, 若
温度每升高10℃,反应速率增加到原来的2倍,
为了把该反应速率提高到1.6mol-L-1.S-1则该反应 需在什么温度下进行(C )
A 30℃ B 40℃ C 50℃ D 60℃
2、把除去氧化膜的Mg 条,投入到盛有稀
盐酸的试管中,发现H 的产生速率 (v)
与时间 (t) 的变化情况如右图所示,
·t ~t 速率变化的主要原因是:
·t ~t 速率变化的主要原因是:
四 、催化剂对反应速率的影响
实验2-4结论:加入催化剂可以加快反应的速率
四、催化剂对反应速率的影响
催化剂能改变化学反应速率而自身的化学组成
和质量在反应前后保持不变
注:不说明指正催化剂
负催化剂 减慢化学反应速率
·使用催化剂,能够降低反应所需的能量,这 样会使更多的反应物分子成为活化分子,大 大增加单位体积内反应物分子中活化分子所 占的百分数。因而使反应速率加快。
正催化剂 加快化学反应速率
催 化 剂
碰撞理论解释(4)催化剂对反应速率的影响
活化能 没加催化剂
活化分子
E
影响 外因 单位体积内 有效碰撞几率
化学反 应速率
分子总数 活化分子数
正催化剂 不变 增加 增加
加快
反应物
加了催化剂
反应过程
生成物
能量
注意事项
1)同一催化剂能同等程度地改变正、逆反应的速率。
2 )催化剂只能改变反应速率,不能将不反应变成反应。
3)催化剂有一定的选择性和活化温度:
4) 催化剂中毒:催化剂的活性往往因接触少量杂质而 明显下降,甚至遭到破坏,这种现象叫催化剂中毒。 催化剂中毒会严重影响反应的顺利进行。工业上为了 防止催化剂中毒,要把原料进行净化除去毒物。
巩 固 练 习
下列条件的变化,是因为降低反应所需的能量而 增加单位体积内的反应物活化分子百分数致使反 应速率加快的是( D )
A、增大浓度 B 、增大压强
C、升高温度 D 、使用催化剂
五、其他如光照、反应物固体的颗粒大小、 电磁波、超声波、溶剂的性质等,也会对化 学反应的速率产生影响。
总结:
各条件对速率的影响大小是:
催化剂>>温度>浓度=压强(体积变 化引起的)。
各种影响都有其局限性,要针对具 体反应具体分析。
本节课小结
决定因素:参加化学反应的物质的性质
影响因素:当其它条件不变时
1.浓度的影响:增加反应物的浓度可以加快化学反应速率;
降低反应物的浓度,可以减慢化学反应速率。
2.压强的影响: (仅适用于有气体参加的反应)增加体系 的压强,可以加快化学反应速率;降低体系的压强,可以 减慢化学反应速率
3.温度的影响:升高体系的温度可以加快化学反应速率; 降低体系的温度,可以减慢化学反应速率。
4.催化剂:使用催化剂同等程度的增大(减慢)正逆反应 速率,从而改变反应到达平衡所需时间。
>没特别指明一般指正催化剂
影响 外因 单位体积内 有效碰撞频率
化学反应
速率
分子 总数 活化分 子数 活化分 百分数
增大反应物浓度 增加 增加 不变 增加
加快
增大压强 增加 增加 不变 增加
加快
升高温度 不变 增加 增大 增加
加快
正催化剂 不变 增加 增大 增加
加快
小结:影响化学反应速率的因素
巩固练习
1、一定量的盐酸跟过量的铁粉反应时,为了 减慢反应速率,而不影响生成H 的总量,可向 其中加入适量的 C
A、Na CO 晶体 B、NaOH 晶体
C、水 D、CuSO 晶体
2、设NO+CO — NO +CO (正反应吸热)反应
速率为v ;N +3H — 2NH (正反应放热)反
应速率为v 。对于前述反应,当温度升高时,v 和v 变化情况为( A )
A、 同时增大 B、 同时减小
C、v 减 少 ,v 增大
D、v 增大,v 减小
3 、用3克块状大理石与30毫升3mol/L 盐酸反应制
取CO 气体,若要增大反应速率,可采取的措施是
①再加入30毫升3mol/L盐酸
②改用30毫升6mol/L盐酸
③改用3克粉末状大理石
④适当升高温度 ( B )
A.①②④ B.②③④
C.①③④ D.①②③
编号 改变的条件
生成SO 的速率
① 升高温度
增大
② 降低温度
减小
③ 增大氧气的浓度
增大
④ 使用V O 作催化剂
增大
⑤ 压缩体积
增大
⑥ 保持压强不变,充入N
减小
⑦ 保持气体总体积不变,充入N
不变
例 :反应2SO +O — 2SO 的△H<0, 当其他条件不变,只
改变一个反应条件时,将生成SO 的反应速率的变化填入空格 里(填“增大”“减小”或“不变”)
·
·
·
·
·
·
·
(1)实验时放出气体总体积是(1)60 mL。
(2)放出一半气体所需的时间约为(2)1 min。
(3)A 、B 、C 、D 各点反应速率快慢的顺序是(3)D>C>B>A
(4)过氧化氢溶液的初始物质的量浓度为(4)0.11 mol/L
把0.1 MnO 粉末加入50 mL过氧化氢的溶液里(p=
·
mol
1.1g L-1),在标准状况下,
放出气体的体积y 和时间t的 关系曲线如图所示。
在C(固)+CO (气)=2CO(气)的反应中。
现采取下列措施:
(1)增大压强;(2)增加碳的量
(3)通入CO ; (4)恒容下充入N ;
(5)恒压下充入N
哪些措施能够使反应速率增大 为什么
答案:(1)(3)
例:室温下,同种规格的铝片分别与下列物质混
合生成氢气的化学反应速率最大的是( C )
A.0.1mol/L 的盐酸15mL
B.0.2mol/L 的盐酸12mL
C.0.15mol/L 的硫酸10mL
D.18mol/L 的硫酸15mL
·把下列四种X溶液分别加入四个盛有10mL 2mol/L盐酸的烧杯中,均匀加水稀释到50 mL。此时X和盐酸缓缓地进行反应。其中 反应速率最大的是( A )
·A.20 mL3 mol/L的X 溶液
·B.20 mL 2mol/L的X 溶液
·C.10 mL 4mol/L的X溶液
·D.10mL 2mol/L的X溶液
变式探究
【例】把下列四种X溶液,分别加入四个盛有 10mL 2mol/L盐酸的烧杯中,并加水稀释到
50ml。此时X和盐酸缓慢进行反应,其中反应
速率最快的是 ( B )
A、10℃ 20ml 3mol/L
B 、20℃30ml 2mol/L
C、10℃10ml 4mol/L
D 、10℃10ml 2mol/L
组 号 反应 温度 (℃) Na S O 3 H SO
H O
(mL) (mol ·L -1) (mL) (mol ·L -1)
(mL)
A 10 5 0.1 10 0.1
5
B 10 5 0.1 5 0.1
10
C 30 5 0.1 5 0.1
10
D 30 5 0.1 5 0.2
10
E 0 10 0.1 10 0.1
5
·下列各组实验中溶液最先浑浊的是( D )
课堂练习
要使在容积恒定的密闭容器中进行的可逆反应
2A ( 气 ) +B ( 固 ) = = 2C ( 气 ) +Q(Q>0 ) 的正反应速率显著加快,可采用的措施是
(不考虑固、气态间的接触面积) ( D
A. 降温 B. 加入B
C.增大体积使压强减小 D. 加入A
(2010 ·黄冈高二检测)在可逆反应中,改变
下列条件一定能加快反应速率的是( )
A.增大反应物的量 B.升高温度
C.增大压强 D.使用催化剂
【解析】选B。
