影响化学平衡的因素高二上学期化学人教版(2019)选择性必修1(共36张PPT)
文档属性
| 名称 | 影响化学平衡的因素高二上学期化学人教版(2019)选择性必修1(共36张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-14 00:00:00 | ||
图片预览








文档简介
(共36张PPT)
第二章
第2节化学平衡
第3课时: 影响化学平衡的因素
一 、化学平衡移动
1、概 念:在一定条件当可逆反应达到平衡状态后,如果浓度、压强、
温度等反应条件改变,原来的平衡状态被破坏,平衡体系的物质组成也 会随着改变,直至达到新的平衡状态。这种由原有的平衡状态达到新的 平衡状态的过程叫做化学平衡的移动
2、实 质:改变条件后,①v正≠v逆,②各组分的百分含量发生改变
3、化学平衡移动的过程分析
化学平 正向移动或
衡状态 逆向移动
化学平衡移动
【微点拨】新平衡与原平衡相比,平衡混合物中各组分的浓度(或质量)发生相应的变化
新的化学 平衡状态
反应开始 尚未平衡
建立平衡
4、化学平衡移动方向的判断:
化学平衡总往反应速率减小的方向移动
(1)若外界条件变化引起v正>V逆:平衡向正反应方向移动
(2)若外界条件变化引起v正(3)若外界条件变化引起v正=V逆:旧平衡未被破坏,平衡不移动
二、外界条件对化学平衡的影响
01 浓度对化学平衡的影响
02 压强对化学平衡的影响
03 温度对化学平衡的影响
04 催化剂对化学平衡的影响
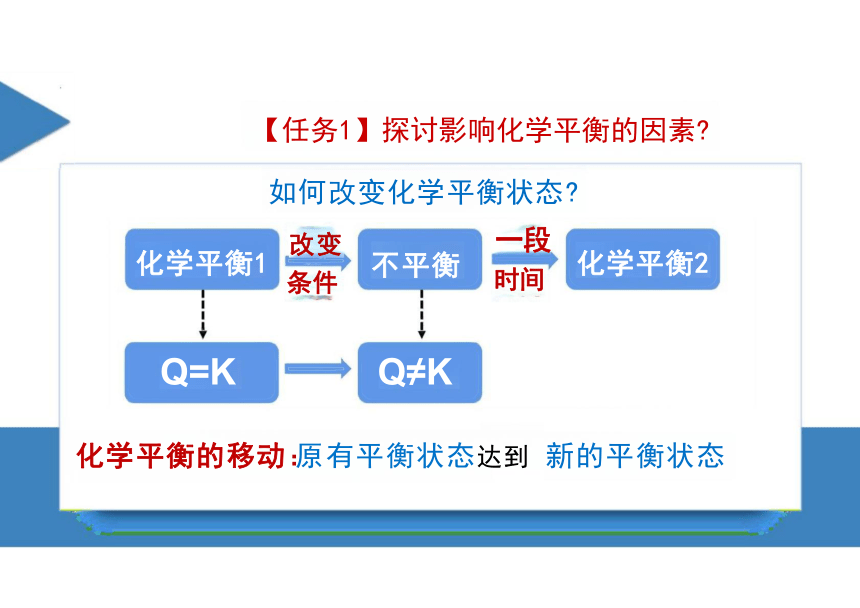
Q=K Q≠K
化学平衡的移动:原有平衡状态达到 新的平衡状态
【任务1】探讨影响化学平衡的因素
如何改变化学平衡状态
化学平衡1
一段
时间
化学平衡2
改变
条件
不平衡
浓度熵Q: 只与浓度有关
平衡常数K : 只与温度有关
【思考】改变哪些反应条件可使Q≠K,从而改变平衡状态
Q 发生变化
K 发生变化
改变浓度C
改变温度T
PART 01
浓度对化学平衡的
影响
浓度对化学平衡的影响
【实验原理】 Fe ++3SCN - =Fe(SCN)
浅黄 无 色 红色
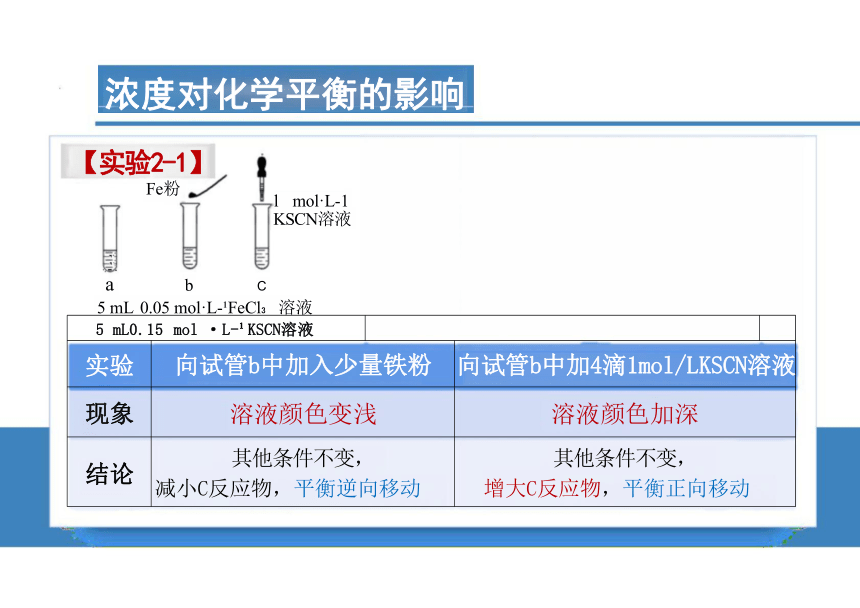
【变量控制】温度等其他因素不变,只改变一种物质的浓度 增 大C 反应物 滴饱和FeCl 或 高浓度KSCN 减 小C 反应物 加Fe 粉降低Fe +浓度
5 mL0.15 mol ·L- KSCN溶液 经量取好的5室升0005摩尔每升氯化铁溶液
实验 向试管b中加入少量铁粉 向试管b中加4滴1mol/LKSCN溶液 现象 溶液颜色变浅 溶液颜色加深 结论 其他条件不变, 减小C反应物,平衡逆向移动 其他条件不变, 增大C反应物,平衡正向移动
【实验2-1】
l mol·L-1 KSCN溶液
a b C
5 mL 0.05 mol·L- FeCl 溶液
浓度对化学平衡的影响
Fe粉
浓度对化学平衡的影响
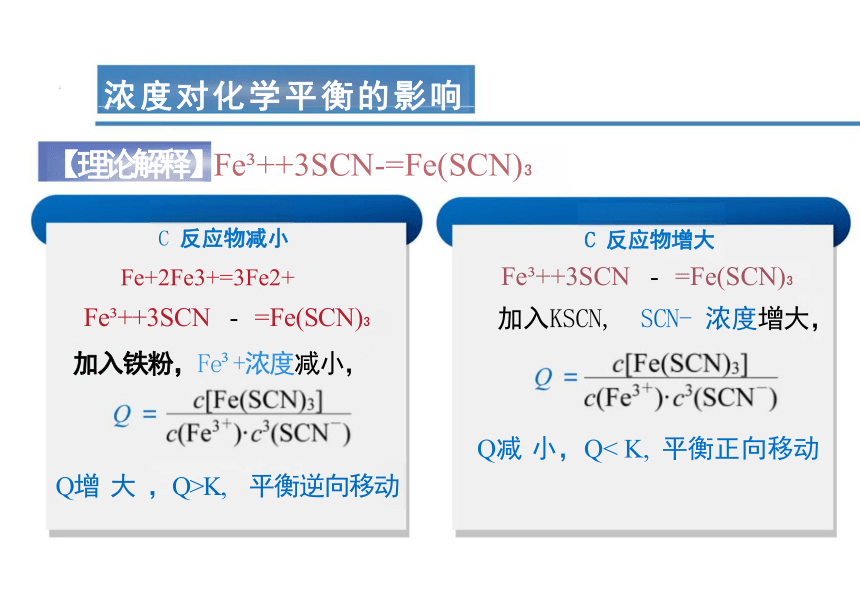
【理论解释】Fe ++3SCN-=Fe(SCN)
C 反应物减小 C 反应物增大
Fe+2Fe3+=3Fe2+ Fe ++3SCN - =Fe(SCN)
Fe ++3SCN - =Fe(SCN) 加入KSCN, SCN- 浓度增大,
加入铁粉,Fe +浓度减小,
Q减 小,Q< K, 平衡正向移动
Q增 大 ,Q>K, 平衡逆向移动
浓度对化学平衡的影响
化学平衡的移动:原有平衡状态达到、新的平衡状态
在一定条件下,当可逆反应达到平衡状态后,如果改变反应条件, 平衡状态被破坏,平衡体系的物质组成也会随着改变,直至达到新的 平衡状态。
→ 平衡正方向移动
平衡逆方向移动
增 大C 反应物或 减 小C 生成物
减 小C 反应物或 增 大C 生成物
特别注意:
①由于纯固体或纯液体的浓度为常数,改变纯固体或纯液体的量并不会
影响v正、V逆的大小,所以化学平衡不移动。
如 :反 应C(s)+H O(g)= CO(g)+H (g) 增加或移去一部分炭固体,化学
平衡不移动
②在溶液中进行,如果稀释溶液(加水),反应物浓度减小,生成物浓
度也减小,v 正减小,v逆也减小,但减小的程度不同,总的结果是使 化学平衡向反应方程式有关化学计量系数之和大的方向移动
记笔记:从v-t图像认识浓度对平衡的影响
减小生成物浓度
v'正>v逆
正向移动
减小反应物浓度
v逆 >v′ 正
逆向移动
mA(g)+nB(g)—
增大反应物浓度增大生成物浓度
pC(g)+qD(g)
v '逆>v′ 正
逆向移动
v′ 正 >v '逆
正向移动
浓度对化学平衡的影响
在等温条件下,对于一个已达到化学平衡的反应, 当改变反应物或生成物的浓度时 ,根据浓度商与平衡 常数的小关系,可以判断化学平衡移动的方向。
当Q=K 时,可逆反应处于 平衡 状 态 ;
当Q当QPART 02
压强对化学平衡的
影响
【任务2】探讨压强对化学平衡的影响
【实验原理】 2NO (g)=N O (g)
红棕 无色
【变量控制】温度等因素不变,只改变压强(可通过改 变体积改变压强)
缩小体积 压强增大
增大体积 压强减小
压强对化学平衡的影响
实验 体系压强增大
体系压强减小
现象 颜色先变深,后又变浅
颜色先变浅,后又变深
解释 变 深 :CNo 瞬间增大 又变浅:压强增大,平衡右移, C(NO )又减小
变 浅 :CNo 瞬间减小
又变深:压强减小,平衡左移,
C(no )又增大
压强对化学平衡的影响
【实验2-2】2 NO (g)=N O (g)
I IⅡ
20 mL NO 、N O
压强对化学平衡的影响
压强对化学平衡的影响
【思考】该反应中反应前后的气体的n又什么变化特点
2NO (g)=N O (g)
正反应方向:气体分子数减小的反应
逆反应方向:气体分子数增 大的反应
增大压强 →平衡向气体体积缩小的方向移动
的移动: 减小压强 平衡向气体体积增大的方向移动
(扩大容器体积)
化学平衡 (减小容器体积)
压强对化学平衡的影响
【思考】是否压强改变,化学平衡就一定会移动
对于H (g)+I =2HI(g) 当其他条件不变, 减小或增大容器容积来改变压强时,化学平衡 如何变化呢
对于反应前后,气体物质的总体积没有变化的可逆反应: 压强改变不能使化学平衡发生移动。
固态或液态物质的体积受压强影响很小,可以忽略不计。
当平衡混合物中都是固态或液态物质时,
改变压强后化学平衡一般不发生移动。
【思考】对于只有固体或液体参加的反应,体系压强的 改变会使化学平衡移动吗
压强对化学平衡的影响
增大压强 减小压强 增大压强 减小压强
正向移动 逆向移动 逆向移动 正向移动
记笔记:从v-t图像认识压强对化学平衡的影响
非等体反应 mA(g)+nB(g) g D(g)
等体积反应 m十n=p
mA(g)+nB(g)= pC(g)+qD(g)
增压 减压
【 经 典 习 题
1、在一密闭容器中,反应aA(g)—一 bB(g)达到平衡后,保持温度不
变,将容器体积增大一倍,当达到新的平衡时,B 的浓度是原来的60%, 则下列说法正确的是(C)
A. 平衡向逆反应方向移动了
B. 物 质A的转化率减小了
C. 物 质B 的质量分数增大了
D.a>b
温度对化学平衡
的影响
PART 03
实验 浸泡在热水中
浸泡在冷水中
现象 颜色加深
颜色变浅
平衡移动 平衡逆移
平衡正移
结论 其他条件不变时,升高温度,化学平衡向吸热反应方向移动; 降低温度,化学平衡向放热反应方向移动。
温度对化学平衡的影响
【实验2-3】
2NO (g)一N O (g)△H=-56.9kJ/mol
记笔记:从v-t图像认识温度对化学平衡的影响
mA(g)+nB(g) pC(g)+qD(g)△H>0 mA(g)+nB(g— pC(g)+qD(g)△H<0
降低温度
逆反应方向
升高温度
逆反应方向
升高温度
正反应方向
降低温度
正反应方向
2、反应:A(g)+3B(g) 2C(g)△H<0, 达平衡后,将反应体系
的温度降低,下列叙述中正确的是( C )
A. 正反应速率增大,逆反应速率减小,平衡向右移动
B. 正反应速率减小,逆反应速率增大,平衡向左移动
C. 正反应速率和逆反应速率都减小,平衡向右移动
D. 正反应速率和逆反应速率都减小,平衡向左移动
【经典 习 题 】
PART 03
催化剂对化学平
衡的影响
催化剂对化学平衡的影响
催化剂可同等程度地改变正、逆反应速率,
因此,对化学平衡的移动没有影响, 但可以改变反应达到平衡所需的时间。
即:催化剂不能使化学平衡发生移动,不能改变达到化学平 衡状态时反应混合物的组成,但是使用催化剂能改变反应达 到化学平衡所需的时间
(2)用v—t图像分析催化剂对化学平衡的影响
4、催化剂对化学平衡的影响 催化剂能同等程度地增
加正反应速率和逆反应 速率,因此它对化学平 衡的移动没有影响。
(1)催化剂对化学平衡的影响规律:
(1)恒温、恒容下,加“惰气”,各反应物、生成物的浓度均未 改 变 ,V正、V逆均不变,故化学平衡不发生移动
(2)恒温、恒压下加入“惰气”,容器体积增大,V正、V逆均减 小,等效于降压,故化学平衡向气体总体积增大的方向移动
(3)对于反应前后气体总体积不变的可逆反应,无论什么情况下 (T 、V不变或T 、P不变)下加入“惰气”,化学平衡均不发生移动
5、“ 惰 性 气 体 ” 对 化 学 平 衡 移 动 的 影 响
3、在一定条件下,合成氨反应到达平称衡状态,此时,再进行如
下操作,平衡不发生移动的是(D )
A. 恒温、恒压时,充入NH B. 恒温、恒容时,充入N
C. 恒温、恒压时,充入He D. 恒温、恒容时,充入He
4、在一定条件下,N +3H =NH 达到平衡状态后,按如下操作, 化学平衡不发生移动的是( D)
A. 保 持T 、V不变,充入HC1 B. 保持T、V不变,充入N
C. 保持T 、P不变,充入He D. 保 持T 、V不变,充入He
【经典 习 题
三 、勒 夏 特 列 原 理
1、定 义:如果改变影响平衡的一个条件(如温度、压强及参加反应的物质的浓 度),平衡就向着能够减弱这种改变的方向移动,该结论就是勒夏特列原理
2、适用范围( 1)仅适用于已达到平衡的反应体系,不可逆过程或未达到平衡的可 逆过程均不能使用该原理。此外,勒夏特列原理对所有的动态平衡(如溶解平衡、 电离平衡和水解平衡等)都适用。(2)只适用于判断“改变影响平衡的一个条件”时 平衡移动的方向。若同时改变影响平衡移动的几个条件,则不能简单地根据勒夏 特列原理来判断平衡移动的方向,只有在改变的条件对平衡移动的方向影响一致 时,才能根据勒夏特列原理进行判断
【特别注意】
平衡移动的结果是“ 减弱”外界条件的影响,而不是“消除”外界条件的 影响,更不是“扭转”外界条件的影响
3、对勒夏特列原理的理解
向一密闭容器中通入1 mol N 、3 mol H 发生反应:
N (g)+3H (g)—→2NH (g)△H<0, 一段时间后达到平衡,当改变下列条 件后:(1)若增大N 的浓度,平衡移动的方向是正向移动;达新平衡时,
氮气的浓度与改变时相比较,其变化是减小。但新平衡时的浓度大于原平 衡时的浓度(2)若升高温度,平衡移动的方向是逆向移动;达新平衡时的 温度与改变时相比较,其变化是降低。但新平衡时的温度高于原平衡时的 温度(3)若增大压强,平衡移动的方向是正向移动;达新平衡时的压强与 改变时相比较,其变化是减小。但新平衡时的压强大于原平衡时的压强
5、下列不能用勒夏特列原理解释的事实是( B )
A. 红棕色的NO 加压后颜色先变深后变浅
B. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C. 黄绿色的氯水光照后颜色变浅
D. 合成氨工业使用高压以提高氨的产量
【经典 习 题 】
增大压强→平衡向气体分子数减小方向移动
减小压强一平衡向气体分子数增大方向移动
升高温度一平衡向吸热方向移动
降低温度→ 平衡向放热方向移动
不影响平衡移动
课堂总结
浓度
压强
温度
催化剂
平衡正方向移动
平衡逆方向移动
增 大C 反应物或
减 小C生成物
减小C 反应物或
增 大C 生成物
影响化学平 衡的因素
第二章
第2节化学平衡
第3课时: 影响化学平衡的因素
一 、化学平衡移动
1、概 念:在一定条件当可逆反应达到平衡状态后,如果浓度、压强、
温度等反应条件改变,原来的平衡状态被破坏,平衡体系的物质组成也 会随着改变,直至达到新的平衡状态。这种由原有的平衡状态达到新的 平衡状态的过程叫做化学平衡的移动
2、实 质:改变条件后,①v正≠v逆,②各组分的百分含量发生改变
3、化学平衡移动的过程分析
化学平 正向移动或
衡状态 逆向移动
化学平衡移动
【微点拨】新平衡与原平衡相比,平衡混合物中各组分的浓度(或质量)发生相应的变化
新的化学 平衡状态
反应开始 尚未平衡
建立平衡
4、化学平衡移动方向的判断:
化学平衡总往反应速率减小的方向移动
(1)若外界条件变化引起v正>V逆:平衡向正反应方向移动
(2)若外界条件变化引起v正
二、外界条件对化学平衡的影响
01 浓度对化学平衡的影响
02 压强对化学平衡的影响
03 温度对化学平衡的影响
04 催化剂对化学平衡的影响
Q=K Q≠K
化学平衡的移动:原有平衡状态达到 新的平衡状态
【任务1】探讨影响化学平衡的因素
如何改变化学平衡状态
化学平衡1
一段
时间
化学平衡2
改变
条件
不平衡
浓度熵Q: 只与浓度有关
平衡常数K : 只与温度有关
【思考】改变哪些反应条件可使Q≠K,从而改变平衡状态
Q 发生变化
K 发生变化
改变浓度C
改变温度T
PART 01
浓度对化学平衡的
影响
浓度对化学平衡的影响
【实验原理】 Fe ++3SCN - =Fe(SCN)
浅黄 无 色 红色
【变量控制】温度等其他因素不变,只改变一种物质的浓度 增 大C 反应物 滴饱和FeCl 或 高浓度KSCN 减 小C 反应物 加Fe 粉降低Fe +浓度
5 mL0.15 mol ·L- KSCN溶液 经量取好的5室升0005摩尔每升氯化铁溶液
实验 向试管b中加入少量铁粉 向试管b中加4滴1mol/LKSCN溶液 现象 溶液颜色变浅 溶液颜色加深 结论 其他条件不变, 减小C反应物,平衡逆向移动 其他条件不变, 增大C反应物,平衡正向移动
【实验2-1】
l mol·L-1 KSCN溶液
a b C
5 mL 0.05 mol·L- FeCl 溶液
浓度对化学平衡的影响
Fe粉
浓度对化学平衡的影响
【理论解释】Fe ++3SCN-=Fe(SCN)
C 反应物减小 C 反应物增大
Fe+2Fe3+=3Fe2+ Fe ++3SCN - =Fe(SCN)
Fe ++3SCN - =Fe(SCN) 加入KSCN, SCN- 浓度增大,
加入铁粉,Fe +浓度减小,
Q减 小,Q< K, 平衡正向移动
Q增 大 ,Q>K, 平衡逆向移动
浓度对化学平衡的影响
化学平衡的移动:原有平衡状态达到、新的平衡状态
在一定条件下,当可逆反应达到平衡状态后,如果改变反应条件, 平衡状态被破坏,平衡体系的物质组成也会随着改变,直至达到新的 平衡状态。
→ 平衡正方向移动
平衡逆方向移动
增 大C 反应物或 减 小C 生成物
减 小C 反应物或 增 大C 生成物
特别注意:
①由于纯固体或纯液体的浓度为常数,改变纯固体或纯液体的量并不会
影响v正、V逆的大小,所以化学平衡不移动。
如 :反 应C(s)+H O(g)= CO(g)+H (g) 增加或移去一部分炭固体,化学
平衡不移动
②在溶液中进行,如果稀释溶液(加水),反应物浓度减小,生成物浓
度也减小,v 正减小,v逆也减小,但减小的程度不同,总的结果是使 化学平衡向反应方程式有关化学计量系数之和大的方向移动
记笔记:从v-t图像认识浓度对平衡的影响
减小生成物浓度
v'正>v逆
正向移动
减小反应物浓度
v逆 >v′ 正
逆向移动
mA(g)+nB(g)—
增大反应物浓度增大生成物浓度
pC(g)+qD(g)
v '逆>v′ 正
逆向移动
v′ 正 >v '逆
正向移动
浓度对化学平衡的影响
在等温条件下,对于一个已达到化学平衡的反应, 当改变反应物或生成物的浓度时 ,根据浓度商与平衡 常数的小关系,可以判断化学平衡移动的方向。
当Q=K 时,可逆反应处于 平衡 状 态 ;
当Q
压强对化学平衡的
影响
【任务2】探讨压强对化学平衡的影响
【实验原理】 2NO (g)=N O (g)
红棕 无色
【变量控制】温度等因素不变,只改变压强(可通过改 变体积改变压强)
缩小体积 压强增大
增大体积 压强减小
压强对化学平衡的影响
实验 体系压强增大
体系压强减小
现象 颜色先变深,后又变浅
颜色先变浅,后又变深
解释 变 深 :CNo 瞬间增大 又变浅:压强增大,平衡右移, C(NO )又减小
变 浅 :CNo 瞬间减小
又变深:压强减小,平衡左移,
C(no )又增大
压强对化学平衡的影响
【实验2-2】2 NO (g)=N O (g)
I IⅡ
20 mL NO 、N O
压强对化学平衡的影响
压强对化学平衡的影响
【思考】该反应中反应前后的气体的n又什么变化特点
2NO (g)=N O (g)
正反应方向:气体分子数减小的反应
逆反应方向:气体分子数增 大的反应
增大压强 →平衡向气体体积缩小的方向移动
的移动: 减小压强 平衡向气体体积增大的方向移动
(扩大容器体积)
化学平衡 (减小容器体积)
压强对化学平衡的影响
【思考】是否压强改变,化学平衡就一定会移动
对于H (g)+I =2HI(g) 当其他条件不变, 减小或增大容器容积来改变压强时,化学平衡 如何变化呢
对于反应前后,气体物质的总体积没有变化的可逆反应: 压强改变不能使化学平衡发生移动。
固态或液态物质的体积受压强影响很小,可以忽略不计。
当平衡混合物中都是固态或液态物质时,
改变压强后化学平衡一般不发生移动。
【思考】对于只有固体或液体参加的反应,体系压强的 改变会使化学平衡移动吗
压强对化学平衡的影响
增大压强 减小压强 增大压强 减小压强
正向移动 逆向移动 逆向移动 正向移动
记笔记:从v-t图像认识压强对化学平衡的影响
非等体反应 mA(g)+nB(g) g D(g)
等体积反应 m十n=p
mA(g)+nB(g)= pC(g)+qD(g)
增压 减压
【 经 典 习 题
1、在一密闭容器中,反应aA(g)—一 bB(g)达到平衡后,保持温度不
变,将容器体积增大一倍,当达到新的平衡时,B 的浓度是原来的60%, 则下列说法正确的是(C)
A. 平衡向逆反应方向移动了
B. 物 质A的转化率减小了
C. 物 质B 的质量分数增大了
D.a>b
温度对化学平衡
的影响
PART 03
实验 浸泡在热水中
浸泡在冷水中
现象 颜色加深
颜色变浅
平衡移动 平衡逆移
平衡正移
结论 其他条件不变时,升高温度,化学平衡向吸热反应方向移动; 降低温度,化学平衡向放热反应方向移动。
温度对化学平衡的影响
【实验2-3】
2NO (g)一N O (g)△H=-56.9kJ/mol
记笔记:从v-t图像认识温度对化学平衡的影响
mA(g)+nB(g) pC(g)+qD(g)△H>0 mA(g)+nB(g— pC(g)+qD(g)△H<0
降低温度
逆反应方向
升高温度
逆反应方向
升高温度
正反应方向
降低温度
正反应方向
2、反应:A(g)+3B(g) 2C(g)△H<0, 达平衡后,将反应体系
的温度降低,下列叙述中正确的是( C )
A. 正反应速率增大,逆反应速率减小,平衡向右移动
B. 正反应速率减小,逆反应速率增大,平衡向左移动
C. 正反应速率和逆反应速率都减小,平衡向右移动
D. 正反应速率和逆反应速率都减小,平衡向左移动
【经典 习 题 】
PART 03
催化剂对化学平
衡的影响
催化剂对化学平衡的影响
催化剂可同等程度地改变正、逆反应速率,
因此,对化学平衡的移动没有影响, 但可以改变反应达到平衡所需的时间。
即:催化剂不能使化学平衡发生移动,不能改变达到化学平 衡状态时反应混合物的组成,但是使用催化剂能改变反应达 到化学平衡所需的时间
(2)用v—t图像分析催化剂对化学平衡的影响
4、催化剂对化学平衡的影响 催化剂能同等程度地增
加正反应速率和逆反应 速率,因此它对化学平 衡的移动没有影响。
(1)催化剂对化学平衡的影响规律:
(1)恒温、恒容下,加“惰气”,各反应物、生成物的浓度均未 改 变 ,V正、V逆均不变,故化学平衡不发生移动
(2)恒温、恒压下加入“惰气”,容器体积增大,V正、V逆均减 小,等效于降压,故化学平衡向气体总体积增大的方向移动
(3)对于反应前后气体总体积不变的可逆反应,无论什么情况下 (T 、V不变或T 、P不变)下加入“惰气”,化学平衡均不发生移动
5、“ 惰 性 气 体 ” 对 化 学 平 衡 移 动 的 影 响
3、在一定条件下,合成氨反应到达平称衡状态,此时,再进行如
下操作,平衡不发生移动的是(D )
A. 恒温、恒压时,充入NH B. 恒温、恒容时,充入N
C. 恒温、恒压时,充入He D. 恒温、恒容时,充入He
4、在一定条件下,N +3H =NH 达到平衡状态后,按如下操作, 化学平衡不发生移动的是( D)
A. 保 持T 、V不变,充入HC1 B. 保持T、V不变,充入N
C. 保持T 、P不变,充入He D. 保 持T 、V不变,充入He
【经典 习 题
三 、勒 夏 特 列 原 理
1、定 义:如果改变影响平衡的一个条件(如温度、压强及参加反应的物质的浓 度),平衡就向着能够减弱这种改变的方向移动,该结论就是勒夏特列原理
2、适用范围( 1)仅适用于已达到平衡的反应体系,不可逆过程或未达到平衡的可 逆过程均不能使用该原理。此外,勒夏特列原理对所有的动态平衡(如溶解平衡、 电离平衡和水解平衡等)都适用。(2)只适用于判断“改变影响平衡的一个条件”时 平衡移动的方向。若同时改变影响平衡移动的几个条件,则不能简单地根据勒夏 特列原理来判断平衡移动的方向,只有在改变的条件对平衡移动的方向影响一致 时,才能根据勒夏特列原理进行判断
【特别注意】
平衡移动的结果是“ 减弱”外界条件的影响,而不是“消除”外界条件的 影响,更不是“扭转”外界条件的影响
3、对勒夏特列原理的理解
向一密闭容器中通入1 mol N 、3 mol H 发生反应:
N (g)+3H (g)—→2NH (g)△H<0, 一段时间后达到平衡,当改变下列条 件后:(1)若增大N 的浓度,平衡移动的方向是正向移动;达新平衡时,
氮气的浓度与改变时相比较,其变化是减小。但新平衡时的浓度大于原平 衡时的浓度(2)若升高温度,平衡移动的方向是逆向移动;达新平衡时的 温度与改变时相比较,其变化是降低。但新平衡时的温度高于原平衡时的 温度(3)若增大压强,平衡移动的方向是正向移动;达新平衡时的压强与 改变时相比较,其变化是减小。但新平衡时的压强大于原平衡时的压强
5、下列不能用勒夏特列原理解释的事实是( B )
A. 红棕色的NO 加压后颜色先变深后变浅
B. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C. 黄绿色的氯水光照后颜色变浅
D. 合成氨工业使用高压以提高氨的产量
【经典 习 题 】
增大压强→平衡向气体分子数减小方向移动
减小压强一平衡向气体分子数增大方向移动
升高温度一平衡向吸热方向移动
降低温度→ 平衡向放热方向移动
不影响平衡移动
课堂总结
浓度
压强
温度
催化剂
平衡正方向移动
平衡逆方向移动
增 大C 反应物或
减 小C生成物
减小C 反应物或
增 大C 生成物
影响化学平 衡的因素
