3.3金属晶体与离子晶体 课件 (共22张PPT) 2024-2025学年高二下学期化学人教版((2019)选择性必修2
文档属性
| 名称 | 3.3金属晶体与离子晶体 课件 (共22张PPT) 2024-2025学年高二下学期化学人教版((2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-16 08:48:40 | ||
图片预览








文档简介
(共22张PPT)
第三节金属晶体与离子晶体
学习目标
1.知道金属晶体的结构特点,能电子气理论解释金属晶体的导电性、导热 性、延展性等宏观性质。
2.知道离子键的特点,能以氯化钠和氯化铯为例解释典型离子化合物的某 些性质,并能说明不同离子晶体的熔点差异。
3.知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存在的。
自学指导 P86-87
1、金属键的成键微粒
2、如何判断金属键的强弱
3、用“电子气理论”解释金属的延展性、导电性、导热性
4、合金的硬度为什么比纯金属大
5、为什么温度升高金属导电性变差
钢硬度大
碳
知识点一金属键与金属晶体
1.金属键
(1)本质:“电子气理论”,该理论把金属键描述为金属原子脱落下来的 价电子 形成遍布整块晶体的“电子气”,被所有原子所共 用,从而把所 有的金属原子维系在一起。
(2) 成键粒子是 金属阳离子 和 自由电子。
(3)金属键的强弱和对金属性质的影响
①金属键的强弱主要取决于金属元素的原子半径和价电子数。原子半径越 小 、价电子数越多,金属键越强。
②金属键越强,金属的熔、沸点越高,硬度越大。例如,熔点最高的金属
是 钨,硬度最大的金属是 铬。
3410℃
共价晶体 金刚石
硅
熔点/℃ >3500
1410
2.金属晶体
(1)在金属晶体中,原子之间以 金属键_相互结合。
(2)金属晶体的性质:优良的 导电性、导热性_和 延展性。
(3)用“电子气理论”解释金属的物理性质
当金属受到外力作用时,晶体中的各原子层
就会发生相对滑动,但不会改变原来的排列 方式,而且弥漫在金属原子间的电子气可以 起到类似轴承中滚珠之间润滑剂的作用,所 以金属有良好的延展性
电子气在电场中做定向移动而形成电流,使 金属呈现良好的导电性
电子气中的自由电子在热的作用下与金属原 子频繁碰撞,将热能从一端传递到另一端, 使金属呈现良好的导热性
延展性
导电性
导热性
反思 归 纳 金属晶体熔点比较的规律
(1)金属晶体的熔点取决于金属键的强弱,一般金属原子的价电子数越 多 ,原子半径越小 ,金属晶体内部的金属键越强,晶体熔点越高。
(2)金属晶体的熔点差别较大,如汞Hg 常温液态,碱金属的熔点较低, 铁、钨等金属的熔点很高,这是由金属键的强弱不同造成的。
(3)一般来说,同一周期金属单质的熔点由左到右逐渐升高;同一主族
金属单质的熔点自上而下逐渐降低。
(4) 一 般合金的熔点低于其成分金属的熔点。
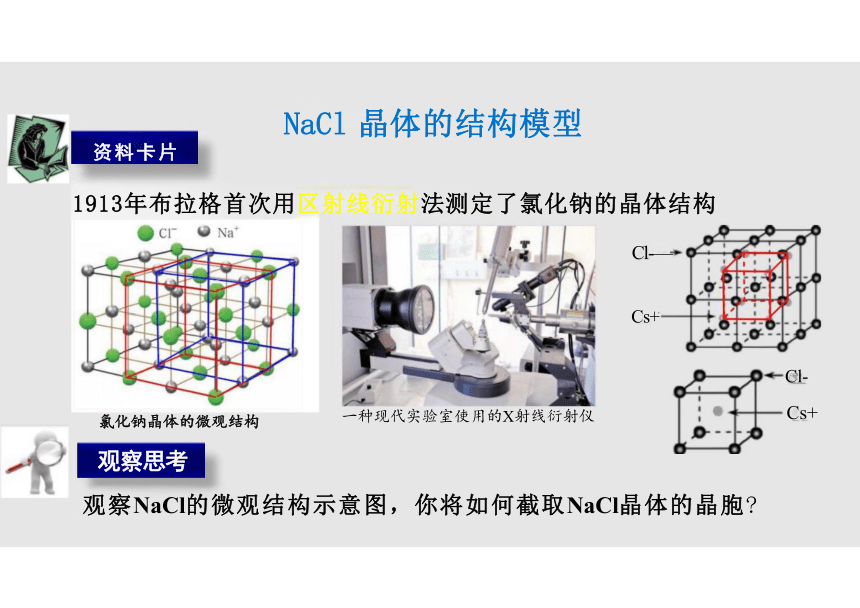
NaCl 晶体的结构模型
1913年布拉格首次用区射线衍射法测定了氯化钠的晶体结构
Cl-—
Cs+
Cl-
Cs+
观察NaCl的微观结构示意图,你将如何截取NaCl晶体的晶胞
观察思考
一种现代实验室使用的X射线衍射仪
资料卡片
氯化钠晶体的微观结构
知识点二离子晶体
1.离子键及其影响因素
( 1 ) 概 念 :阴、阳离子之间的相互作用。
(2)影响因素:离子所带电荷数越多,离子半径越小,离子键越强。 2.离子晶体及其物理性质
(1)概令 · 中 阳离子 和 阳离子 相石作用而形成的晶体。
(2 离子间距/pm 电荷数 熔点/℃
NaCl 276 1 801 共价晶体 金刚石 硅
NaBr 290 1 750 连 熔点/℃ >3500 1410
MgO 205 2 2800 大,难于压缩 CaO 239 2 2576 态和在水溶液中都 能导电 晶体 晶胞
晶胞详解
NaCl Cl- Na+
(1)在NaCl晶体中,Na+的配位数为6,cl- 的配位数为 6 ;
(2)与Na+(Cl-)最近且等距离的Na+(Cl-)有 12个,每个Na+(Cl-)周围与它最近且等距离 的Cl-(Na+)有6个;
(3)每个晶胞中有4个Na+和4个Cl- ;
(4)每个Cl-周围的Na+构成正八面体形
3.常见的离子晶体
晶体 晶胞
晶胞详解
CsCl Cl Cs+ Cl- Cs+
(1)在CsCl晶体中,Cs+的配位数为8,Cl- 的配位数为8;
(2)每个Cs+与6个Cs+等距离相邻,每个 Cs+与8个Cl-等距离相邻
(3)每个晶胞中含有1个Cs+和1个Cl-
晶体 晶胞
晶胞详解
CaF
(1)在CaF 晶体中,Ca +的配位数为8, F-的配位数为4;
(2)每个晶胞中含有4个Ca +和8个F- ;
(3)与Ca +最近且等距离的Ca +有12个, 与F-最近且等距离的F-有6个
拓展视野 实际上,大量离子晶体中的阴离子或阳离子不是单原子离子。
有的还存在电中性分子(H O 、NH 等)。
有些离子组成的物质在常温下甚至以液态形式存在。
化合物
熔点/℃
NH NO
169.6
Ca(H PO )
109
CH CO0Cs
194
离子液体:熔点低、稳定性强、
是优良的绿色溶剂等优点
C H NH NO
12
KAI (SO ) 12H O CuSO ·5H O 氢键
1-乙基-3-甲基咪唑四氟硼酸盐
离子液体在锂离子电池中作为电解质的应用是一个重点关注的研究领域。 传统的有机溶剂电解质在高温或高电压下可能会出现安全隐患,而离子 液体由离子组成, 具有较高的热稳定性和化学稳定性,因此被认为是一 种潜在的替代电解质。电解质的研究终点是固态电解质。
晶体类型 分 子 晶 体 共 价 晶 体 金 属 晶 体
离 子 晶 体
微粒种类 分子 原子 金属阳离子 和自由电子
阴、阳离子
微粒间 相互作用 分子间 作用力 共价键 金属键
离子键
典型晶体 CO 金刚石晶胞 金 属 C u
NaCl
【归纳总结】
共价晶体 分子晶体 离子晶体 金属晶体
晶体类型之间存在绝对的界限吗
知识点三过渡晶体与混合型晶体
1.过渡晶体
(1)四类典型晶体是 分子晶体、共价 晶体、金属 晶体、离子晶体。
事实上,纯粹的典型晶体是不多的,大多数晶体是它们之间的过渡晶 体。四类晶体都有过渡型。
(2)离子晶体和共价晶体的过渡标准是化学键中离子键成分的百分数。
若离子键成分的百分数大,则作为 离子晶体 处理;若离子键成分的百分 数小,则作为 共价晶体 处理。
[特别提醒]离子键的百分数是依据电负性的差值计算出来的,差值越
大,离子键的百分数越大。
离子晶体
NaCl
MgCl 离子晶体
AICl 过渡晶体
SiCl 分子晶体
SCl 分子晶体
金属晶体 Mg S1 P S 分子晶体
Na
第三周期元素的氯化物及其晶体类型
图2石墨的层状结构 图3石墨结构中未参
与杂化的p轨道
2.混合型晶体——石墨
(1)结构模型
图1石墨晶体中的二维平面结构
(2)结构特点——层状结构
①同层内,碳原子采用sp 杂 化,以 共价键 结合形成 平面六元并环 结 构(如图1)。每个碳原子的配位数为3,有一个未参与杂化的2p 电子, 它的原子轨道垂直于碳原子平面(如图3)。由于所有碳原子的p轨道相
互平行而且相互重叠,使口轨道中的电子可在整个碳原子平面中运动。
②层内的碳原子的核间距为142 pm, 层间距离为335 pm, 说明层间没有
③ 碳原子与C=C 键个数比为 2:3
化学键相连,是靠 范德华力 维系的(如图2)。
(3)晶体类型
石墨晶体中,既有 共价键,又有 范德华力,且有类似金属晶体的导电 性,属于 混合型晶体。
(4)物理性质:①导电性;②导热性;③润滑性。
共价晶体
分子晶体
335 pm
142 pm
谢谢观看
第三节金属晶体与离子晶体
学习目标
1.知道金属晶体的结构特点,能电子气理论解释金属晶体的导电性、导热 性、延展性等宏观性质。
2.知道离子键的特点,能以氯化钠和氯化铯为例解释典型离子化合物的某 些性质,并能说明不同离子晶体的熔点差异。
3.知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存在的。
自学指导 P86-87
1、金属键的成键微粒
2、如何判断金属键的强弱
3、用“电子气理论”解释金属的延展性、导电性、导热性
4、合金的硬度为什么比纯金属大
5、为什么温度升高金属导电性变差
钢硬度大
碳
知识点一金属键与金属晶体
1.金属键
(1)本质:“电子气理论”,该理论把金属键描述为金属原子脱落下来的 价电子 形成遍布整块晶体的“电子气”,被所有原子所共 用,从而把所 有的金属原子维系在一起。
(2) 成键粒子是 金属阳离子 和 自由电子。
(3)金属键的强弱和对金属性质的影响
①金属键的强弱主要取决于金属元素的原子半径和价电子数。原子半径越 小 、价电子数越多,金属键越强。
②金属键越强,金属的熔、沸点越高,硬度越大。例如,熔点最高的金属
是 钨,硬度最大的金属是 铬。
3410℃
共价晶体 金刚石
硅
熔点/℃ >3500
1410
2.金属晶体
(1)在金属晶体中,原子之间以 金属键_相互结合。
(2)金属晶体的性质:优良的 导电性、导热性_和 延展性。
(3)用“电子气理论”解释金属的物理性质
当金属受到外力作用时,晶体中的各原子层
就会发生相对滑动,但不会改变原来的排列 方式,而且弥漫在金属原子间的电子气可以 起到类似轴承中滚珠之间润滑剂的作用,所 以金属有良好的延展性
电子气在电场中做定向移动而形成电流,使 金属呈现良好的导电性
电子气中的自由电子在热的作用下与金属原 子频繁碰撞,将热能从一端传递到另一端, 使金属呈现良好的导热性
延展性
导电性
导热性
反思 归 纳 金属晶体熔点比较的规律
(1)金属晶体的熔点取决于金属键的强弱,一般金属原子的价电子数越 多 ,原子半径越小 ,金属晶体内部的金属键越强,晶体熔点越高。
(2)金属晶体的熔点差别较大,如汞Hg 常温液态,碱金属的熔点较低, 铁、钨等金属的熔点很高,这是由金属键的强弱不同造成的。
(3)一般来说,同一周期金属单质的熔点由左到右逐渐升高;同一主族
金属单质的熔点自上而下逐渐降低。
(4) 一 般合金的熔点低于其成分金属的熔点。
NaCl 晶体的结构模型
1913年布拉格首次用区射线衍射法测定了氯化钠的晶体结构
Cl-—
Cs+
Cl-
Cs+
观察NaCl的微观结构示意图,你将如何截取NaCl晶体的晶胞
观察思考
一种现代实验室使用的X射线衍射仪
资料卡片
氯化钠晶体的微观结构
知识点二离子晶体
1.离子键及其影响因素
( 1 ) 概 念 :阴、阳离子之间的相互作用。
(2)影响因素:离子所带电荷数越多,离子半径越小,离子键越强。 2.离子晶体及其物理性质
(1)概令 · 中 阳离子 和 阳离子 相石作用而形成的晶体。
(2 离子间距/pm 电荷数 熔点/℃
NaCl 276 1 801 共价晶体 金刚石 硅
NaBr 290 1 750 连 熔点/℃ >3500 1410
MgO 205 2 2800 大,难于压缩 CaO 239 2 2576 态和在水溶液中都 能导电 晶体 晶胞
晶胞详解
NaCl Cl- Na+
(1)在NaCl晶体中,Na+的配位数为6,cl- 的配位数为 6 ;
(2)与Na+(Cl-)最近且等距离的Na+(Cl-)有 12个,每个Na+(Cl-)周围与它最近且等距离 的Cl-(Na+)有6个;
(3)每个晶胞中有4个Na+和4个Cl- ;
(4)每个Cl-周围的Na+构成正八面体形
3.常见的离子晶体
晶体 晶胞
晶胞详解
CsCl Cl Cs+ Cl- Cs+
(1)在CsCl晶体中,Cs+的配位数为8,Cl- 的配位数为8;
(2)每个Cs+与6个Cs+等距离相邻,每个 Cs+与8个Cl-等距离相邻
(3)每个晶胞中含有1个Cs+和1个Cl-
晶体 晶胞
晶胞详解
CaF
(1)在CaF 晶体中,Ca +的配位数为8, F-的配位数为4;
(2)每个晶胞中含有4个Ca +和8个F- ;
(3)与Ca +最近且等距离的Ca +有12个, 与F-最近且等距离的F-有6个
拓展视野 实际上,大量离子晶体中的阴离子或阳离子不是单原子离子。
有的还存在电中性分子(H O 、NH 等)。
有些离子组成的物质在常温下甚至以液态形式存在。
化合物
熔点/℃
NH NO
169.6
Ca(H PO )
109
CH CO0Cs
194
离子液体:熔点低、稳定性强、
是优良的绿色溶剂等优点
C H NH NO
12
KAI (SO ) 12H O CuSO ·5H O 氢键
1-乙基-3-甲基咪唑四氟硼酸盐
离子液体在锂离子电池中作为电解质的应用是一个重点关注的研究领域。 传统的有机溶剂电解质在高温或高电压下可能会出现安全隐患,而离子 液体由离子组成, 具有较高的热稳定性和化学稳定性,因此被认为是一 种潜在的替代电解质。电解质的研究终点是固态电解质。
晶体类型 分 子 晶 体 共 价 晶 体 金 属 晶 体
离 子 晶 体
微粒种类 分子 原子 金属阳离子 和自由电子
阴、阳离子
微粒间 相互作用 分子间 作用力 共价键 金属键
离子键
典型晶体 CO 金刚石晶胞 金 属 C u
NaCl
【归纳总结】
共价晶体 分子晶体 离子晶体 金属晶体
晶体类型之间存在绝对的界限吗
知识点三过渡晶体与混合型晶体
1.过渡晶体
(1)四类典型晶体是 分子晶体、共价 晶体、金属 晶体、离子晶体。
事实上,纯粹的典型晶体是不多的,大多数晶体是它们之间的过渡晶 体。四类晶体都有过渡型。
(2)离子晶体和共价晶体的过渡标准是化学键中离子键成分的百分数。
若离子键成分的百分数大,则作为 离子晶体 处理;若离子键成分的百分 数小,则作为 共价晶体 处理。
[特别提醒]离子键的百分数是依据电负性的差值计算出来的,差值越
大,离子键的百分数越大。
离子晶体
NaCl
MgCl 离子晶体
AICl 过渡晶体
SiCl 分子晶体
SCl 分子晶体
金属晶体 Mg S1 P S 分子晶体
Na
第三周期元素的氯化物及其晶体类型
图2石墨的层状结构 图3石墨结构中未参
与杂化的p轨道
2.混合型晶体——石墨
(1)结构模型
图1石墨晶体中的二维平面结构
(2)结构特点——层状结构
①同层内,碳原子采用sp 杂 化,以 共价键 结合形成 平面六元并环 结 构(如图1)。每个碳原子的配位数为3,有一个未参与杂化的2p 电子, 它的原子轨道垂直于碳原子平面(如图3)。由于所有碳原子的p轨道相
互平行而且相互重叠,使口轨道中的电子可在整个碳原子平面中运动。
②层内的碳原子的核间距为142 pm, 层间距离为335 pm, 说明层间没有
③ 碳原子与C=C 键个数比为 2:3
化学键相连,是靠 范德华力 维系的(如图2)。
(3)晶体类型
石墨晶体中,既有 共价键,又有 范德华力,且有类似金属晶体的导电 性,属于 混合型晶体。
(4)物理性质:①导电性;②导热性;③润滑性。
共价晶体
分子晶体
335 pm
142 pm
谢谢观看
