3.2.3水的电离和溶液的pH- 酸碱中和滴定-课件(共25张ppt)高中化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.2.3水的电离和溶液的pH- 酸碱中和滴定-课件(共25张ppt)高中化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 763.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-16 19:04:33 | ||
图片预览








文档简介
(共25张PPT)
第三章 第二节水的电离和溶液的pH
第三课时酸碱中和滴定
碱式滴定管
实验室有一瓶标签污损的NaOH溶液,你通过哪
些方法可以测出其准确浓度
1.使用pH计
2.使用pH试纸
3.取一定体积的NaOH溶液,向其中滴加MgCl 溶 液,直至沉淀不再产生,过滤沉淀,洗涤干燥, 称量沉淀的质量。
4.取一定体积的NaOH溶液,向其中滴加已知浓度 的盐酸,两者恰好中和完全,记录消耗盐酸的体
积 。
一、酸碱中和滴定
1.概念:依据中和反应,用已知浓度的酸或碱(标准液)来测定未知浓度 的碱或酸(待测液)的方法
2.原理: 酸碱恰好中和时:n(H+)=n(OH-)
即:C酸V酸=C碱V碱(一元酸和一元碱)
3.关键: (1)准确测量标准液、待测液的体积
(2)准确判定是否恰好中和完全(滴定终点)
二、酸碱中和滴定实验
1.主要试剂:0.1000mol/LHCl 溶液(标准液)、
0.1000mol/L左右NaOH溶液(待测液)、
酚酞溶液(指示剂)、蒸馏水
2.主要仪器:酸式滴定管、碱式滴定管、滴定管夹、 铁架台、锥形瓶、烧杯
锥形瓶 烧 杯
酸式痛定管 台
架 铁
碱式滴定管
滴定管夹
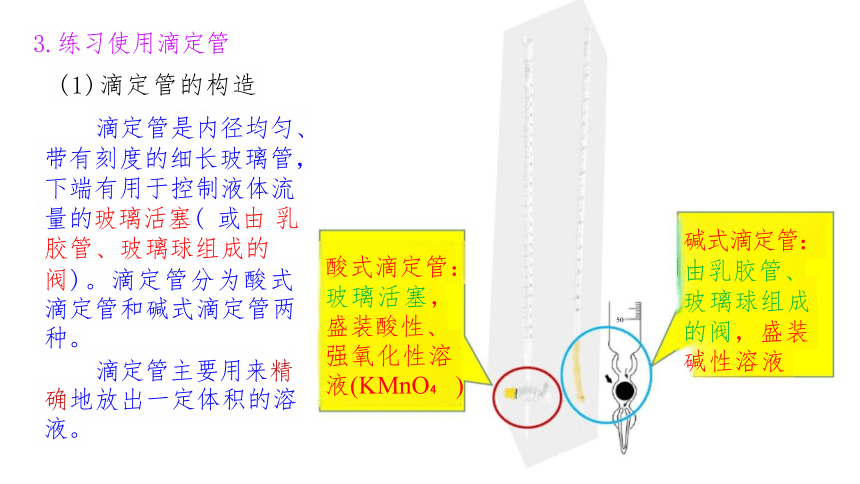
3.练习使用滴定管
(1)滴定管的构造
滴定管是内径均匀、 带有刻度的细长玻璃管, 下端有用于控制液体流 量的玻璃活塞( 或由 乳 胶管、玻璃球组成的
阀)。滴定管分为酸式 滴定管和碱式滴定管两 种。
滴定管主要用来精 确地放出一定体积的溶 液。
碱式滴定管:
由乳胶管、 玻璃球组成
的阀,盛装 碱性溶液
50
酸式滴定管: 玻璃活塞,
盛装酸性、 强氧化性溶 液(KMnO )
0刻度处
①滴定管上方标有:容积、温度、“0”刻度。
②全部装满溶液时,体积多于所标容积。
③读数时眼睛平视,视线和凹液面最低处相切。不能仰视和俯视。
④最小刻度:0.1mL, 读到小数点后两位,精确度:0.01 mL 。 如24.00mL,23.38mL。
⑤实际滴出的溶液体积=滴定后的读数-滴定前的读数
25ml 酸式滴定管
25ml 刻度处
滴定管
量筒
规格 25mL、50mL
10mL、25mL...
0刻度 上端
无
最小刻度 0.1mL
精确度 0.01mL
0.1mL
思考:量筒与滴定管有哪些差异
(2)滴定管的使用方法
1.检查仪器: 检查滴定管活塞是否漏水,转动是否灵活。
2.洗涤仪器: 滴定管:自来水冲洗→蒸馏水洗2~3次→待装液润洗2~3次。
润洗方法:P89 锥形瓶:自来水冲洗→蒸馏水清洗2~3次。不能用待装液润洗
3.装液:注入酸、碱反应液至滴定管0刻度以上2~3mL处。
滴定管内不能留有气泡。
4.调节起始读数:①使滴定管尖嘴部分充满溶液。
酸式滴定管:迅速转动活塞,快速放液。
碱式滴定管:乳胶管向上翘起,迅速挤压玻璃球。
③调 整液面在“0”或“0”刻度线以下,准确记下初始读数。
②排气泡
5.放出反应液:根据实验需要从滴定管中逐滴放出一定量的反应液。
将一定量待测液放入锥形瓶中,加入2~3滴指示剂(下垫一张白纸)
便于观察锥形瓶内溶液颜色的变化,减小滴定误差。
6.滴定过程左手:控制活塞或挤压玻璃球。
右手:轻轻摇动锥形瓶。
两眼:注视锥形瓶内溶液颜色的变化以及滴定的速度。
7.滴定终点的判断
当滴入最后半滴xx溶液时,溶液颜色恰好由xx色变为xx色,且半分钟内 不复色,即为滴定终点。读数并记录。
8.重复操作:为减少实验误差,要求重复实验2~3次,记录所用标准溶液 体积,取平均值求出结果。
实验 次数 待测NaOH体 积 ( m L ) 标准盐酸体积(0.1000mol/L)
N a O H 浓 度 (mol/L)
初读数 末读数 体积 1 25.00 0.00 24.70 24.70
0.0988
2 25.00 1.00 25.90 24.90 3 25.00 5.00 29.50 24.50
4.指示剂的选择
(1)原则:
①终点时,指示剂的颜色变化明显
②变色范围越窄越好,对溶液酸碱性变化较灵敏
③变色范围尽可能与所生成盐的酸碱性范围一致
5.0
8.0
3.1
4.4
8.2
10.0
石蕊因变色不明显,通常不用作指示剂。
甲基橙
石蕊
酚酞
酚 酞 粉红 → 无色
甲基橙 黄色 →橙色 酚 酞 无色→粉红 甲基橙 橙色 →黄色 甲基橙 黄色 → 橙色 酚 酞无色→粉红
酸碱中和滴定选用酚 酞或甲基橙作指示剂,
但其滴定终点的变色点 并不是pH=7, 这样对中 和滴定终点的判断有没 有影响
强酸滴定强碱
强碱滴定强酸
强酸滴定弱碱 强碱滴定弱酸
(2)用量:2—3滴
(3)指示剂的选择和滴定终点的判断
25℃在20.00mL 0.1000mol/L的盐酸中,逐滴滴入0.1000mol/LNaOH 溶液20.00mL。
(1)判断下列情况下溶液的pH。
①滴加NaOH 溶液到完全反应相差半滴(一滴溶液的体积是0.04mL), 这时溶液的 pH;
②完全反应后再多加半滴NaOH 溶液时的pH;
(pH=9.7)
(2)跟完全反应所需NaOH(20.00mL) 溶液少(多)加半滴,计算盐酸的物质的量浓度是
多少
=0.0999mol/L =0.1001mol/L
跟实际浓度0.1000mol/L 相比,只有0 . 1%的误差,可忽略
pH
12
10
酚
反应终点
6
甲基橙
2
V(NaOH)/mL
10 20 30
V(NaOH) 0.00 5.00 10.00 15.00 18.00 19.00
19.98
pH 1.00 1.22 1.48 1.84 3.12 3.60
4.30
20.00 20.02 20.08 20.10 21.00 25.00 30.00
35.00
7.00 9.70 10.30 10.40 11.38 12.05 12.30
12.44
突跃范围在pH 为4.30~9.70,
所以应选择pH变色范围在这 个范围的指示剂,如酚酞、
甲基橙。即使变色不在恰好 中和的pH=7 的点上,但体积 差距很小,可以忽略不计。
以0.1000mol/LNaOH滴定0.1000mol/L HC120.00mL为例:
突变 范围
40
4
0
8
三 、酸碱中和滴定曲线分析
1.滴定曲线概念
以滴加酸(或碱)的量为横坐标,以溶液pH 为纵坐标绘出一条溶液 pH 随酸(或碱)的滴加量而变化的曲线。
2.酸碱中和滴定曲线的应用
①看纵坐标,搞清楚是酸加入碱中,还是碱加入酸中;
②看起点,起点可以看出酸性或碱性的强弱;
③再找滴定终点和pH=7 的中性点,判断滴定终点的酸碱性,然后确定中性点(pH=7) 的位置;
④最后分析其他的特殊点(如滴定一半点,过量一半点等),分析酸、碱过量情况。
A. 原来盐酸的物质的量浓度为0.1 mol-L-1
B.X的值为0.1
C.原来盐酸的物质的量浓度为1 mol-L-1
D.X的值为0.001
1.如图是向100 mL的盐酸中逐渐加入NaOH溶液时,溶液的pH变化图像,
根据图像所得结论正确的是
已知
滴定测得
标
2
待
(待)
预先量取
关键:紧扣公式,分析V(标)的变化。
四 、酸碱中和滴定误差分析
(标)
计算
(1)盛装标准液的滴定管用蒸馏水洗涤后未用标准液润洗。
V(标)增大 c(待)增大
(2)盛装待测液的滴定管用蒸馏水洗后未用待测液润洗。
n (待)减小 V(标)减小 c(待)减小
(3)锥形瓶用蒸馏水洗后再用待测液润洗。
n(待)增大 V(标)增大 c(待)增大
量蒸馏 (待)是否有影响
无影响
误差产生的原因:
1、润洗不当
(标)
(待)
2.读数不规范
滴定前仰视,滴定后俯视
滴定前
滴定后
V(标)偏大,导致c(待)偏大。
V(标)偏小,导致c(待)偏小。
滴定前
滴定后
滴定前俯视,滴定后仰视
实际值
读出值
实际值
读出值
3.操作不当
(1)盛装标准液的滴定管漏液。 V(标)增大→ c(待)偏大
(2)盛标准液的滴定管滴前尖嘴部分留有气泡,滴定过程中,气泡变 小或消失,最后无气泡。 V(标)增大→ c(待)偏大
(3)滴定过程中,将标准液滴到锥形瓶外。V(标)增大→ c(待)偏大
(4)移液时,将移液管尖嘴处的残留液吹入锥形瓶中。
V(待)增大→ V (标)增大→ c(待)偏大
(5)滴定过程中,振荡锥形瓶时,不小心将待测液溅出。
V(待)减小→ V(标)减小→ c(待)偏小
4.杂质的影响
(1)用含有Na CO 杂质的NaOH配置标液来测定盐酸的浓度。
(若用标准盐酸来滴定这种NaOH 溶液呢 )V(标)增大→ c(待)偏高
V(标)减小→ c(待)偏低
(2)用含有KOH 杂质的NaOH 配置标液来测定盐酸的浓度。
V(标)增大→ c (待)偏高
( 3 ) 用NaOH 配置的因存放不当而变质的标液来测定盐酸的浓度。
c(待)不变
5.终点判断不准
(1)强酸滴定弱碱时,甲基橙由黄色变为红色时停止滴定。
判断终点过晚→V (标)增大→ c(待)偏大
(2)强碱滴定弱酸时,酚酞由无色变为粉红时立即停止滴定。
判断终点过早→V(标)减小→ c(待)偏小
(3)滴定终点时滴定管尖嘴处半滴尚未滴下,或一滴标准液附着在锥形 瓶内壁上未流下。
V(标)增大→c(待)偏大
第三章 第二节水的电离和溶液的pH
第三课时酸碱中和滴定
碱式滴定管
实验室有一瓶标签污损的NaOH溶液,你通过哪
些方法可以测出其准确浓度
1.使用pH计
2.使用pH试纸
3.取一定体积的NaOH溶液,向其中滴加MgCl 溶 液,直至沉淀不再产生,过滤沉淀,洗涤干燥, 称量沉淀的质量。
4.取一定体积的NaOH溶液,向其中滴加已知浓度 的盐酸,两者恰好中和完全,记录消耗盐酸的体
积 。
一、酸碱中和滴定
1.概念:依据中和反应,用已知浓度的酸或碱(标准液)来测定未知浓度 的碱或酸(待测液)的方法
2.原理: 酸碱恰好中和时:n(H+)=n(OH-)
即:C酸V酸=C碱V碱(一元酸和一元碱)
3.关键: (1)准确测量标准液、待测液的体积
(2)准确判定是否恰好中和完全(滴定终点)
二、酸碱中和滴定实验
1.主要试剂:0.1000mol/LHCl 溶液(标准液)、
0.1000mol/L左右NaOH溶液(待测液)、
酚酞溶液(指示剂)、蒸馏水
2.主要仪器:酸式滴定管、碱式滴定管、滴定管夹、 铁架台、锥形瓶、烧杯
锥形瓶 烧 杯
酸式痛定管 台
架 铁
碱式滴定管
滴定管夹
3.练习使用滴定管
(1)滴定管的构造
滴定管是内径均匀、 带有刻度的细长玻璃管, 下端有用于控制液体流 量的玻璃活塞( 或由 乳 胶管、玻璃球组成的
阀)。滴定管分为酸式 滴定管和碱式滴定管两 种。
滴定管主要用来精 确地放出一定体积的溶 液。
碱式滴定管:
由乳胶管、 玻璃球组成
的阀,盛装 碱性溶液
50
酸式滴定管: 玻璃活塞,
盛装酸性、 强氧化性溶 液(KMnO )
0刻度处
①滴定管上方标有:容积、温度、“0”刻度。
②全部装满溶液时,体积多于所标容积。
③读数时眼睛平视,视线和凹液面最低处相切。不能仰视和俯视。
④最小刻度:0.1mL, 读到小数点后两位,精确度:0.01 mL 。 如24.00mL,23.38mL。
⑤实际滴出的溶液体积=滴定后的读数-滴定前的读数
25ml 酸式滴定管
25ml 刻度处
滴定管
量筒
规格 25mL、50mL
10mL、25mL...
0刻度 上端
无
最小刻度 0.1mL
精确度 0.01mL
0.1mL
思考:量筒与滴定管有哪些差异
(2)滴定管的使用方法
1.检查仪器: 检查滴定管活塞是否漏水,转动是否灵活。
2.洗涤仪器: 滴定管:自来水冲洗→蒸馏水洗2~3次→待装液润洗2~3次。
润洗方法:P89 锥形瓶:自来水冲洗→蒸馏水清洗2~3次。不能用待装液润洗
3.装液:注入酸、碱反应液至滴定管0刻度以上2~3mL处。
滴定管内不能留有气泡。
4.调节起始读数:①使滴定管尖嘴部分充满溶液。
酸式滴定管:迅速转动活塞,快速放液。
碱式滴定管:乳胶管向上翘起,迅速挤压玻璃球。
③调 整液面在“0”或“0”刻度线以下,准确记下初始读数。
②排气泡
5.放出反应液:根据实验需要从滴定管中逐滴放出一定量的反应液。
将一定量待测液放入锥形瓶中,加入2~3滴指示剂(下垫一张白纸)
便于观察锥形瓶内溶液颜色的变化,减小滴定误差。
6.滴定过程左手:控制活塞或挤压玻璃球。
右手:轻轻摇动锥形瓶。
两眼:注视锥形瓶内溶液颜色的变化以及滴定的速度。
7.滴定终点的判断
当滴入最后半滴xx溶液时,溶液颜色恰好由xx色变为xx色,且半分钟内 不复色,即为滴定终点。读数并记录。
8.重复操作:为减少实验误差,要求重复实验2~3次,记录所用标准溶液 体积,取平均值求出结果。
实验 次数 待测NaOH体 积 ( m L ) 标准盐酸体积(0.1000mol/L)
N a O H 浓 度 (mol/L)
初读数 末读数 体积 1 25.00 0.00 24.70 24.70
0.0988
2 25.00 1.00 25.90 24.90 3 25.00 5.00 29.50 24.50
4.指示剂的选择
(1)原则:
①终点时,指示剂的颜色变化明显
②变色范围越窄越好,对溶液酸碱性变化较灵敏
③变色范围尽可能与所生成盐的酸碱性范围一致
5.0
8.0
3.1
4.4
8.2
10.0
石蕊因变色不明显,通常不用作指示剂。
甲基橙
石蕊
酚酞
酚 酞 粉红 → 无色
甲基橙 黄色 →橙色 酚 酞 无色→粉红 甲基橙 橙色 →黄色 甲基橙 黄色 → 橙色 酚 酞无色→粉红
酸碱中和滴定选用酚 酞或甲基橙作指示剂,
但其滴定终点的变色点 并不是pH=7, 这样对中 和滴定终点的判断有没 有影响
强酸滴定强碱
强碱滴定强酸
强酸滴定弱碱 强碱滴定弱酸
(2)用量:2—3滴
(3)指示剂的选择和滴定终点的判断
25℃在20.00mL 0.1000mol/L的盐酸中,逐滴滴入0.1000mol/LNaOH 溶液20.00mL。
(1)判断下列情况下溶液的pH。
①滴加NaOH 溶液到完全反应相差半滴(一滴溶液的体积是0.04mL), 这时溶液的 pH;
②完全反应后再多加半滴NaOH 溶液时的pH;
(pH=9.7)
(2)跟完全反应所需NaOH(20.00mL) 溶液少(多)加半滴,计算盐酸的物质的量浓度是
多少
=0.0999mol/L =0.1001mol/L
跟实际浓度0.1000mol/L 相比,只有0 . 1%的误差,可忽略
pH
12
10
酚
反应终点
6
甲基橙
2
V(NaOH)/mL
10 20 30
V(NaOH) 0.00 5.00 10.00 15.00 18.00 19.00
19.98
pH 1.00 1.22 1.48 1.84 3.12 3.60
4.30
20.00 20.02 20.08 20.10 21.00 25.00 30.00
35.00
7.00 9.70 10.30 10.40 11.38 12.05 12.30
12.44
突跃范围在pH 为4.30~9.70,
所以应选择pH变色范围在这 个范围的指示剂,如酚酞、
甲基橙。即使变色不在恰好 中和的pH=7 的点上,但体积 差距很小,可以忽略不计。
以0.1000mol/LNaOH滴定0.1000mol/L HC120.00mL为例:
突变 范围
40
4
0
8
三 、酸碱中和滴定曲线分析
1.滴定曲线概念
以滴加酸(或碱)的量为横坐标,以溶液pH 为纵坐标绘出一条溶液 pH 随酸(或碱)的滴加量而变化的曲线。
2.酸碱中和滴定曲线的应用
①看纵坐标,搞清楚是酸加入碱中,还是碱加入酸中;
②看起点,起点可以看出酸性或碱性的强弱;
③再找滴定终点和pH=7 的中性点,判断滴定终点的酸碱性,然后确定中性点(pH=7) 的位置;
④最后分析其他的特殊点(如滴定一半点,过量一半点等),分析酸、碱过量情况。
A. 原来盐酸的物质的量浓度为0.1 mol-L-1
B.X的值为0.1
C.原来盐酸的物质的量浓度为1 mol-L-1
D.X的值为0.001
1.如图是向100 mL的盐酸中逐渐加入NaOH溶液时,溶液的pH变化图像,
根据图像所得结论正确的是
已知
滴定测得
标
2
待
(待)
预先量取
关键:紧扣公式,分析V(标)的变化。
四 、酸碱中和滴定误差分析
(标)
计算
(1)盛装标准液的滴定管用蒸馏水洗涤后未用标准液润洗。
V(标)增大 c(待)增大
(2)盛装待测液的滴定管用蒸馏水洗后未用待测液润洗。
n (待)减小 V(标)减小 c(待)减小
(3)锥形瓶用蒸馏水洗后再用待测液润洗。
n(待)增大 V(标)增大 c(待)增大
量蒸馏 (待)是否有影响
无影响
误差产生的原因:
1、润洗不当
(标)
(待)
2.读数不规范
滴定前仰视,滴定后俯视
滴定前
滴定后
V(标)偏大,导致c(待)偏大。
V(标)偏小,导致c(待)偏小。
滴定前
滴定后
滴定前俯视,滴定后仰视
实际值
读出值
实际值
读出值
3.操作不当
(1)盛装标准液的滴定管漏液。 V(标)增大→ c(待)偏大
(2)盛标准液的滴定管滴前尖嘴部分留有气泡,滴定过程中,气泡变 小或消失,最后无气泡。 V(标)增大→ c(待)偏大
(3)滴定过程中,将标准液滴到锥形瓶外。V(标)增大→ c(待)偏大
(4)移液时,将移液管尖嘴处的残留液吹入锥形瓶中。
V(待)增大→ V (标)增大→ c(待)偏大
(5)滴定过程中,振荡锥形瓶时,不小心将待测液溅出。
V(待)减小→ V(标)减小→ c(待)偏小
4.杂质的影响
(1)用含有Na CO 杂质的NaOH配置标液来测定盐酸的浓度。
(若用标准盐酸来滴定这种NaOH 溶液呢 )V(标)增大→ c(待)偏高
V(标)减小→ c(待)偏低
(2)用含有KOH 杂质的NaOH 配置标液来测定盐酸的浓度。
V(标)增大→ c (待)偏高
( 3 ) 用NaOH 配置的因存放不当而变质的标液来测定盐酸的浓度。
c(待)不变
5.终点判断不准
(1)强酸滴定弱碱时,甲基橙由黄色变为红色时停止滴定。
判断终点过晚→V (标)增大→ c(待)偏大
(2)强碱滴定弱酸时,酚酞由无色变为粉红时立即停止滴定。
判断终点过早→V(标)减小→ c(待)偏小
(3)滴定终点时滴定管尖嘴处半滴尚未滴下,或一滴标准液附着在锥形 瓶内壁上未流下。
V(标)增大→c(待)偏大
